*****对大鼠肾脏某些抗氧化酶活性的影响
作者:马文军 常元勋 秦祥忠 刘尚军 徐文寿 崔京伟 赵茜 江泉观
单位:马文军 常元勋 崔京伟 赵 茜 江泉观 (北京医科大学劳动卫生教研室 100083); 秦祥忠 刘尚军 徐文寿 (山东省枣庄矿务局中心医院)
关键词:*****;安妥明;肾脏;过氧化氢酶;谷胱甘肽过氧化物酶
卫生毒理学杂志990206 内容摘要 本研究观察了*****(TNT)不同剂量染毒和阳性对照安妥明处理对大鼠肾组织匀浆过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)活性及肾组织蛋白含量的影响。结果表明,TNT染毒组、阳性对照组大鼠肾匀浆CAT与GSH-PX活性显著高于对照组(P<0.05),而肾蛋白含量显著降低(P<0.05),表明TNT染毒和安妥明处理均可诱导肾组织过氧化氢生成。推测TNT可能具有诱发肾脏过氧化物小体增生作用。
, http://www.100md.com
Effect on activities of certain antioxidases in renal tissues induced by trinitrotoluene
Ma Wen-jun Chang Yuan-xun Qin Xiang-zhong,et al
(Department of Occupational Health,Beijing Medical University,Beijing 100083)
The activities of catalase(CAT),glutathione peroxidase(GSH-PX),superoxide dismutase(SOD) and protein contents in renal homogenates of rats exposed to TNT and treated with clofibrate were observed at present study.The results indicated the increases of CAT and GSH-PX activities,and the dec eases of protein contents in renal homogenates of TNT-exposed group and clofibrate-treated group were significantly in comparetion with those of the control(P<0.05).It indicated that both TNT and clofibrate could induce the production of H2O2 in renal tissues.It seems that TNT may induce kidney peroxisome proliferation.
, 百拇医药
Key words:Trinitrotoluene;Clofibrate;Catalase;Glutathione peroxidase
*****(TNT)可引起肝脏和肾脏等多器官系统损伤。无论流行病学调查证实[1],还是动物实验表明[1,2],TNT均可诱发肾脏损伤。然而TNT致肾脏损伤的机理至今尚不清楚。为此,我们通过动物实验探讨了TNT对大鼠肾脏某些生化指标的影响,以便探讨TNT致肾脏损伤的可能机理。
材料与方法
一、试剂与仪器
TNT由山东枣庄矿务局某化工厂提供,纯度大于99.9%。上海第三分析仪器厂生产721分光光度计;荷兰philips公司生产的紫外分光光度计。
二、动物及处理
, 百拇医药
雄性Wistar大鼠,体重150~170g,由北京医科大学实验动物部提供。随机分为正常对照组,50,100,200mg/kg TNT染毒组和阳性对照组,每组动物25只。TNT以2%淀粉混匀后灌胃。正常对照组以等量2%淀粉灌胃。阳性对照组经口给予安妥明300mg/kg(溶于5%吐温20)。每周染毒6天,共染毒8周。分别于染毒后的第2,4,6,8和9周(恢复期)分批处死动物,处死前晚禁食但给水,每批每组处死5只。
三、观察指标
1.肾脏匀浆制备:大鼠处死后立即取出肾脏,并称量肾脏重量。取肾脏用Tris-HCl缓冲液制备5%肾匀浆,用于各项指标测定。
2.肾脏酶活性测定:肾脏匀浆过氧化氢酶活性(Cai法)[3]、谷胱甘肽过氧化物酶(GSH-PX)活性(DTNB法)[4]和超氧化物歧化酶(SOD)活性测定(Cai法)[3]。
, 百拇医药
3.肾脏蛋白质含量测定:按考马士亮蓝法测定。
4.统计处理:用软件进行方差分析(ANON)。
结 果
一、TNT对大鼠肾脏过氧化氢酶活性的影响
由表1可见,在染毒第4,8和9周(恢复期),TNT各染毒组和阳性对照组肾脏过氧化氢酶活性均有不同程度升高。F检验证实差异具有极显著性(P<0.01)。Q检验表明,TNT各染毒剂量组和阳性对照组,过氧化氢酶活性均显著高于对照组(P<0.05),但无明显剂量-反应关系。
表1 不同染毒剂量TNT(mg/kg)对大鼠肾脏过氧化氢酶活性的影响(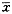 ±s) 染毒时间(周)
±s) 染毒时间(周)
, 百拇医药
动物
数
过氧化氢酶活性(mmolH2O2/30”/mg组织)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
P
2
, 百拇医药
5
3.98±0.24
4.28±0.76
4.13±0.29
3.98±0.38
4.05±0.35
0.91
>0.05
4
5
3.90±0.25
4.59±0.41
, 百拇医药
4.44±0.38
4.67±0.35
4.59±0.29
5.03
<0.01
6
5
4.22±0.50
4.68±0.38
4.41±0.52
4.68±0.39
4.77±0.52
, 百拇医药
1.21
>0.05
8
5
3.85±0.25
4.77±0.25
4.13±0.56
4.50±0.60
4.89±0.25
5.29
<0.01
9
5
, http://www.100md.com
3.85±0.52
4.68±0.38
4.22±0.50
5.05±0.32
4.68±0.68
4.33
<0.01
Q检验:4周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
8周染毒:(5)vs(1)、(3);(4)vs(1)、(3);(3)vs(2),(2)vs(1) P<0.05
恢复期:(5)、(4)、(3)、(2)vs(1) P<0.05
, http://www.100md.com
二、TNT对大鼠肾脏GSH-PX活性的影响
表2结果表明,在染毒第2和第8周时,TNT各染毒组和阳性对照组肾脏GSH-PX含量均有不同程度改变。F检验证实差异具有极显著性(P<0.01)。Q检验证实,在染毒第2周时,TNT各染毒组和阳性对照组肾脏GSH-PX活性均升高,仅TNT200mg/kg染毒组,肾脏GSH-PX活性显著高于其他TNT染毒组和阳性对照组(P<0.05)。在染毒第8周时,仅阳性对照组肾脏GSH-PX活性显著高于对照组(P<0.05)。
表2 不同染毒剂量TNT(mg/kg)对大鼠肾脏GSH-PX活性的影响(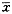 ±s) 时间(周)
±s) 时间(周)
动物
数
, 百拇医药 CSH-PX活性(U/min.mg组织)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
P
2
5
1.377±0.598
1.748±0.253
, 百拇医药
1.809±0.579
1.556±0.414
2.527±0.403
4.41
<0.05
4
5
1.295±0.186
1.240±0.522
0.937±1.259
1.129±0.673
1.557±0.758
, 百拇医药
0.44
>0.05
6
5
1.255±0.220
1.212±0.251
1.423±0.183
1.418±0.446
1.851±1.027
0.56
>0.05
8
, http://www.100md.com
5
1.292±0.133
4.054±1.062
2.230±0.988
2.191±0.403
2.424±1.147
7.00
<0.01
9
5
1.292±0.118
1.588±0.835
, 百拇医药
0.872±0.307
0.952±0.348
1.341±0.597
1.69
>0.05
Q检验:2周染毒:(5)vs(1)、(2)、(3)、(4) P<0.05
8周染毒:(4)vs(1)、(2)、(2)vs(1)、(3)、(4)、(5) P<0.05
三、TNT对大鼠肾脏蛋白质含量的影响
表3结果表明,在染毒第6和第8周时,TNT各染毒组和阳性对照组肾脏蛋白质含量均有不同程度下降。F检验证实具有显著性差异(P<0.01)。Q检验证实,在染毒第6和第8周时,TNT各染毒组和阳性对照组,肾脏蛋白质含量均显著低于对照组(P<0.05)。
, 百拇医药
表3 不同染毒剂量TNT(mg/kg)对肾脏蛋白含量的影响(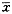 ±s) 时间(周)
±s) 时间(周)
动物
数
肾脏蛋白含量(mg/ml)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
, 百拇医药
P
2
5
3.432±0.411
4.088±1.177
4.198±0.605
3.898±0.416
3.945±0.410
2.72
<0.05
4
5
, 百拇医药 3.428±0.745
3.588±0.284
3.828±0.493
3.775±0.380
3.625±0.389
0.64
>0.05
6
5
3.432±0.432
2.504±0.547
2.418±0.349
, 百拇医药
2.446±0.189
2.224±0.613
5.51
<0.01
8
5
3.426±0.265
2.298±0.330
2.388±0.371
2.462±0.373
2.596±0.492
7.45
, 百拇医药
<0.01
9
5
3.428±0.862
3.372±1.167
3.476±1.069
3.312±1.054
3.902±0.992
0.26
>0.05
Q检验:2周染毒:(3)vs(1) P<0.05
6周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
, http://www.100md.com
8周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
四、TNT对大鼠肾脏SOD活性的影响
不同剂量TNT染毒组和阳性对照处理组肾脏SOD活性无明显改变。
讨 论
已有研究证实[3],肾脏具有SOD、CAT和GSH-PX多种酶,而且主要定位于肾曲小管中。已有体外试验证实[5],TNT与肾脏线粒体一起孵育,可诱发H2O2生成。由表1结果表明在TNT整体动物染毒实验条件下也可诱发H2O2生成,导致H2O2蓄积。还有研究表明[6],在Fe2+的存在下,H2O2与Fe2+发生Fenton反应。反应式:Fe2++H2O2→Fe3++OH-+OH·。已知OH·为活性很强的氧自由基,可诱发对膜的脂质过氧化作用。已知GSH-PX的作用:一方面可催化H2O2的转变,降低细胞内H2O2水平,以减少自由基的形成;另一方面,还可催化还原脂质过氧化物为羟基酸的反应,以减少过氧化物的蓄积。表2结果表明,肾脏GSH-PX活性升高,可能与消除体内H2O2蓄积和还原脂质过氧化物有关。由表3可见,在染毒第6和第8周时,肾脏蛋白质含量下降,推测可能与肾组织发生脂质过氧化作用导致蛋白质发生降解有关。
, http://www.100md.com
由表2,表3结果可见,安妥明处理可诱发肾脏H2O2蓄积。据报道[7],过氧化物小体酶系统的脂酰CoA氧化酶为过氧化物小体β-氧化的起始酶或限速酶。在催化脂酰CoA反应,将脂酰CoA还原为反式-2-烯酰CoA时,不是将电子转移给FAD生成FADH2,而是将电子转移给氧生成H2O2。Lazarow等[8]经腹腔注射给予大鼠安妥明(clofibrate)85mg/kg,连续1周,发现棕榈酰CoA氧化酶活性增高,并诱发大量H2O2生成,表明棕榈酰CoA氧化酶可将电子转移给氧生成H2O2。已知安妥明为过氧化物小体增生剂(peroxisome proliferator,PP)(7),因此安妥明处理的阳性对照组大鼠H2O2生成增加,可能与安妥明致肾脏过氧化物小体增生有关。
, http://www.100md.com
值得注意的是,无论是TNT染毒大鼠,还是安妥明处理大鼠均可诱发大鼠肾脏过氧化氢蓄积。TNT染毒大鼠肾脏生成的H2O2,似乎与TNT通过致肾脏过氧化物小体增生而诱发H2O2生成有关。其确切机理还需进一步研究证实。同时,无论TNT染毒大鼠,还是安妥明处理大鼠,均未引起大鼠肾脏SOD活性变化,可能与过氧化物小体在催化脂酰CoA反应时,将电子直接转移给氧生成H2O2有关。
参考文献
1.王刚垛,等.卫生毒理学杂志,1992,6(2):135.
2.江泉观,刘振生主编.*****中毒及其防治.北京:北京医科大学中国协和医科大学联合出版社,1992,53.
3.Cai QY,et al.Nutr Canccr,1996,25(1):1.
4.夏奕明,等.卫生研究 1987,16(4):29.
5.江泉观,崔京伟.卫生毒理学杂志1987,1:37.
6.常元勋,等.工业卫生与职业病 1993,19(3):184.
7.常元勋,等.卫生毒理学杂志 1994,8(4):245.
8.Lazarow P,et al.Proc Natl Acad Sci USA,1976,73:2042.
(修回日期 1998年10月), 百拇医药
单位:马文军 常元勋 崔京伟 赵 茜 江泉观 (北京医科大学劳动卫生教研室 100083); 秦祥忠 刘尚军 徐文寿 (山东省枣庄矿务局中心医院)
关键词:*****;安妥明;肾脏;过氧化氢酶;谷胱甘肽过氧化物酶
卫生毒理学杂志990206 内容摘要 本研究观察了*****(TNT)不同剂量染毒和阳性对照安妥明处理对大鼠肾组织匀浆过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)活性及肾组织蛋白含量的影响。结果表明,TNT染毒组、阳性对照组大鼠肾匀浆CAT与GSH-PX活性显著高于对照组(P<0.05),而肾蛋白含量显著降低(P<0.05),表明TNT染毒和安妥明处理均可诱导肾组织过氧化氢生成。推测TNT可能具有诱发肾脏过氧化物小体增生作用。
, http://www.100md.com
Effect on activities of certain antioxidases in renal tissues induced by trinitrotoluene
Ma Wen-jun Chang Yuan-xun Qin Xiang-zhong,et al
(Department of Occupational Health,Beijing Medical University,Beijing 100083)
The activities of catalase(CAT),glutathione peroxidase(GSH-PX),superoxide dismutase(SOD) and protein contents in renal homogenates of rats exposed to TNT and treated with clofibrate were observed at present study.The results indicated the increases of CAT and GSH-PX activities,and the dec eases of protein contents in renal homogenates of TNT-exposed group and clofibrate-treated group were significantly in comparetion with those of the control(P<0.05).It indicated that both TNT and clofibrate could induce the production of H2O2 in renal tissues.It seems that TNT may induce kidney peroxisome proliferation.
, 百拇医药
Key words:Trinitrotoluene;Clofibrate;Catalase;Glutathione peroxidase
*****(TNT)可引起肝脏和肾脏等多器官系统损伤。无论流行病学调查证实[1],还是动物实验表明[1,2],TNT均可诱发肾脏损伤。然而TNT致肾脏损伤的机理至今尚不清楚。为此,我们通过动物实验探讨了TNT对大鼠肾脏某些生化指标的影响,以便探讨TNT致肾脏损伤的可能机理。
材料与方法
一、试剂与仪器
TNT由山东枣庄矿务局某化工厂提供,纯度大于99.9%。上海第三分析仪器厂生产721分光光度计;荷兰philips公司生产的紫外分光光度计。
二、动物及处理
, 百拇医药
雄性Wistar大鼠,体重150~170g,由北京医科大学实验动物部提供。随机分为正常对照组,50,100,200mg/kg TNT染毒组和阳性对照组,每组动物25只。TNT以2%淀粉混匀后灌胃。正常对照组以等量2%淀粉灌胃。阳性对照组经口给予安妥明300mg/kg(溶于5%吐温20)。每周染毒6天,共染毒8周。分别于染毒后的第2,4,6,8和9周(恢复期)分批处死动物,处死前晚禁食但给水,每批每组处死5只。
三、观察指标
1.肾脏匀浆制备:大鼠处死后立即取出肾脏,并称量肾脏重量。取肾脏用Tris-HCl缓冲液制备5%肾匀浆,用于各项指标测定。
2.肾脏酶活性测定:肾脏匀浆过氧化氢酶活性(Cai法)[3]、谷胱甘肽过氧化物酶(GSH-PX)活性(DTNB法)[4]和超氧化物歧化酶(SOD)活性测定(Cai法)[3]。
, 百拇医药
3.肾脏蛋白质含量测定:按考马士亮蓝法测定。
4.统计处理:用软件进行方差分析(ANON)。
结 果
一、TNT对大鼠肾脏过氧化氢酶活性的影响
由表1可见,在染毒第4,8和9周(恢复期),TNT各染毒组和阳性对照组肾脏过氧化氢酶活性均有不同程度升高。F检验证实差异具有极显著性(P<0.01)。Q检验表明,TNT各染毒剂量组和阳性对照组,过氧化氢酶活性均显著高于对照组(P<0.05),但无明显剂量-反应关系。
表1 不同染毒剂量TNT(mg/kg)对大鼠肾脏过氧化氢酶活性的影响(
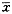 ±s) 染毒时间(周)
±s) 染毒时间(周), 百拇医药
动物
数
过氧化氢酶活性(mmolH2O2/30”/mg组织)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
P
2
, 百拇医药
5
3.98±0.24
4.28±0.76
4.13±0.29
3.98±0.38
4.05±0.35
0.91
>0.05
4
5
3.90±0.25
4.59±0.41
, 百拇医药
4.44±0.38
4.67±0.35
4.59±0.29
5.03
<0.01
6
5
4.22±0.50
4.68±0.38
4.41±0.52
4.68±0.39
4.77±0.52
, 百拇医药
1.21
>0.05
8
5
3.85±0.25
4.77±0.25
4.13±0.56
4.50±0.60
4.89±0.25
5.29
<0.01
9
5
, http://www.100md.com
3.85±0.52
4.68±0.38
4.22±0.50
5.05±0.32
4.68±0.68
4.33
<0.01
Q检验:4周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
8周染毒:(5)vs(1)、(3);(4)vs(1)、(3);(3)vs(2),(2)vs(1) P<0.05
恢复期:(5)、(4)、(3)、(2)vs(1) P<0.05
, http://www.100md.com
二、TNT对大鼠肾脏GSH-PX活性的影响
表2结果表明,在染毒第2和第8周时,TNT各染毒组和阳性对照组肾脏GSH-PX含量均有不同程度改变。F检验证实差异具有极显著性(P<0.01)。Q检验证实,在染毒第2周时,TNT各染毒组和阳性对照组肾脏GSH-PX活性均升高,仅TNT200mg/kg染毒组,肾脏GSH-PX活性显著高于其他TNT染毒组和阳性对照组(P<0.05)。在染毒第8周时,仅阳性对照组肾脏GSH-PX活性显著高于对照组(P<0.05)。
表2 不同染毒剂量TNT(mg/kg)对大鼠肾脏GSH-PX活性的影响(
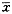 ±s) 时间(周)
±s) 时间(周)动物
数
, 百拇医药 CSH-PX活性(U/min.mg组织)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
P
2
5
1.377±0.598
1.748±0.253
, 百拇医药
1.809±0.579
1.556±0.414
2.527±0.403
4.41
<0.05
4
5
1.295±0.186
1.240±0.522
0.937±1.259
1.129±0.673
1.557±0.758
, 百拇医药
0.44
>0.05
6
5
1.255±0.220
1.212±0.251
1.423±0.183
1.418±0.446
1.851±1.027
0.56
>0.05
8
, http://www.100md.com
5
1.292±0.133
4.054±1.062
2.230±0.988
2.191±0.403
2.424±1.147
7.00
<0.01
9
5
1.292±0.118
1.588±0.835
, 百拇医药
0.872±0.307
0.952±0.348
1.341±0.597
1.69
>0.05
Q检验:2周染毒:(5)vs(1)、(2)、(3)、(4) P<0.05
8周染毒:(4)vs(1)、(2)、(2)vs(1)、(3)、(4)、(5) P<0.05
三、TNT对大鼠肾脏蛋白质含量的影响
表3结果表明,在染毒第6和第8周时,TNT各染毒组和阳性对照组肾脏蛋白质含量均有不同程度下降。F检验证实具有显著性差异(P<0.01)。Q检验证实,在染毒第6和第8周时,TNT各染毒组和阳性对照组,肾脏蛋白质含量均显著低于对照组(P<0.05)。
, 百拇医药
表3 不同染毒剂量TNT(mg/kg)对肾脏蛋白含量的影响(
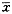 ±s) 时间(周)
±s) 时间(周)动物
数
肾脏蛋白含量(mg/ml)
F检验
正常对照组(1)
阳性对照组(2)
50(3)
100(4)
200(5)
F
, 百拇医药
P
2
5
3.432±0.411
4.088±1.177
4.198±0.605
3.898±0.416
3.945±0.410
2.72
<0.05
4
5
, 百拇医药 3.428±0.745
3.588±0.284
3.828±0.493
3.775±0.380
3.625±0.389
0.64
>0.05
6
5
3.432±0.432
2.504±0.547
2.418±0.349
, 百拇医药
2.446±0.189
2.224±0.613
5.51
<0.01
8
5
3.426±0.265
2.298±0.330
2.388±0.371
2.462±0.373
2.596±0.492
7.45
, 百拇医药
<0.01
9
5
3.428±0.862
3.372±1.167
3.476±1.069
3.312±1.054
3.902±0.992
0.26
>0.05
Q检验:2周染毒:(3)vs(1) P<0.05
6周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
, http://www.100md.com
8周染毒:(5)、(4)、(3)、(2)vs(1) P<0.05
四、TNT对大鼠肾脏SOD活性的影响
不同剂量TNT染毒组和阳性对照处理组肾脏SOD活性无明显改变。
讨 论
已有研究证实[3],肾脏具有SOD、CAT和GSH-PX多种酶,而且主要定位于肾曲小管中。已有体外试验证实[5],TNT与肾脏线粒体一起孵育,可诱发H2O2生成。由表1结果表明在TNT整体动物染毒实验条件下也可诱发H2O2生成,导致H2O2蓄积。还有研究表明[6],在Fe2+的存在下,H2O2与Fe2+发生Fenton反应。反应式:Fe2++H2O2→Fe3++OH-+OH·。已知OH·为活性很强的氧自由基,可诱发对膜的脂质过氧化作用。已知GSH-PX的作用:一方面可催化H2O2的转变,降低细胞内H2O2水平,以减少自由基的形成;另一方面,还可催化还原脂质过氧化物为羟基酸的反应,以减少过氧化物的蓄积。表2结果表明,肾脏GSH-PX活性升高,可能与消除体内H2O2蓄积和还原脂质过氧化物有关。由表3可见,在染毒第6和第8周时,肾脏蛋白质含量下降,推测可能与肾组织发生脂质过氧化作用导致蛋白质发生降解有关。
, http://www.100md.com
由表2,表3结果可见,安妥明处理可诱发肾脏H2O2蓄积。据报道[7],过氧化物小体酶系统的脂酰CoA氧化酶为过氧化物小体β-氧化的起始酶或限速酶。在催化脂酰CoA反应,将脂酰CoA还原为反式-2-烯酰CoA时,不是将电子转移给FAD生成FADH2,而是将电子转移给氧生成H2O2。Lazarow等[8]经腹腔注射给予大鼠安妥明(clofibrate)85mg/kg,连续1周,发现棕榈酰CoA氧化酶活性增高,并诱发大量H2O2生成,表明棕榈酰CoA氧化酶可将电子转移给氧生成H2O2。已知安妥明为过氧化物小体增生剂(peroxisome proliferator,PP)(7),因此安妥明处理的阳性对照组大鼠H2O2生成增加,可能与安妥明致肾脏过氧化物小体增生有关。
, http://www.100md.com
值得注意的是,无论是TNT染毒大鼠,还是安妥明处理大鼠均可诱发大鼠肾脏过氧化氢蓄积。TNT染毒大鼠肾脏生成的H2O2,似乎与TNT通过致肾脏过氧化物小体增生而诱发H2O2生成有关。其确切机理还需进一步研究证实。同时,无论TNT染毒大鼠,还是安妥明处理大鼠,均未引起大鼠肾脏SOD活性变化,可能与过氧化物小体在催化脂酰CoA反应时,将电子直接转移给氧生成H2O2有关。
参考文献
1.王刚垛,等.卫生毒理学杂志,1992,6(2):135.
2.江泉观,刘振生主编.*****中毒及其防治.北京:北京医科大学中国协和医科大学联合出版社,1992,53.
3.Cai QY,et al.Nutr Canccr,1996,25(1):1.
4.夏奕明,等.卫生研究 1987,16(4):29.
5.江泉观,崔京伟.卫生毒理学杂志1987,1:37.
6.常元勋,等.工业卫生与职业病 1993,19(3):184.
7.常元勋,等.卫生毒理学杂志 1994,8(4):245.
8.Lazarow P,et al.Proc Natl Acad Sci USA,1976,73:2042.
(修回日期 1998年10月), 百拇医药