荧光素标记的庚型肝炎病毒基因探针的制备及应用
作者:宁德刚 刘海燕 雷时美 覃巍巍 项恩鸿 李天宪
单位:宁德刚 刘海燕 雷时美 覃巍巍 项恩鸿(南宁市卫生防疫站,南宁 530011);李天宪(中国科学院武汉病毒研究所,武汉 430071)
关键词:庚型肝炎病毒;逆转录-聚合酶链反应;荧光素标记基因探针;分子杂交
荧光素标记的庚型肝炎病毒基因探针的制备及应用 摘 要 参考国内外已完成测序的庚型肝炎病毒(GBV-C/HGV)基因序列,选取毒株间系列较保守的基因片段,并合成与之互补的核苷酸序列(Antisense),用末端转移酶将荧光素-N6-dd ATP标记该片段,制成庚肝病毒基因探针。在严格控制温度的条件下,与固定于硝酸纤维膜(NC膜)上血清斑点杂交,洗膜后与抗-荧光素-碱性磷酸酶(AP)结合,加底物后化学发光自显影判断结果。该方法检测与套式逆转录-聚合酶链反应(Nested RT-PCR)检测结果的阳性符合率为88.2%,阴性符合率为100%;并且与其他相关病毒基因无交叉反应,具有较好的特异性与灵敏性。其检测结果比EIA法检测庚肝病毒抗体更具临床意义。
, 百拇医药
Detection of HGV-RNA by Hybridization with Fluorescein-Labeled Probe
Ning Degang Liu Haiyan Lei Shimei
(Sanitary and Anti-epidmic Station of Nanning, Nanning 530011)
Li Tianxian
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071)
Abstract The sequences of HGV gene that had been reported were checked and analyzed. After comparison of HGV seqences from different virus strains, a gene fragment of 31 nucleotides (7121-7152 nt) served as a probe was labeled by fluorescein-N6-dd ATP with terminal transferase. The specificity of HGV probe was tested by dot-blot hybridization with HCV RNA—related virus RNA, C.T DNA, HGV-RNA, and Southern-blot hybridization with RT-PCR product of HGV. Positive results obstained only from the HGV-RNA of positive sera that was confirmed by nested RT-PCR, all others were negative. The sensitivity of fluorescein-labeled probe was examined. The result showed that the fluorescein-labeled probe was able to check≥1.56 pg of target genome. The conformity of HGV-RNA detection using RT-PCR and HGV gene probe was 97.9%. The experiment suggested that fluorescein-labeled probe can be used in clinic detection and epidemic study.
, 百拇医药
Key words HGV, RT-PCR, Fluorescein-labeled probe, Hybridization
1995年起美国Abbot公司与Genlab公司相继报道一种新的与人类肝炎相关的病原因子GBV-C/HGV,现统称为庚型肝炎病毒。流行病学研究表明[1~3],庚肝病毒是一种广泛分布并经肠道外传播的病原因子,它在急慢性肝炎患者,献血员和吸毒人群中都存在感染。
国内外已发表多株庚肝病毒基因的全序列[4~7],并选择不同地理株间同源性较高的核苷酸序列作为PCR引物,检测病毒RNA,并开发了庚肝病毒基因重组抗原EIA试剂检测抗体。RT-PCR是目前检测庚肝病毒最为灵敏的方法,但试验费用高、操作复杂,且假阳性率高,故不能作为常规方法在临床上应用。庚肝病毒抗体一般要在感染数周后才能检出,且抗体阳性不能直接说明受检者体内庚肝病毒的存在,而现行的EIA试剂检测结果也难以信服。为此本研究建立了荧光素标记基因探针,利用分子杂交方法检测血清中庚肝病毒RNA。
, 百拇医药
1 材料方法
1.1 标本来源
收集本站和南宁中心血站及市内部分医院体检的从业人员、献血员及患者血清,血清标本于-70℃保存。
1.2 RT-PCR引物及探针DNA片段合成
参照GBV-C克隆序列(Genbank U36 380)设计两对引物及用于标记的单链DNA片段,委托中科院上海细胞生物所合成,引物及探针序列如下:
引物F1:5′-CTC TTT GTG GTA GCC GAG AGA T-3′(6902~6926nt)
引物F2:5′-TCG GTT ACT GAG AGC TCA GAT GAG-3′(6978~7004nt)
, http://www.100md.com
引物R1:5′-AGA TCC CCA GCC CAT GGC AGC-3′(7673~7693nt)
引物R2:5′-CAT GCT TAG GCA GGC TTG AGC-3′(7610~7629nt)
探针基因片段(Antisense):5′-GCG TCG CTC TGT GGA AAT AAG GCT TTG AGT AC-3′(7121~7152nt)
1.3 探针标记
依照产品操作说明(美国NEN NEL公司)进行。3′-末端转移酶2.0μL,氯化钴2.5μL,荧光素-N6-ddATP 4.0μL,用于标记基因片段1μL(100pmol/μL)加水至体积35μL,37℃30min,于-20℃保存备用。
, 百拇医药
1.4 血清中病毒RNA的提取、TR-PCR检测及Southen-blot杂交
血清中病毒RNA的提取依文献[5]所述方法进行。病毒RNA利用套式RT-PCR进行检测,在25μL总体积中含提取的病毒RNA模板和转录系统各成分(均为Promega公司产品),依照产品操作说明合成病毒cDNA。套式PCR第一步反应总体积50μL,含逆转录合成的cDNA,引物F1、R1,以及PCR各成分(Promega公司产品),经94℃ 1min,52℃ 1min,72℃ 1.5min,30个循环;第二步反应取5μL第一步反应产物作为模板、引物F2、R2,以及PCR各成分,循环方式同第一步反应。2.0%琼脂糖凝胶观察结果。
RT-PCR产物依常规方法转移至NC膜上[8],与用上述方法标记的庚肝病毒基因探针杂交,化学发光观察结果。
, 百拇医药
1.5 点膜、斑点杂交
取血清标本用3∶2的20×SSC,37%甲醛65℃处理35min,取混合物经加样器真空抽滤至NC膜上[8],NC膜于真空干燥器80℃1h,将NC膜置于预杂交液中[5×SSC,0.1%SDS,5g/L Blocking Reagent, 50g/L萄聚糖硫酸酯]于51℃下杂交1.5h,将标记好的探针加入预杂交液中使探针终浓度为10pmol/mL,于51℃下杂交2h,NC膜于洗涤液Ⅰ(2×SSC、0.1%SDS)及洗涤液Ⅱ(0.1×SSC、0.1%SDS)中51℃各洗1次。
1.6 化学发光自显影判断结果
将上述洗膜后的NC膜置抗-荧光素抗体缓冲液中[1×磷酸盐缓冲液,0.5%Tween-20、5g/L Blocking Reagent, 0.1%(体积分数)Antifluoresein-AP Conjugate]1h,用洗涤液[1×磷酸盐缓冲液(pH7.4),0.05%Tween-2]洗2次,每次2min,于NC膜上加发光剂CDP-starTm 5min,x光片压10min,观察结果,感光斑点为阳性(参见美国NEN NEL公司3′-end labeling Fluoresein kit with Anti-fluoresein-AP操作说明)。
, 百拇医药
2 结果
2.1 血清标本的RT-PCR检测
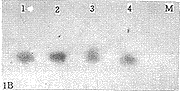
血清标本经套式RT-PCR重复检测有17例为庚肝病毒RNA阳性,用正常人血清及HCV-RNA阳性血清各一份作为对照,扩增产物经电泳分析,庚肝病毒-RNA阳性标本产生长640bp条带,正常人及HCV-RNA阳性血清未见扩增产物。结果见图1-A。
为了证明RT-PCR结果的可靠性,在设计基因探针核苷酸序列时,选择了位于套式RT-PCR所用两对引物之间的互补序列,以此片段制备的基因探针与RT-PCR产物转膜后印迹(Southern-blot)杂交,结果表明该基因探针与RT-PCR产物杂交均为阳性,结果见图1-B,说明RT-PCR产物为庚肝病毒RNA特异性扩增产物。
, 百拇医药
图1 HGV-RNA RT-PCR产物凝胶电泳分析(A)及RT-PCR Southern-blot与荧光素标记基因探针杂交分析(B) M:DNA分子量标准 1~4:HGV-RNA标本
Fig.1 Agarose gel elcetrophoresis of RT-PCR product of HGV-RNA (A) and hybridization of RT-PCR Southern blot with fluorescein-labeled oligonucleotide probe (B)M: DNA marker 1~4: HGV-RNA specimens
2.2 探针的特异性及敏感性
为了测定用荧光素标记探针的灵敏度,将纯化后的Oxgtoxin DNA (NEN NEL公司提供)分别按100、25、6.25、1.56、0.4和0.1pg点样于NC膜上,将纯化后的Oxytoxin基因片段(Antisense 30 mer由NEN NEL公司提供)用荧光素标记制成探针,并与上述斑点杂交,结果显示可检测出≥1.56pg的基因组DNA,结果见图2。证明该方法制备的基因探针具有极高的灵敏度。由于HCV与庚肝病毒在进化顺序上有着很近的亲缘关系,以HCV-RNA与庚肝病毒基因探针进行斑点杂交,结果表明庚肝病毒基因探针与HCV-RNA没有出现阳性结果,证明该基因探针具有很好的特异性,结果见图3。
, 百拇医药
图2 荧光素标记的HGV基因探针灵敏度检测
Fig.2 Sensitivity of fluorescein-Labeled oxytoxin (30-mer) antisense oligonucleotide for the detection of oxytoxin sense DNA by hybridization.
Purified DNA from A to F: 100pg、 25pg、6.25pg、1.56pg、0.38pg、0.01pg.
图3 荧光素标记探针特异性检测
A-E: RT-PCR及Southern-blot杂交证明为HGV-RNA阳性
, 百拇医药
标本,F:小牛胸腺DNA、G~T: RT-PCR检测为HCV-RNA阳性标本。
Fig.3 Specificity of fluorescein-labeled oligonucleotide probe by dot-blot hybridization with HGV-RNA specimens and HCV-RNA specimens, calf thymus DNA. A~E:HGV-RNA positive specimens; F:Calf thymus DNA; G~J:HCV-RNA positive specimens.
2.3 庚肝病毒基因探针检测及与RT-PCR检测结果的符合率
庚肝病毒基因探针与部分样品斑点杂交结果如图4所示。标本在用基因探针检测的同时,进行了套式RT-PCR检测,结果表明在17例经RT-PCR检测阳性的标本中15例基因探针检测为阳性,阳性符合率为88.2%。30例经RT-PCR检测阴性的血清标本,经基因探针检测均为阴性,阴性符合率为100%,基因探针检测阳性率低于RT-PCR检出率,其可能的原因为血清中庚肝病毒滴度低,受基因探针灵敏度的限制而无法检出。
, http://www.100md.com
图4 荧光素标记基因探针与部分样品HGV-RNA斑点杂交结果(化学发光自显影)
Fig.4 Dot-blot hybridization of HGV-RNA with fluorescein-labeled HGV oligonucleotide probe (by chemilumirescence autography).
3 讨论
目前在临床诊断中,实验室检测HGV RNA乃为诊断HGV感染的直接证据。目前医疗单位应用的诊断庚肝病毒的试剂,主要利用人工合成多肽抗原或基因重组抗原包被的EIA法检测抗体,在实际应用过程中试剂本身存在诸多尚需改进之处,同时庚肝病毒抗体阳性并不能说明受检者体内庚肝病毒存在。PCR技术为检测目的基因最为灵敏的方法,但由于PCR的影响因素较多,对标本的检测常导致假阴性[9],并且此法高度敏感,污染又会通过扩增造成假阳性[10],同时PCR技术的应用需要一定的条件,一定程度上限制了它的临床应用。
, http://www.100md.com
核酸基因探针杂交技术由于具有很高的特异性和敏感性,而被广泛应用于鉴定特定的核酸。同位素标记的基因探针尽管具有很高的敏感性,但存在放射性污染和半衰期短等问题,在推广应用方面受到一些条件限制,相对而言非放射性基因探针显示其优越性,放射性转为非放射性,消除了对人和环境的危害,操作方法简单,对核酸的标记适用面广,单链、双链DNA,RNA均可,亦可人工合成,稳定性好,保存时间长,不需长时间自显影和特殊设备,成本低,不失为值得推广的技术,尤其对大规模诊断的基层实验室,可采用分子杂交作为诊断依据。
此外,荧光素标记探针相对其他非放射性基因探针具有独特的优点:(1)本研究中根据公式Tm=81.5-16.6 lg[Na+]+0.41(G+C)%-600/N计算Tm,在杂交和洗膜中选择了Tm-16℃即51℃的温度严格进行,保证了杂交结果的特异性,该类探针可区分点突变[9];同时该探针选择了比较保守的NS5区基因作为探针标记片段,试验结果证明该基因探针不与庚肝病毒在进化顺序上亲缘关系较近的HCV-RNA杂交,它可与不同庚肝病毒毒株进行杂交,又具有良好的特异性;并且由于标记物荧光素不象生物素标记的探针,因人体本身就有生物素存在,而使杂交产生非特异的杂交反应。(2)该基因探针采用了3′-末端拖尾标记的方法,增加了标记物的掺入,提高了杂交信号放大率,而碱性磷酸酶和化学发光剂底物的应用使杂交信号进一步放大。本试验的结果也证明,利用其进行斑点杂交可检测出≥1.56pg的基因组RNA。(3)由于探针所用的基因片段仅有31个核苷酸,杂交时探针容易与标本间目的基因的碱基互补配对,因而杂交时间短[8];同时由于采用增效化学发光剂,化学发光在10min内足以使普通X光片感光。但需要指出的是基因探针还未达到PCR的灵敏度,同时目前人们掌握不同病毒株基因序列有限,因此试图用一个寡核苷酸基因探针对庚肝病毒不同变异株进行检测仍有困难。随着庚肝病毒的分子生物学进化研究的不断深入,核酸片段的选用将更为全面可靠。
, 百拇医药
参考文献
[1] Maoven L, Bowden D S, Locarnini S A. Hepatitis G virus and hapatitis GB virus, Today's Life Sci, 1995,21:24
[2] Nubling C M, Lower J. GBV-C genomes in a high-risk group in plasmapools and in intravenous immunoglobulin. Lancet, 1996,347:68
[3] Dawson G J, Schlander G G, Pilot-Matias T T et al. Prevalance studies of GB virus C infection using RT-PCR. J Med Virol, 1996, 50:97~103
, 百拇医药
[4] Simons J N, Leary T P, Dawson G J et al. Isolation of novel virus-like sequence associated with human hepatitis. Nat Med, 1995, 1:564~569
[5] Leary T P, Muerhoff A S, Simons J N et al. Sequence and genomic organization of GB-C: a novel member of the flauiviridae associated with human non-A-E hepatitis. J Med VIrol, 1996,48:60~67
[6] 周育森,王海涛,何玉光等.中国庚肝病毒株全基因结构特点及其感染地理分布,微生物学报,1996,24:27~30
, 百拇医药 [7] 周育森,陈薇,赵敏等.中国人庚型肝炎病毒全基因cDNA克隆及序列测定.军事医学院刊,1996,20:249~254
[8] Sambrook J, Fritsch E F, Maniatis T. Synthetic oligonucleotide probes in molecular cloning, A laboratiry manual. 2nd ed. NY:Cold Spring Harbor Laboratory Press, 1989.11:1~11.61
[9] Eiden JJ, Wilde J, Firoozmand F et al. Detection of animal and human group B rotaviruses in fecal spccimens by polymerase chain reaction. J Clin Microbiol, 1991,29:539~543
[10] Kitchin, Szotyoriz, Almond N et al. Avoidance of fales positives, Nature, 1990,334:20
收稿日期:1998-10-21,修回日期:1998-12-31, 百拇医药
单位:宁德刚 刘海燕 雷时美 覃巍巍 项恩鸿(南宁市卫生防疫站,南宁 530011);李天宪(中国科学院武汉病毒研究所,武汉 430071)
关键词:庚型肝炎病毒;逆转录-聚合酶链反应;荧光素标记基因探针;分子杂交
荧光素标记的庚型肝炎病毒基因探针的制备及应用 摘 要 参考国内外已完成测序的庚型肝炎病毒(GBV-C/HGV)基因序列,选取毒株间系列较保守的基因片段,并合成与之互补的核苷酸序列(Antisense),用末端转移酶将荧光素-N6-dd ATP标记该片段,制成庚肝病毒基因探针。在严格控制温度的条件下,与固定于硝酸纤维膜(NC膜)上血清斑点杂交,洗膜后与抗-荧光素-碱性磷酸酶(AP)结合,加底物后化学发光自显影判断结果。该方法检测与套式逆转录-聚合酶链反应(Nested RT-PCR)检测结果的阳性符合率为88.2%,阴性符合率为100%;并且与其他相关病毒基因无交叉反应,具有较好的特异性与灵敏性。其检测结果比EIA法检测庚肝病毒抗体更具临床意义。
, 百拇医药
Detection of HGV-RNA by Hybridization with Fluorescein-Labeled Probe
Ning Degang Liu Haiyan Lei Shimei
(Sanitary and Anti-epidmic Station of Nanning, Nanning 530011)
Li Tianxian
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071)
Abstract The sequences of HGV gene that had been reported were checked and analyzed. After comparison of HGV seqences from different virus strains, a gene fragment of 31 nucleotides (7121-7152 nt) served as a probe was labeled by fluorescein-N6-dd ATP with terminal transferase. The specificity of HGV probe was tested by dot-blot hybridization with HCV RNA—related virus RNA, C.T DNA, HGV-RNA, and Southern-blot hybridization with RT-PCR product of HGV. Positive results obstained only from the HGV-RNA of positive sera that was confirmed by nested RT-PCR, all others were negative. The sensitivity of fluorescein-labeled probe was examined. The result showed that the fluorescein-labeled probe was able to check≥1.56 pg of target genome. The conformity of HGV-RNA detection using RT-PCR and HGV gene probe was 97.9%. The experiment suggested that fluorescein-labeled probe can be used in clinic detection and epidemic study.
, 百拇医药
Key words HGV, RT-PCR, Fluorescein-labeled probe, Hybridization
1995年起美国Abbot公司与Genlab公司相继报道一种新的与人类肝炎相关的病原因子GBV-C/HGV,现统称为庚型肝炎病毒。流行病学研究表明[1~3],庚肝病毒是一种广泛分布并经肠道外传播的病原因子,它在急慢性肝炎患者,献血员和吸毒人群中都存在感染。
国内外已发表多株庚肝病毒基因的全序列[4~7],并选择不同地理株间同源性较高的核苷酸序列作为PCR引物,检测病毒RNA,并开发了庚肝病毒基因重组抗原EIA试剂检测抗体。RT-PCR是目前检测庚肝病毒最为灵敏的方法,但试验费用高、操作复杂,且假阳性率高,故不能作为常规方法在临床上应用。庚肝病毒抗体一般要在感染数周后才能检出,且抗体阳性不能直接说明受检者体内庚肝病毒的存在,而现行的EIA试剂检测结果也难以信服。为此本研究建立了荧光素标记基因探针,利用分子杂交方法检测血清中庚肝病毒RNA。
, 百拇医药
1 材料方法
1.1 标本来源
收集本站和南宁中心血站及市内部分医院体检的从业人员、献血员及患者血清,血清标本于-70℃保存。
1.2 RT-PCR引物及探针DNA片段合成
参照GBV-C克隆序列(Genbank U36 380)设计两对引物及用于标记的单链DNA片段,委托中科院上海细胞生物所合成,引物及探针序列如下:
引物F1:5′-CTC TTT GTG GTA GCC GAG AGA T-3′(6902~6926nt)
引物F2:5′-TCG GTT ACT GAG AGC TCA GAT GAG-3′(6978~7004nt)
, http://www.100md.com
引物R1:5′-AGA TCC CCA GCC CAT GGC AGC-3′(7673~7693nt)
引物R2:5′-CAT GCT TAG GCA GGC TTG AGC-3′(7610~7629nt)
探针基因片段(Antisense):5′-GCG TCG CTC TGT GGA AAT AAG GCT TTG AGT AC-3′(7121~7152nt)
1.3 探针标记
依照产品操作说明(美国NEN NEL公司)进行。3′-末端转移酶2.0μL,氯化钴2.5μL,荧光素-N6-ddATP 4.0μL,用于标记基因片段1μL(100pmol/μL)加水至体积35μL,37℃30min,于-20℃保存备用。
, 百拇医药
1.4 血清中病毒RNA的提取、TR-PCR检测及Southen-blot杂交
血清中病毒RNA的提取依文献[5]所述方法进行。病毒RNA利用套式RT-PCR进行检测,在25μL总体积中含提取的病毒RNA模板和转录系统各成分(均为Promega公司产品),依照产品操作说明合成病毒cDNA。套式PCR第一步反应总体积50μL,含逆转录合成的cDNA,引物F1、R1,以及PCR各成分(Promega公司产品),经94℃ 1min,52℃ 1min,72℃ 1.5min,30个循环;第二步反应取5μL第一步反应产物作为模板、引物F2、R2,以及PCR各成分,循环方式同第一步反应。2.0%琼脂糖凝胶观察结果。
RT-PCR产物依常规方法转移至NC膜上[8],与用上述方法标记的庚肝病毒基因探针杂交,化学发光观察结果。
, 百拇医药
1.5 点膜、斑点杂交
取血清标本用3∶2的20×SSC,37%甲醛65℃处理35min,取混合物经加样器真空抽滤至NC膜上[8],NC膜于真空干燥器80℃1h,将NC膜置于预杂交液中[5×SSC,0.1%SDS,5g/L Blocking Reagent, 50g/L萄聚糖硫酸酯]于51℃下杂交1.5h,将标记好的探针加入预杂交液中使探针终浓度为10pmol/mL,于51℃下杂交2h,NC膜于洗涤液Ⅰ(2×SSC、0.1%SDS)及洗涤液Ⅱ(0.1×SSC、0.1%SDS)中51℃各洗1次。
1.6 化学发光自显影判断结果
将上述洗膜后的NC膜置抗-荧光素抗体缓冲液中[1×磷酸盐缓冲液,0.5%Tween-20、5g/L Blocking Reagent, 0.1%(体积分数)Antifluoresein-AP Conjugate]1h,用洗涤液[1×磷酸盐缓冲液(pH7.4),0.05%Tween-2]洗2次,每次2min,于NC膜上加发光剂CDP-starTm 5min,x光片压10min,观察结果,感光斑点为阳性(参见美国NEN NEL公司3′-end labeling Fluoresein kit with Anti-fluoresein-AP操作说明)。
, 百拇医药
2 结果
2.1 血清标本的RT-PCR检测
血清标本经套式RT-PCR重复检测有17例为庚肝病毒RNA阳性,用正常人血清及HCV-RNA阳性血清各一份作为对照,扩增产物经电泳分析,庚肝病毒-RNA阳性标本产生长640bp条带,正常人及HCV-RNA阳性血清未见扩增产物。结果见图1-A。
为了证明RT-PCR结果的可靠性,在设计基因探针核苷酸序列时,选择了位于套式RT-PCR所用两对引物之间的互补序列,以此片段制备的基因探针与RT-PCR产物转膜后印迹(Southern-blot)杂交,结果表明该基因探针与RT-PCR产物杂交均为阳性,结果见图1-B,说明RT-PCR产物为庚肝病毒RNA特异性扩增产物。


, 百拇医药
图1 HGV-RNA RT-PCR产物凝胶电泳分析(A)及RT-PCR Southern-blot与荧光素标记基因探针杂交分析(B) M:DNA分子量标准 1~4:HGV-RNA标本
Fig.1 Agarose gel elcetrophoresis of RT-PCR product of HGV-RNA (A) and hybridization of RT-PCR Southern blot with fluorescein-labeled oligonucleotide probe (B)M: DNA marker 1~4: HGV-RNA specimens
2.2 探针的特异性及敏感性
为了测定用荧光素标记探针的灵敏度,将纯化后的Oxgtoxin DNA (NEN NEL公司提供)分别按100、25、6.25、1.56、0.4和0.1pg点样于NC膜上,将纯化后的Oxytoxin基因片段(Antisense 30 mer由NEN NEL公司提供)用荧光素标记制成探针,并与上述斑点杂交,结果显示可检测出≥1.56pg的基因组DNA,结果见图2。证明该方法制备的基因探针具有极高的灵敏度。由于HCV与庚肝病毒在进化顺序上有着很近的亲缘关系,以HCV-RNA与庚肝病毒基因探针进行斑点杂交,结果表明庚肝病毒基因探针与HCV-RNA没有出现阳性结果,证明该基因探针具有很好的特异性,结果见图3。

, 百拇医药
图2 荧光素标记的HGV基因探针灵敏度检测
Fig.2 Sensitivity of fluorescein-Labeled oxytoxin (30-mer) antisense oligonucleotide for the detection of oxytoxin sense DNA by hybridization.
Purified DNA from A to F: 100pg、 25pg、6.25pg、1.56pg、0.38pg、0.01pg.

图3 荧光素标记探针特异性检测
A-E: RT-PCR及Southern-blot杂交证明为HGV-RNA阳性
, 百拇医药
标本,F:小牛胸腺DNA、G~T: RT-PCR检测为HCV-RNA阳性标本。
Fig.3 Specificity of fluorescein-labeled oligonucleotide probe by dot-blot hybridization with HGV-RNA specimens and HCV-RNA specimens, calf thymus DNA. A~E:HGV-RNA positive specimens; F:Calf thymus DNA; G~J:HCV-RNA positive specimens.
2.3 庚肝病毒基因探针检测及与RT-PCR检测结果的符合率
庚肝病毒基因探针与部分样品斑点杂交结果如图4所示。标本在用基因探针检测的同时,进行了套式RT-PCR检测,结果表明在17例经RT-PCR检测阳性的标本中15例基因探针检测为阳性,阳性符合率为88.2%。30例经RT-PCR检测阴性的血清标本,经基因探针检测均为阴性,阴性符合率为100%,基因探针检测阳性率低于RT-PCR检出率,其可能的原因为血清中庚肝病毒滴度低,受基因探针灵敏度的限制而无法检出。

, http://www.100md.com
图4 荧光素标记基因探针与部分样品HGV-RNA斑点杂交结果(化学发光自显影)
Fig.4 Dot-blot hybridization of HGV-RNA with fluorescein-labeled HGV oligonucleotide probe (by chemilumirescence autography).
3 讨论
目前在临床诊断中,实验室检测HGV RNA乃为诊断HGV感染的直接证据。目前医疗单位应用的诊断庚肝病毒的试剂,主要利用人工合成多肽抗原或基因重组抗原包被的EIA法检测抗体,在实际应用过程中试剂本身存在诸多尚需改进之处,同时庚肝病毒抗体阳性并不能说明受检者体内庚肝病毒存在。PCR技术为检测目的基因最为灵敏的方法,但由于PCR的影响因素较多,对标本的检测常导致假阴性[9],并且此法高度敏感,污染又会通过扩增造成假阳性[10],同时PCR技术的应用需要一定的条件,一定程度上限制了它的临床应用。
, http://www.100md.com
核酸基因探针杂交技术由于具有很高的特异性和敏感性,而被广泛应用于鉴定特定的核酸。同位素标记的基因探针尽管具有很高的敏感性,但存在放射性污染和半衰期短等问题,在推广应用方面受到一些条件限制,相对而言非放射性基因探针显示其优越性,放射性转为非放射性,消除了对人和环境的危害,操作方法简单,对核酸的标记适用面广,单链、双链DNA,RNA均可,亦可人工合成,稳定性好,保存时间长,不需长时间自显影和特殊设备,成本低,不失为值得推广的技术,尤其对大规模诊断的基层实验室,可采用分子杂交作为诊断依据。
此外,荧光素标记探针相对其他非放射性基因探针具有独特的优点:(1)本研究中根据公式Tm=81.5-16.6 lg[Na+]+0.41(G+C)%-600/N计算Tm,在杂交和洗膜中选择了Tm-16℃即51℃的温度严格进行,保证了杂交结果的特异性,该类探针可区分点突变[9];同时该探针选择了比较保守的NS5区基因作为探针标记片段,试验结果证明该基因探针不与庚肝病毒在进化顺序上亲缘关系较近的HCV-RNA杂交,它可与不同庚肝病毒毒株进行杂交,又具有良好的特异性;并且由于标记物荧光素不象生物素标记的探针,因人体本身就有生物素存在,而使杂交产生非特异的杂交反应。(2)该基因探针采用了3′-末端拖尾标记的方法,增加了标记物的掺入,提高了杂交信号放大率,而碱性磷酸酶和化学发光剂底物的应用使杂交信号进一步放大。本试验的结果也证明,利用其进行斑点杂交可检测出≥1.56pg的基因组RNA。(3)由于探针所用的基因片段仅有31个核苷酸,杂交时探针容易与标本间目的基因的碱基互补配对,因而杂交时间短[8];同时由于采用增效化学发光剂,化学发光在10min内足以使普通X光片感光。但需要指出的是基因探针还未达到PCR的灵敏度,同时目前人们掌握不同病毒株基因序列有限,因此试图用一个寡核苷酸基因探针对庚肝病毒不同变异株进行检测仍有困难。随着庚肝病毒的分子生物学进化研究的不断深入,核酸片段的选用将更为全面可靠。
, 百拇医药
参考文献
[1] Maoven L, Bowden D S, Locarnini S A. Hepatitis G virus and hapatitis GB virus, Today's Life Sci, 1995,21:24
[2] Nubling C M, Lower J. GBV-C genomes in a high-risk group in plasmapools and in intravenous immunoglobulin. Lancet, 1996,347:68
[3] Dawson G J, Schlander G G, Pilot-Matias T T et al. Prevalance studies of GB virus C infection using RT-PCR. J Med Virol, 1996, 50:97~103
, 百拇医药
[4] Simons J N, Leary T P, Dawson G J et al. Isolation of novel virus-like sequence associated with human hepatitis. Nat Med, 1995, 1:564~569
[5] Leary T P, Muerhoff A S, Simons J N et al. Sequence and genomic organization of GB-C: a novel member of the flauiviridae associated with human non-A-E hepatitis. J Med VIrol, 1996,48:60~67
[6] 周育森,王海涛,何玉光等.中国庚肝病毒株全基因结构特点及其感染地理分布,微生物学报,1996,24:27~30
, 百拇医药 [7] 周育森,陈薇,赵敏等.中国人庚型肝炎病毒全基因cDNA克隆及序列测定.军事医学院刊,1996,20:249~254
[8] Sambrook J, Fritsch E F, Maniatis T. Synthetic oligonucleotide probes in molecular cloning, A laboratiry manual. 2nd ed. NY:Cold Spring Harbor Laboratory Press, 1989.11:1~11.61
[9] Eiden JJ, Wilde J, Firoozmand F et al. Detection of animal and human group B rotaviruses in fecal spccimens by polymerase chain reaction. J Clin Microbiol, 1991,29:539~543
[10] Kitchin, Szotyoriz, Almond N et al. Avoidance of fales positives, Nature, 1990,334:20
收稿日期:1998-10-21,修回日期:1998-12-31, 百拇医药