腺病毒E1A基因高效真核表达载体的构建与鉴定
作者:石宇 赵清正 陈艳
单位:100021 北京,中国医学科学院中国协和医科大学肿瘤医院放射治疗科
关键词:腺病毒E1A基因;质粒;肿瘤抑制基因
中华放射肿瘤学杂志990213 【摘要】 目的 构建真核高效表达该基因的载体,为进一步探讨运用高效表达E1A的重组质粒进行肿瘤基因治疗及研究E1A基因的作用机理和与其他基因的相互作用提供方法。方法 运用分子克隆技术构建2套用较强启动子驱动的表达E1A的真核重组质粒,并用多种限制性内切酶和DNA测序对重组质粒进行鉴定。结果 构建的重组质粒分别含有1.34kb和1.77kbE1A片段,分别命名为pE1A-1和pE1A-2, 且插入的方向均为正向, 无重排等异常现象, 核苷酸序列无误。结论 为人腺病毒5型(Ad5)E1A基因实验性抗肿瘤基因治疗包括放射增敏研究提供方法学及资料。
, 百拇医药 Construction and identification of adenovirus E1A gene recombinant eukaryotic expression vector
SHI Yu ,ZHAO Qingzheng, CHEN Yan.
Department of Radiation Oncology,Cancer Institute (Hospital), Chinese Academy of Medical Sciences,Peking Union Medical College, Beijing 100021
【Abstract】 Objective Adenovirus type 5 E1A gene has been found to be a tumor suppressor gene recently. The E1A products are positive and negative regulators for many other genes which are important in carcinogenesis and tumor metastasis. E1A possesses activities which suppress transformation, tumorigenesis and malignant progression of tumor cells. Methods To study the structure, function and antitumor effect of E1A gene, we have cloned separately a full-length E1A DNA and another variant lacking the nuclear localization domain into pcDNA3 vector. The recombinants were cleaved with appropriate endonucleases and sequenced. Results The orientation of the insert was found to be correct, and no rearrangement was observed. Conclusions Our work provides data and material for the future research on the antitumorigenic effects of the E1A gene.
, 百拇医药
【Key words】 Adenovirus E1A gene Vector Tumor suppressor gene
腺病毒E1A基因位于腺病毒基因组左端大约1700碱基左右。E1A编码2 个主要的蛋白,一个有243个氨基酸,另一个有289个氨基酸。E1A的N端参与编码了所有的重要功能[1]。E1A基因过去被认为是肿瘤的转化基因,但至今仍无证据表明其与人类致癌有关。相反,越来越多的实验证实,E1A实际上作为肿瘤抑制因子即抗癌基因而发挥作用[2]。它从正向或负向2个途径来调控多种细胞基因的转录[3]。它还可以提高细胞发生程序性死亡的敏感性,其在抑制肿瘤细胞转化、转移及提高瘤细胞对化疗和放射治疗敏感性等方面都发挥了一定的作用[4]。为了进一步探讨E1A基因的抗瘤特性及应用前景,我们对原质粒进行了改造,并构建了用较强启动子驱动的人腺病毒5型E1A基因重组质粒,为更深入的研究奠定基础。
, http://www.100md.com
1 材料与方法
1.1 工具酶及主要试剂:限制性内切酶,T4连接酶,DNA Marker分别购于美国Promega和GibcoBRL公司。E1A基因cDNA由美国德州大学MD Anderson肿瘤中心洪明琪教授惠赠。真核表达质粒pcDNA3,载体质粒pUC119,pBluescript M13,受体菌JM109,HB101均为中国医学科学院肿瘤医院放射治疗科放射生物室保存。
1.2 E1A真核表达质粒的构建方法
质粒的提取、纯化、鉴定、细菌转化等的方法见文献[5]。
1.2.1 pE1A-1的构建:用EcoRI和SacI酶切pE1A质粒,回收1.77kb E1AcDNA片段,与用同样酶切开的pUC119载体按摩尔量浓度比3∶1混均,于12℃连接并过夜。产物转化JM109受体菌,接种于含氨苄青霉素(100μg/mL)、X-gal和IPTG显色液的LB培养基平板上,37℃过夜。挑取白色菌落,小样制备质粒,酶切鉴定。将重组质粒扩增后,用EcoRI和XbaI酶切获得1.34kb片段,此片段与用同样酶切的pcDNA3连接。产物转化HB101受体菌,接种于含氨苄青霉素的LB平板上,37℃过夜。随机挑取菌落,小样制备质粒,酶切鉴定,筛选出重组质粒。构建流程见图1。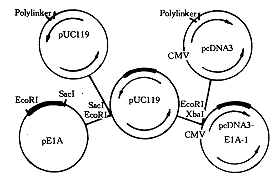
, 百拇医药
图1 pE1A-1构建的流程图
1.2.2 pE1A-2的构建: 带有E1A全长基因的pUC119质粒和pBluescript M13质粒经EcoRI和BamHI酶切电泳后,分别回收1.77kb全长E1A和2.96kb的pBluescript载体片段。T4连接酶12℃过夜,将产物转化JM109受体菌,蓝或白斑法筛选并鉴定出有E1A的阳性克隆,扩增并大量制备重组质粒。将此质粒和pcDNA3质粒用HindIII和BamHI酶切,电泳后回收1.77kb全长E1A和5.4kb的载体片段。用T4连接酶,12℃过夜,转化HB101受体菌,在含氨苄青霉素培养平板上筛出阳性克隆,并用HindIII和BamHI酶切鉴定。流程见图2。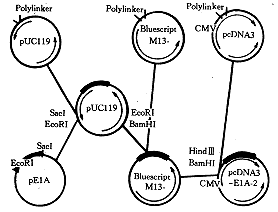
图2 pE1A-2构建的流程图
2 结果
, 百拇医药
由于再克隆步骤较多(特别是pE1A-2),为了确保在整个过程中DNA不发生重排及其他可能的变化,我们对所构建的质粒进行了内切酶图谱的鉴定和序列分析。
2.1 pE1A-1的鉴定:用AvaⅠ酶切,获得5.1kb,1.2kb 2个大片段。用EcoRI和XbaI酶切,获得5.4kb,1.34kb 2个大片段。酶切电泳如图3
1:λDNA/HindⅢ;
2:未用酶切的质粒pE1A-1(5.4+1.34);
3:pE1A-1+AvaⅠ(5.1,1.2);
4:pE1A-1+EcoRI+XbaⅠ(5.4,1.34)
, http://www.100md.com
图3 pE1A-1的酶切鉴定
2.2 pE1A-2的鉴定:用AvaⅠ酶切,获得5kb,1.2kb,0.6kb 3个大片段。用XbaⅠ酶切,获得6.6kb ,0.5kb 2个大片段。用SacⅠ酶切,获得5.2kb,1.8kb 2个大片段。用HindⅢ, BamHI酶切,获得5.4kb, 1.7kb2个大片段。均与预计相符。酶切电泳如图4。
1:λDNA/HindⅢ;
2:E1A-2+AvaⅠ (5.1,1.1,0.6);
3:pE1A-2+SacⅠ (5.2,1.8);
4:pE1A-2+XbaⅠ(6.6,0.5);
, http://www.100md.com
5:pE1A-2+HindⅢ+BamHI (5.4,1.7)
图4 pE1A-2的酶切鉴定
上述结果表明:所构建的2个质粒插入方向正确,无明显重排现象。
2.3 用ABI Prism377自动测序仪测定DNA序列,结果:经与GeneBank比较,核苷酸序列正确无误。
3 讨论
目前认为癌基因的激活和抑癌基因的失活是肿瘤发生的一个重要原因。E1A作为一种近年来发现的抑癌基因受到广泛研究。它通过调控多种细胞的基因表达而影响它们的功能。E1A基因可抑制HER-2/neu的表达,提高p53表达水平,可促进肿瘤细胞的凋亡[6~8]。同时它还可以提高NK细胞,CTL细胞,巨噬细胞的杀伤效应。它对NF-κB(nuclear factor-κB)发挥负调节作用,从而提高射线的杀伤效力[8]。
, http://www.100md.com
为了进一步探讨E1A与肿瘤的发生、发展的关系和其抗肿瘤特性,我们将E1A基因定向克隆到整合型哺乳动物表达载体pcDNA3的多克隆位点上,构建了腺病毒E1A基因重组质粒(pcDNA-E1A)。该载体具有活性较强的细胞肥大病毒(CMV)启动子,其活性比长末端重复序列(LTR)及猿猴病毒(SV40)启动子的活性高,是目前认为较理想的启动子[9]。其中pE1A-1缺少核定位编码序列,pE1A-2为含全长的E1A基因。构建这2个质粒的目的是为了进一步探讨E1A基因产物的作用部位,关于核定位序列在E1A抑癌作用中究竟起什么作用,国内外尚未见报道。
在下一阶段的研究中,作者将把E1A基因转染不同瘤细胞株,并检测多种基因的表达情况,观察转染后细胞的生长情况及对放射治疗和化疗的增敏作用等,拟为E1A基因应用的可行性提供理论依据。
本课题获国家自然科学基金资助(基金编号:39770822)
, http://www.100md.com
参考文献
[1] Osborne TF, Gaynor RB, Berk AJ. The TATA homology and the mRNA 5' untranslated sequence are not required for expression of essential adenovirus E1A functions. Cell, 1982,29:138-148.
[2] Chinnadurai G. Adenovirus E1A as a tumor-suppressor gene. Oncogene,1992,7:1255-1258.
[3] Nevins J. Adenovirus E1A-dependent transactivation of transcription. Cancer Biol, 1990,1:59-63.
, 百拇医药
[4] Uneno NT, Yu D, Hung MC. Chemosensitization of HER-2/neu-overexpressing human breast cancer cells to paclitaxel(Texol) by adenovirus type 5 E1A. Oncogene,1997, 15:953-957.
[5] 张励,石立成译.质粒载体.见:萨姆布克丁,弗里奇EF,曼尼阿蒂斯,编著.分子克隆实验指南.北京:科学出版社,1992 .16-56.
[6] Querido E, Teodoro JG, Branton PE, et al. Accumulation of p53 induced by the Adenovirus E1A protein requires regions involved in the stimulation of DNA synthesis. J Viro, 1997, 71: 3526-3533.
, http://www.100md.com
[7] Bellgrau D, Walker AT, Cook LJ, et al. Recognition of adenovirus E1A gene products on immortalized cell surfaces by cytotoxic T lymphocyte. J Viro, 1988,62:1513-1519.
[8] Shao RP, Karumagaran D, Bihua P. Inhibition of nuclear factor-κB activity is involved in E1A-mediated sensitization of radiation-induced apoptosis. J Biol Chem,1997,272(52):32739-32742.
[9] 陈晓巍,曹克利,刘德培,等.抑制人喉癌细胞生长的p53基因反转录病毒重组体的构建.中国医学科学院学报,1996,18:252-256.
(收稿:1998-08-31 修回:1998-09-29), 百拇医药
单位:100021 北京,中国医学科学院中国协和医科大学肿瘤医院放射治疗科
关键词:腺病毒E1A基因;质粒;肿瘤抑制基因
中华放射肿瘤学杂志990213 【摘要】 目的 构建真核高效表达该基因的载体,为进一步探讨运用高效表达E1A的重组质粒进行肿瘤基因治疗及研究E1A基因的作用机理和与其他基因的相互作用提供方法。方法 运用分子克隆技术构建2套用较强启动子驱动的表达E1A的真核重组质粒,并用多种限制性内切酶和DNA测序对重组质粒进行鉴定。结果 构建的重组质粒分别含有1.34kb和1.77kbE1A片段,分别命名为pE1A-1和pE1A-2, 且插入的方向均为正向, 无重排等异常现象, 核苷酸序列无误。结论 为人腺病毒5型(Ad5)E1A基因实验性抗肿瘤基因治疗包括放射增敏研究提供方法学及资料。
, 百拇医药 Construction and identification of adenovirus E1A gene recombinant eukaryotic expression vector
SHI Yu ,ZHAO Qingzheng, CHEN Yan.
Department of Radiation Oncology,Cancer Institute (Hospital), Chinese Academy of Medical Sciences,Peking Union Medical College, Beijing 100021
【Abstract】 Objective Adenovirus type 5 E1A gene has been found to be a tumor suppressor gene recently. The E1A products are positive and negative regulators for many other genes which are important in carcinogenesis and tumor metastasis. E1A possesses activities which suppress transformation, tumorigenesis and malignant progression of tumor cells. Methods To study the structure, function and antitumor effect of E1A gene, we have cloned separately a full-length E1A DNA and another variant lacking the nuclear localization domain into pcDNA3 vector. The recombinants were cleaved with appropriate endonucleases and sequenced. Results The orientation of the insert was found to be correct, and no rearrangement was observed. Conclusions Our work provides data and material for the future research on the antitumorigenic effects of the E1A gene.
, 百拇医药
【Key words】 Adenovirus E1A gene Vector Tumor suppressor gene
腺病毒E1A基因位于腺病毒基因组左端大约1700碱基左右。E1A编码2 个主要的蛋白,一个有243个氨基酸,另一个有289个氨基酸。E1A的N端参与编码了所有的重要功能[1]。E1A基因过去被认为是肿瘤的转化基因,但至今仍无证据表明其与人类致癌有关。相反,越来越多的实验证实,E1A实际上作为肿瘤抑制因子即抗癌基因而发挥作用[2]。它从正向或负向2个途径来调控多种细胞基因的转录[3]。它还可以提高细胞发生程序性死亡的敏感性,其在抑制肿瘤细胞转化、转移及提高瘤细胞对化疗和放射治疗敏感性等方面都发挥了一定的作用[4]。为了进一步探讨E1A基因的抗瘤特性及应用前景,我们对原质粒进行了改造,并构建了用较强启动子驱动的人腺病毒5型E1A基因重组质粒,为更深入的研究奠定基础。
, http://www.100md.com
1 材料与方法
1.1 工具酶及主要试剂:限制性内切酶,T4连接酶,DNA Marker分别购于美国Promega和GibcoBRL公司。E1A基因cDNA由美国德州大学MD Anderson肿瘤中心洪明琪教授惠赠。真核表达质粒pcDNA3,载体质粒pUC119,pBluescript M13,受体菌JM109,HB101均为中国医学科学院肿瘤医院放射治疗科放射生物室保存。
1.2 E1A真核表达质粒的构建方法
质粒的提取、纯化、鉴定、细菌转化等的方法见文献[5]。
1.2.1 pE1A-1的构建:用EcoRI和SacI酶切pE1A质粒,回收1.77kb E1AcDNA片段,与用同样酶切开的pUC119载体按摩尔量浓度比3∶1混均,于12℃连接并过夜。产物转化JM109受体菌,接种于含氨苄青霉素(100μg/mL)、X-gal和IPTG显色液的LB培养基平板上,37℃过夜。挑取白色菌落,小样制备质粒,酶切鉴定。将重组质粒扩增后,用EcoRI和XbaI酶切获得1.34kb片段,此片段与用同样酶切的pcDNA3连接。产物转化HB101受体菌,接种于含氨苄青霉素的LB平板上,37℃过夜。随机挑取菌落,小样制备质粒,酶切鉴定,筛选出重组质粒。构建流程见图1。

, 百拇医药
图1 pE1A-1构建的流程图
1.2.2 pE1A-2的构建: 带有E1A全长基因的pUC119质粒和pBluescript M13质粒经EcoRI和BamHI酶切电泳后,分别回收1.77kb全长E1A和2.96kb的pBluescript载体片段。T4连接酶12℃过夜,将产物转化JM109受体菌,蓝或白斑法筛选并鉴定出有E1A的阳性克隆,扩增并大量制备重组质粒。将此质粒和pcDNA3质粒用HindIII和BamHI酶切,电泳后回收1.77kb全长E1A和5.4kb的载体片段。用T4连接酶,12℃过夜,转化HB101受体菌,在含氨苄青霉素培养平板上筛出阳性克隆,并用HindIII和BamHI酶切鉴定。流程见图2。

图2 pE1A-2构建的流程图
2 结果
, 百拇医药
由于再克隆步骤较多(特别是pE1A-2),为了确保在整个过程中DNA不发生重排及其他可能的变化,我们对所构建的质粒进行了内切酶图谱的鉴定和序列分析。
2.1 pE1A-1的鉴定:用AvaⅠ酶切,获得5.1kb,1.2kb 2个大片段。用EcoRI和XbaI酶切,获得5.4kb,1.34kb 2个大片段。酶切电泳如图3

1:λDNA/HindⅢ;
2:未用酶切的质粒pE1A-1(5.4+1.34);
3:pE1A-1+AvaⅠ(5.1,1.2);
4:pE1A-1+EcoRI+XbaⅠ(5.4,1.34)
, http://www.100md.com
图3 pE1A-1的酶切鉴定
2.2 pE1A-2的鉴定:用AvaⅠ酶切,获得5kb,1.2kb,0.6kb 3个大片段。用XbaⅠ酶切,获得6.6kb ,0.5kb 2个大片段。用SacⅠ酶切,获得5.2kb,1.8kb 2个大片段。用HindⅢ, BamHI酶切,获得5.4kb, 1.7kb2个大片段。均与预计相符。酶切电泳如图4。

1:λDNA/HindⅢ;
2:E1A-2+AvaⅠ (5.1,1.1,0.6);
3:pE1A-2+SacⅠ (5.2,1.8);
4:pE1A-2+XbaⅠ(6.6,0.5);
, http://www.100md.com
5:pE1A-2+HindⅢ+BamHI (5.4,1.7)
图4 pE1A-2的酶切鉴定
上述结果表明:所构建的2个质粒插入方向正确,无明显重排现象。
2.3 用ABI Prism377自动测序仪测定DNA序列,结果:经与GeneBank比较,核苷酸序列正确无误。
3 讨论
目前认为癌基因的激活和抑癌基因的失活是肿瘤发生的一个重要原因。E1A作为一种近年来发现的抑癌基因受到广泛研究。它通过调控多种细胞的基因表达而影响它们的功能。E1A基因可抑制HER-2/neu的表达,提高p53表达水平,可促进肿瘤细胞的凋亡[6~8]。同时它还可以提高NK细胞,CTL细胞,巨噬细胞的杀伤效应。它对NF-κB(nuclear factor-κB)发挥负调节作用,从而提高射线的杀伤效力[8]。
, http://www.100md.com
为了进一步探讨E1A与肿瘤的发生、发展的关系和其抗肿瘤特性,我们将E1A基因定向克隆到整合型哺乳动物表达载体pcDNA3的多克隆位点上,构建了腺病毒E1A基因重组质粒(pcDNA-E1A)。该载体具有活性较强的细胞肥大病毒(CMV)启动子,其活性比长末端重复序列(LTR)及猿猴病毒(SV40)启动子的活性高,是目前认为较理想的启动子[9]。其中pE1A-1缺少核定位编码序列,pE1A-2为含全长的E1A基因。构建这2个质粒的目的是为了进一步探讨E1A基因产物的作用部位,关于核定位序列在E1A抑癌作用中究竟起什么作用,国内外尚未见报道。
在下一阶段的研究中,作者将把E1A基因转染不同瘤细胞株,并检测多种基因的表达情况,观察转染后细胞的生长情况及对放射治疗和化疗的增敏作用等,拟为E1A基因应用的可行性提供理论依据。
本课题获国家自然科学基金资助(基金编号:39770822)
, http://www.100md.com
参考文献
[1] Osborne TF, Gaynor RB, Berk AJ. The TATA homology and the mRNA 5' untranslated sequence are not required for expression of essential adenovirus E1A functions. Cell, 1982,29:138-148.
[2] Chinnadurai G. Adenovirus E1A as a tumor-suppressor gene. Oncogene,1992,7:1255-1258.
[3] Nevins J. Adenovirus E1A-dependent transactivation of transcription. Cancer Biol, 1990,1:59-63.
, 百拇医药
[4] Uneno NT, Yu D, Hung MC. Chemosensitization of HER-2/neu-overexpressing human breast cancer cells to paclitaxel(Texol) by adenovirus type 5 E1A. Oncogene,1997, 15:953-957.
[5] 张励,石立成译.质粒载体.见:萨姆布克丁,弗里奇EF,曼尼阿蒂斯,编著.分子克隆实验指南.北京:科学出版社,1992 .16-56.
[6] Querido E, Teodoro JG, Branton PE, et al. Accumulation of p53 induced by the Adenovirus E1A protein requires regions involved in the stimulation of DNA synthesis. J Viro, 1997, 71: 3526-3533.
, http://www.100md.com
[7] Bellgrau D, Walker AT, Cook LJ, et al. Recognition of adenovirus E1A gene products on immortalized cell surfaces by cytotoxic T lymphocyte. J Viro, 1988,62:1513-1519.
[8] Shao RP, Karumagaran D, Bihua P. Inhibition of nuclear factor-κB activity is involved in E1A-mediated sensitization of radiation-induced apoptosis. J Biol Chem,1997,272(52):32739-32742.
[9] 陈晓巍,曹克利,刘德培,等.抑制人喉癌细胞生长的p53基因反转录病毒重组体的构建.中国医学科学院学报,1996,18:252-256.
(收稿:1998-08-31 修回:1998-09-29), 百拇医药