转染人骨形成蛋白2基因对NIH3T3细胞生物学行为的影响
作者:司晓辉 杨连甲 金岩
单位:710032 西安,第四军医大学口腔医学院
关键词:转染;细胞分化;免疫组织化学;基因疗法
中华口腔医学杂志990212 【摘要】 目的 从分子水平探讨骨形成蛋白2(bone morphogenetic protein-2, BMP2)对细胞分化的调节作用,并为BMP2基因疗法的建立提供依据。方法 用脂质体转染法将人BMP2噬菌粒表达载体pBK-B2导入NIH3T3 细胞,G-418筛选获得阳性细胞克隆。原位杂交、免疫组化及夹心ELISA法检测BMP2基因的稳定转染及表达分泌,并检测转染细胞增殖活力及碱性磷酸酶和骨钙素的含量。结果 转染细胞有BMP2 mRNA 的转录及其蛋白的表达分泌,转染细胞的增殖能力减弱但碱性磷酸酶和骨钙素的含量增加。结论 BMP2 基因在NIH3T3细胞中得到表达并参与了其向成骨样细胞分化的过程。
, 百拇医药
Effects of human BMP2 gene transfection on NIH3T3 cells in vitro SI Xiaohui, YANG Lianjia, JIN Yan. Department of Oral Pathology, Stomatological College of Fourth Military Medical University, Xi'an 710032
【Abstract】 Objective To elucidate the mechanism of bone morphogenetic protein (BMP ) on cell differentiation and to provide basis for BMP gene therapy. Methods A phagemid expression vector for human BMP2 (pBK-B2) was constructed and transfected into the NIH3T3 cells by using Lipofect AMINE. Positive cell clones were selected with G-418. The stable transfection, expression and secretion of hBMP2 were determined by in situ hybridization, immunohistochemistry and sandwich-in ELISA methods. The proliferativity of the transfected cells were assayed by methabenzthiazuron (MTT) method. Alkaline phosphatase (ALP) and osteocalcin (OC) production were also measured in the transfected cells. Results The results showed that cell proliferation was inhibited after the transfection with hBMP2 gene. But the transfected cells showed increased ALP activity and OC production. Conclusion These results indicate that BMP2 is expressed stably and efficiently in the NIH3T3 cells and is involved in inducing differentiation of NIH3T3 cells into osteoblast-like cells.
, 百拇医药
【Key words】 Transfection Cell differentiation Immunohistochemistry Gene therapy
骨形成蛋白(bone morphogenetic protein, BMP)属于转化生长因子β超家族。它能在非骨组织如肌肉中诱导新骨形成,因而在骨生长和骨缺损治疗中极为重要。对BMP的进一步研究表明,它在形态发生和细胞分化过程中发挥重要作用。BMP家族至少包括20个成员,其中BMP2被认为是活性最强、唯一能单独诱导成骨的因子[1]。我们以BMP2基因为目的基因,以小鼠成纤维细胞NIH3T3为载体细胞,建立了稳定表达BMP2的细胞株,并检测了转染细胞的增殖活力和碱性磷酸酶(alkaline phosphatase, ALP)、骨钙素(osteocalcin, OC)的含量,从分子水平探讨了BMP2对细胞分化的调控作用,为BMP2基因疗法的建立提供依据。
材料和方法
, 百拇医药
1.主要材料 :①pSP65-BMP2克隆质粒,由美国基因研究所Wozney博士惠赠。②噬菌粒表达载体pBK-CMV(原核、真核均表达),由本校杨连君博士惠赠。③限制性内切酶和T4 连接酶,购自Promega和华美公司。④脂质体转染试剂盒(Lipofect AMINE)、DMEM、G-418,为美国Gibco公司产品。⑤ALP检测试剂盒,购自广州标佳公司。⑥OC放免检测试剂盒,购自北京东亚免疫技术研究所。
2.pBK-B2表达载体的构建与鉴定[2]:pSP65-BMP2和pBK-CMV分别经Sal I和Xba I双酶切后,分别回收4.5kb和1.2kb的片段,用T4 DNA连接酶连接后转化大肠杆菌DH5α,小提质粒进行酶切鉴定,阳性克隆命名为pBK-B2。
3.基因转染和克隆筛选[3]:用Lipofect AMINE将pBK-B2转染NIH3T3细胞。3天后,弃去原培养液,加入含G-418 的DMEM培养液,在标准环境下培养,15天后绝大多数细胞死亡,收集G-418抗性的细胞克隆,扩大培养并制备细胞爬片。
, http://www.100md.com
4.原位杂交[4]:细胞爬片固定后分别用Triton X-100、0.2mol/L HCl及蛋白酶K处理,逐级酒精脱水后,加热变性的含地高辛标记BMP2探针的杂交液,42℃杂交过夜。梯度枸橼酸盐缓冲液充分漂洗、正常羊血清封闭后,加标记ALP的抗地高辛抗体。Buffer I、BufferⅢ充分漂洗后,NBT/ BCIP显色、脱水、透明、封片。
5.免疫组化[5]:细胞爬片经H2O2、正常马血清处理后加鼠抗人BMP2单抗(G8A6)[6],4℃过夜后加生物素化的羊抗鼠IgG及ABC复合物,各步之间均以PBS充分振洗,DAB显色、脱水、透明、封片。
6.夹心ELISA检测:转染细胞以4×103的密度(200 μl)接种于96孔板,培养7天后,取上清加入预先包被有BMP2单抗并用正常马血清封闭的酶标软板中,37℃孵育后加生物素化的羊抗鼠IgG及 ABC复合物,各步之间均以PBS充分振洗,DAB显色 ,2mol/L H2SO4 终止反应。用ELISA仪测定490 nm 的吸光度(A)值,同时设未转染细胞及空白对照。样本A值减去空白A值后,采用统计学软件(Statgraphics, Version 3.0)进行二组间统计学分析。
, 百拇医药
7.细胞存活及生长检测:细胞接种与培养同6。3天后,每孔加噻唑蓝(methabenzthiazuron,MTT)20μl,继续培养4小时,轻轻吸尽上清,加二甲基亚砜充分振荡。用ELISA仪测定490 nm 的A值。同时设未转染细胞及空白对照,统计学分析。
8.ALP检测:细胞接种与培养同6。5天后弃去培养液,加入Triton X-100冰浴下超声粉碎,然后加底物反应液37℃孵育,0.2mol/L NaOH 终止反应。用ELISA仪测定410 nm 的A值。同时设未转染细胞及空白对照,统计学分析。
9.OC检测:细胞接种与培养同6。5天后取待测培养液100μl、125I标记的OC 100μl与OC抗体100μl混合后4℃放置24小时。加分离剂混匀后室温放置,4℃ 离心并弃上清,检测沉淀物放射剂量。同时设未转染细胞及空白对照,统计学分析。
结果
, 百拇医药
1. pBK-B2表达载体的鉴定:pBK-B2经Sal I和Xba I双酶切,切出4.5kb和1.2kb的两条片段,表明构建成功(图1)。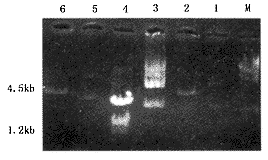
M:λDNA/Hind III 1. pBK-CMV;2. pBK-CMV/Sal I-Xba I; 3. pSP65-BMP2;
4. pSP65-BMP2/Sal I-Xba I; 5. pPBK-B2;6. pBK-B2/Sal I-Xba I
图1 pBK-B2真核表达载体的鉴定
2.克隆细胞:通过脂质体介导转染细胞,经G-418筛选,2周后得到抗性的细胞克隆,而亲本细胞在G-418培养液中1周内全部死亡,初步证明基因转染成功。
, 百拇医药
3.原位杂交:在转染细胞的胞浆中有蓝色颗粒样阳性杂交信号(图2),而亲本细胞为阴性,进一步证明pBK-B2已成功导入细胞,并有mRNA的较高表达。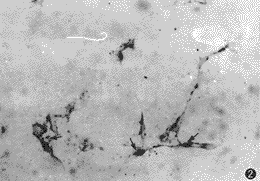
图2 转染细胞胞浆呈BMP2mRNA阳性原位杂交(×200)
4.免疫组化:在转染细胞的胞浆中有棕色阳性信号(图3),而亲本细胞为阴性,证明人BMP2基因在NIH3T3细胞中得到表达。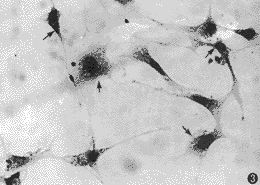
图3 转染细胞胞浆呈BMP2阳性,免疫组比,苏木精衬染(×200)
5.夹心ELISA 、MTT、 ALP活性和OC含量检测:转染BMP2基因后,细胞培养上清中检测到BMP2抗原,活力细胞数降低,细胞ALP活性和OC含量提高,与未转染细胞相比差异有显著性(表1)。
, 百拇医药
表1 夹心ELISA、噻唑蓝、碱性磷酸酶活性和骨钙素含量检测(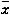 ±s) 细胞
±s) 细胞
ELISA
噻唑蓝
碱性磷酸酶
骨钙素
n
A
n
A
n
A
, 百拇医药 n
A
未转染
7
0.0027±0.007
6
0.277±0.007
6
0.013±0.002
10
0.110±0.055
转染
6
, 百拇医药
0.088±0.007
10
0.230±0.019
10
0.021±0.001
14
2.227±0.310
讨论
近年来已有诸多的生长因子特别是BMP2和BMP7与人工植骨材料复合后用以促进骨组织的修复。但它们属于外源性因子,因而在体内不能长久发挥作用。如何延长其在体内的作用是目前研究的热点问题之一。许多研究表明,外源性BMP 不仅可以诱导未分化间充质细胞向骨-软骨细胞分化,而且还具有诱导肌源性细胞、成骨前体细胞、成纤维细胞等向骨细胞系分化的作用。BMP能够促进Balb-c 3T3、Swiss 3T3及3T3-L1等成纤维细胞向脂肪细胞或成骨细胞分化[7]。NIH3T3细胞来源于Swiss小鼠胚胎,受到诱导后可向成骨样细胞或脂肪细胞等分化,而BMP2是重要的细胞诱导因子,并且小鼠胚胎NIH3T3细胞与标记的BMP2有高亲和力[8],这些均提示NIH3T3细胞是BMP2的靶细胞,且NIH3T3细胞生命力强,增殖旺盛,将BMP2基因导入NIH3T3细胞基因组中并检测其功能,将有助于研究BMP2对细胞表型的影响及其调控机理。
, http://www.100md.com
通过基因转染方法研究某一外源基因在细胞中的作用是目前分子生物学常用的技术手段。自1988年以来,已获得至少17种人BMP cDNA 克隆,其存在范围极其广泛且具有高度的同源性。人BMP2的cDNA 全长1 587 bp,编码396个氨基酸。我们选择在cDNA起始密码ATG前2个bp处,用Sal I酶切,删除大部分5' 端旁侧序列,并将此片段定向克隆于pBK-CMV载体中。利用简单、安全、高效的Lipofect AMINE,将pBK-B2基因导入NIH3T3细胞,用G-418筛选抗性克隆,获得了稳定表达BMP2的细胞克隆,并从mRNA水平及蛋白质水平证实了稳定转染后的NIH3T3细胞不仅可以表达外源BMP2基因,而且所表达的BMP2能够分泌到细胞外。
细胞分化过程与细胞增殖密切相关,当细胞去分化时,细胞的功能受到抑制而增殖更加活跃;当细胞高度分化时,处于合成和分泌特殊物质(蛋白质和酶)的状态,细胞的功能被充分表达出来,而其增殖活性受到抑制。MTT比色实验是一种检测细胞存活和生长的方法,本实验结果表明转染BMP2基因后细胞的增殖变慢,提示该细胞的功能得到增强。
, http://www.100md.com
评价一种细胞是否具有成骨细胞倾向是多种指标的结合,包括细胞的ALP活性、OC含量及甲状旁腺素依赖的环单磷酸腺苷的产生[9]。ALP是成骨细胞分化成熟的重要标志之一,是参与骨组织形成、代谢及再生的重要物质。OC是唯一已知的由成骨细胞产生的骨特异性蛋白,又称骨玻璃蛋白,它在骨细胞分化的终末阶段出现。外源性BMP2能够促进细胞的ALP活性和OC的含量,且具有剂量依赖性[9]。本实验结果显示,转染BMP2基因后细胞ALP活性和OC含量增加,提示转染BMP2基因可促进细胞向成骨样细胞分化。
以往研究表明,外源性BMP2既能促进多潜能细胞系ROB-C26分化又可促进其增殖,且ALP的活性及mRNA水平也明显增加,在1 α, 二羟维生素D3存在时,OC的含量和mRNA水平显著增高;而对于分化程度较高的成骨样细胞系ROB-C20则促进其分化但却抑制其增殖,细胞的ALP和OC的指标无变化[10]。结合本实验的结果,说明BMP2对于不同分化程度的细胞效应不尽相同。
, http://www.100md.com
总之,NIH3T3细胞在转染BMP2基因后增殖能力减弱,而细胞的ALP活性和OC含量提高,其功能得到增强,促使其向成骨样细胞分化,并且细胞具有了分泌BMP2的功能。BMP的骨诱导作用依赖于不同的细胞系、细胞分化时期等因素。BMP通过增强ALP、OC等成骨细胞标志物的表达促进细胞向骨细胞系分化。随着分子生物学技术的不断发展,外源BMP基因的直接或间接导入和表达将会对局部骨缺损修复和某些骨疾病的基因治疗产生重要意义,并为BMP的临床应用开辟新途径。
参考文献
1 Riley EH, Lane JM, Urist MR, et al. Bone morphogenetic protein-2: biology and applications. Clin Orthop, 1996, (324): 39-46.
2 司晓辉,杨连甲,金岩. 人骨形成蛋白2噬菌粒表达载体的构建与鉴定. 细胞与分子免疫学杂志,1998, 14:141.
, 百拇医药
3 姜泊,张亚历,周殿元. 分子生物学常用实验方法. 北京:人民军医出版社,1997. 153-161.
4 Si X, Jin Y, Yang L, et al. Expression of BMP-2 and TGF-beta 1 mRNA during healing of the rabbit mandible. Eur J Oral Sci, 1997, 105: 325-330.
5 司徒镇强,吴军正. 细胞培养. 西安:世界图书出版公司,1996.202-203.
6 卢兹凡,胡传闽,陈苏民, 等 . 人骨形成蛋白2单克隆抗体的制备及鉴定. 细胞与分子免疫学杂志,1997, 13:32.
7 Lindholm S. BMPs: biology, biochemistry and reconstructive surgery. R.G. Landes Company, 1996. 68-69.
, 百拇医药
8 Iwasaki S, Tsuruoka N, Hattori A, et al. Distribution and characterization of specific cellular binding proteins for bone morphogenetic protein-2. J Biol Chem, 1995, 270: 5476-5482.
9 Komori T, Yagi H, Nomura S, et al. Targeted disruption of Cbfal results in a complete lack of bone formation owing to maturational arrest of osteoblasts. Cell, 1997, 89: 755-764.
10 Yamaguchi A, Katagiri T, Ikeda T, et al. Recombinant human bone morphogenetic protein-2 stimulates osteoblastic maturation and inhibits myogenic differentiation in vitro. J Cell Biol, 1991, 113: 681-687.
(收稿:1998-04-10 修回:1998-10-25), 百拇医药
单位:710032 西安,第四军医大学口腔医学院
关键词:转染;细胞分化;免疫组织化学;基因疗法
中华口腔医学杂志990212 【摘要】 目的 从分子水平探讨骨形成蛋白2(bone morphogenetic protein-2, BMP2)对细胞分化的调节作用,并为BMP2基因疗法的建立提供依据。方法 用脂质体转染法将人BMP2噬菌粒表达载体pBK-B2导入NIH3T3 细胞,G-418筛选获得阳性细胞克隆。原位杂交、免疫组化及夹心ELISA法检测BMP2基因的稳定转染及表达分泌,并检测转染细胞增殖活力及碱性磷酸酶和骨钙素的含量。结果 转染细胞有BMP2 mRNA 的转录及其蛋白的表达分泌,转染细胞的增殖能力减弱但碱性磷酸酶和骨钙素的含量增加。结论 BMP2 基因在NIH3T3细胞中得到表达并参与了其向成骨样细胞分化的过程。
, 百拇医药
Effects of human BMP2 gene transfection on NIH3T3 cells in vitro SI Xiaohui, YANG Lianjia, JIN Yan. Department of Oral Pathology, Stomatological College of Fourth Military Medical University, Xi'an 710032
【Abstract】 Objective To elucidate the mechanism of bone morphogenetic protein (BMP ) on cell differentiation and to provide basis for BMP gene therapy. Methods A phagemid expression vector for human BMP2 (pBK-B2) was constructed and transfected into the NIH3T3 cells by using Lipofect AMINE. Positive cell clones were selected with G-418. The stable transfection, expression and secretion of hBMP2 were determined by in situ hybridization, immunohistochemistry and sandwich-in ELISA methods. The proliferativity of the transfected cells were assayed by methabenzthiazuron (MTT) method. Alkaline phosphatase (ALP) and osteocalcin (OC) production were also measured in the transfected cells. Results The results showed that cell proliferation was inhibited after the transfection with hBMP2 gene. But the transfected cells showed increased ALP activity and OC production. Conclusion These results indicate that BMP2 is expressed stably and efficiently in the NIH3T3 cells and is involved in inducing differentiation of NIH3T3 cells into osteoblast-like cells.
, 百拇医药
【Key words】 Transfection Cell differentiation Immunohistochemistry Gene therapy
骨形成蛋白(bone morphogenetic protein, BMP)属于转化生长因子β超家族。它能在非骨组织如肌肉中诱导新骨形成,因而在骨生长和骨缺损治疗中极为重要。对BMP的进一步研究表明,它在形态发生和细胞分化过程中发挥重要作用。BMP家族至少包括20个成员,其中BMP2被认为是活性最强、唯一能单独诱导成骨的因子[1]。我们以BMP2基因为目的基因,以小鼠成纤维细胞NIH3T3为载体细胞,建立了稳定表达BMP2的细胞株,并检测了转染细胞的增殖活力和碱性磷酸酶(alkaline phosphatase, ALP)、骨钙素(osteocalcin, OC)的含量,从分子水平探讨了BMP2对细胞分化的调控作用,为BMP2基因疗法的建立提供依据。
材料和方法
, 百拇医药
1.主要材料 :①pSP65-BMP2克隆质粒,由美国基因研究所Wozney博士惠赠。②噬菌粒表达载体pBK-CMV(原核、真核均表达),由本校杨连君博士惠赠。③限制性内切酶和T4 连接酶,购自Promega和华美公司。④脂质体转染试剂盒(Lipofect AMINE)、DMEM、G-418,为美国Gibco公司产品。⑤ALP检测试剂盒,购自广州标佳公司。⑥OC放免检测试剂盒,购自北京东亚免疫技术研究所。
2.pBK-B2表达载体的构建与鉴定[2]:pSP65-BMP2和pBK-CMV分别经Sal I和Xba I双酶切后,分别回收4.5kb和1.2kb的片段,用T4 DNA连接酶连接后转化大肠杆菌DH5α,小提质粒进行酶切鉴定,阳性克隆命名为pBK-B2。
3.基因转染和克隆筛选[3]:用Lipofect AMINE将pBK-B2转染NIH3T3细胞。3天后,弃去原培养液,加入含G-418 的DMEM培养液,在标准环境下培养,15天后绝大多数细胞死亡,收集G-418抗性的细胞克隆,扩大培养并制备细胞爬片。
, http://www.100md.com
4.原位杂交[4]:细胞爬片固定后分别用Triton X-100、0.2mol/L HCl及蛋白酶K处理,逐级酒精脱水后,加热变性的含地高辛标记BMP2探针的杂交液,42℃杂交过夜。梯度枸橼酸盐缓冲液充分漂洗、正常羊血清封闭后,加标记ALP的抗地高辛抗体。Buffer I、BufferⅢ充分漂洗后,NBT/ BCIP显色、脱水、透明、封片。
5.免疫组化[5]:细胞爬片经H2O2、正常马血清处理后加鼠抗人BMP2单抗(G8A6)[6],4℃过夜后加生物素化的羊抗鼠IgG及ABC复合物,各步之间均以PBS充分振洗,DAB显色、脱水、透明、封片。
6.夹心ELISA检测:转染细胞以4×103的密度(200 μl)接种于96孔板,培养7天后,取上清加入预先包被有BMP2单抗并用正常马血清封闭的酶标软板中,37℃孵育后加生物素化的羊抗鼠IgG及 ABC复合物,各步之间均以PBS充分振洗,DAB显色 ,2mol/L H2SO4 终止反应。用ELISA仪测定490 nm 的吸光度(A)值,同时设未转染细胞及空白对照。样本A值减去空白A值后,采用统计学软件(Statgraphics, Version 3.0)进行二组间统计学分析。
, 百拇医药
7.细胞存活及生长检测:细胞接种与培养同6。3天后,每孔加噻唑蓝(methabenzthiazuron,MTT)20μl,继续培养4小时,轻轻吸尽上清,加二甲基亚砜充分振荡。用ELISA仪测定490 nm 的A值。同时设未转染细胞及空白对照,统计学分析。
8.ALP检测:细胞接种与培养同6。5天后弃去培养液,加入Triton X-100冰浴下超声粉碎,然后加底物反应液37℃孵育,0.2mol/L NaOH 终止反应。用ELISA仪测定410 nm 的A值。同时设未转染细胞及空白对照,统计学分析。
9.OC检测:细胞接种与培养同6。5天后取待测培养液100μl、125I标记的OC 100μl与OC抗体100μl混合后4℃放置24小时。加分离剂混匀后室温放置,4℃ 离心并弃上清,检测沉淀物放射剂量。同时设未转染细胞及空白对照,统计学分析。
结果
, 百拇医药
1. pBK-B2表达载体的鉴定:pBK-B2经Sal I和Xba I双酶切,切出4.5kb和1.2kb的两条片段,表明构建成功(图1)。

M:λDNA/Hind III 1. pBK-CMV;2. pBK-CMV/Sal I-Xba I; 3. pSP65-BMP2;
4. pSP65-BMP2/Sal I-Xba I; 5. pPBK-B2;6. pBK-B2/Sal I-Xba I
图1 pBK-B2真核表达载体的鉴定
2.克隆细胞:通过脂质体介导转染细胞,经G-418筛选,2周后得到抗性的细胞克隆,而亲本细胞在G-418培养液中1周内全部死亡,初步证明基因转染成功。
, 百拇医药
3.原位杂交:在转染细胞的胞浆中有蓝色颗粒样阳性杂交信号(图2),而亲本细胞为阴性,进一步证明pBK-B2已成功导入细胞,并有mRNA的较高表达。

图2 转染细胞胞浆呈BMP2mRNA阳性原位杂交(×200)
4.免疫组化:在转染细胞的胞浆中有棕色阳性信号(图3),而亲本细胞为阴性,证明人BMP2基因在NIH3T3细胞中得到表达。

图3 转染细胞胞浆呈BMP2阳性,免疫组比,苏木精衬染(×200)
5.夹心ELISA 、MTT、 ALP活性和OC含量检测:转染BMP2基因后,细胞培养上清中检测到BMP2抗原,活力细胞数降低,细胞ALP活性和OC含量提高,与未转染细胞相比差异有显著性(表1)。
, 百拇医药
表1 夹心ELISA、噻唑蓝、碱性磷酸酶活性和骨钙素含量检测(
 ±s) 细胞
±s) 细胞ELISA
噻唑蓝
碱性磷酸酶
骨钙素
n
A
n
A
n
A
, 百拇医药 n
A
未转染
7
0.0027±0.007
6
0.277±0.007
6
0.013±0.002
10
0.110±0.055
转染
6
, 百拇医药
0.088±0.007
10
0.230±0.019
10
0.021±0.001
14
2.227±0.310
讨论
近年来已有诸多的生长因子特别是BMP2和BMP7与人工植骨材料复合后用以促进骨组织的修复。但它们属于外源性因子,因而在体内不能长久发挥作用。如何延长其在体内的作用是目前研究的热点问题之一。许多研究表明,外源性BMP 不仅可以诱导未分化间充质细胞向骨-软骨细胞分化,而且还具有诱导肌源性细胞、成骨前体细胞、成纤维细胞等向骨细胞系分化的作用。BMP能够促进Balb-c 3T3、Swiss 3T3及3T3-L1等成纤维细胞向脂肪细胞或成骨细胞分化[7]。NIH3T3细胞来源于Swiss小鼠胚胎,受到诱导后可向成骨样细胞或脂肪细胞等分化,而BMP2是重要的细胞诱导因子,并且小鼠胚胎NIH3T3细胞与标记的BMP2有高亲和力[8],这些均提示NIH3T3细胞是BMP2的靶细胞,且NIH3T3细胞生命力强,增殖旺盛,将BMP2基因导入NIH3T3细胞基因组中并检测其功能,将有助于研究BMP2对细胞表型的影响及其调控机理。
, http://www.100md.com
通过基因转染方法研究某一外源基因在细胞中的作用是目前分子生物学常用的技术手段。自1988年以来,已获得至少17种人BMP cDNA 克隆,其存在范围极其广泛且具有高度的同源性。人BMP2的cDNA 全长1 587 bp,编码396个氨基酸。我们选择在cDNA起始密码ATG前2个bp处,用Sal I酶切,删除大部分5' 端旁侧序列,并将此片段定向克隆于pBK-CMV载体中。利用简单、安全、高效的Lipofect AMINE,将pBK-B2基因导入NIH3T3细胞,用G-418筛选抗性克隆,获得了稳定表达BMP2的细胞克隆,并从mRNA水平及蛋白质水平证实了稳定转染后的NIH3T3细胞不仅可以表达外源BMP2基因,而且所表达的BMP2能够分泌到细胞外。
细胞分化过程与细胞增殖密切相关,当细胞去分化时,细胞的功能受到抑制而增殖更加活跃;当细胞高度分化时,处于合成和分泌特殊物质(蛋白质和酶)的状态,细胞的功能被充分表达出来,而其增殖活性受到抑制。MTT比色实验是一种检测细胞存活和生长的方法,本实验结果表明转染BMP2基因后细胞的增殖变慢,提示该细胞的功能得到增强。
, http://www.100md.com
评价一种细胞是否具有成骨细胞倾向是多种指标的结合,包括细胞的ALP活性、OC含量及甲状旁腺素依赖的环单磷酸腺苷的产生[9]。ALP是成骨细胞分化成熟的重要标志之一,是参与骨组织形成、代谢及再生的重要物质。OC是唯一已知的由成骨细胞产生的骨特异性蛋白,又称骨玻璃蛋白,它在骨细胞分化的终末阶段出现。外源性BMP2能够促进细胞的ALP活性和OC的含量,且具有剂量依赖性[9]。本实验结果显示,转染BMP2基因后细胞ALP活性和OC含量增加,提示转染BMP2基因可促进细胞向成骨样细胞分化。
以往研究表明,外源性BMP2既能促进多潜能细胞系ROB-C26分化又可促进其增殖,且ALP的活性及mRNA水平也明显增加,在1 α, 二羟维生素D3存在时,OC的含量和mRNA水平显著增高;而对于分化程度较高的成骨样细胞系ROB-C20则促进其分化但却抑制其增殖,细胞的ALP和OC的指标无变化[10]。结合本实验的结果,说明BMP2对于不同分化程度的细胞效应不尽相同。
, http://www.100md.com
总之,NIH3T3细胞在转染BMP2基因后增殖能力减弱,而细胞的ALP活性和OC含量提高,其功能得到增强,促使其向成骨样细胞分化,并且细胞具有了分泌BMP2的功能。BMP的骨诱导作用依赖于不同的细胞系、细胞分化时期等因素。BMP通过增强ALP、OC等成骨细胞标志物的表达促进细胞向骨细胞系分化。随着分子生物学技术的不断发展,外源BMP基因的直接或间接导入和表达将会对局部骨缺损修复和某些骨疾病的基因治疗产生重要意义,并为BMP的临床应用开辟新途径。
参考文献
1 Riley EH, Lane JM, Urist MR, et al. Bone morphogenetic protein-2: biology and applications. Clin Orthop, 1996, (324): 39-46.
2 司晓辉,杨连甲,金岩. 人骨形成蛋白2噬菌粒表达载体的构建与鉴定. 细胞与分子免疫学杂志,1998, 14:141.
, 百拇医药
3 姜泊,张亚历,周殿元. 分子生物学常用实验方法. 北京:人民军医出版社,1997. 153-161.
4 Si X, Jin Y, Yang L, et al. Expression of BMP-2 and TGF-beta 1 mRNA during healing of the rabbit mandible. Eur J Oral Sci, 1997, 105: 325-330.
5 司徒镇强,吴军正. 细胞培养. 西安:世界图书出版公司,1996.202-203.
6 卢兹凡,胡传闽,陈苏民, 等 . 人骨形成蛋白2单克隆抗体的制备及鉴定. 细胞与分子免疫学杂志,1997, 13:32.
7 Lindholm S. BMPs: biology, biochemistry and reconstructive surgery. R.G. Landes Company, 1996. 68-69.
, 百拇医药
8 Iwasaki S, Tsuruoka N, Hattori A, et al. Distribution and characterization of specific cellular binding proteins for bone morphogenetic protein-2. J Biol Chem, 1995, 270: 5476-5482.
9 Komori T, Yagi H, Nomura S, et al. Targeted disruption of Cbfal results in a complete lack of bone formation owing to maturational arrest of osteoblasts. Cell, 1997, 89: 755-764.
10 Yamaguchi A, Katagiri T, Ikeda T, et al. Recombinant human bone morphogenetic protein-2 stimulates osteoblastic maturation and inhibits myogenic differentiation in vitro. J Cell Biol, 1991, 113: 681-687.
(收稿:1998-04-10 修回:1998-10-25), 百拇医药