菌斑中超氧化物阴离子自由基的测定
作者:阎 鹏 黄力子 王成龙 王多宁
单位:阎 鹏 黄力子 王成龙 第四军医大学口腔医学院口腔预防医学教研室 710032 王多宁 基础部化学教研室
关键词:
华西口腔医学杂志990230 菌斑作为龋病病因的始动因素,已经得到公认。为了更深入研究菌斑、氧自由基与龋病发病的关系,作者对菌斑中氧自由基进行检测。
1 材料和方法
1.1 主要仪器和试剂
发光光度计(DG3030型,华东电子管厂);分析天平(1/100000,上海分析仪器厂);匀浆器(6 ml,第四军医大学玻璃试验设备室制);Luminol液(简称L),0.1 mmol,PB∶CB=1∶1体积比,pH=9.0(第四军医大学化学教研室制);牛血超氧化物歧化酶(SOD),生理盐水稀释浓度为0.1 mg/ml(甘肃省夏河生物制剂厂);生理盐水(简称NS,陕西省康乐制药厂);96孔培养板(瑞士产);酶联免疫检测仪(DG2022A型)。
, http://www.100md.com
1.2 实验原理[1]
由于自由基很不稳定,无法分离,用化学方法检测自由基比较困难。但可以用间接方法证明自由基的存在。本实验利用化学发光剂Luminol与自由基反应,使之激活,当其返回基态时就向外发光,用发光光度计可计数。超氧化物歧化酶能特异抑制超氧化物阴离子自由基,所以能抑制Luminol的发光。根据组织发光强度是否被抑制可以间接检测超氧化物阴离子自由基。
1.3 实验方法
1.3.1 样品采集[2] 选择无口腔软组织炎症、无牙周疾病的志愿者31例,男性14人,女性17人,年龄16~40岁。采样前24小时禁止口腔卫生,正常饮食。样品采集前用清水充分漱口以去除食物残渣及软垢。收集自然非刺激性混合性唾液1 ml,为对照组;再用棉垫隔离牙菌斑收集区,用无菌蜡刀和探针刮取全牙面菌斑(下颌前牙区除外),用菌斑染色剂检测所取部位,若该部位仍残留部分菌斑,则上述所取菌斑为有效,为实验组。否则为无效。取样均在上午8~9时,10时进行发光强度测定。
, 百拇医药
1.3.2 实验步骤 先测定发光值强度。测定条件为25 ℃,60秒。实验组样品加1.0 ml NS,匀浆管内匀浆,取0.1 ml匀浆液置于化学发光管中,分别加NS或SOD液10 μl测定本底后,加L液0.1 ml进行化学发光测定,得到(NS+L)组和(SOD+L)组发光值。同法取0.1 ml唾液分别加(NS+L)和(SOD+L)测定发光值作为对照组值。
蛋白定量[3]采用考马斯亮蓝法测定。取0.5 mg/ml牛血清白蛋白10 μl(即5 μg)作标准,生理盐水10 μl为空白对照,剩余匀浆液或唾液5 μl加生理盐水5 μl为样品。然后加考马斯亮蓝试剂200 μl。混匀放置10分钟,600 nm波长测吸光度(A)值。根据(A)值得到每份样品的蛋白含量,进而得到样品中每毫克蛋白每秒发光值。
2 结 果
菌斑匀浆液和唾液中均含有超氧化物阴离子自由基,结果见表1。实验组与对照组的[(NS+L)组-(SOD+L)组]差值的比较见表2。SOD对实验组与对照组发光值强度抑制率比较见表3。
, 百拇医药
表1 两组发光值(单位:每秒发光值/mg蛋白) 组别
实验组
对照组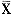 ±s
±s
t
P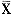 ±s
±s
t
P
(NS+L)组
34.29±
31.76
, 百拇医药
3.85±
1.18
5.65
<0.001
2.421
<0.05
(SOD+L)组
5.04±
5.40
3.24±
0.88
表2 抑制发光强度值比较(单位:每秒发光值/mg蛋白) 组别
, 百拇医药
Δ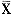 ±s
±s
t
P
实验组
对照组
29.10±2.73
0.36±0.08
5.625
<0.001
表3 SOD对两组发光强度抑制率比较(%) 组别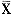 ±s
±s
, 百拇医药
t
P
实验组
对照组
85.32±7.75
6.90±19.21
20.01
<0.001
3 讨 论
本实验结果表明,实验组与对照组均含有超氧化物阴离子自由基,实验组中超氧化物阴离子自由基的水平远远高于对照组,两组之间的抑制发光强度值比为29.1/0.36=81倍,即菌斑内自由基含量明显高于唾液内自由基含量。
, http://www.100md.com
龋坏组织内大量自由基的存在已经得到证实[4],且自由基与龋变牙面电位(Eh)密切相关[5]。如果菌斑内同样存在大量的自由基,则说明自由基在龋病发生之前就大量存在。根据龋病发病机理的生物电化学理论[6]设想推断自由基有可能是龋病发生的动因。本实验证明了菌斑内高浓度超氧化物阴离子自由基的存在,为该理论提供了物质基础。Wilson等[7]、Matsumoto等[8]、Shimamoto等[9]和Marquis[10]的报道说明菌斑与自由基的生成有关。
本测定结果,菌斑中自由基的水平远远高于唾液中自由基水平,可以排除因唾液自由基水平升高继而造成菌斑中自由基水平升高的可能性。同时,菌斑附着牙面的牙体硬组织代谢活动不可能产生如此高浓度的自由基。因此,本实验检测到的超氧化物阴离子自由基只可能是由菌斑组织的存在而产生的。
, http://www.100md.com
本测定结果可见SOD对菌斑发光强度抑制率明显高于对唾液发光强度的抑制,说明SOD对超氧化物阴离子自由基的特异性抑制作用,也说明所取菌斑样品并非食物残渣或软垢。食物残渣或软垢中可能有发光物质的存在,但SOD并不抑制其发光,SOD只可能抑制细菌代谢过程中产生的超氧化物阴离子自由基。
参考文献
1 莫 简.自由基生物学导论.北京:人民卫生出版社,1989:19~50
2 周学东,岳松龄.人牙菌斑和唾液中淀粉酶、蔗糖酶活性测定.牙体牙髓牙周病学杂志,1992,2(3):129~130
3 吴补领,史俊南,王多宁.牙髓炎组织超氧化物阴离子自由基的测定分析.实用口腔医学杂志,1996,6(增刊):228~229
4 王成龙.龋病发病机理的生物电化学理论与自由基.西安:第四军医大学学位论文,1997
, 百拇医药
5 阎 鹏.自由基与龋病发病机理的作用机制的研究.西安:第四军医大学学位论文,1998
6 黄力子.龋病病变中的生物电现象初探.中华口腔医学杂志,1993,28(3):297~298
7 Wilson M, Gibson M, Strahan D, et al. A preliminary evaluation of a redox agent in the treatment of chronic periodontitis. J Periodont Res, 1992,27(5):522~527
8 Matsumoto J, Higuchi M, Shimada M, et al. Molecular cloning and sequence analysis of the gene encoding the H2O-forming NADH oxidase from Streptococcus mutans. Biosci Biotechnol Biochem,1996,60(1):39~43
9 Shinamoto T, Fukui K, Kodama T, et al. Effects of oxygen on growth of Streptococcus mutans. Shika Kiso Igakkai Zasshi, 1990,32(1):10~19
10 Marquis RE. Oxygen metabolism, oxidative stress and acid-base physiology of dental plaque biofilms. J Ind Microbiol, 1995,15(3):198~207
(1998-04-21收稿), http://www.100md.com
单位:阎 鹏 黄力子 王成龙 第四军医大学口腔医学院口腔预防医学教研室 710032 王多宁 基础部化学教研室
关键词:
华西口腔医学杂志990230 菌斑作为龋病病因的始动因素,已经得到公认。为了更深入研究菌斑、氧自由基与龋病发病的关系,作者对菌斑中氧自由基进行检测。
1 材料和方法
1.1 主要仪器和试剂
发光光度计(DG3030型,华东电子管厂);分析天平(1/100000,上海分析仪器厂);匀浆器(6 ml,第四军医大学玻璃试验设备室制);Luminol液(简称L),0.1 mmol,PB∶CB=1∶1体积比,pH=9.0(第四军医大学化学教研室制);牛血超氧化物歧化酶(SOD),生理盐水稀释浓度为0.1 mg/ml(甘肃省夏河生物制剂厂);生理盐水(简称NS,陕西省康乐制药厂);96孔培养板(瑞士产);酶联免疫检测仪(DG2022A型)。
, http://www.100md.com
1.2 实验原理[1]
由于自由基很不稳定,无法分离,用化学方法检测自由基比较困难。但可以用间接方法证明自由基的存在。本实验利用化学发光剂Luminol与自由基反应,使之激活,当其返回基态时就向外发光,用发光光度计可计数。超氧化物歧化酶能特异抑制超氧化物阴离子自由基,所以能抑制Luminol的发光。根据组织发光强度是否被抑制可以间接检测超氧化物阴离子自由基。
1.3 实验方法
1.3.1 样品采集[2] 选择无口腔软组织炎症、无牙周疾病的志愿者31例,男性14人,女性17人,年龄16~40岁。采样前24小时禁止口腔卫生,正常饮食。样品采集前用清水充分漱口以去除食物残渣及软垢。收集自然非刺激性混合性唾液1 ml,为对照组;再用棉垫隔离牙菌斑收集区,用无菌蜡刀和探针刮取全牙面菌斑(下颌前牙区除外),用菌斑染色剂检测所取部位,若该部位仍残留部分菌斑,则上述所取菌斑为有效,为实验组。否则为无效。取样均在上午8~9时,10时进行发光强度测定。
, 百拇医药
1.3.2 实验步骤 先测定发光值强度。测定条件为25 ℃,60秒。实验组样品加1.0 ml NS,匀浆管内匀浆,取0.1 ml匀浆液置于化学发光管中,分别加NS或SOD液10 μl测定本底后,加L液0.1 ml进行化学发光测定,得到(NS+L)组和(SOD+L)组发光值。同法取0.1 ml唾液分别加(NS+L)和(SOD+L)测定发光值作为对照组值。
蛋白定量[3]采用考马斯亮蓝法测定。取0.5 mg/ml牛血清白蛋白10 μl(即5 μg)作标准,生理盐水10 μl为空白对照,剩余匀浆液或唾液5 μl加生理盐水5 μl为样品。然后加考马斯亮蓝试剂200 μl。混匀放置10分钟,600 nm波长测吸光度(A)值。根据(A)值得到每份样品的蛋白含量,进而得到样品中每毫克蛋白每秒发光值。
2 结 果
菌斑匀浆液和唾液中均含有超氧化物阴离子自由基,结果见表1。实验组与对照组的[(NS+L)组-(SOD+L)组]差值的比较见表2。SOD对实验组与对照组发光值强度抑制率比较见表3。
, 百拇医药
表1 两组发光值(单位:每秒发光值/mg蛋白) 组别
实验组
对照组
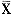 ±s
±st
P
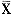 ±s
±st
P
(NS+L)组
34.29±
31.76
, 百拇医药
3.85±
1.18
5.65
<0.001
2.421
<0.05
(SOD+L)组
5.04±
5.40
3.24±
0.88
表2 抑制发光强度值比较(单位:每秒发光值/mg蛋白) 组别
, 百拇医药
Δ
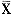 ±s
±st
P
实验组
对照组
29.10±2.73
0.36±0.08
5.625
<0.001
表3 SOD对两组发光强度抑制率比较(%) 组别
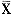 ±s
±s, 百拇医药
t
P
实验组
对照组
85.32±7.75
6.90±19.21
20.01
<0.001
3 讨 论
本实验结果表明,实验组与对照组均含有超氧化物阴离子自由基,实验组中超氧化物阴离子自由基的水平远远高于对照组,两组之间的抑制发光强度值比为29.1/0.36=81倍,即菌斑内自由基含量明显高于唾液内自由基含量。
, http://www.100md.com
龋坏组织内大量自由基的存在已经得到证实[4],且自由基与龋变牙面电位(Eh)密切相关[5]。如果菌斑内同样存在大量的自由基,则说明自由基在龋病发生之前就大量存在。根据龋病发病机理的生物电化学理论[6]设想推断自由基有可能是龋病发生的动因。本实验证明了菌斑内高浓度超氧化物阴离子自由基的存在,为该理论提供了物质基础。Wilson等[7]、Matsumoto等[8]、Shimamoto等[9]和Marquis[10]的报道说明菌斑与自由基的生成有关。
本测定结果,菌斑中自由基的水平远远高于唾液中自由基水平,可以排除因唾液自由基水平升高继而造成菌斑中自由基水平升高的可能性。同时,菌斑附着牙面的牙体硬组织代谢活动不可能产生如此高浓度的自由基。因此,本实验检测到的超氧化物阴离子自由基只可能是由菌斑组织的存在而产生的。
, http://www.100md.com
本测定结果可见SOD对菌斑发光强度抑制率明显高于对唾液发光强度的抑制,说明SOD对超氧化物阴离子自由基的特异性抑制作用,也说明所取菌斑样品并非食物残渣或软垢。食物残渣或软垢中可能有发光物质的存在,但SOD并不抑制其发光,SOD只可能抑制细菌代谢过程中产生的超氧化物阴离子自由基。
参考文献
1 莫 简.自由基生物学导论.北京:人民卫生出版社,1989:19~50
2 周学东,岳松龄.人牙菌斑和唾液中淀粉酶、蔗糖酶活性测定.牙体牙髓牙周病学杂志,1992,2(3):129~130
3 吴补领,史俊南,王多宁.牙髓炎组织超氧化物阴离子自由基的测定分析.实用口腔医学杂志,1996,6(增刊):228~229
4 王成龙.龋病发病机理的生物电化学理论与自由基.西安:第四军医大学学位论文,1997
, 百拇医药
5 阎 鹏.自由基与龋病发病机理的作用机制的研究.西安:第四军医大学学位论文,1998
6 黄力子.龋病病变中的生物电现象初探.中华口腔医学杂志,1993,28(3):297~298
7 Wilson M, Gibson M, Strahan D, et al. A preliminary evaluation of a redox agent in the treatment of chronic periodontitis. J Periodont Res, 1992,27(5):522~527
8 Matsumoto J, Higuchi M, Shimada M, et al. Molecular cloning and sequence analysis of the gene encoding the H2O-forming NADH oxidase from Streptococcus mutans. Biosci Biotechnol Biochem,1996,60(1):39~43
9 Shinamoto T, Fukui K, Kodama T, et al. Effects of oxygen on growth of Streptococcus mutans. Shika Kiso Igakkai Zasshi, 1990,32(1):10~19
10 Marquis RE. Oxygen metabolism, oxidative stress and acid-base physiology of dental plaque biofilms. J Ind Microbiol, 1995,15(3):198~207
(1998-04-21收稿), http://www.100md.com