Tricine-SDS-PAGE法分析腮腺唾液蛋白
作者:郭 颖 罗海燕 黄 宁 杨美薷 吴 琦 王伯瑶
单位:郭 颖 罗海燕 杨美薷 华西医科大学口腔医学院 610041;黄 宁 吴 琦 王伯瑶 华西医科大学感染与免疫研究室
关键词:
华西口腔医学杂志990229 多种口腔疾病或系统性疾病的发生、发展过程中,唾液成分的质和量都可能发生改变[1]。唾液蛋白作为唾液的主要有机成分,与唾液的多种生理功能密切相关[2]。因此研究唾液蛋白对于了解机体的生理及病理状况具有重要意义。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)是常用的唾液蛋白的分离方法。传统的SDS-PAGE系统由Laemmli建立,该系统对分子量在20 kD以下的蛋白分离欠佳[3],需通过繁琐的操作制备梯度凝胶。而腮腺唾液的主要成分富脯蛋白和富组蛋白的分子量为10~40 kD和3~5 kD,故分析腮腺唾液蛋白需要对Laemmli的方法进行改进。既往研究发现经SDS-PAGE电泳后,唾液富脯蛋白难以着色。但可去除乙酸脱色液中的其他有机溶剂成分,使富脯蛋白发生变色效应呈紫红色,与其它蛋白区分[4]。
, 百拇医药
本实验旨在Laemmli方法的基础上,采用N-三羟甲基甘氨酸(Tricine)代替常用的甘氨酸,用Tricine-SDS-PAGE方法慢离子电泳分析腮腺唾液蛋白,探求适合于腮腺唾液蛋白分析的电泳方法,同时改进常规的染色方法,确定CBB R-250染色后紫红色区带和蓝色区带的数目,为进一步研究唾液蛋白提供方法学依据。
1 材料和方法
1.1 试剂
Tricine购自Merck公司,聚丙烯酰胺凝胶电泳试剂及蛋白质分子量标准品均为Gibco产品,其余试剂为国产分析纯。
1.2 腮腺唾液的收集和处理
试验时,每隔20秒在舌尖部滴一滴2.5%柠檬酸以刺激唾液分泌。用仿制的Carlson-Crittenden装置收集禁食2小时后(上午10:00~12:00)的刺激性腮腺唾液。收集3 ml唾液于刻度离心管内,然后取出100 μl唾液,加入等体积2×SDS样品缓冲液,内含8%(0.28 mol/L)SDS、24%(3.29 mol/L)甘油、100 mmol/L Tris、4%(0.57 mol/L)巯基乙醇及溴酚蓝,-30 ℃冰冻保存备用。依此法先后收集25名正常青年、7例牙龈炎及13例牙周炎患者腮腺唾液为样品。
, 百拇医药
1.3 腮腺唾液蛋白含量的测定
蛋白含量的测定采用考马斯亮蓝G-250(CBBG-250)微板法[5],以牛血清白蛋白(BSA)为标准。
1.4 腮腺唾液蛋白的Tricine-SDS-PAGE分析
参照Sch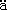 gger等[3]的方法进行。电泳装置为Mini-protean Ⅱ型电泳仪(Bio-rad产品),板胶厚0.75 mm。分离胶浓度分别为16.5%和10%,浓缩胶浓度为4%。采用不连续缓冲系统,阳极缓冲液为0.2 mol/L Tris(pH 8.9),阴极缓冲液为0.1 mol/L Tricine内含0.1%(3.47 mmol/L)SDS和0.1 mol/L Tris(pH 8.25),凝胶缓冲液为3 mol/L Tris内含0.3%(0.01 mol/L)SDS(pH 8.45)。唾液样品经40 ℃水浴30分钟后,在每样品池内加样15 μl,于80 V恒压电泳。电泳后,用两种染色方法处理凝胶。方法1:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、40%乙醇、10%乙酸的染液染色7小时,10%乙酸脱色过夜。方法2:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、46%甲醇、9%乙酸的染液染色7小时,以含10%乙酸、25%甲醇的脱色液脱色过夜。
gger等[3]的方法进行。电泳装置为Mini-protean Ⅱ型电泳仪(Bio-rad产品),板胶厚0.75 mm。分离胶浓度分别为16.5%和10%,浓缩胶浓度为4%。采用不连续缓冲系统,阳极缓冲液为0.2 mol/L Tris(pH 8.9),阴极缓冲液为0.1 mol/L Tricine内含0.1%(3.47 mmol/L)SDS和0.1 mol/L Tris(pH 8.25),凝胶缓冲液为3 mol/L Tris内含0.3%(0.01 mol/L)SDS(pH 8.45)。唾液样品经40 ℃水浴30分钟后,在每样品池内加样15 μl,于80 V恒压电泳。电泳后,用两种染色方法处理凝胶。方法1:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、40%乙醇、10%乙酸的染液染色7小时,10%乙酸脱色过夜。方法2:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、46%甲醇、9%乙酸的染液染色7小时,以含10%乙酸、25%甲醇的脱色液脱色过夜。
, 百拇医药
2 结 果
腮腺唾液经16.5%Tricine-SDS-PAGE,CBB R-250染色,10%乙酸脱色,可分离出15条以上蛋白区带,分子量在3~100 kD,其中有十多条呈紫红色的富脯蛋白区带(图1)。若脱色液中含有甲醇(方法2),则蓝色区带仍很明显,但未显现紫色区带(图2)。此外,从图1、图2还可以看到,不同个体蛋白区带的染色深浅不一,表明腮腺唾液蛋白的Tricine-SDS-PAGE电泳图谱存在明显的个体差异。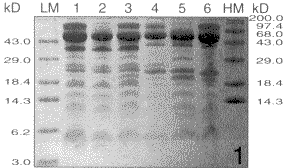
图1 腮腺唾液16.5%Tricine-SDS-PAGE电泳图谱(染色方法一) LM:低分子量蛋白标准品,HM:高分子量蛋白标准品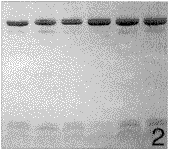
图2 腮腺唾液16.5%Tricine-SDS-PAGE电泳图谱(染色方法二)
, 百拇医药
腮腺唾液经10% Tricine-SDS-PAGE分析,不同的染色方法得到的电泳图谱与16.5%的板胶相似,但对分子量在43 kD以上的蛋白区带分离效果优于16.5%的板胶。
3 讨 论
Tricine-SDS-PAGE可使小分子量蛋白得到很好的分离,16.5%的Tricine-SDS-PAGE适于分离分子量在1~70 kD的蛋白。本实验结果发现采用16.5%的Tricine-SDS-PAGE使主要的腮腺唾液蛋白都得到较好的分离。这与用5%~20%的梯度凝胶电泳结果相似[6]。而且通过调节凝胶浓度,也可使高分子量蛋白得到很好的分离。本实验采用的10%Tricine-SDS-PAGE对分子量在43 kD以上的蛋白分离效果好。由于电泳系统内没有尿素和甘氨酸,不会影响蛋白质氨基酸序列的测定。
本实验采用两种染色方法对电泳后的凝胶进行处理,发现CBB R-250染色,10%乙酸脱色,可以清晰地显现紫红色的富脯蛋白区带,而脱色液中含有甲醇的方法只显出蓝色区带。本实验进一步证实了Beeley等的观点。富脯蛋白的这种变色效应与CBB R-250和富脯蛋白的特殊结构有关[6]。
, 百拇医药
本实验结果表明不同个体之间唾液蛋白存在明显差异。牙周病患者与正常个体腮腺唾液蛋白Tricine-SDS-PAGE电泳图谱的差别是由疾病所致还是个体差异的缘故,有待进一步研究。
本实验采用的Tricine-SDS-PAGE方法分析腮腺唾液蛋白,操作简便,不必对唾液样品进行脱盐、浓缩等处理,可直接加样,样品用量少,分辨率高,尤其适合于小分子量蛋白的分离。此方法还可以应用于全唾液及颌下腺-舌下腺唾液蛋白的分离纯化。
参考文献
1 Mandel ID. The diagnostic uses of saliva. J Oral Pathol Med,1990,19(3):119~125
2 杨萍综述.唾液蛋白质的研究进展.国外医学口腔医学分册,1993,20(2):78~82
, 百拇医药
3 Sch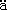 gger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem,1987,166:368~379
gger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem,1987,166:368~379
4 Beeley JA. Clinical applications of electrophoresis of human salivary proteins. J Chromatogr, 1991,569:261~280
5 李成文主编.现代免疫化学技术.北京:军事医学科学院微生物流行病研究所出版社,1990:6
6 Beeley JA, Sweeney D, Lindsay JC, et al. Sodium dodecyl sulphate-polyacrylamide gel electrophoresis of human parotid salivary proteins. Electrophoresis, 1991,12:1032~1041
(1998-09-15收稿), 百拇医药
单位:郭 颖 罗海燕 杨美薷 华西医科大学口腔医学院 610041;黄 宁 吴 琦 王伯瑶 华西医科大学感染与免疫研究室
关键词:
华西口腔医学杂志990229 多种口腔疾病或系统性疾病的发生、发展过程中,唾液成分的质和量都可能发生改变[1]。唾液蛋白作为唾液的主要有机成分,与唾液的多种生理功能密切相关[2]。因此研究唾液蛋白对于了解机体的生理及病理状况具有重要意义。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)是常用的唾液蛋白的分离方法。传统的SDS-PAGE系统由Laemmli建立,该系统对分子量在20 kD以下的蛋白分离欠佳[3],需通过繁琐的操作制备梯度凝胶。而腮腺唾液的主要成分富脯蛋白和富组蛋白的分子量为10~40 kD和3~5 kD,故分析腮腺唾液蛋白需要对Laemmli的方法进行改进。既往研究发现经SDS-PAGE电泳后,唾液富脯蛋白难以着色。但可去除乙酸脱色液中的其他有机溶剂成分,使富脯蛋白发生变色效应呈紫红色,与其它蛋白区分[4]。
, 百拇医药
本实验旨在Laemmli方法的基础上,采用N-三羟甲基甘氨酸(Tricine)代替常用的甘氨酸,用Tricine-SDS-PAGE方法慢离子电泳分析腮腺唾液蛋白,探求适合于腮腺唾液蛋白分析的电泳方法,同时改进常规的染色方法,确定CBB R-250染色后紫红色区带和蓝色区带的数目,为进一步研究唾液蛋白提供方法学依据。
1 材料和方法
1.1 试剂
Tricine购自Merck公司,聚丙烯酰胺凝胶电泳试剂及蛋白质分子量标准品均为Gibco产品,其余试剂为国产分析纯。
1.2 腮腺唾液的收集和处理
试验时,每隔20秒在舌尖部滴一滴2.5%柠檬酸以刺激唾液分泌。用仿制的Carlson-Crittenden装置收集禁食2小时后(上午10:00~12:00)的刺激性腮腺唾液。收集3 ml唾液于刻度离心管内,然后取出100 μl唾液,加入等体积2×SDS样品缓冲液,内含8%(0.28 mol/L)SDS、24%(3.29 mol/L)甘油、100 mmol/L Tris、4%(0.57 mol/L)巯基乙醇及溴酚蓝,-30 ℃冰冻保存备用。依此法先后收集25名正常青年、7例牙龈炎及13例牙周炎患者腮腺唾液为样品。
, 百拇医药
1.3 腮腺唾液蛋白含量的测定
蛋白含量的测定采用考马斯亮蓝G-250(CBBG-250)微板法[5],以牛血清白蛋白(BSA)为标准。
1.4 腮腺唾液蛋白的Tricine-SDS-PAGE分析
参照Sch
 gger等[3]的方法进行。电泳装置为Mini-protean Ⅱ型电泳仪(Bio-rad产品),板胶厚0.75 mm。分离胶浓度分别为16.5%和10%,浓缩胶浓度为4%。采用不连续缓冲系统,阳极缓冲液为0.2 mol/L Tris(pH 8.9),阴极缓冲液为0.1 mol/L Tricine内含0.1%(3.47 mmol/L)SDS和0.1 mol/L Tris(pH 8.25),凝胶缓冲液为3 mol/L Tris内含0.3%(0.01 mol/L)SDS(pH 8.45)。唾液样品经40 ℃水浴30分钟后,在每样品池内加样15 μl,于80 V恒压电泳。电泳后,用两种染色方法处理凝胶。方法1:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、40%乙醇、10%乙酸的染液染色7小时,10%乙酸脱色过夜。方法2:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、46%甲醇、9%乙酸的染液染色7小时,以含10%乙酸、25%甲醇的脱色液脱色过夜。
gger等[3]的方法进行。电泳装置为Mini-protean Ⅱ型电泳仪(Bio-rad产品),板胶厚0.75 mm。分离胶浓度分别为16.5%和10%,浓缩胶浓度为4%。采用不连续缓冲系统,阳极缓冲液为0.2 mol/L Tris(pH 8.9),阴极缓冲液为0.1 mol/L Tricine内含0.1%(3.47 mmol/L)SDS和0.1 mol/L Tris(pH 8.25),凝胶缓冲液为3 mol/L Tris内含0.3%(0.01 mol/L)SDS(pH 8.45)。唾液样品经40 ℃水浴30分钟后,在每样品池内加样15 μl,于80 V恒压电泳。电泳后,用两种染色方法处理凝胶。方法1:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、40%乙醇、10%乙酸的染液染色7小时,10%乙酸脱色过夜。方法2:以含0.1%(1.2 mmol/L)考马斯亮蓝R-250、46%甲醇、9%乙酸的染液染色7小时,以含10%乙酸、25%甲醇的脱色液脱色过夜。, 百拇医药
2 结 果
腮腺唾液经16.5%Tricine-SDS-PAGE,CBB R-250染色,10%乙酸脱色,可分离出15条以上蛋白区带,分子量在3~100 kD,其中有十多条呈紫红色的富脯蛋白区带(图1)。若脱色液中含有甲醇(方法2),则蓝色区带仍很明显,但未显现紫色区带(图2)。此外,从图1、图2还可以看到,不同个体蛋白区带的染色深浅不一,表明腮腺唾液蛋白的Tricine-SDS-PAGE电泳图谱存在明显的个体差异。

图1 腮腺唾液16.5%Tricine-SDS-PAGE电泳图谱(染色方法一) LM:低分子量蛋白标准品,HM:高分子量蛋白标准品

图2 腮腺唾液16.5%Tricine-SDS-PAGE电泳图谱(染色方法二)
, 百拇医药
腮腺唾液经10% Tricine-SDS-PAGE分析,不同的染色方法得到的电泳图谱与16.5%的板胶相似,但对分子量在43 kD以上的蛋白区带分离效果优于16.5%的板胶。
3 讨 论
Tricine-SDS-PAGE可使小分子量蛋白得到很好的分离,16.5%的Tricine-SDS-PAGE适于分离分子量在1~70 kD的蛋白。本实验结果发现采用16.5%的Tricine-SDS-PAGE使主要的腮腺唾液蛋白都得到较好的分离。这与用5%~20%的梯度凝胶电泳结果相似[6]。而且通过调节凝胶浓度,也可使高分子量蛋白得到很好的分离。本实验采用的10%Tricine-SDS-PAGE对分子量在43 kD以上的蛋白分离效果好。由于电泳系统内没有尿素和甘氨酸,不会影响蛋白质氨基酸序列的测定。
本实验采用两种染色方法对电泳后的凝胶进行处理,发现CBB R-250染色,10%乙酸脱色,可以清晰地显现紫红色的富脯蛋白区带,而脱色液中含有甲醇的方法只显出蓝色区带。本实验进一步证实了Beeley等的观点。富脯蛋白的这种变色效应与CBB R-250和富脯蛋白的特殊结构有关[6]。
, 百拇医药
本实验结果表明不同个体之间唾液蛋白存在明显差异。牙周病患者与正常个体腮腺唾液蛋白Tricine-SDS-PAGE电泳图谱的差别是由疾病所致还是个体差异的缘故,有待进一步研究。
本实验采用的Tricine-SDS-PAGE方法分析腮腺唾液蛋白,操作简便,不必对唾液样品进行脱盐、浓缩等处理,可直接加样,样品用量少,分辨率高,尤其适合于小分子量蛋白的分离。此方法还可以应用于全唾液及颌下腺-舌下腺唾液蛋白的分离纯化。
参考文献
1 Mandel ID. The diagnostic uses of saliva. J Oral Pathol Med,1990,19(3):119~125
2 杨萍综述.唾液蛋白质的研究进展.国外医学口腔医学分册,1993,20(2):78~82
, 百拇医药
3 Sch
 gger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem,1987,166:368~379
gger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal Biochem,1987,166:368~3794 Beeley JA. Clinical applications of electrophoresis of human salivary proteins. J Chromatogr, 1991,569:261~280
5 李成文主编.现代免疫化学技术.北京:军事医学科学院微生物流行病研究所出版社,1990:6
6 Beeley JA, Sweeney D, Lindsay JC, et al. Sodium dodecyl sulphate-polyacrylamide gel electrophoresis of human parotid salivary proteins. Electrophoresis, 1991,12:1032~1041
(1998-09-15收稿), 百拇医药