移植患者感染性并发症及防治原则
作者:肖鑫武 童茂荣 夏锡荣
单位:南京军区南京总医院呼吸内科(南京,210002)
关键词:器官移植;并发症;防治原则
各种感染是器官移植患者最常见的危及生命的并发症
各种感染是器官移植患者最常见的危及生命的并发症。使用免疫抑制药物使患者发生感染的危险明显增加,而且这些患者的临床表现及影像学表现与免疫功能正常者有较大差别,给诊断和治疗带来了困难。本文就移植患者感染性并发症的特点及防治原则作一综述。
1 器官移植患者发生感染的危险因素
器官移植患者发生感染的危险因素主要有两方面:患者接触潜在致病原的强度及患者免疫抑制净状态。
, http://www.100md.com
1.1 接触潜在致病原 该因素包括社区性和医院内两方面。患者在社区内可接触到的致病原有各种呼吸道病毒及一些经食物传播的致病原,如沙门菌、产单孢李氏菌及空肠弯曲菌。免疫功能抑制可增加致病原侵入、播散及二重感染的危险。
医院内接触潜在致病原包括住院及非住院性因素。在住院患者主要为病室内空气或饮用水被曲菌、军团菌或革兰阴性菌(如绿脓杆菌)污染。近年来尚有院内对万古霉素耐药的粪肠球菌、抗甲氧苯青霉素的金黄色葡萄球菌(MRSA)及艰难梭菌暴发感染的报道。住院患者院内感染的特点为感染的发生在时间、地点上十分集中。
门诊患者院内因素是指患者在赴医院手术或摄片等时接触污染的空气。这种接触导致的感染也许更为常见,但因病例分散,故较难发现。当患者出现某种机会性感染,而其免疫抑制净状态又不至于导致这种感染时,应考虑到患者可能有异常致病原接触史。
1.2 免疫抑制净状态 免疫抑制净状态为多种因素交互作用的结果。其中最主要的因素包括免疫抑制治疗(剂量、疗程及使用各药物的时间顺序)、是否有具免疫调节功能的病毒感染(尤其是CMV,还包括EBV、HBV、HCV及HIV)及与移植手术有关的因素(残存坏死或损伤组织、积液未引流彻底等)。
, http://www.100md.com
2 器官移植患者发生感染的时间特点
所有实体器官移植后的免疫抑制治疗方案相似,均以环孢素和tacrolimus为抗排斥反应的核心药物。因此,移植术后出现何种感染具有相对固定的时间特点(图1)。根据移植术后感染的流行病学资料可大致划分三个时间段,即术后第一个月内、术后一个月至六个月及六个月以上[1]。下面简述在这三个不同时间段内发生感染的特征。
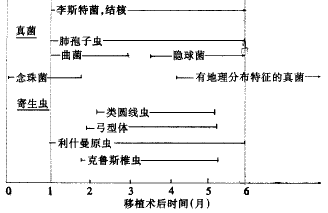
图1 移植术后出现感染的一般顺序
, http://www.100md.com
注:HSV单纯疱疹,RSV呼吸道合胞病毒,PTLD移植后淋巴增生病
2.1 移植术后第一个月内 在这段时间内出现的医院内细菌或真菌感染(包括手术创口、肺部、泌尿道或血管内留置管道的感染)与免疫功能正常的手术后患者相似,包括病毒、细菌及真菌等。术后出现感染机率的大小与下列因素有关,即血管内留置管及引流管放置时间的长短、气管插管时间的长短、有无放置斯坦特固定片或其它异物、有无坏死组织存在或积液等。如上述因素未妥善处理,预防性抗感染治疗只能使出现感染的时间延迟而已。
术后第一个月内不应出现一些机会性感染如卡氏肺孢子虫及星型奴卡菌感染。否则提示患者在移植术前即存在严重免疫功能低下、移植器官供体或受体本身患有这些病原体感染或患者有特殊接触史。尽管在这期间应用的免疫抑制药物量最大,但免疫抑制净效应主要取决于免疫抑制治疗维持量水平而非某一特定免疫抑制方案的短期效应。
在某些病例,感染可能通过移植的器官传播。有作者报道,接受者有系统性弓形虫或单纯疱疹病毒感染供体的器官导致移植患者出现上述病原体的全身性感染。在对供、受体进行评价时,关键要排除菌血症(包括真菌血症)的可能性,因为无论在器官供体还是在移植患者出现菌血症均可能导致移植器官感染,尤其是血管吻合处感染可导致真菌性血管瘤,一旦破裂会造成严重后果。
, http://www.100md.com
2.2 移植术一至六个月 器官移植一个月后,感染性疾病的性质出现变化。具有免疫调节功能的病毒感染开始成为主要矛盾,这些病毒包括巨细胞病毒(CMV)、Epstein-Barr病毒(EBV)、人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)及丙型肝炎病毒(HCV),其中尤以CMV为甚。持续的免疫抑制加上病毒感染使患者易于出现机会性感染,如卡氏肺孢子虫、曲菌及产单孢李氏菌(L.Monocytogenes)等。
2.3 移植术六个月后 器官移植六个月后,按其感染性疾病的特点可将患者分为三类:
2.3.1 80%以上的患者只需维持最小量的免疫抑制治疗,移植器官功能良好。这些患者出现的感染性疾病与一般人群相同,主要为呼吸道感染。机会性感染罕见,除非有特殊接触史。
2.3.2 约10%的患者患有慢性或进行性HBV、HCV、CMV、EBV或乳头瘤病毒感染。这些病毒感染可导致感染器官的损伤,如HBV造成肝脏损害、CMV造成视网膜损伤;或导致恶性肿瘤,如HBV或HCV感染后的肝细胞癌、EBV感染后的淋巴瘤及乳头瘤病毒感染导致的鳞状细胞癌。
, 百拇医药
2.3.3 另外5%~10%的患者可能出现反复或慢性排斥反应,使免疫抑制治疗强度增加,后者常导致慢性病毒感染。这些患者出现机会感染的机率最大,因此需要长期预防性使用复方新诺明,避免接触环境性致病因素,必要时应用预防性抗真菌治疗。
3 移植患者的几种主要致病原
3.1 CMV CMV感染不仅可直接造成组织损伤,还可产生许多间接作用[2](见图2)。患者一旦感染CMV(其实验室检查标志为血清学检查阳性),将终生携带病毒。在移植患者存在许多激活CMV的因素:应用抗淋巴细胞抗体及细胞毒性药物、排斥反应、全身感染及炎症反应。全身炎症反应伴有肿瘤坏死因子及其它亲炎性细胞因子的释放,后者通过刺激产生一系列细胞内信使而将CMV由静止状态激活,导致病毒复制。不同免疫抑制剂可通过不同环节影响病毒感染的发生发展:抗淋巴细胞抗体及细胞毒性药物可激活病毒,而糖皮质激素、环孢素及tacrolimus则通过抑制宿主抗病毒免疫反应促进病毒的扩散。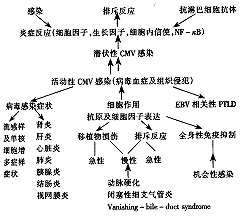
, http://www.100md.com
图2 CMV感染对移植患者的影响
移植术前血清学检查对评价CMV感染的危险性有重要价值。血清学阴性的器官受者接受血清学阳性供体的移植器官后出现临床CMV感染的危险性增加50%。但血清学(系列抗体滴度或IgM测定)对CMV感染的诊断意义有限。确诊有赖于发现病毒血症或感染组织活检证实有病毒侵犯。目前较好的诊断方法还有检测血标本中的病毒抗原或定量PCR分析[3,4]。
CMV感染的临床表现包括发热、全身不适,实验室检查异常包括白细胞减少、血小板减少、轻度异型淋巴细胞增多及轻度肝功能损害。移植器官似乎较自身器官更易受到CMV感染的损害。排斥反应与CMV感染之间的关系可能是双向的:一方面CMV感染可导致排斥,另一方面排斥反应引起的炎症又增加了病毒的复制[5,6]。因此,无论急性或各种形式的慢性排斥反应均与CMV感染有关。Reinke等[5]报道80%的经活检证实的晚期移植肾排斥反应经更昔洛韦治疗有效,而不需其它免疫抑制治疗。另有报道证实,CMV感染还可使移植后淋巴细胞增生性疾病的发生率显著增加[7]。
, http://www.100md.com
CMV感染的治疗常需经静脉使用更昔洛韦2~4周。因为CMV感染的复发率相当高(原发感染患者复发率为50%~75%,血清学阳性的患者,复发率为10%~20%),为减少复发及防止CMV对更昔洛韦的耐药性,应在证实病毒血症消失后方可停药。有些作者在重症或复发病例加用抗CMV超免疫球蛋白;另有作者在停用静脉更昔洛韦后,继续使用2~3个月的口服治疗[8,9]。在CMV处于高水平复制期间若更昔洛韦血药浓度过低(如口服用药时)可导致CMV对该药出现耐药。对耐更昔洛韦的CMV感染可采用膦甲酸(foscarnet)治疗,或联合应用多种抗病毒制剂[10]。
预防CMV感染具有重要价值。尽管目前尚无公认的预防性给药方案,以下三点值得强调:①预防用药的强度需与免疫抑制治疗强度一致,还需考虑到出现病毒复燃的危险性(如在应用抗淋巴细胞抗体治疗期间应予静脉内使用更昔洛韦);②预防性治疗应始于病毒复燃以前;③有效预防性抗病毒治疗(保持血清血检查阴性)需维持至少3个月,以避免疗程过短导致复发。
, 百拇医药
3.2 EBV及移植后淋巴增生病 接受维持性免疫抑制治疗的移植患者中约20%~30%存在EBV复制,而在接受抗淋巴细胞抗体治疗的患者中80%以上存在EBV复制。在某些患者EBV感染虽亦可导致类似CMV感染的单核细胞增多综合征,但EBV感染的主要意义在于可引起移植后淋巴细胞增生病[7]。通常为B淋巴细胞增生,严重程度不等;可为良性多克隆病变,亦可表现为高度恶性的单克隆淋巴瘤,对后者目前尚无有效治疗方法。移植后淋巴细胞增生病常表现为结外病变,侵犯脑、骨髓、移植器官、胃肠道及肝脏。出现移植后淋巴细胞增生病的危险因素包括免疫抑制治疗(使用抗淋巴细胞抗体、环孢素或tacrolimus等)、原发性EBV感染、口咽部高水平病毒复制及近期CMV感染。治疗主要为减少或停用免疫抑制剂[7]。
3.3 肺炎 肺部感染是移植患者最常见的感染性并发症。早期诊断及特异性治疗为治愈的关健,因此在这些患者应提倡积极使用创伤性诊断技术。
, 百拇医药 移植患者因其免疫功能低下,发生肺部感染时出现胸部X线异常可能较晚,且与免疫功能正常患者的表现有较大差异。胸部CT检查在评价移植患者肺部感染方面具有极其重要价值,尤其当胸片阴性或表现不典型时。胸部CT检查还有助于确定病变范围及指导选择最佳创伤性检查手段(如累及胸膜的局灶性病变可作经皮肺穿刺检查而弥漫性病变则需作经纤维支气管镜肺活检)。在机会性真菌或奴卡菌感染患者,确诊时应了解病变范围、认真观察所有部位病变对治疗的反应对指导治疗极为重要,应在所有病灶消失后方可考虑停药。CT表现不典型时提示可能存在多重感染。
3.4 中枢神经系统感染 移植患者中枢神经系统感染有四种典型的模式。
3.4.1 急性脑膜炎通常由产单孢李氏菌引起。
3.4.2 亚急性或慢性脑膜炎(发热、头痛持续数天或数周,有时伴神志改变)多为新型隐球菌感染,另亦可能为结核分枝杆菌、产单孢李氏菌、荚膜组织胞浆菌、星形奴卡菌、粪链球菌感染,或EBV相关性移植后淋巴增生病。
, 百拇医药
3.4.3 局灶性脑内感染,表现为癫痫或局部神经功能异常,可由产单孢李氏菌及星形奴卡菌感染引起,偶尔与移植后淋巴增生病有关,但最常见的原因为迁徙性曲菌感染。
3.4.4 进行性痴呆,伴或不伴有局部神经病变或癫痫,常与JC病毒(一种乳多空病毒)感染引起的多灶性脑白质病变有关,亦可能与其它一些病毒感染(包括单纯疱疹病毒、CMV及EBV)、神经脱髓鞘病变及环孢素或tacrolimus的毒性作用有关。
总之,产单孢李氏菌、新型隐球菌及烟曲菌为移植患者中枢神经系统感染的主要致病原[11]。移植患者中枢神经系统感染的临床表现与免疫功能正常患者有很大差异。尤其是免疫抑制治疗的抗炎作用可掩盖脑膜炎症反应的体征。在这种患者不明原因的发热及头痛提示为中枢神经系统感染,需立即行头颅CT及腰穿检查。
4 移植患者抗微生物治疗原则
, http://www.100md.com
移植患者的抗微生物治疗包括三方面:即治疗明确存在的感染;就某种特殊重要的感染对所有患者作预防性治疗(prophylactic therapy);及就某些感染对某些高危患者作提前治疗(preemptive therapy)。下面就预防性治疗和提前治疗作一简述。
4.1 预防治疗 对移植患者来说,最有效的预防性治疗为在移植术后4~12个月内服用复方新诺明。该治疗可有效地预防卡氏肺孢子虫肺炎及减少发生其它常见肺部感染(包括产单孢李氏菌、及星形奴卡菌)的危险性。在肾移植患者,预防性使用复方新诺明可使术后第一个月内泌尿道感染的发生率由30%~60%降至5%[12]。但预防性治疗的剂量及疗程需个体化。
4.2 提前治疗 提前治疗有两种方法。其一为对尚未出现临床症状,但已表现出具有某种特殊感染的危险因素的患者进行治疗,如给CMV抗体阳性同时接受抗淋巴细胞抗体治疗的移植患者进行小剂量更昔洛韦治疗,可使CMV感染发病率由65%减至20%以下[13]。另一方法为采用高度特异性检测手段对高危患者进行常规检测,如检测曲菌在呼吸道的定植(约65%的移植患者在发生曲菌呼吸道定植后可出现活动性曲菌感染)、CMV血症,并据此制定相应的提前治疗方案。
, http://www.100md.com
4.3 药物毒性问题 移植患者药物毒性多由药物的相互作用引起,而非单一药物的副作用所致[14]。可改变环孢素及tacrolimus代谢的药物往往为肝脏CYP3A(细胞色素P450-IIIA)酶系统的诱导物、抑制剂或底物。在移植患者存在三种常见的抗微生物药物与免疫抑制药物之间的相互作用。首先,利福平、异烟肼及新青Ⅲ等药物可引起环孢素或tacrolimus代谢的上调,导致在使用一定剂量免疫抑制剂时,血药浓度低于应有水平,从而增加排斥的危险。其次,某些药物可引起环孢素及tacrolimus代谢下调,导致使用一定剂量免疫抑制剂时,血药浓度高于应有水平,使肾损害及重症感染危险增加。可产生这一作用的药物通常有两大类:大环内酯类抗生素及azole类抗真菌药物(酮康唑、依曲康唑及氟康唑)[14,15]。最后,治疗浓度的免疫抑制剂与抗微生物药物相互作用还可产生两种肾毒性作用。第一,某些抗生素,如氟喹喏酮类药物和复方新诺明在低剂量时(如氧氟沙星每天200~400mg)患者耐受良好,剂量较高时则可引起环孢素或tacrolimus相关性肾损害[14]。第二,某些抗生素如两性霉素B及氨基糖甙类可于首剂治疗时导致肾毒性,且随着药物的继续使用,肾毒性的机会增加。
, 百拇医药
为避免药物相互作用导致的毒性反应,β-内酰胺类抗生素、小剂量氟喹喏酮类抗菌药物及中等剂量的氟康唑构成了移植患者抗微生物治疗的基石。同时,在开始及停用抗微生物治疗时对免疫抑制药物用药方案及剂量作适当调整亦十分重要。
参考文献
1 Rubin RH,Wolfson JS,Cosimi AB et al.Infection in the renal transplant patient.Am J Med,1981,70:405
2 Fietze E,Prosch S,Reinke P et al.Cytomegalovirus infection in transplant recipients:the role of tumor necrosis factor.Transplantation,1994,58:675
, 百拇医药 3 Manez R,Kusne S,Rinaldo C et al.Time to detection of cytomegalovirus (CMV) DNA in blood leukocytes is a predictor for the development of CMV disease in CMV-seronegative recipients of allografts from CMV-seropositive donors following liver transplantation.J Infect Dis,1996,173:1072
4 Niubo J,Perez JL,Martinez-Lacasa JT et al.Association of quantitative cytomegalovirus antigenemia with symptomatic infection in solid organ transplant patients.Diagn Microbiol Infect Dis,1996,24:19
, http://www.100md.com
5 Reinke P,Fietze E,Ode-Hakin S et al.Late-acute renal allograft rejection and symptomless cytomegalovirus infection.Lancet,1994,344:1737
6 Kowdley KV,Fawaz KA,Kaplan MM.Extrahepatic biliary stricture associated with cytomegalovirus in a liver transplant recipient.Transpl Int,1996,9:161
7 Basgoz N,Preiksaitis J.Post-transplant lymphoproliferative disorder.Infect Dis Clin North Am,1995,9:901
8 Snydman DR,Werner BG,Dougherty NN et al.Cytomegalovirus immune globulin prophylaxis in liver transplantation:a randomized,double-blind,placebo-controlled trial.Ann Intern Med,1993,119:984
, 百拇医药
9 Falagas ME,Snydman DR,Ruthazer R et al.Primary cytomegalovirus infection in liver transplant recipients:Boston Center for Liver Transplantation CMVIG Study Group.Clin Infect Dis,1996,23:292
10 Manion DJ,Vibhagool A,Chou T-C et al.Susceptibility of human cytomegalovirus to two-drug combinations in vitro.Antiviral Ther,1996,1:237
11 Hooper DC,Pruitt AA,Rubin RH et al.Central nervous system infections in the chronically immunosuppressed.Medicine(Baltimore),1982,61:166
, 百拇医药
12 Rubin RH,Tolkoff-Rubin NE.Antimicrobial strategies in the care of organ transplant recipients.Antimicrobial Agents Chemother,1993,37:619
13 Hibberd PL,Tolkoff-Rubin NE,Conti D et al.Preemptive ganciclovir therapy to prevent cytomegalovirus disease in cytomegalovirus antibody-positive renal transplant recipients:a randomized controlled trial.Ann Intern Med,1995,123:18
14 Venkataramanan R,Habucky K,Burckart GJ et al.Clinical pharmacokinetics in organ transplant patients.Clin Pharmacokinet,1989,16:134
15 Amacher DE,Schomaker SJ,Retsema JA.Comparison of the effects of the new azalide antibiotic,azithromycin,and erythromycin estolate on rat liver cytochrom P-450.Antimicrob Agents Chemother,1991,36:1186
(1999-03-10收稿), 百拇医药
单位:南京军区南京总医院呼吸内科(南京,210002)
关键词:器官移植;并发症;防治原则
各种感染是器官移植患者最常见的危及生命的并发症
各种感染是器官移植患者最常见的危及生命的并发症。使用免疫抑制药物使患者发生感染的危险明显增加,而且这些患者的临床表现及影像学表现与免疫功能正常者有较大差别,给诊断和治疗带来了困难。本文就移植患者感染性并发症的特点及防治原则作一综述。
1 器官移植患者发生感染的危险因素
器官移植患者发生感染的危险因素主要有两方面:患者接触潜在致病原的强度及患者免疫抑制净状态。
, http://www.100md.com
1.1 接触潜在致病原 该因素包括社区性和医院内两方面。患者在社区内可接触到的致病原有各种呼吸道病毒及一些经食物传播的致病原,如沙门菌、产单孢李氏菌及空肠弯曲菌。免疫功能抑制可增加致病原侵入、播散及二重感染的危险。
医院内接触潜在致病原包括住院及非住院性因素。在住院患者主要为病室内空气或饮用水被曲菌、军团菌或革兰阴性菌(如绿脓杆菌)污染。近年来尚有院内对万古霉素耐药的粪肠球菌、抗甲氧苯青霉素的金黄色葡萄球菌(MRSA)及艰难梭菌暴发感染的报道。住院患者院内感染的特点为感染的发生在时间、地点上十分集中。
门诊患者院内因素是指患者在赴医院手术或摄片等时接触污染的空气。这种接触导致的感染也许更为常见,但因病例分散,故较难发现。当患者出现某种机会性感染,而其免疫抑制净状态又不至于导致这种感染时,应考虑到患者可能有异常致病原接触史。
1.2 免疫抑制净状态 免疫抑制净状态为多种因素交互作用的结果。其中最主要的因素包括免疫抑制治疗(剂量、疗程及使用各药物的时间顺序)、是否有具免疫调节功能的病毒感染(尤其是CMV,还包括EBV、HBV、HCV及HIV)及与移植手术有关的因素(残存坏死或损伤组织、积液未引流彻底等)。
, http://www.100md.com
2 器官移植患者发生感染的时间特点
所有实体器官移植后的免疫抑制治疗方案相似,均以环孢素和tacrolimus为抗排斥反应的核心药物。因此,移植术后出现何种感染具有相对固定的时间特点(图1)。根据移植术后感染的流行病学资料可大致划分三个时间段,即术后第一个月内、术后一个月至六个月及六个月以上[1]。下面简述在这三个不同时间段内发生感染的特征。


图1 移植术后出现感染的一般顺序
, http://www.100md.com
注:HSV单纯疱疹,RSV呼吸道合胞病毒,PTLD移植后淋巴增生病
2.1 移植术后第一个月内 在这段时间内出现的医院内细菌或真菌感染(包括手术创口、肺部、泌尿道或血管内留置管道的感染)与免疫功能正常的手术后患者相似,包括病毒、细菌及真菌等。术后出现感染机率的大小与下列因素有关,即血管内留置管及引流管放置时间的长短、气管插管时间的长短、有无放置斯坦特固定片或其它异物、有无坏死组织存在或积液等。如上述因素未妥善处理,预防性抗感染治疗只能使出现感染的时间延迟而已。
术后第一个月内不应出现一些机会性感染如卡氏肺孢子虫及星型奴卡菌感染。否则提示患者在移植术前即存在严重免疫功能低下、移植器官供体或受体本身患有这些病原体感染或患者有特殊接触史。尽管在这期间应用的免疫抑制药物量最大,但免疫抑制净效应主要取决于免疫抑制治疗维持量水平而非某一特定免疫抑制方案的短期效应。
在某些病例,感染可能通过移植的器官传播。有作者报道,接受者有系统性弓形虫或单纯疱疹病毒感染供体的器官导致移植患者出现上述病原体的全身性感染。在对供、受体进行评价时,关键要排除菌血症(包括真菌血症)的可能性,因为无论在器官供体还是在移植患者出现菌血症均可能导致移植器官感染,尤其是血管吻合处感染可导致真菌性血管瘤,一旦破裂会造成严重后果。
, http://www.100md.com
2.2 移植术一至六个月 器官移植一个月后,感染性疾病的性质出现变化。具有免疫调节功能的病毒感染开始成为主要矛盾,这些病毒包括巨细胞病毒(CMV)、Epstein-Barr病毒(EBV)、人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)及丙型肝炎病毒(HCV),其中尤以CMV为甚。持续的免疫抑制加上病毒感染使患者易于出现机会性感染,如卡氏肺孢子虫、曲菌及产单孢李氏菌(L.Monocytogenes)等。
2.3 移植术六个月后 器官移植六个月后,按其感染性疾病的特点可将患者分为三类:
2.3.1 80%以上的患者只需维持最小量的免疫抑制治疗,移植器官功能良好。这些患者出现的感染性疾病与一般人群相同,主要为呼吸道感染。机会性感染罕见,除非有特殊接触史。
2.3.2 约10%的患者患有慢性或进行性HBV、HCV、CMV、EBV或乳头瘤病毒感染。这些病毒感染可导致感染器官的损伤,如HBV造成肝脏损害、CMV造成视网膜损伤;或导致恶性肿瘤,如HBV或HCV感染后的肝细胞癌、EBV感染后的淋巴瘤及乳头瘤病毒感染导致的鳞状细胞癌。
, 百拇医药
2.3.3 另外5%~10%的患者可能出现反复或慢性排斥反应,使免疫抑制治疗强度增加,后者常导致慢性病毒感染。这些患者出现机会感染的机率最大,因此需要长期预防性使用复方新诺明,避免接触环境性致病因素,必要时应用预防性抗真菌治疗。
3 移植患者的几种主要致病原
3.1 CMV CMV感染不仅可直接造成组织损伤,还可产生许多间接作用[2](见图2)。患者一旦感染CMV(其实验室检查标志为血清学检查阳性),将终生携带病毒。在移植患者存在许多激活CMV的因素:应用抗淋巴细胞抗体及细胞毒性药物、排斥反应、全身感染及炎症反应。全身炎症反应伴有肿瘤坏死因子及其它亲炎性细胞因子的释放,后者通过刺激产生一系列细胞内信使而将CMV由静止状态激活,导致病毒复制。不同免疫抑制剂可通过不同环节影响病毒感染的发生发展:抗淋巴细胞抗体及细胞毒性药物可激活病毒,而糖皮质激素、环孢素及tacrolimus则通过抑制宿主抗病毒免疫反应促进病毒的扩散。

, http://www.100md.com
图2 CMV感染对移植患者的影响
移植术前血清学检查对评价CMV感染的危险性有重要价值。血清学阴性的器官受者接受血清学阳性供体的移植器官后出现临床CMV感染的危险性增加50%。但血清学(系列抗体滴度或IgM测定)对CMV感染的诊断意义有限。确诊有赖于发现病毒血症或感染组织活检证实有病毒侵犯。目前较好的诊断方法还有检测血标本中的病毒抗原或定量PCR分析[3,4]。
CMV感染的临床表现包括发热、全身不适,实验室检查异常包括白细胞减少、血小板减少、轻度异型淋巴细胞增多及轻度肝功能损害。移植器官似乎较自身器官更易受到CMV感染的损害。排斥反应与CMV感染之间的关系可能是双向的:一方面CMV感染可导致排斥,另一方面排斥反应引起的炎症又增加了病毒的复制[5,6]。因此,无论急性或各种形式的慢性排斥反应均与CMV感染有关。Reinke等[5]报道80%的经活检证实的晚期移植肾排斥反应经更昔洛韦治疗有效,而不需其它免疫抑制治疗。另有报道证实,CMV感染还可使移植后淋巴细胞增生性疾病的发生率显著增加[7]。
, http://www.100md.com
CMV感染的治疗常需经静脉使用更昔洛韦2~4周。因为CMV感染的复发率相当高(原发感染患者复发率为50%~75%,血清学阳性的患者,复发率为10%~20%),为减少复发及防止CMV对更昔洛韦的耐药性,应在证实病毒血症消失后方可停药。有些作者在重症或复发病例加用抗CMV超免疫球蛋白;另有作者在停用静脉更昔洛韦后,继续使用2~3个月的口服治疗[8,9]。在CMV处于高水平复制期间若更昔洛韦血药浓度过低(如口服用药时)可导致CMV对该药出现耐药。对耐更昔洛韦的CMV感染可采用膦甲酸(foscarnet)治疗,或联合应用多种抗病毒制剂[10]。
预防CMV感染具有重要价值。尽管目前尚无公认的预防性给药方案,以下三点值得强调:①预防用药的强度需与免疫抑制治疗强度一致,还需考虑到出现病毒复燃的危险性(如在应用抗淋巴细胞抗体治疗期间应予静脉内使用更昔洛韦);②预防性治疗应始于病毒复燃以前;③有效预防性抗病毒治疗(保持血清血检查阴性)需维持至少3个月,以避免疗程过短导致复发。
, 百拇医药
3.2 EBV及移植后淋巴增生病 接受维持性免疫抑制治疗的移植患者中约20%~30%存在EBV复制,而在接受抗淋巴细胞抗体治疗的患者中80%以上存在EBV复制。在某些患者EBV感染虽亦可导致类似CMV感染的单核细胞增多综合征,但EBV感染的主要意义在于可引起移植后淋巴细胞增生病[7]。通常为B淋巴细胞增生,严重程度不等;可为良性多克隆病变,亦可表现为高度恶性的单克隆淋巴瘤,对后者目前尚无有效治疗方法。移植后淋巴细胞增生病常表现为结外病变,侵犯脑、骨髓、移植器官、胃肠道及肝脏。出现移植后淋巴细胞增生病的危险因素包括免疫抑制治疗(使用抗淋巴细胞抗体、环孢素或tacrolimus等)、原发性EBV感染、口咽部高水平病毒复制及近期CMV感染。治疗主要为减少或停用免疫抑制剂[7]。
3.3 肺炎 肺部感染是移植患者最常见的感染性并发症。早期诊断及特异性治疗为治愈的关健,因此在这些患者应提倡积极使用创伤性诊断技术。
, 百拇医药 移植患者因其免疫功能低下,发生肺部感染时出现胸部X线异常可能较晚,且与免疫功能正常患者的表现有较大差异。胸部CT检查在评价移植患者肺部感染方面具有极其重要价值,尤其当胸片阴性或表现不典型时。胸部CT检查还有助于确定病变范围及指导选择最佳创伤性检查手段(如累及胸膜的局灶性病变可作经皮肺穿刺检查而弥漫性病变则需作经纤维支气管镜肺活检)。在机会性真菌或奴卡菌感染患者,确诊时应了解病变范围、认真观察所有部位病变对治疗的反应对指导治疗极为重要,应在所有病灶消失后方可考虑停药。CT表现不典型时提示可能存在多重感染。
3.4 中枢神经系统感染 移植患者中枢神经系统感染有四种典型的模式。
3.4.1 急性脑膜炎通常由产单孢李氏菌引起。
3.4.2 亚急性或慢性脑膜炎(发热、头痛持续数天或数周,有时伴神志改变)多为新型隐球菌感染,另亦可能为结核分枝杆菌、产单孢李氏菌、荚膜组织胞浆菌、星形奴卡菌、粪链球菌感染,或EBV相关性移植后淋巴增生病。
, 百拇医药
3.4.3 局灶性脑内感染,表现为癫痫或局部神经功能异常,可由产单孢李氏菌及星形奴卡菌感染引起,偶尔与移植后淋巴增生病有关,但最常见的原因为迁徙性曲菌感染。
3.4.4 进行性痴呆,伴或不伴有局部神经病变或癫痫,常与JC病毒(一种乳多空病毒)感染引起的多灶性脑白质病变有关,亦可能与其它一些病毒感染(包括单纯疱疹病毒、CMV及EBV)、神经脱髓鞘病变及环孢素或tacrolimus的毒性作用有关。
总之,产单孢李氏菌、新型隐球菌及烟曲菌为移植患者中枢神经系统感染的主要致病原[11]。移植患者中枢神经系统感染的临床表现与免疫功能正常患者有很大差异。尤其是免疫抑制治疗的抗炎作用可掩盖脑膜炎症反应的体征。在这种患者不明原因的发热及头痛提示为中枢神经系统感染,需立即行头颅CT及腰穿检查。
4 移植患者抗微生物治疗原则
, http://www.100md.com
移植患者的抗微生物治疗包括三方面:即治疗明确存在的感染;就某种特殊重要的感染对所有患者作预防性治疗(prophylactic therapy);及就某些感染对某些高危患者作提前治疗(preemptive therapy)。下面就预防性治疗和提前治疗作一简述。
4.1 预防治疗 对移植患者来说,最有效的预防性治疗为在移植术后4~12个月内服用复方新诺明。该治疗可有效地预防卡氏肺孢子虫肺炎及减少发生其它常见肺部感染(包括产单孢李氏菌、及星形奴卡菌)的危险性。在肾移植患者,预防性使用复方新诺明可使术后第一个月内泌尿道感染的发生率由30%~60%降至5%[12]。但预防性治疗的剂量及疗程需个体化。
4.2 提前治疗 提前治疗有两种方法。其一为对尚未出现临床症状,但已表现出具有某种特殊感染的危险因素的患者进行治疗,如给CMV抗体阳性同时接受抗淋巴细胞抗体治疗的移植患者进行小剂量更昔洛韦治疗,可使CMV感染发病率由65%减至20%以下[13]。另一方法为采用高度特异性检测手段对高危患者进行常规检测,如检测曲菌在呼吸道的定植(约65%的移植患者在发生曲菌呼吸道定植后可出现活动性曲菌感染)、CMV血症,并据此制定相应的提前治疗方案。
, http://www.100md.com
4.3 药物毒性问题 移植患者药物毒性多由药物的相互作用引起,而非单一药物的副作用所致[14]。可改变环孢素及tacrolimus代谢的药物往往为肝脏CYP3A(细胞色素P450-IIIA)酶系统的诱导物、抑制剂或底物。在移植患者存在三种常见的抗微生物药物与免疫抑制药物之间的相互作用。首先,利福平、异烟肼及新青Ⅲ等药物可引起环孢素或tacrolimus代谢的上调,导致在使用一定剂量免疫抑制剂时,血药浓度低于应有水平,从而增加排斥的危险。其次,某些药物可引起环孢素及tacrolimus代谢下调,导致使用一定剂量免疫抑制剂时,血药浓度高于应有水平,使肾损害及重症感染危险增加。可产生这一作用的药物通常有两大类:大环内酯类抗生素及azole类抗真菌药物(酮康唑、依曲康唑及氟康唑)[14,15]。最后,治疗浓度的免疫抑制剂与抗微生物药物相互作用还可产生两种肾毒性作用。第一,某些抗生素,如氟喹喏酮类药物和复方新诺明在低剂量时(如氧氟沙星每天200~400mg)患者耐受良好,剂量较高时则可引起环孢素或tacrolimus相关性肾损害[14]。第二,某些抗生素如两性霉素B及氨基糖甙类可于首剂治疗时导致肾毒性,且随着药物的继续使用,肾毒性的机会增加。
, 百拇医药
为避免药物相互作用导致的毒性反应,β-内酰胺类抗生素、小剂量氟喹喏酮类抗菌药物及中等剂量的氟康唑构成了移植患者抗微生物治疗的基石。同时,在开始及停用抗微生物治疗时对免疫抑制药物用药方案及剂量作适当调整亦十分重要。
参考文献
1 Rubin RH,Wolfson JS,Cosimi AB et al.Infection in the renal transplant patient.Am J Med,1981,70:405
2 Fietze E,Prosch S,Reinke P et al.Cytomegalovirus infection in transplant recipients:the role of tumor necrosis factor.Transplantation,1994,58:675
, 百拇医药 3 Manez R,Kusne S,Rinaldo C et al.Time to detection of cytomegalovirus (CMV) DNA in blood leukocytes is a predictor for the development of CMV disease in CMV-seronegative recipients of allografts from CMV-seropositive donors following liver transplantation.J Infect Dis,1996,173:1072
4 Niubo J,Perez JL,Martinez-Lacasa JT et al.Association of quantitative cytomegalovirus antigenemia with symptomatic infection in solid organ transplant patients.Diagn Microbiol Infect Dis,1996,24:19
, http://www.100md.com
5 Reinke P,Fietze E,Ode-Hakin S et al.Late-acute renal allograft rejection and symptomless cytomegalovirus infection.Lancet,1994,344:1737
6 Kowdley KV,Fawaz KA,Kaplan MM.Extrahepatic biliary stricture associated with cytomegalovirus in a liver transplant recipient.Transpl Int,1996,9:161
7 Basgoz N,Preiksaitis J.Post-transplant lymphoproliferative disorder.Infect Dis Clin North Am,1995,9:901
8 Snydman DR,Werner BG,Dougherty NN et al.Cytomegalovirus immune globulin prophylaxis in liver transplantation:a randomized,double-blind,placebo-controlled trial.Ann Intern Med,1993,119:984
, 百拇医药
9 Falagas ME,Snydman DR,Ruthazer R et al.Primary cytomegalovirus infection in liver transplant recipients:Boston Center for Liver Transplantation CMVIG Study Group.Clin Infect Dis,1996,23:292
10 Manion DJ,Vibhagool A,Chou T-C et al.Susceptibility of human cytomegalovirus to two-drug combinations in vitro.Antiviral Ther,1996,1:237
11 Hooper DC,Pruitt AA,Rubin RH et al.Central nervous system infections in the chronically immunosuppressed.Medicine(Baltimore),1982,61:166
, 百拇医药
12 Rubin RH,Tolkoff-Rubin NE.Antimicrobial strategies in the care of organ transplant recipients.Antimicrobial Agents Chemother,1993,37:619
13 Hibberd PL,Tolkoff-Rubin NE,Conti D et al.Preemptive ganciclovir therapy to prevent cytomegalovirus disease in cytomegalovirus antibody-positive renal transplant recipients:a randomized controlled trial.Ann Intern Med,1995,123:18
14 Venkataramanan R,Habucky K,Burckart GJ et al.Clinical pharmacokinetics in organ transplant patients.Clin Pharmacokinet,1989,16:134
15 Amacher DE,Schomaker SJ,Retsema JA.Comparison of the effects of the new azalide antibiotic,azithromycin,and erythromycin estolate on rat liver cytochrom P-450.Antimicrob Agents Chemother,1991,36:1186
(1999-03-10收稿), 百拇医药