非小细胞肺癌p16基因突变与表达的研究
作者:李伟峰 赵 彤 李晓丹 朱梅刚
单位:李伟峰(广州军区总医院呼吸内科,广州,510010);赵彤 朱梅刚(第一军医大学病理学教研室,广州,510515);李晓丹(广州军区医学高等专科学校内科教研室,广州,510315)
关键词:非小细胞肺癌;p16基因;免疫组织化学;聚合酶链反应;单链构象多态性
第一军医大学学报990306 摘要:目的 观察p16基因在非小细胞肺癌(Non-small cell lung cancer, NSCLC)中的表达与突变情况及其与NSCLC发生发展的关系。方法 应用免疫组织化学、PCR、PCR-SSCP技术对52例非小细胞肺癌石蜡标本进行p16蛋白及p16基因纯合性缺失与点突变检测。结果 发现44 (84.6%)例p16蛋白表达阳性,p16蛋白在良、恶性细胞中均有表达,肿瘤细胞中p16表达呈现异质性。各肿瘤类型中鳞癌和大细胞癌阳性率高于腺癌,但无显著差异。高分化腺癌阳性率高于低分化腺癌(P<0.005)。伴淋巴结转移组阳性率(63.1%)显著低于非转移组(96.9%)(P<0.005)。同步检测发现5例标本出现p16基因异常(4例纯合性缺失和1例点突变),相应p16蛋白亦表达缺失,且5例患者临床分期皆为期。结论 p16基因突变与表达缺失参予了NSCLC的发生发展过程,且与肿瘤分化、转移有关,但可能为肿瘤进程中的迟发事件。
, http://www.100md.com
中图分类法:R365.7
Mutation and expression of p16 gene in non-small cell lung cancer
Li Weifeng1, Zhao Tong2, Li Xiaodan3, Zhu Meigang2
1Department of Respiratary, Guangzhou Genernal Hospital of PLA, Guangzhou, 510010; 2Department of Pathology, First Military Medical University, Guangzhou, 510515; 1Deparment of Internal Medical, Guangzhou Medical College of PLA, Guangzhou, 510315Abstract: Objective To study the expression and mutation of p16 gene and its relationship with the carcinogenesis and advancement of non-small cell lung cancer (NSCLC). Methods Immunohistochemistry (IHC) was used to detect p16 protein and the PCR and PCR-SSCP were used in the sychronous detection of the genomic status of p16 gene in 52 samples. Results 44 samples (84.6%) were positive for p16 protein. Among the tumors, the expression level of p16 was lower in poorly-differentiated adenocarcinomas compared with those in well-differentiated adenocarcinomas (P<0.05), 8(15.4%) samples were negatively stained, including 7 patients with lymphnode metastasis, the expression rate of p16 was negatively correlated with the size of tumor and the number of lymphnode metastasis. Besides these, alterations of p16 gene were detected in 5 (4 homozygous detections and 1 point mutation) of 7 patients with p16 negative staining and with lymph-nodes metastases. Conclusions The inactivation of p16 is involved in the carcinogenesis and advancement of NSCLC and implicates in tumor differentiation and metastasis, and it is associated mainly with the p16 gene mutations.
, 百拇医药
Key words: non-small cell lung cancer; p16 gene; immunohistochemistry; PCR; PCR-SSCP
p16蛋白最初是从各种肿瘤病毒转化的细胞中鉴定出的一种CDK4相关蛋白 [1]。p16基因被发现后,已有一些文献[2~5]对其在肺癌中出现的基因缺失和突变进行了报道,但关于原发性肺癌中p16基因的突变和表达与患者的病理及临床资料相结合的研究目前还少见报道。本文采用免疫组化和PCR及PCR-SSCP技术对52例原发性非小细胞肺癌 (NSCLC) 同步进行p16基因的表达与突变研究,以探讨p16基因表达及突变与非小细胞肺癌一系列病理、临床资料之间的关系。
1 材料与方法
1.1 标本 52例原发非小细胞肺癌的石蜡包埋组织标本取自南方医院病理科1994~1995年的病理档案。按WHO标准分类,鳞癌23例,腺癌20例,大细胞癌9例。其中19例带淋巴结转移灶,蜡块制成5mm切片,载玻片预涂多聚赖氨酸,切片置于恒温烤箱60° C烤片2h,室温无尘保存。
, 百拇医药
1.2 抗体 兔抗人p16(N-10)多克隆抗体为美国Santa Cruz生物技术公司产品。LSAB试剂盒(Kit 9230)为福州迈新生物技术开发公司产品。
1.3 免疫组化染色 采用微波抗原修复技术,按试剂盒说明进行。
1.4 结果判定 采用双盲法,以细胞核、细胞浆或细胞膜呈清晰棕黄色为阳性。
1.5 统计分析 采用卡方检验。
1.6 DNA提取 连续切片2~5张 (5~10mm厚),置于载玻片上,二甲苯脱蜡2次,无水乙醇洗涤去除二甲苯,电扇吹干或室温晾干,将组织对照光镜下HE染色切片,用刀片最大程度地去除癌组织中的正常组织和坏死组织成份。剩余组织刮入Eppendorf管中,加入50~100ml消化液(50mmol/L Tris,1mmol EDTA,0.5% Tween20,100mg/L蛋白酶K),50° C孵育过夜,煮沸10min,离心(10000~12000r/min)沉淀未消化组织,取上清液为PCR模板,正常对照为每例患者的正常的淋巴结组织或肺组织。
, 百拇医药
1.7 PCR反应 应用两对引物,分别扩增外显子1和外显子2。同时为了确定模板DNA的质量,采用片断长度近似的b -actin基因的扩增产物为参照物(约400 bp),三对引物的序列及PCR扩增条件:外显子1,S1(sense)5`GCGCTACCTGATTCCAATTC, AS1(antisense) GCGCTACCTGATTCCAATTC。94 ° C,5min;一循环94℃、30s,65℃ (Tann),30s,72℃、30s;一循环Tann=63 ℃、30s;一循环Tann=61 ℃,30s;一循环Tann=59 ℃,30s;一循环Tann=57 ℃,30s;20循环Tann=55 ℃,30s。外显子,S2 (sense)5’-TGGCTCTGA CCATTCTGT,AS2 (antisense) 5’-AGCTTTGGAA-GCTCTCAG。94℃,5min;30循环94 ℃,30s;55℃,30s;72℃,30s。b-actin,S3 (sense)5`-GAAACTACCTTCAACTCCATCAS3 (antisense)5`-CTAGAAGCATTTGCGGGGACGAATGGAGGGG-CC。94 ℃,5min;35循环94℃,30s;55℃,2min;72℃,3min。该三对引物由陈艺华副教授在美国实验室合成后赠送。扩增体系为25ml反应体系,各成份浓度为:DNA模板5μl (约为100~200ng),50mmolKCl,10mmol Tris-HCl,pH8.3,1.5 mmol MgCl2,0.01%明胶,50m mol 4×dNTP,5% DMSO,1UTaq DNA聚合酶(加拿大真达公司),1 μmol/L引物。反应在Hema-480扩增仪(珠海黑马公司)中进行。扩增结束后,72℃延伸10min,PCR产物进行1.5%琼脂糖凝胶电泳。
, 百拇医药
1.8 PCR-SSCP分析 PCR扩增反应同前。以正常组织中的p16扩增产物为对照。取6ml 扩增产物,加18ml上样缓冲液(95%去离子甲酰胺,0.20mmol/L EDTA,0.025%溴酚蓝,0.025%二甲苯青蓝),97° C变性10min,冰浴骤冷10min,上样进行电泳。本实验SSCP分析的条件为:6%的丙烯酰胺-甲叉丙烯酰胺(29:1),10%甘油,0.5×TBE,13℃,电压400V,电泳至二甲苯青蓝接近凝胶下缘。
1.9 银染 取下凝胶,置于10%乙醇和0.5%乙酸溶液中固定10min,0.2%硝酸银染色15min,去离子水清洗2~3次,0.75M NaOH-0.8%甲醛显色10~15min,10%乙醇和0.5%乙酸中止显色。观察结果,在凝胶分析系统上照相,也可制成干胶保存结果用于分析。
2 结果
2.1 p16染色特征 在肺癌组织和癌旁正常组织,p16蛋白皆定位于细胞浆中,阳性产物呈弥漫或散在棕黄色分布,阳性细胞在各类型非小细胞肺癌中的分布无明显特征,且表达存在异质性。癌旁正常组织中,支气管粘膜上皮、浆液腺及肺泡上皮有较高水平的p16蛋白表达。肿瘤间质p16表达阴性。
, 百拇医药
2.2 p16表达特征 p16在不同组织学类型的非小细胞肺癌中的表达情况见表1,从表1可见p16蛋白在非小细胞肺癌中表达的总阳性率为84.6%。腺癌p16蛋白的阳性率低于鳞癌和大细胞癌,但无显著差异(P>0.05)。另外,随着分化程度的降低,p16表达的阳性率呈现下降的趋势,高分化的腺癌和鳞癌100% p16蛋白染色阳性,中分化腺癌和鳞癌中也仅各有10例阴性,p16基因的表达缺失主要发生在低分化的非小细胞肺癌中,其中低分化腺癌(9例)与高分化腺癌(6例)之间的p16蛋白阳性率有显著差异 (P<0.05)。
表1 p16在不同组织类型的NSCLC中的表达情况
Tab. 1 The expression of p16 in different tissue types of NSCLC
SCC: Squamous cell carcinoma; AC: Adenocarcinoma; LCC: Large cell carcinoma Tumor
, 百拇医药
n
p16 protein expression
Positive rate(%)
-
+
SCC*
23
2
21
91.3
AC*
20
, 百拇医药
5
15
75.0
LCC*
9
1
8
88.8
Total
52
8
44
84.6
, http://www.100md.com
p16蛋白在肺癌原发灶中的表达与淋巴结转移的关系见表2,19例发生淋巴结转移的患者,7例原发灶p16蛋白表达阴性,占全部阴性表达的85.5% (7/8),统计学处理结果表明p16蛋白表达阳性率与非小细胞肺癌淋巴结转移呈非常显著的相关性(P<0.01)。
表2 p16表达与非小细胞肺癌淋巴结转移关系
Tab. 2 The relationship between p16 expression and lymphnode metastasis Metastasis
n
Positive cases
Positive rate (%)
+
, 百拇医药
19
12
63.2
-
34
33
97.1
2.3 PCR及PCR-SSCP分析 52例原发性非小细胞肺癌病例,47例基因组DNA质量符合PCR扩增p16基因外显子1、2的要求。1.5%琼脂糖电泳检测p16基因纯合性缺失情况,发现4例出现p16基因外显子1、2的缺失,且缺失皆为1、2外显子的共同缺失。而在43例患者的SSCP分析中发现1例出现p16基因第2外显子的单链DNA泳动异常。将此结果与p16基因产物表达结果相比较,发现该5例p16基因突变者均为p16蛋白表达阴性的淋巴结转移病例,临床资料显示皆为肺癌TNM III期(图1、2)。
, 百拇医药
图1 1.5%琼脂糖电泳检测p16基因纯合性缺失外显子点突变
Fig.1 Detection of homozygous detections of exon1 and exon2 in the p16 and p15 genes in a 1.5% agarose gel
Lane 1, 3, 5, 7: Lung cancer tissue; Lane2, 4, 6, 8: Normal tissue Lane 5: Abnormal mobility shifts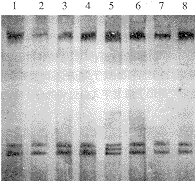
图2 SSCP方法检测p16基因第二外显子点突变
Fig.2 PCR-SSCP analysis of the exon2 in the p16 genes
, http://www.100md.com
Lane 2,7: Homozyous detections of exon1 and exon2 in p16 genes are observed
3 讨论
p16基因近来被认为是一个与多种肿瘤发生有关的新的肿瘤抑制基因。在人类,该基因主要通过其蛋白产物与细胞周期蛋白依赖性激酶4或6(CDK4或CDK6)竞争结合,直接阻止后二者与细胞周期蛋白1(cyclin D1)形成复合物,从而导致该复合物的一系列底物(如Rb)保持持续去磷酸化高活性,使细胞周期停滞在G1/S期,因而抑制细胞增殖,呈现抑癌基因作用[6~7]。肺癌中,小细胞肺癌尚未检测到p16基因突变存在,这可能与SCLC中染色体丢失的最常见区域为3P而非9P有关[8~9]。因此p16基因与肺癌关系的研究主要集中于非小细胞肺癌。
本实验中,52例原发性NSCLC的p16蛋白染色阳性率为84.6%,说明p16基因异常在NSCLC中可能并非频发事件。我们将p16蛋白染色阳性率与肿瘤患者的NSCLC组织学分型,分化程度进行相关分析后,结果发现,在不同组织类型的NSCLC中,腺癌p16蛋白表达阳性率低于鳞癌和大细胞癌,且腺癌中p16蛋白缺失率与其分化程度呈负相关,高分化腺癌与低分化腺癌之间的p16表达阳性率有显著差异(P<0.05),鳞癌中p16表达阳性率也随分化程度降低呈现下降趋势。另外,肺鳞、腺癌中p16表达强阳性者(+++)大多分布在分化程度较高的肿瘤中,表明p16基因表达失活可能与肺癌分化不良有关。
, http://www.100md.com
本实验显示,p16蛋白表达缺失与NSCLC患者有无淋巴结转移之间具有显著相关性。肺癌在临床上具有发现晚、发展快,转移早及预后差的特点,而淋巴结转移是公认的肺癌预后不良的最重要指标,因此,判断及预测肺癌淋巴结转移趋势,具有重要的临床意义。我们的实验结果发现p16蛋白的表达丧失几乎都出现在伴有淋巴结转移的NSCLC中,提示p16基因的失活对非小细胞肺癌细胞演进及获得转移能力可能具有重要作用。
p16基因的突变方式与其它已发现的抑癌基因不同,主要以纯合性缺失为主[1]。在某些肿瘤细胞系中,p16基因的纯合缺失率可超过75%,但象点突变和读框移位等微小的基因组改变则往往较少发生[10]。本研究中,我们应用PCR技术扩增p16基因,并使用其扩增产物进行SSCP分析,方法简便、快速且经济合算。本文结果中,共发现5/47例患者出现p16基因突变,5其中纯合性缺失占多数(4/5),结果与Nakagawa等[11]的发现相一致。对比PCR结果与免疫组化结果,4例缺失皆发生在p16蛋白染色阴性者中,这一结果一方面证实了PCR结果的真实性和可靠性,另一方面表明p16基因的纯合缺失可能为p16蛋白产物表达丧失的主要原因,但可能尚有其它调节机制异常导致此现象[4~5,12]。关于p16基因突变在非小细胞肺癌演进中的发生时期,目前的研究意见尚不一致,本实验中出现p16基因突变的5例人均伴有淋巴结转移灶,且临床TNM分期皆为III期,结果支持p16基因异常为一晚期事件的观点。
, 百拇医药
作者简介:李伟峰,男,1969年出生;1997年毕业于第一军医大学;硕士,医师,电话:86662205-53555
参考文献
1 Nobori T, Muira K, Wu D et al. Deletions of the cyclin-dependent kinase-4 inhibitor gene in multiple human cancers. Nature(Lond.), 1994, 386(2):753
2 OkamotoA, Demetrick D J, SpilareE A et al. Mutations and altered expression of p16 in human cancer.PNAS-USA, 1994, 91(24): 11045
3 Hayashi N, Sugimoto Y, Tsuchiva E et al. Somatic mutations of the MTSI/CDK4I gene in human primary non-small cell lung carcinoma. Biochem Biophy Res Commun, 1994, 202(4):1426
, 百拇医药
4 Okamoto A, Husain PE, Hagiware K et al.. Mutations in the p16INK4/MTSI/CDKN2, p15INK4B/MTS2, and p18 genes in primary and Metastatic Lung Cancer. Cancer Res, 1994, 55(5):1448
5 Washimi O, Nagatake M, Osada H et al . In vivo occurrence of p16 (MTSI) and p15 (MTS2) alterations preferentially in non-small cell lung cancers. Cancer Res, 1995, 55(2):514
6 Mieke S, Ralph H H, Joseph G et al. Abrogation of the Rb/p16 tumor-suppressive pathway in virtually all pancreatic carcinoma. Cancer Res, 1997, 57: 3126
, 百拇医药
7 Kelley MJ, Nakagawa K, Steinberg SM et al.. Differential inactivation of CDKN2 and Rb protein in non-small cell lung cancer cell lines. J Natl Cancer Inst , 1995, 87(10):756
8 Johnson BE, Kelley MJ. Biology of small cell lung cancer. Lung Cancer, 1995,12 (Supple 3):S5
9 Jonathan S W, Wilbur A F, John T O et al.. Identific action of a Novel Region of Homozygous Deletion on chromosome 9P in Squamous Cell carcinoma of the lung: location of putative tumor suppressor gene. Cancer Res. 1997, 57: 1
, 百拇医药
10 Kamb A, Gruis N A, Weaver F J et al. A cell cycle regulator potentially involved in genesis of many tumor types. Science (Washington DC), 1994, 264(2): 436.
11 Nakagawa K, Conrad NK, Williams JP et al. Mechanism of inactivation of CDKN2 and MTS2 in non-small cell lung cancer and association with advanced stage. Oncogene, 1995,11(9):1843
12 Lo KW, Cheung ST, Leung SF et al. Hypermethylation of the p16 gene in nasopharyngeal carcinoma. Cancer Res, 1996, 56 (12) : 2721
(收稿日期:1998-08-02), 百拇医药
单位:李伟峰(广州军区总医院呼吸内科,广州,510010);赵彤 朱梅刚(第一军医大学病理学教研室,广州,510515);李晓丹(广州军区医学高等专科学校内科教研室,广州,510315)
关键词:非小细胞肺癌;p16基因;免疫组织化学;聚合酶链反应;单链构象多态性
第一军医大学学报990306 摘要:目的 观察p16基因在非小细胞肺癌(Non-small cell lung cancer, NSCLC)中的表达与突变情况及其与NSCLC发生发展的关系。方法 应用免疫组织化学、PCR、PCR-SSCP技术对52例非小细胞肺癌石蜡标本进行p16蛋白及p16基因纯合性缺失与点突变检测。结果 发现44 (84.6%)例p16蛋白表达阳性,p16蛋白在良、恶性细胞中均有表达,肿瘤细胞中p16表达呈现异质性。各肿瘤类型中鳞癌和大细胞癌阳性率高于腺癌,但无显著差异。高分化腺癌阳性率高于低分化腺癌(P<0.005)。伴淋巴结转移组阳性率(63.1%)显著低于非转移组(96.9%)(P<0.005)。同步检测发现5例标本出现p16基因异常(4例纯合性缺失和1例点突变),相应p16蛋白亦表达缺失,且5例患者临床分期皆为期。结论 p16基因突变与表达缺失参予了NSCLC的发生发展过程,且与肿瘤分化、转移有关,但可能为肿瘤进程中的迟发事件。
, http://www.100md.com
中图分类法:R365.7
Mutation and expression of p16 gene in non-small cell lung cancer
Li Weifeng1, Zhao Tong2, Li Xiaodan3, Zhu Meigang2
1Department of Respiratary, Guangzhou Genernal Hospital of PLA, Guangzhou, 510010; 2Department of Pathology, First Military Medical University, Guangzhou, 510515; 1Deparment of Internal Medical, Guangzhou Medical College of PLA, Guangzhou, 510315Abstract: Objective To study the expression and mutation of p16 gene and its relationship with the carcinogenesis and advancement of non-small cell lung cancer (NSCLC). Methods Immunohistochemistry (IHC) was used to detect p16 protein and the PCR and PCR-SSCP were used in the sychronous detection of the genomic status of p16 gene in 52 samples. Results 44 samples (84.6%) were positive for p16 protein. Among the tumors, the expression level of p16 was lower in poorly-differentiated adenocarcinomas compared with those in well-differentiated adenocarcinomas (P<0.05), 8(15.4%) samples were negatively stained, including 7 patients with lymphnode metastasis, the expression rate of p16 was negatively correlated with the size of tumor and the number of lymphnode metastasis. Besides these, alterations of p16 gene were detected in 5 (4 homozygous detections and 1 point mutation) of 7 patients with p16 negative staining and with lymph-nodes metastases. Conclusions The inactivation of p16 is involved in the carcinogenesis and advancement of NSCLC and implicates in tumor differentiation and metastasis, and it is associated mainly with the p16 gene mutations.
, 百拇医药
Key words: non-small cell lung cancer; p16 gene; immunohistochemistry; PCR; PCR-SSCP
p16蛋白最初是从各种肿瘤病毒转化的细胞中鉴定出的一种CDK4相关蛋白 [1]。p16基因被发现后,已有一些文献[2~5]对其在肺癌中出现的基因缺失和突变进行了报道,但关于原发性肺癌中p16基因的突变和表达与患者的病理及临床资料相结合的研究目前还少见报道。本文采用免疫组化和PCR及PCR-SSCP技术对52例原发性非小细胞肺癌 (NSCLC) 同步进行p16基因的表达与突变研究,以探讨p16基因表达及突变与非小细胞肺癌一系列病理、临床资料之间的关系。
1 材料与方法
1.1 标本 52例原发非小细胞肺癌的石蜡包埋组织标本取自南方医院病理科1994~1995年的病理档案。按WHO标准分类,鳞癌23例,腺癌20例,大细胞癌9例。其中19例带淋巴结转移灶,蜡块制成5mm切片,载玻片预涂多聚赖氨酸,切片置于恒温烤箱60° C烤片2h,室温无尘保存。
, 百拇医药
1.2 抗体 兔抗人p16(N-10)多克隆抗体为美国Santa Cruz生物技术公司产品。LSAB试剂盒(Kit 9230)为福州迈新生物技术开发公司产品。
1.3 免疫组化染色 采用微波抗原修复技术,按试剂盒说明进行。
1.4 结果判定 采用双盲法,以细胞核、细胞浆或细胞膜呈清晰棕黄色为阳性。
1.5 统计分析 采用卡方检验。
1.6 DNA提取 连续切片2~5张 (5~10mm厚),置于载玻片上,二甲苯脱蜡2次,无水乙醇洗涤去除二甲苯,电扇吹干或室温晾干,将组织对照光镜下HE染色切片,用刀片最大程度地去除癌组织中的正常组织和坏死组织成份。剩余组织刮入Eppendorf管中,加入50~100ml消化液(50mmol/L Tris,1mmol EDTA,0.5% Tween20,100mg/L蛋白酶K),50° C孵育过夜,煮沸10min,离心(10000~12000r/min)沉淀未消化组织,取上清液为PCR模板,正常对照为每例患者的正常的淋巴结组织或肺组织。
, 百拇医药
1.7 PCR反应 应用两对引物,分别扩增外显子1和外显子2。同时为了确定模板DNA的质量,采用片断长度近似的b -actin基因的扩增产物为参照物(约400 bp),三对引物的序列及PCR扩增条件:外显子1,S1(sense)5`GCGCTACCTGATTCCAATTC, AS1(antisense) GCGCTACCTGATTCCAATTC。94 ° C,5min;一循环94℃、30s,65℃ (Tann),30s,72℃、30s;一循环Tann=63 ℃、30s;一循环Tann=61 ℃,30s;一循环Tann=59 ℃,30s;一循环Tann=57 ℃,30s;20循环Tann=55 ℃,30s。外显子,S2 (sense)5’-TGGCTCTGA CCATTCTGT,AS2 (antisense) 5’-AGCTTTGGAA-GCTCTCAG。94℃,5min;30循环94 ℃,30s;55℃,30s;72℃,30s。b-actin,S3 (sense)5`-GAAACTACCTTCAACTCCATCAS3 (antisense)5`-CTAGAAGCATTTGCGGGGACGAATGGAGGGG-CC。94 ℃,5min;35循环94℃,30s;55℃,2min;72℃,3min。该三对引物由陈艺华副教授在美国实验室合成后赠送。扩增体系为25ml反应体系,各成份浓度为:DNA模板5μl (约为100~200ng),50mmolKCl,10mmol Tris-HCl,pH8.3,1.5 mmol MgCl2,0.01%明胶,50m mol 4×dNTP,5% DMSO,1UTaq DNA聚合酶(加拿大真达公司),1 μmol/L引物。反应在Hema-480扩增仪(珠海黑马公司)中进行。扩增结束后,72℃延伸10min,PCR产物进行1.5%琼脂糖凝胶电泳。
, 百拇医药
1.8 PCR-SSCP分析 PCR扩增反应同前。以正常组织中的p16扩增产物为对照。取6ml 扩增产物,加18ml上样缓冲液(95%去离子甲酰胺,0.20mmol/L EDTA,0.025%溴酚蓝,0.025%二甲苯青蓝),97° C变性10min,冰浴骤冷10min,上样进行电泳。本实验SSCP分析的条件为:6%的丙烯酰胺-甲叉丙烯酰胺(29:1),10%甘油,0.5×TBE,13℃,电压400V,电泳至二甲苯青蓝接近凝胶下缘。
1.9 银染 取下凝胶,置于10%乙醇和0.5%乙酸溶液中固定10min,0.2%硝酸银染色15min,去离子水清洗2~3次,0.75M NaOH-0.8%甲醛显色10~15min,10%乙醇和0.5%乙酸中止显色。观察结果,在凝胶分析系统上照相,也可制成干胶保存结果用于分析。
2 结果
2.1 p16染色特征 在肺癌组织和癌旁正常组织,p16蛋白皆定位于细胞浆中,阳性产物呈弥漫或散在棕黄色分布,阳性细胞在各类型非小细胞肺癌中的分布无明显特征,且表达存在异质性。癌旁正常组织中,支气管粘膜上皮、浆液腺及肺泡上皮有较高水平的p16蛋白表达。肿瘤间质p16表达阴性。
, 百拇医药
2.2 p16表达特征 p16在不同组织学类型的非小细胞肺癌中的表达情况见表1,从表1可见p16蛋白在非小细胞肺癌中表达的总阳性率为84.6%。腺癌p16蛋白的阳性率低于鳞癌和大细胞癌,但无显著差异(P>0.05)。另外,随着分化程度的降低,p16表达的阳性率呈现下降的趋势,高分化的腺癌和鳞癌100% p16蛋白染色阳性,中分化腺癌和鳞癌中也仅各有10例阴性,p16基因的表达缺失主要发生在低分化的非小细胞肺癌中,其中低分化腺癌(9例)与高分化腺癌(6例)之间的p16蛋白阳性率有显著差异 (P<0.05)。
表1 p16在不同组织类型的NSCLC中的表达情况
Tab. 1 The expression of p16 in different tissue types of NSCLC
SCC: Squamous cell carcinoma; AC: Adenocarcinoma; LCC: Large cell carcinoma Tumor
, 百拇医药
n
p16 protein expression
Positive rate(%)
-
+
SCC*
23
2
21
91.3
AC*
20
, 百拇医药
5
15
75.0
LCC*
9
1
8
88.8
Total
52
8
44
84.6
, http://www.100md.com
p16蛋白在肺癌原发灶中的表达与淋巴结转移的关系见表2,19例发生淋巴结转移的患者,7例原发灶p16蛋白表达阴性,占全部阴性表达的85.5% (7/8),统计学处理结果表明p16蛋白表达阳性率与非小细胞肺癌淋巴结转移呈非常显著的相关性(P<0.01)。
表2 p16表达与非小细胞肺癌淋巴结转移关系
Tab. 2 The relationship between p16 expression and lymphnode metastasis Metastasis
n
Positive cases
Positive rate (%)
+
, 百拇医药
19
12
63.2
-
34
33
97.1
2.3 PCR及PCR-SSCP分析 52例原发性非小细胞肺癌病例,47例基因组DNA质量符合PCR扩增p16基因外显子1、2的要求。1.5%琼脂糖电泳检测p16基因纯合性缺失情况,发现4例出现p16基因外显子1、2的缺失,且缺失皆为1、2外显子的共同缺失。而在43例患者的SSCP分析中发现1例出现p16基因第2外显子的单链DNA泳动异常。将此结果与p16基因产物表达结果相比较,发现该5例p16基因突变者均为p16蛋白表达阴性的淋巴结转移病例,临床资料显示皆为肺癌TNM III期(图1、2)。

, 百拇医药
图1 1.5%琼脂糖电泳检测p16基因纯合性缺失外显子点突变
Fig.1 Detection of homozygous detections of exon1 and exon2 in the p16 and p15 genes in a 1.5% agarose gel
Lane 1, 3, 5, 7: Lung cancer tissue; Lane2, 4, 6, 8: Normal tissue Lane 5: Abnormal mobility shifts

图2 SSCP方法检测p16基因第二外显子点突变
Fig.2 PCR-SSCP analysis of the exon2 in the p16 genes
, http://www.100md.com
Lane 2,7: Homozyous detections of exon1 and exon2 in p16 genes are observed
3 讨论
p16基因近来被认为是一个与多种肿瘤发生有关的新的肿瘤抑制基因。在人类,该基因主要通过其蛋白产物与细胞周期蛋白依赖性激酶4或6(CDK4或CDK6)竞争结合,直接阻止后二者与细胞周期蛋白1(cyclin D1)形成复合物,从而导致该复合物的一系列底物(如Rb)保持持续去磷酸化高活性,使细胞周期停滞在G1/S期,因而抑制细胞增殖,呈现抑癌基因作用[6~7]。肺癌中,小细胞肺癌尚未检测到p16基因突变存在,这可能与SCLC中染色体丢失的最常见区域为3P而非9P有关[8~9]。因此p16基因与肺癌关系的研究主要集中于非小细胞肺癌。
本实验中,52例原发性NSCLC的p16蛋白染色阳性率为84.6%,说明p16基因异常在NSCLC中可能并非频发事件。我们将p16蛋白染色阳性率与肿瘤患者的NSCLC组织学分型,分化程度进行相关分析后,结果发现,在不同组织类型的NSCLC中,腺癌p16蛋白表达阳性率低于鳞癌和大细胞癌,且腺癌中p16蛋白缺失率与其分化程度呈负相关,高分化腺癌与低分化腺癌之间的p16表达阳性率有显著差异(P<0.05),鳞癌中p16表达阳性率也随分化程度降低呈现下降趋势。另外,肺鳞、腺癌中p16表达强阳性者(+++)大多分布在分化程度较高的肿瘤中,表明p16基因表达失活可能与肺癌分化不良有关。
, http://www.100md.com
本实验显示,p16蛋白表达缺失与NSCLC患者有无淋巴结转移之间具有显著相关性。肺癌在临床上具有发现晚、发展快,转移早及预后差的特点,而淋巴结转移是公认的肺癌预后不良的最重要指标,因此,判断及预测肺癌淋巴结转移趋势,具有重要的临床意义。我们的实验结果发现p16蛋白的表达丧失几乎都出现在伴有淋巴结转移的NSCLC中,提示p16基因的失活对非小细胞肺癌细胞演进及获得转移能力可能具有重要作用。
p16基因的突变方式与其它已发现的抑癌基因不同,主要以纯合性缺失为主[1]。在某些肿瘤细胞系中,p16基因的纯合缺失率可超过75%,但象点突变和读框移位等微小的基因组改变则往往较少发生[10]。本研究中,我们应用PCR技术扩增p16基因,并使用其扩增产物进行SSCP分析,方法简便、快速且经济合算。本文结果中,共发现5/47例患者出现p16基因突变,5其中纯合性缺失占多数(4/5),结果与Nakagawa等[11]的发现相一致。对比PCR结果与免疫组化结果,4例缺失皆发生在p16蛋白染色阴性者中,这一结果一方面证实了PCR结果的真实性和可靠性,另一方面表明p16基因的纯合缺失可能为p16蛋白产物表达丧失的主要原因,但可能尚有其它调节机制异常导致此现象[4~5,12]。关于p16基因突变在非小细胞肺癌演进中的发生时期,目前的研究意见尚不一致,本实验中出现p16基因突变的5例人均伴有淋巴结转移灶,且临床TNM分期皆为III期,结果支持p16基因异常为一晚期事件的观点。
, 百拇医药
作者简介:李伟峰,男,1969年出生;1997年毕业于第一军医大学;硕士,医师,电话:86662205-53555
参考文献
1 Nobori T, Muira K, Wu D et al. Deletions of the cyclin-dependent kinase-4 inhibitor gene in multiple human cancers. Nature(Lond.), 1994, 386(2):753
2 OkamotoA, Demetrick D J, SpilareE A et al. Mutations and altered expression of p16 in human cancer.PNAS-USA, 1994, 91(24): 11045
3 Hayashi N, Sugimoto Y, Tsuchiva E et al. Somatic mutations of the MTSI/CDK4I gene in human primary non-small cell lung carcinoma. Biochem Biophy Res Commun, 1994, 202(4):1426
, 百拇医药
4 Okamoto A, Husain PE, Hagiware K et al.. Mutations in the p16INK4/MTSI/CDKN2, p15INK4B/MTS2, and p18 genes in primary and Metastatic Lung Cancer. Cancer Res, 1994, 55(5):1448
5 Washimi O, Nagatake M, Osada H et al . In vivo occurrence of p16 (MTSI) and p15 (MTS2) alterations preferentially in non-small cell lung cancers. Cancer Res, 1995, 55(2):514
6 Mieke S, Ralph H H, Joseph G et al. Abrogation of the Rb/p16 tumor-suppressive pathway in virtually all pancreatic carcinoma. Cancer Res, 1997, 57: 3126
, 百拇医药
7 Kelley MJ, Nakagawa K, Steinberg SM et al.. Differential inactivation of CDKN2 and Rb protein in non-small cell lung cancer cell lines. J Natl Cancer Inst , 1995, 87(10):756
8 Johnson BE, Kelley MJ. Biology of small cell lung cancer. Lung Cancer, 1995,12 (Supple 3):S5
9 Jonathan S W, Wilbur A F, John T O et al.. Identific action of a Novel Region of Homozygous Deletion on chromosome 9P in Squamous Cell carcinoma of the lung: location of putative tumor suppressor gene. Cancer Res. 1997, 57: 1
, 百拇医药
10 Kamb A, Gruis N A, Weaver F J et al. A cell cycle regulator potentially involved in genesis of many tumor types. Science (Washington DC), 1994, 264(2): 436.
11 Nakagawa K, Conrad NK, Williams JP et al. Mechanism of inactivation of CDKN2 and MTS2 in non-small cell lung cancer and association with advanced stage. Oncogene, 1995,11(9):1843
12 Lo KW, Cheung ST, Leung SF et al. Hypermethylation of the p16 gene in nasopharyngeal carcinoma. Cancer Res, 1996, 56 (12) : 2721
(收稿日期:1998-08-02), 百拇医药