5α-胆甾烷-3β,7-二醇水溶性衍生物的合成及体外抗癌活性
作者:李文姬 容士宏
单位:沈阳药科大学化学制药教研室,沈阳110015
关键词:氧代固醇;抗癌活性;合成
摘 要 为考察胆甾摘 要 为考察胆甾-5-烯-3β,7β-二醇双琥珀酸单酯钠(RS 034)结构中的5,6-双键是否为其产生抗癌活性的必要部位,合成了5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及其水溶性衍生物——乙醇胺盐(6)、哌嗪盐(7)及N-2-羟乙基哌嗪盐(8),体外抗癌活性试验表明,所合成的化合物均具有一定程度的抗癌活性.
Synthesis of Water-soluble Derivatives of 5α-Cholestane-
3β,7-diol and Their in vitro Anticancer Activities
, 百拇医药
Li Wenji,Rong Shihong
(Department of Chemical Pharmaceuticals ,Shenyang
Pharmaceutical Unive rsity,Shenyang 110015)
Abstract In order to investigate whether the 5,6-double bond of cholest-5-ene-3β,7β-diol 3,7-bishemisuccinate plays an important ro le in its anticancer activity,5α-cholestane-3β,7-diol 3-hemisuccinate and i ts water-soluble derivati ves—its salts of ethanolamine,piperazine and N-2-hydroxylamine were synth esized.Their in vitro tests demonstrated that the target compounds all posse s sed anticancer activities.
, 百拇医药
Key words oxysterols;anticancer activity;synthesis
本世纪70年代中期,郑国平〔1〕从中药僵蚕中提取出7β-羟基胆固醇,体外试验证明,它对小鼠的肝癌细胞具有细胞溶解作用,并有较好的选择性,但体内试验结果不稳定.之后,容士宏〔2〕合成了它的水溶性衍生物7β-羟基胆固醇双琥珀酸单酯钠(RS034),该化合物对接种了腹水癌细胞的小鼠呈现较强的抗癌活性,在随后进行的构效关系研究〔3〕中发现,一些与RS034结构类似的化合物也具有抗癌活性,为进一步探讨7β-羟基胆固醇中5,6-双键所起的作用,合成了5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及其盐类衍生物——乙醇胺盐(6)、哌嗪盐(7)及N-2-羟乙基哌嗪盐(8),并对其进行了抗癌活性试验.
1 合成路线
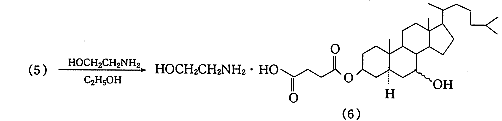
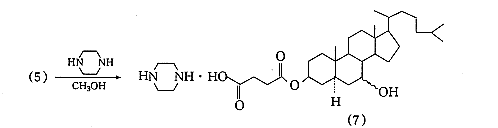
据Wintersteiner等〔4〕报道,由于5α-胆甾烷-3β,7-二醇未能由7-羟基胆固醇直接氢化制得,采用7-氧代胆固醇醋酸酯为起始原料,以氧化铂为催化剂,将双键和羰基同时还原然后水解制得;或在不同的溶剂中先将双键饱和,再将双键还原后水解得目标化合物.此外,Marker等〔5〕报道用异丙醇铝将胆甾烷-3β-醇-7-酮3-醋酸酯还原后水解制备胆甾烷-3β,7-二醇的方法.经比较采用分两步还原的方法:以氧化铂为催化剂,醋酸乙酯为溶剂,常温常压下,先将7-氧代胆固醇醋酸酯的5,6-双键饱和,再改用冰醋酸为溶剂在相同条件下,将羰基还原为羟基,最后将醋酸酯在碱性下水解.其优点是操作简便且收率高.起始原料7-氧代胆固醇醋酸酯,参考Salmond等〔6〕报道的方法制得.5α-胆甾烷-3β,7-二醇的琥珀酰化是以甲苯为反应介质在吡啶存在下进行的,将制得的胆甾烷-3β,7-二醇3-琥珀酸单酯分别与乙醇胺、哌嗪及N-2-羟乙基哌嗪成盐,得到目标化合物(6),(7),(8).合成路线见图1.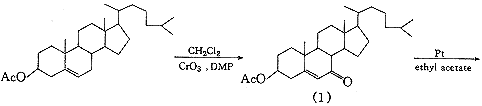
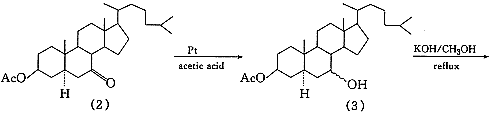

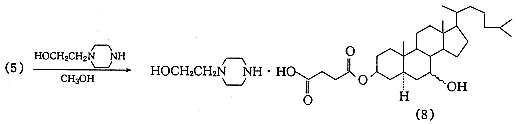
, 百拇医药
Fig.1 The synthesis route of the aim compounds
2 合成实验
熔点用毛细管法测定,温度未经校正.红外光谱用IFS55傅立叶红外光谱仪测定,KBr压片.1H-NMR谱用ARX-300核磁共振仪测定.元素分析用意大利Carlo-Erba1106型有机元素分析仪测定.质谱用VG7070E型质谱仪测定.
2.1 7-氧代胆固醇醋酸酯(1)的制备
将25g3,5-二甲基吡唑(DMP)加入200mL干燥二氯甲烷中,冷却至-15℃,搅拌全溶后慢慢加入25g三氧化铬,控制温度在-10℃以下,加完后降温至-15℃,慢慢加入10g胆固醇醋酸酯,并在此温度下搅拌5h,然后升温至0~5℃,加入10%盐酸130mL,搅拌1h.将反应液倾入分液漏斗中,分出酸水层(酸水层保存),二氯甲烷层用5%盐酸洗(100mL×3),再用水洗(100mL×3,酸水层保存).二氯甲烷溶液减压蒸除大部分二氯甲烷,加入少量无水乙醚,用硅胶柱层析,二氯甲烷-乙醚(v∶v=1∶1)洗脱,洗脱液减压浓缩后以95%乙醇重结晶,得白色针状产物结晶7.0g,收率:69.0%,mp156~158℃(文献〔4〕mp157~158℃).1H-NMR(CDCl3)δ:5.70(1H,s,6-H),4.70(1H,m,3α-H),2.19(3H,s,3-COCH3),1.20(3H,s,19-CH3),0.64(3H,s,18-CH3);IR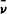 cm-1:2947,2871(C-H),1735(C=O),1671(C=O,环酮),1631(C=C),1241(C=O).
cm-1:2947,2871(C-H),1735(C=O),1671(C=O,环酮),1631(C=C),1241(C=O).
, 百拇医药
将上述酸水层合并,用1mol/L氢氧化钠溶液调至pH11~12,用乙醚提取(100mL×3),回收乙醚,得白色结晶状化合物3,5-二甲基吡唑12.5g,mp106~108℃.
2.2 5α-胆甾烷-3β-醇-7-酮3-醋酸酯(2)的制备
将5.0g7-氧代胆固醇醋酸酯(1)溶于80mL醋酸乙酯中,吸入新制备的铂催化剂,常温常压下催化氢化,至板层检测无荧光点,滤除铂粉(保留),母液减压浓缩至干,析出片状结晶4.9g,收率:98.1%,mp148~149℃(文献〔4〕mp148~149℃).1H-NMR(CDCl3)δ:4.70(1H,m,3α-H),2.30(1H,t,5α-H),2.20(1H,s,6α-H),2.10(1H,s,6β-H),1.20(3H,s,19-CH3),0.60(3H,s,18-CH3);IR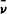 cm-1:3401(H2O),2950(C-H),1731(C=O,酯),1706(C=O,环酮),1264(C-O).
cm-1:3401(H2O),2950(C-H),1731(C=O,酯),1706(C=O,环酮),1264(C-O).
, 百拇医药
2.3 5α-胆甾烷-3β,7-二醇3-醋酸酯(3)的制备
将2.0g5α-胆甾烷-3β-醇-7-酮3-醋酸酯(2)溶于40mL冰醋酸中,加入新制备的铂催化剂,常温常压振荡下通氢气,至板层显示反应完全,滤除铂粉(保留),母液浓缩至干,甲醇重结晶得白色片状结晶1.8g,收率:90%,mp104~105℃(文献〔4〕mp106~112℃).1H-NMR(CDCl3)δ:4.70(1H,m,3α-H),3.80(1H,m,7β-H),3.40(1H,m,7α-H);IR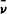 cm-1:3560(—OH),2950(C-C),1712(C=O,酯),1027(C-O).
cm-1:3560(—OH),2950(C-C),1712(C=O,酯),1027(C-O).
2.4 5α-胆甾烷-3β,7-二醇(4)制备
, 百拇医药
3.0g5α-胆甾烷-3β,7-二醇3-醋酸酯(3)加入62.5mL5%氢氧化钾-甲醇溶液中,加热使之溶解,并于65℃保温3h,然后用10%盐酸中和至pH6~7,加水稀释,析出白色沉淀,放置,抽滤,得白色粉末2.2g,收率:78.6%,mp149~157℃.1H-NMR(CD3OD)δ:3.85(1H,m,7α-H,7β-H),3.64(1H,m,3α-H);IR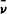 cm-1:3389(—OH),2931(C-H),1035(C-O).
cm-1:3389(—OH),2931(C-H),1035(C-O).
2.5 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)的合成
将2.0g5α-胆甾烷-3β,7-二醇(4)溶于160mL甲苯中,加入6mL吡啶及1.1g琥珀酸酐,加热使之溶解,回流10h.减压蒸除甲苯和吡啶后,趁热加入少量甲苯使成糊状,再加入少量石油醚,放置,冷却,析出结晶,抽滤,干燥,无水乙醇重结晶,得白色粉末2.0g,收率:66.7%,mp177~179℃.元素分析C31H52O5,计算值(%):C73.77,H10.38;实测值(%):C73.93,H10.46.1H-NMR(CDCl3)δ:4.75(1H,m,3α-H),3.85(1H,m,7-H),2.63(4H,m,-COCH2CH2CO-),0.95(3H,s,19-CH3),0.60(3H,s,18-CH3);IR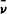 cm-1:3468(OH),2941(C-C),1723(C=O);MS(EI)m/e:504(M+),486(M+-H2O),386(M+-H2O-C4H4O3),368(M+-2H2O-C4H4O3).
cm-1:3468(OH),2941(C-C),1723(C=O);MS(EI)m/e:504(M+),486(M+-H2O),386(M+-H2O-C4H4O3),368(M+-2H2O-C4H4O3).
, 百拇医药
2.6 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-乙醇胺盐(6)的合成
精密称量1.000g5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及0.122g乙醇胺,并分别溶于10mL,2mL无水乙醇中,震摇下将乙醇胺溶液加入到5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)溶液中,静置,减压蒸除少量乙醇,冷却,析出白色沉淀,过滤,得白色粉末0.9g,收率:80.4%,mp179℃(分解).元素分析C33H59NO6,计算值(%):C70.05,H10.51,N2.48;实测值(%):C70.10,H10.07,N2.26.IR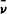 cm-1:3425(—NH2,—OH 重叠),1723(C=O),1384(C=N).
cm-1:3425(—NH2,—OH 重叠),1723(C=O),1384(C=N).
, 百拇医药
2.7 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-哌嗪盐(7)的合成
精密称量1.010g5α-胆甾烷-3β,7-二醇-3-琥珀酸单酯(5)及0.180g无水哌嗪,分别溶于10mL,2mL无水甲醇中,其余操作同(6)的合成,得白色粉末1.0g,收率:84.7%,mp159℃(分解).元素分析C35H62N2O5,计算值(%):C71.14,H10.57,N4.74;实测值(%):C69.09,H10.52,N4.64.IR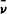 cm-1:3428(—NH,—OH 重叠),1710(C=O),1404(C-N).
cm-1:3428(—NH,—OH 重叠),1710(C=O),1404(C-N).
2.8 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-N-2-羟乙基哌嗪盐(8)的合成
, 百拇医药
精密称量1.020g5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及0.280gN-2-羟乙基哌嗪,并分别溶于1.5mL,2mL无水甲醇中,其余操作同(6)的合成,得白色结晶1.1g,收率:85.9%,mp148~150℃(分解).元素分析C37H66N2O6,计算值(%):C69.99,H10.48,N4.41;实测值(%):C69.93,H10.38,N4.28.IR cm-1:3500~3233(—NH2,—OH 重叠),1730,1700(C=O),1382(C-N).
cm-1:3500~3233(—NH2,—OH 重叠),1730,1700(C=O),1382(C-N).
3 药理实验
对所合成的化合物(5)~(8)分别进行L1210小鼠白血病细胞体外增殖抑制实验.
, 百拇医药
水溶样品用PBS(-)溶液稀释,DMSO溶解和乙醇溶解样品加PBS(-)稀释(最终浓度均≤0.5%).将各档浓度组的样品加入96孔培养板各孔内,对照组加相应的稀释液,每孔加试液10μL,每样品设六档浓度,每档浓度设双复孔.取对数生长期的L1210细胞用RPMI1640培养液稀释,各孔内加入90μL(1×10-4悬浮细胞),置37℃二氧化碳培养箱内,48h后加入MTT液,继续培养4h后,加入三联液,于37℃放置.次日用DG3022酶免疫检测仪测各孔A(570nm)值,各加试液孔均值与对照孔均值比较,计算出各浓度组的百分抑制率[IC%=(1-T/C)×100%]和样品的直线回归方程,求出各样品的IC50值.药理试验结果见表1.
Tab.1 In vitro inhibiting effect of compounds
(5)~(8) and RS 034 on L1210 tumor cells
, http://www.100md.com
Compd.
Regression equation
Correlation coefficient(r)
IC50/μg.mL-1
5
Y①=-42.89+90.27lgx②
0.953
10.69
Y=-44.07+105.53lgx
0.99
, http://www.100md.com
7.28
6
Y=-28.01+79.79lgx
0.97
9.49
Y=-38.80+98.86lgx
0.99
7.9
7
Y=-103.9+143.31lgx
0.99
11.86
, 百拇医药
Y=-32.67+84.26lgx
0.97
9.57
8
Y=-34.75+80.12lgx
0.97
11.42
Y=-32.2+84.26lgx
0.97
9.45
RS034
Y=-106.9+106.11lgx
, http://www.100md.com
0.98
6.32
①Y:inhibiting percentage(%) ②x:concentration of compounds(μg/mg)4 讨论
a.化合物5α-胆甾烷-3β,7-二醇(4)的合成中,由于对7-羰基的还原采用的是非立体选择性的还原方法,产物5α-胆甾烷-3β,7-二醇3-醋酸酯(3)及化合物(4)应为α-异构体和β-异构体的混合物;由于7α-H和7β-H受到不同的去屏蔽效应,故在谱图上可看到,7α-H在相对高场(δ3.40,为多重峰)出现,而7β-H在相对低场(δ3.80,为多重峰)出现.从两处峰的积分值看,两异构体的生成比例为2∶1.
b.曾用多种展开系统进行薄层层析,都没有得到分离的两个斑点,考虑到合成化合物的目的是用来将目标化合物的药理结果与7-羟基胆固醇的药理结果相比较,以观察此类化合物中双键的存在对抗癌活性的影响,因此,将所得产物直接进行下步反应,并进行了药理试验,结果表明:5α-胆甾烷-3β,7-二醇3-琥珀酸单酯的各盐类衍生物有较强的抗癌活性.与7-羟基胆固醇-3,7-双琥珀酸单酯盐的药理结果比较表明:双键的存在对抗癌活性的影响并不明显.
, 百拇医药
致谢:元素分析、质谱、核磁共振谱、红外光谱等由中国科学院上海有机化学研究所、中国科学院沈阳应用生态研究所、沈阳药科大学分析测试中心等单位协助测定;上海医药工业研究院药理室代做体外抗癌活性试验,在此一并表示感谢.
李文姬:通讯联系人 现址:第二军医大学基础部药理学教研室,上海200433
容士宏:现通讯处:9110 Lichtenauer Dr.#229,Lenexa,KS 66219,U.S.A
参考文献
1 Cheng KP,Nagano H,Luu B,et al.Chemistry and biochemistry of Chin ese drugs Part 1. Sterol derivatives cytotoxic to hepatoma cells,isolated from t he drugs Bombyx Cum Botryte.J Chem Res(s),1977,9:217(CA 88:68955n)
, 百拇医药
2 Rong SH.Activitive antitive antitumorale de derives hydrosolubles de stroides p olyoxygeness:[Doctoral dissertation].France:Universite L. Pasteur Strasbourg,1 983
3 张新华,闫少羽,李惠琴,等.氧代固醇类化合物的抗癌活性研究4.胆甾烷-3β,5α,6β(6α)-三醇和胆甾-4-烯-3β,6β(6α)-二醇的琥珀酸单酯钠的合成与抗癌活性.中国药物化学杂志,1995,5(2):101~108
4 Wintersteiner, Moore M.The preparation and properties of the 7-peimeric c holestanediols-3β,7.J Am Chem Soc,1943,65(2):1503~1507
5 Marker ,Rohrmann.Sterols LXXV.Cholesterol derivatives.J Am Chem Soc,1939,61 (3):3022~3024
6 Salmond WG,Barta MA, Havens JL.Allylic oxidation with 3,5-dimethylpyrazole ,chromium trioxide complex.Steroidal Δ5-7-ketones.J Org Chem,1978,43 (10):2057~2059
收稿日期:1999-04-20, http://www.100md.com
单位:沈阳药科大学化学制药教研室,沈阳110015
关键词:氧代固醇;抗癌活性;合成
摘 要 为考察胆甾摘 要 为考察胆甾-5-烯-3β,7β-二醇双琥珀酸单酯钠(RS 034)结构中的5,6-双键是否为其产生抗癌活性的必要部位,合成了5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及其水溶性衍生物——乙醇胺盐(6)、哌嗪盐(7)及N-2-羟乙基哌嗪盐(8),体外抗癌活性试验表明,所合成的化合物均具有一定程度的抗癌活性.
Synthesis of Water-soluble Derivatives of 5α-Cholestane-
3β,7-diol and Their in vitro Anticancer Activities
, 百拇医药
Li Wenji,Rong Shihong
(Department of Chemical Pharmaceuticals ,Shenyang
Pharmaceutical Unive rsity,Shenyang 110015)
Abstract In order to investigate whether the 5,6-double bond of cholest-5-ene-3β,7β-diol 3,7-bishemisuccinate plays an important ro le in its anticancer activity,5α-cholestane-3β,7-diol 3-hemisuccinate and i ts water-soluble derivati ves—its salts of ethanolamine,piperazine and N-2-hydroxylamine were synth esized.Their in vitro tests demonstrated that the target compounds all posse s sed anticancer activities.
, 百拇医药
Key words oxysterols;anticancer activity;synthesis
本世纪70年代中期,郑国平〔1〕从中药僵蚕中提取出7β-羟基胆固醇,体外试验证明,它对小鼠的肝癌细胞具有细胞溶解作用,并有较好的选择性,但体内试验结果不稳定.之后,容士宏〔2〕合成了它的水溶性衍生物7β-羟基胆固醇双琥珀酸单酯钠(RS034),该化合物对接种了腹水癌细胞的小鼠呈现较强的抗癌活性,在随后进行的构效关系研究〔3〕中发现,一些与RS034结构类似的化合物也具有抗癌活性,为进一步探讨7β-羟基胆固醇中5,6-双键所起的作用,合成了5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及其盐类衍生物——乙醇胺盐(6)、哌嗪盐(7)及N-2-羟乙基哌嗪盐(8),并对其进行了抗癌活性试验.
1 合成路线
据Wintersteiner等〔4〕报道,由于5α-胆甾烷-3β,7-二醇未能由7-羟基胆固醇直接氢化制得,采用7-氧代胆固醇醋酸酯为起始原料,以氧化铂为催化剂,将双键和羰基同时还原然后水解制得;或在不同的溶剂中先将双键饱和,再将双键还原后水解得目标化合物.此外,Marker等〔5〕报道用异丙醇铝将胆甾烷-3β-醇-7-酮3-醋酸酯还原后水解制备胆甾烷-3β,7-二醇的方法.经比较采用分两步还原的方法:以氧化铂为催化剂,醋酸乙酯为溶剂,常温常压下,先将7-氧代胆固醇醋酸酯的5,6-双键饱和,再改用冰醋酸为溶剂在相同条件下,将羰基还原为羟基,最后将醋酸酯在碱性下水解.其优点是操作简便且收率高.起始原料7-氧代胆固醇醋酸酯,参考Salmond等〔6〕报道的方法制得.5α-胆甾烷-3β,7-二醇的琥珀酰化是以甲苯为反应介质在吡啶存在下进行的,将制得的胆甾烷-3β,7-二醇3-琥珀酸单酯分别与乙醇胺、哌嗪及N-2-羟乙基哌嗪成盐,得到目标化合物(6),(7),(8).合成路线见图1.

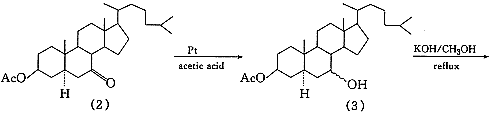




, 百拇医药
Fig.1 The synthesis route of the aim compounds
2 合成实验
熔点用毛细管法测定,温度未经校正.红外光谱用IFS55傅立叶红外光谱仪测定,KBr压片.1H-NMR谱用ARX-300核磁共振仪测定.元素分析用意大利Carlo-Erba1106型有机元素分析仪测定.质谱用VG7070E型质谱仪测定.
2.1 7-氧代胆固醇醋酸酯(1)的制备
将25g3,5-二甲基吡唑(DMP)加入200mL干燥二氯甲烷中,冷却至-15℃,搅拌全溶后慢慢加入25g三氧化铬,控制温度在-10℃以下,加完后降温至-15℃,慢慢加入10g胆固醇醋酸酯,并在此温度下搅拌5h,然后升温至0~5℃,加入10%盐酸130mL,搅拌1h.将反应液倾入分液漏斗中,分出酸水层(酸水层保存),二氯甲烷层用5%盐酸洗(100mL×3),再用水洗(100mL×3,酸水层保存).二氯甲烷溶液减压蒸除大部分二氯甲烷,加入少量无水乙醚,用硅胶柱层析,二氯甲烷-乙醚(v∶v=1∶1)洗脱,洗脱液减压浓缩后以95%乙醇重结晶,得白色针状产物结晶7.0g,收率:69.0%,mp156~158℃(文献〔4〕mp157~158℃).1H-NMR(CDCl3)δ:5.70(1H,s,6-H),4.70(1H,m,3α-H),2.19(3H,s,3-COCH3),1.20(3H,s,19-CH3),0.64(3H,s,18-CH3);IR
, 百拇医药
将上述酸水层合并,用1mol/L氢氧化钠溶液调至pH11~12,用乙醚提取(100mL×3),回收乙醚,得白色结晶状化合物3,5-二甲基吡唑12.5g,mp106~108℃.
2.2 5α-胆甾烷-3β-醇-7-酮3-醋酸酯(2)的制备
将5.0g7-氧代胆固醇醋酸酯(1)溶于80mL醋酸乙酯中,吸入新制备的铂催化剂,常温常压下催化氢化,至板层检测无荧光点,滤除铂粉(保留),母液减压浓缩至干,析出片状结晶4.9g,收率:98.1%,mp148~149℃(文献〔4〕mp148~149℃).1H-NMR(CDCl3)δ:4.70(1H,m,3α-H),2.30(1H,t,5α-H),2.20(1H,s,6α-H),2.10(1H,s,6β-H),1.20(3H,s,19-CH3),0.60(3H,s,18-CH3);IR
, 百拇医药
2.3 5α-胆甾烷-3β,7-二醇3-醋酸酯(3)的制备
将2.0g5α-胆甾烷-3β-醇-7-酮3-醋酸酯(2)溶于40mL冰醋酸中,加入新制备的铂催化剂,常温常压振荡下通氢气,至板层显示反应完全,滤除铂粉(保留),母液浓缩至干,甲醇重结晶得白色片状结晶1.8g,收率:90%,mp104~105℃(文献〔4〕mp106~112℃).1H-NMR(CDCl3)δ:4.70(1H,m,3α-H),3.80(1H,m,7β-H),3.40(1H,m,7α-H);IR
2.4 5α-胆甾烷-3β,7-二醇(4)制备
, 百拇医药
3.0g5α-胆甾烷-3β,7-二醇3-醋酸酯(3)加入62.5mL5%氢氧化钾-甲醇溶液中,加热使之溶解,并于65℃保温3h,然后用10%盐酸中和至pH6~7,加水稀释,析出白色沉淀,放置,抽滤,得白色粉末2.2g,收率:78.6%,mp149~157℃.1H-NMR(CD3OD)δ:3.85(1H,m,7α-H,7β-H),3.64(1H,m,3α-H);IR
2.5 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)的合成
将2.0g5α-胆甾烷-3β,7-二醇(4)溶于160mL甲苯中,加入6mL吡啶及1.1g琥珀酸酐,加热使之溶解,回流10h.减压蒸除甲苯和吡啶后,趁热加入少量甲苯使成糊状,再加入少量石油醚,放置,冷却,析出结晶,抽滤,干燥,无水乙醇重结晶,得白色粉末2.0g,收率:66.7%,mp177~179℃.元素分析C31H52O5,计算值(%):C73.77,H10.38;实测值(%):C73.93,H10.46.1H-NMR(CDCl3)δ:4.75(1H,m,3α-H),3.85(1H,m,7-H),2.63(4H,m,-COCH2CH2CO-),0.95(3H,s,19-CH3),0.60(3H,s,18-CH3);IR
, 百拇医药
2.6 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-乙醇胺盐(6)的合成
精密称量1.000g5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及0.122g乙醇胺,并分别溶于10mL,2mL无水乙醇中,震摇下将乙醇胺溶液加入到5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)溶液中,静置,减压蒸除少量乙醇,冷却,析出白色沉淀,过滤,得白色粉末0.9g,收率:80.4%,mp179℃(分解).元素分析C33H59NO6,计算值(%):C70.05,H10.51,N2.48;实测值(%):C70.10,H10.07,N2.26.IR
, 百拇医药
2.7 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-哌嗪盐(7)的合成
精密称量1.010g5α-胆甾烷-3β,7-二醇-3-琥珀酸单酯(5)及0.180g无水哌嗪,分别溶于10mL,2mL无水甲醇中,其余操作同(6)的合成,得白色粉末1.0g,收率:84.7%,mp159℃(分解).元素分析C35H62N2O5,计算值(%):C71.14,H10.57,N4.74;实测值(%):C69.09,H10.52,N4.64.IR
2.8 5α-胆甾烷-3β,7-二醇3-琥珀酸单酯-N-2-羟乙基哌嗪盐(8)的合成
, 百拇医药
精密称量1.020g5α-胆甾烷-3β,7-二醇3-琥珀酸单酯(5)及0.280gN-2-羟乙基哌嗪,并分别溶于1.5mL,2mL无水甲醇中,其余操作同(6)的合成,得白色结晶1.1g,收率:85.9%,mp148~150℃(分解).元素分析C37H66N2O6,计算值(%):C69.99,H10.48,N4.41;实测值(%):C69.93,H10.38,N4.28.IR
3 药理实验
对所合成的化合物(5)~(8)分别进行L1210小鼠白血病细胞体外增殖抑制实验.
, 百拇医药
水溶样品用PBS(-)溶液稀释,DMSO溶解和乙醇溶解样品加PBS(-)稀释(最终浓度均≤0.5%).将各档浓度组的样品加入96孔培养板各孔内,对照组加相应的稀释液,每孔加试液10μL,每样品设六档浓度,每档浓度设双复孔.取对数生长期的L1210细胞用RPMI1640培养液稀释,各孔内加入90μL(1×10-4悬浮细胞),置37℃二氧化碳培养箱内,48h后加入MTT液,继续培养4h后,加入三联液,于37℃放置.次日用DG3022酶免疫检测仪测各孔A(570nm)值,各加试液孔均值与对照孔均值比较,计算出各浓度组的百分抑制率[IC%=(1-T/C)×100%]和样品的直线回归方程,求出各样品的IC50值.药理试验结果见表1.
Tab.1 In vitro inhibiting effect of compounds
(5)~(8) and RS 034 on L1210 tumor cells
, http://www.100md.com
Compd.
Regression equation
Correlation coefficient(r)
IC50/μg.mL-1
5
Y①=-42.89+90.27lgx②
0.953
10.69
Y=-44.07+105.53lgx
0.99
, http://www.100md.com
7.28
6
Y=-28.01+79.79lgx
0.97
9.49
Y=-38.80+98.86lgx
0.99
7.9
7
Y=-103.9+143.31lgx
0.99
11.86
, 百拇医药
Y=-32.67+84.26lgx
0.97
9.57
8
Y=-34.75+80.12lgx
0.97
11.42
Y=-32.2+84.26lgx
0.97
9.45
RS034
Y=-106.9+106.11lgx
, http://www.100md.com
0.98
6.32
①Y:inhibiting percentage(%) ②x:concentration of compounds(μg/mg)4 讨论
a.化合物5α-胆甾烷-3β,7-二醇(4)的合成中,由于对7-羰基的还原采用的是非立体选择性的还原方法,产物5α-胆甾烷-3β,7-二醇3-醋酸酯(3)及化合物(4)应为α-异构体和β-异构体的混合物;由于7α-H和7β-H受到不同的去屏蔽效应,故在谱图上可看到,7α-H在相对高场(δ3.40,为多重峰)出现,而7β-H在相对低场(δ3.80,为多重峰)出现.从两处峰的积分值看,两异构体的生成比例为2∶1.
b.曾用多种展开系统进行薄层层析,都没有得到分离的两个斑点,考虑到合成化合物的目的是用来将目标化合物的药理结果与7-羟基胆固醇的药理结果相比较,以观察此类化合物中双键的存在对抗癌活性的影响,因此,将所得产物直接进行下步反应,并进行了药理试验,结果表明:5α-胆甾烷-3β,7-二醇3-琥珀酸单酯的各盐类衍生物有较强的抗癌活性.与7-羟基胆固醇-3,7-双琥珀酸单酯盐的药理结果比较表明:双键的存在对抗癌活性的影响并不明显.
, 百拇医药
致谢:元素分析、质谱、核磁共振谱、红外光谱等由中国科学院上海有机化学研究所、中国科学院沈阳应用生态研究所、沈阳药科大学分析测试中心等单位协助测定;上海医药工业研究院药理室代做体外抗癌活性试验,在此一并表示感谢.
李文姬:通讯联系人 现址:第二军医大学基础部药理学教研室,上海200433
容士宏:现通讯处:9110 Lichtenauer Dr.#229,Lenexa,KS 66219,U.S.A
参考文献
1 Cheng KP,Nagano H,Luu B,et al.Chemistry and biochemistry of Chin ese drugs Part 1. Sterol derivatives cytotoxic to hepatoma cells,isolated from t he drugs Bombyx Cum Botryte.J Chem Res(s),1977,9:217(CA 88:68955n)
, 百拇医药
2 Rong SH.Activitive antitive antitumorale de derives hydrosolubles de stroides p olyoxygeness:[Doctoral dissertation].France:Universite L. Pasteur Strasbourg,1 983
3 张新华,闫少羽,李惠琴,等.氧代固醇类化合物的抗癌活性研究4.胆甾烷-3β,5α,6β(6α)-三醇和胆甾-4-烯-3β,6β(6α)-二醇的琥珀酸单酯钠的合成与抗癌活性.中国药物化学杂志,1995,5(2):101~108
4 Wintersteiner, Moore M.The preparation and properties of the 7-peimeric c holestanediols-3β,7.J Am Chem Soc,1943,65(2):1503~1507
5 Marker ,Rohrmann.Sterols LXXV.Cholesterol derivatives.J Am Chem Soc,1939,61 (3):3022~3024
6 Salmond WG,Barta MA, Havens JL.Allylic oxidation with 3,5-dimethylpyrazole ,chromium trioxide complex.Steroidal Δ5-7-ketones.J Org Chem,1978,43 (10):2057~2059
收稿日期:1999-04-20, http://www.100md.com