壳聚糖固定α-淀粉酶的研究
作者:康杰 唐威 罗红斌
单位:福建医科大学化学教研室(福州 350004)
关键词:α-淀粉酶;壳聚糖;固定化酶
福建医科大学学报990316 目的 从虾蛄壳提取壳聚糖,将α-淀粉酶固定在壳聚糖上。 方法 以自制壳聚糖为载体,一氯乙酸或三氯乙酸为交联剂,将α-淀粉酶固定化。 结果 三氯乙酸是较好的交联剂。固定化酶与原酶的最适pH及最适温度基本相同,均为6.5,50℃;固定化酶在65℃仍有较高热稳定性,而原酶活力明显下降;固定化酶的表观米氏常数Km=0.6×10-2 g/ml,原酶Km=1.1×10-2 g/ml;一定浓度Cl-、Br-离子有助提高固定化酶活力。 结论 该固定化酶活力较高,热稳定性和贮存稳定性好,是良好的检测试剂。
, 百拇医药 Study of Immobilization of α-Amylase with Chitosan
Kang Jie, Tan Wei, Luo Hongbin, et al
(Department of Chemistry, Fujian Medical University, Fuzhou, 350004)
Objective This paper is intended to discuss the immobilization of α-amylase on chitosan extracted from shrimp crust. Methods Immobilizing α-amylase on chitosan by using trichloroacetic acid or chloroacetic acid as cross-link agent. Results It has been shown that trichloroacetic acid was the better one as cross-link agent. Cl- or Br- of certain concentration was conductive to the immobilization of α-amylase. The optimum pH, temperature, Km of the immobilized enzyme were 6.5, 50℃, 0.6×10-2g/ml, respectively, and these enzymatic properties of the protoenzyme were 6.5, 50℃ 1.1×10-2g/ml, respectively. Conclusion It is concluded that the immobilzed α-amylase can be used in clinical laboratory as a good reagent because of its high activation and stability of heat and reservation.
, 百拇医药
Key words α-amylase; chitosan; immobilization
壳聚糖是一种具有广泛应用价值的新材料,其用途涉及众多领域和部门[1]。有关壳聚糖作为固定化酶载体的研究近年来已有不少报道[2,3]。本文从虾蛄壳中提取壳聚糖作为载体,分别以一氯乙酸、三氯乙酸为交联剂,固定化α-淀粉酶,探讨α-淀粉酶固定化的最佳条件和固定化酶的理化性质。
1 材料、仪器和方法
1.1 材料与仪器
1.1.1 材料 虾蛄壳,自行收集。α-淀粉酶,生化试剂,中科院上海生化所东风生化技术公司出品。一氯乙酸,生化试剂,金山化工厂出品。三氯乙酸,生化试剂,北京化工厂出品。3、5-二硝基水杨酸,分析纯,湖州生物化学品厂出品。马铃薯支链淀粉及其他试剂均为分析纯。
, 百拇医药
1.1.2 仪器 721型分光光度计,上海第三分析仪器厂。超级恒温水浴,上海实验仪器总厂。800型离心沉淀器,上海手术器械十厂。PHS-3B型精密pH计,上海雷磁仪器厂。
1.2 方法
1.2.1 壳聚糖的制备 称取新鲜、洗净晾干的虾蛄壳200 g,加入4%HCl 1000 ml浸泡3 h后取出,弃废酸,以大量水洗至中性。加入4%~5%NaOH 800 ml煮沸2 h,脱去蛋白质,弃废碱洗至中性。重新操作一次。再以3%HCl浸泡1 h,取出洗至中性,得白色片状几丁质。将几丁质投入盛有40%~50%NaOH 500 ml溶液中,70~80℃下保温24 h,脱去乙酰基,水洗得白色透明状的壳聚糖,干燥后称重33.5 g,得率为16.7%。
1.2.2 酶活力测定方法 原酶活力测定按参考文献[4]进行。固定化酶活力测定取固定化酶0.1 g加1%马铃薯支链淀粉5.0 ml(20 mmol/L pH 6.9磷酸钠,内含0.7 mmol/L NaCl的缓冲液配制)溶液,37℃水浴反应30 min后,离心5 min(3000 r/min)。吸取上清液1.0 ml,加蒸馏水10.0 ml和3、5-二硝基水杨酸显色剂3.0 ml,显色后于540 nm处测其吸光值。以同量马铃薯支链淀粉加同量显色剂为对照。
, 百拇医药
1.2.3 α-淀粉酶固定化 按壳聚糖(干)1 g加入1%醋酸100 ml的比例配成透明胶液。平行取壳聚糖的醋酸胶液20 ml 5~6份,分置于100 ml烧杯中,分别加入5 mol/L NaOH溶液30 ml和不同浓度的交联剂(一氯乙酸或三氯乙酸)5.0 ml,磁力搅拌3 h,静置2 h,抽滤,洗涤至中性,再分别加入不同量的α-淀粉酶溶液(1 mg/ml),磁力搅拌2h后,于冰箱中4℃下过夜,次日用去离子水洗涤后过滤即制得固定化酶。
2 结 果
2.1 α-淀粉酶固定化条件
2.1.1 不同交联剂及其固定化条件浓度对固定化酶活力的影响(图1)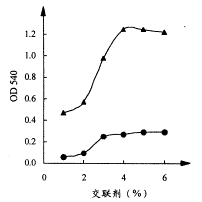
图1 交联剂浓度(%)
, http://www.100md.com
●:一氯乙酸 ▲:三氯乙酸
固定化酶活力随加入的一氯乙酸或三氯乙酸浓度增大而增加,但当交联剂浓度达4%以上后,固定化酶活力基本不变,说明此浓度足以使该壳聚糖分子上的活性基团充分发生交联反应,经此交联形成的载体与酶结合量达最大。同时亦显示以三氯乙酸作为交联剂固定化效果更好,这可能与氯的电负性大有关,其作用机理有待进一步探讨。后续部分交联剂均采用三氯乙酸。
2.1.2 给酶量对固定化酶活力的影响(图2)
图2 给酶量对固定化酶活力的影响
固定化酶活力随给酶量的增加而增加,但当给酶量达4.0 mg时,酶活力趋于平稳,再增加酶量未见酶活力上升。
2.1.3 卤素离子对固定化酶活力的影响(附表)
, 百拇医药
附表 不同浓度卤素离子(mol/L)对固定化酶活力的影响OD值
0
0.05
0.10
0.15
0.20
F-
0.60
±
0.08
0.35
±
, 百拇医药
0.05
0.25
±
0.05
0.05
±
0.02
0.01
±
0.01
Cl-
0.60
±
, 百拇医药
0.08
0.75
±
0.05
0.85
±
0.08
0.20
±
0.03
0.15
±
0.03
, http://www.100md.com
Br-
0.60
±
0.08
0.70
±
0.07
0.83
±
0.05
0.10
±
0.02
, http://www.100md.com
0.05
±
0.01
I-
0.60
±
0.08
0.15
±
0.05
0.55
±
0.02
, 百拇医药
0.01
±
0.01
0.01
±
0.01
2.2 固定化α-淀粉酶的理化性质
平行取1 mg/ml液态原酶0.1 ml和固定化酶0.1 g作对照,分别测定固定化酶的Km值,最适温度,贮存稳定性和pH对酶活力的影响。
2.2.1 固定化酶的Km值(图3)
依据实验测定值,以双倒数作图法,求得在本实验条件下,原酶和固定化酶的Km值分别为1.1×10-2 g/ml,0.6×10-2 g/ml。
, 百拇医药
图3 固定化酶的Km值
●:原酶 ▲:固定化酶(下图同)
2.2.2 固定化酶的最适温度(图4)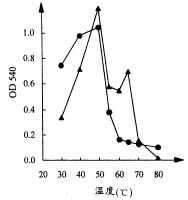
图4 固定化酶、原酶的最适温度
原酶和固定化酶的最适温度相同,均为50℃,但固定化酶在65℃时仍有较高热稳定性,而此时原酶活力明显下降。
2.2.3 pH对酶活力的影响(图5)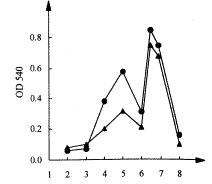
图5 固定化酶、原酶的最适pH
pH值的变化对于固定化酶和原酶的影响大致相同,且它们的最适pH值均为6.5,可见α-淀粉酶在固定化前后,其最适pH及pH活性曲线未见明显变化。
, 百拇医药
2.2.4 固定化酶的贮存稳定性 该固定化酶在4℃冰箱分别保存1,4,8周后进行酶活力测定,活力未见明显不同。
3 讨 论
本文以壳聚糖为载体,分别以一氯乙酸,三氯乙酸为交联剂固定化α-淀粉酶。在固定化过程中,固定化酶的活力将受到载体性能,交联剂用量,载体与酶的比例,以及温度,pH值等因素的影响。由于壳聚糖系氨基多糖,其氨基含量随几丁质脱乙酰基程度不同而异。本实验采用的虾蛄壳聚糖粘度达到500厘泊(0.5%的壳聚糖醋酸液在20℃,NDJ-1型旋转粘度仪测定),氨基含量为75%(采用凯氏定氮法测定)。
实验结果表明,三氯乙酸是比一氯乙酸更好的一种交联剂。壳聚糖(干)0.2 g加入4%三氯乙酸交联后与α-淀粉酶4.0 mg固定结合,效果较佳,即单位壳聚糖载体的最大固定酶量为20 mg/g干载体。在交联过程中,一定浓度的Cl-或Br-有助于提高固定化酶的活力,继续增加Cl-或Br-浓度固定化酶活力反而下降,而F-、I-的存在对固定化酶活力有一定抑制作用。据文献[5]所述,F-、Cl-、Br-、I-是淀粉酶的激活剂,Cl-激活效应最大。推测壳聚糖对Cl-、Br-存在物理吸附,浓度过大妨碍了酶固定化,导致固定化酶活力下降。
, 百拇医药
固定化酶和原酶相比,其最适pH值不变,均有两个值(pH 5.0和pH 6.5),这可能与该酶活性中心的氨基酸残基组成有关,推测组成该酶活性中心的氨基酸残基受固定化过程影响不大。固定化酶的Km值为0.6×10-2 g/ml,比原酶的Km值1.1×10-2 g/ml小,显示酶经固定化后与底物亲和能力有所增大,与文献[6]所述的固定化酶情况类似。原酶和固定化酶的最适温度相同,均为50℃,但固定化酶在65℃时仍有较高热稳定性,而此时原酶活力明显下降,说明α-淀粉酶在固定化后在热稳定性上有一定提高。固定化酶置于4℃冰箱保存,经2月重复使用测定,活力未见下降,显示了其贮存稳定性和重复使用性较好。以资源丰富,制备简单的壳聚糖作为载体,制得的固定化α-淀粉酶,其酶活力较高,热稳定性和贮存稳定性好,易于回收,可望为今后工业化酶法生产葡萄糖和临床检测等提供一些有价值的参考资料。
参考文献
1 侯惠民. 甲壳质—一种具有广泛应用价值的新材料. 医药工业, 1988;19:328
, http://www.100md.com
2 陈 盛,吴海生. 壳聚糖固定脲酶的研究. 福建师范大学学报(自然科学版), 1990;6(2):69
3 康 杰,罗红斌,李柱来. 壳聚糖固定胰蛋白酶的研究. 福建医学院学报, 1996;30:55
4 蒋传葵,金承德,吴仁龙.工具酶的活力测定.上海:上海科学技术出版社,1982:74~75
5 罗 侃. 临床化学方法学评价. 兰州;兰州大学出版社, 1998:231
6 千一郎. 固定化酶. 石家庄;河北人民出版社, 1981:136
(收稿:1999-03-24 修回:1999-05-26), http://www.100md.com
单位:福建医科大学化学教研室(福州 350004)
关键词:α-淀粉酶;壳聚糖;固定化酶
福建医科大学学报990316 目的 从虾蛄壳提取壳聚糖,将α-淀粉酶固定在壳聚糖上。 方法 以自制壳聚糖为载体,一氯乙酸或三氯乙酸为交联剂,将α-淀粉酶固定化。 结果 三氯乙酸是较好的交联剂。固定化酶与原酶的最适pH及最适温度基本相同,均为6.5,50℃;固定化酶在65℃仍有较高热稳定性,而原酶活力明显下降;固定化酶的表观米氏常数Km=0.6×10-2 g/ml,原酶Km=1.1×10-2 g/ml;一定浓度Cl-、Br-离子有助提高固定化酶活力。 结论 该固定化酶活力较高,热稳定性和贮存稳定性好,是良好的检测试剂。
, 百拇医药 Study of Immobilization of α-Amylase with Chitosan
Kang Jie, Tan Wei, Luo Hongbin, et al
(Department of Chemistry, Fujian Medical University, Fuzhou, 350004)
Objective This paper is intended to discuss the immobilization of α-amylase on chitosan extracted from shrimp crust. Methods Immobilizing α-amylase on chitosan by using trichloroacetic acid or chloroacetic acid as cross-link agent. Results It has been shown that trichloroacetic acid was the better one as cross-link agent. Cl- or Br- of certain concentration was conductive to the immobilization of α-amylase. The optimum pH, temperature, Km of the immobilized enzyme were 6.5, 50℃, 0.6×10-2g/ml, respectively, and these enzymatic properties of the protoenzyme were 6.5, 50℃ 1.1×10-2g/ml, respectively. Conclusion It is concluded that the immobilzed α-amylase can be used in clinical laboratory as a good reagent because of its high activation and stability of heat and reservation.
, 百拇医药
Key words α-amylase; chitosan; immobilization
壳聚糖是一种具有广泛应用价值的新材料,其用途涉及众多领域和部门[1]。有关壳聚糖作为固定化酶载体的研究近年来已有不少报道[2,3]。本文从虾蛄壳中提取壳聚糖作为载体,分别以一氯乙酸、三氯乙酸为交联剂,固定化α-淀粉酶,探讨α-淀粉酶固定化的最佳条件和固定化酶的理化性质。
1 材料、仪器和方法
1.1 材料与仪器
1.1.1 材料 虾蛄壳,自行收集。α-淀粉酶,生化试剂,中科院上海生化所东风生化技术公司出品。一氯乙酸,生化试剂,金山化工厂出品。三氯乙酸,生化试剂,北京化工厂出品。3、5-二硝基水杨酸,分析纯,湖州生物化学品厂出品。马铃薯支链淀粉及其他试剂均为分析纯。
, 百拇医药
1.1.2 仪器 721型分光光度计,上海第三分析仪器厂。超级恒温水浴,上海实验仪器总厂。800型离心沉淀器,上海手术器械十厂。PHS-3B型精密pH计,上海雷磁仪器厂。
1.2 方法
1.2.1 壳聚糖的制备 称取新鲜、洗净晾干的虾蛄壳200 g,加入4%HCl 1000 ml浸泡3 h后取出,弃废酸,以大量水洗至中性。加入4%~5%NaOH 800 ml煮沸2 h,脱去蛋白质,弃废碱洗至中性。重新操作一次。再以3%HCl浸泡1 h,取出洗至中性,得白色片状几丁质。将几丁质投入盛有40%~50%NaOH 500 ml溶液中,70~80℃下保温24 h,脱去乙酰基,水洗得白色透明状的壳聚糖,干燥后称重33.5 g,得率为16.7%。
1.2.2 酶活力测定方法 原酶活力测定按参考文献[4]进行。固定化酶活力测定取固定化酶0.1 g加1%马铃薯支链淀粉5.0 ml(20 mmol/L pH 6.9磷酸钠,内含0.7 mmol/L NaCl的缓冲液配制)溶液,37℃水浴反应30 min后,离心5 min(3000 r/min)。吸取上清液1.0 ml,加蒸馏水10.0 ml和3、5-二硝基水杨酸显色剂3.0 ml,显色后于540 nm处测其吸光值。以同量马铃薯支链淀粉加同量显色剂为对照。
, 百拇医药
1.2.3 α-淀粉酶固定化 按壳聚糖(干)1 g加入1%醋酸100 ml的比例配成透明胶液。平行取壳聚糖的醋酸胶液20 ml 5~6份,分置于100 ml烧杯中,分别加入5 mol/L NaOH溶液30 ml和不同浓度的交联剂(一氯乙酸或三氯乙酸)5.0 ml,磁力搅拌3 h,静置2 h,抽滤,洗涤至中性,再分别加入不同量的α-淀粉酶溶液(1 mg/ml),磁力搅拌2h后,于冰箱中4℃下过夜,次日用去离子水洗涤后过滤即制得固定化酶。
2 结 果
2.1 α-淀粉酶固定化条件
2.1.1 不同交联剂及其固定化条件浓度对固定化酶活力的影响(图1)

图1 交联剂浓度(%)
, http://www.100md.com
●:一氯乙酸 ▲:三氯乙酸
固定化酶活力随加入的一氯乙酸或三氯乙酸浓度增大而增加,但当交联剂浓度达4%以上后,固定化酶活力基本不变,说明此浓度足以使该壳聚糖分子上的活性基团充分发生交联反应,经此交联形成的载体与酶结合量达最大。同时亦显示以三氯乙酸作为交联剂固定化效果更好,这可能与氯的电负性大有关,其作用机理有待进一步探讨。后续部分交联剂均采用三氯乙酸。
2.1.2 给酶量对固定化酶活力的影响(图2)

图2 给酶量对固定化酶活力的影响
固定化酶活力随给酶量的增加而增加,但当给酶量达4.0 mg时,酶活力趋于平稳,再增加酶量未见酶活力上升。
2.1.3 卤素离子对固定化酶活力的影响(附表)
, 百拇医药
附表 不同浓度卤素离子(mol/L)对固定化酶活力的影响OD值
0
0.05
0.10
0.15
0.20
F-
0.60
±
0.08
0.35
±
, 百拇医药
0.05
0.25
±
0.05
0.05
±
0.02
0.01
±
0.01
Cl-
0.60
±
, 百拇医药
0.08
0.75
±
0.05
0.85
±
0.08
0.20
±
0.03
0.15
±
0.03
, http://www.100md.com
Br-
0.60
±
0.08
0.70
±
0.07
0.83
±
0.05
0.10
±
0.02
, http://www.100md.com
0.05
±
0.01
I-
0.60
±
0.08
0.15
±
0.05
0.55
±
0.02
, 百拇医药
0.01
±
0.01
0.01
±
0.01
2.2 固定化α-淀粉酶的理化性质
平行取1 mg/ml液态原酶0.1 ml和固定化酶0.1 g作对照,分别测定固定化酶的Km值,最适温度,贮存稳定性和pH对酶活力的影响。
2.2.1 固定化酶的Km值(图3)
依据实验测定值,以双倒数作图法,求得在本实验条件下,原酶和固定化酶的Km值分别为1.1×10-2 g/ml,0.6×10-2 g/ml。

, 百拇医药
图3 固定化酶的Km值
●:原酶 ▲:固定化酶(下图同)
2.2.2 固定化酶的最适温度(图4)

图4 固定化酶、原酶的最适温度
原酶和固定化酶的最适温度相同,均为50℃,但固定化酶在65℃时仍有较高热稳定性,而此时原酶活力明显下降。
2.2.3 pH对酶活力的影响(图5)

图5 固定化酶、原酶的最适pH
pH值的变化对于固定化酶和原酶的影响大致相同,且它们的最适pH值均为6.5,可见α-淀粉酶在固定化前后,其最适pH及pH活性曲线未见明显变化。
, 百拇医药
2.2.4 固定化酶的贮存稳定性 该固定化酶在4℃冰箱分别保存1,4,8周后进行酶活力测定,活力未见明显不同。
3 讨 论
本文以壳聚糖为载体,分别以一氯乙酸,三氯乙酸为交联剂固定化α-淀粉酶。在固定化过程中,固定化酶的活力将受到载体性能,交联剂用量,载体与酶的比例,以及温度,pH值等因素的影响。由于壳聚糖系氨基多糖,其氨基含量随几丁质脱乙酰基程度不同而异。本实验采用的虾蛄壳聚糖粘度达到500厘泊(0.5%的壳聚糖醋酸液在20℃,NDJ-1型旋转粘度仪测定),氨基含量为75%(采用凯氏定氮法测定)。
实验结果表明,三氯乙酸是比一氯乙酸更好的一种交联剂。壳聚糖(干)0.2 g加入4%三氯乙酸交联后与α-淀粉酶4.0 mg固定结合,效果较佳,即单位壳聚糖载体的最大固定酶量为20 mg/g干载体。在交联过程中,一定浓度的Cl-或Br-有助于提高固定化酶的活力,继续增加Cl-或Br-浓度固定化酶活力反而下降,而F-、I-的存在对固定化酶活力有一定抑制作用。据文献[5]所述,F-、Cl-、Br-、I-是淀粉酶的激活剂,Cl-激活效应最大。推测壳聚糖对Cl-、Br-存在物理吸附,浓度过大妨碍了酶固定化,导致固定化酶活力下降。
, 百拇医药
固定化酶和原酶相比,其最适pH值不变,均有两个值(pH 5.0和pH 6.5),这可能与该酶活性中心的氨基酸残基组成有关,推测组成该酶活性中心的氨基酸残基受固定化过程影响不大。固定化酶的Km值为0.6×10-2 g/ml,比原酶的Km值1.1×10-2 g/ml小,显示酶经固定化后与底物亲和能力有所增大,与文献[6]所述的固定化酶情况类似。原酶和固定化酶的最适温度相同,均为50℃,但固定化酶在65℃时仍有较高热稳定性,而此时原酶活力明显下降,说明α-淀粉酶在固定化后在热稳定性上有一定提高。固定化酶置于4℃冰箱保存,经2月重复使用测定,活力未见下降,显示了其贮存稳定性和重复使用性较好。以资源丰富,制备简单的壳聚糖作为载体,制得的固定化α-淀粉酶,其酶活力较高,热稳定性和贮存稳定性好,易于回收,可望为今后工业化酶法生产葡萄糖和临床检测等提供一些有价值的参考资料。
参考文献
1 侯惠民. 甲壳质—一种具有广泛应用价值的新材料. 医药工业, 1988;19:328
, http://www.100md.com
2 陈 盛,吴海生. 壳聚糖固定脲酶的研究. 福建师范大学学报(自然科学版), 1990;6(2):69
3 康 杰,罗红斌,李柱来. 壳聚糖固定胰蛋白酶的研究. 福建医学院学报, 1996;30:55
4 蒋传葵,金承德,吴仁龙.工具酶的活力测定.上海:上海科学技术出版社,1982:74~75
5 罗 侃. 临床化学方法学评价. 兰州;兰州大学出版社, 1998:231
6 千一郎. 固定化酶. 石家庄;河北人民出版社, 1981:136
(收稿:1999-03-24 修回:1999-05-26), http://www.100md.com