淋巴细胞趋化因子基因修饰增强肿瘤抗原多肽致敏的树突状细胞的抗肿瘤免疫效果
作者:章卫平 何龙 曹雪涛
单位:200433 上海,第二军医大学免疫学教研室
关键词:树突状细胞;抗原,肿瘤;基因转移
中华医学杂志990303 【摘要】 目的 通过选择性增强树突状细胞(DC)与T细胞的体内相互作用,优化其体内抗原提呈的微环境,为进一步增强DC介导的肿瘤免疫治疗效果。方法 体外培养的小鼠骨髓树突状细胞体外经Ltn重组腺病毒感染后(Ltn-DC),用3LL Lewis肺癌细胞株的Mut1抗原肽冲击致敏,按不同剂量免疫正常同系小鼠体内,观察其体内诱导的细胞毒性T淋巴细胞(CTL)活性保护性免疫反应;通过体内阻断试验探讨免疫细胞亚群及免疫分子在DC诱导抗肿瘤免疫应答中的作用;建立肺癌的自发性肺转移模型,观察免疫治疗作用。结果 抗原肽Mut1刺激的Ltn-DC能更有效地诱导特异CTL活性,能使免疫动物产生更有效的免疫保护作用,抵抗肿瘤细胞的攻击。在抗肿瘤免疫排斥反应的诱导过程中,必需有CD4+T 和CD8+T细胞的参与;而在其效应阶段,则依赖于CD8+T细胞、B7/CD28的共刺激信号途径及γ干扰素(IFN-γ)的参与,并在诱导过程中起着重要作用。抗原肽刺激的Ltn-DC能有效抑制3LL细胞的自发性肺转移,具有更明显的治疗作用。结论 通过基因修饰增强树突状细胞对T细胞的体内选择性趋化活性,能更有效地诱导抗肿瘤免疫反应,为树突状细胞介导的肿瘤免疫治疗开辟了新的途径。
, 百拇医药
Enhanced antitumor effects induced by lymphotactin gene-modified dendritic cells after pulsed with tumor antigen peptide ZHANG Weiping, HE Long, CAO Xuetao. Department of Immunology, Second Military Medical University, Shanghai 200433
【Abstract】 Objective To evaluate the potent effects of lymphotactin on tumor immunogene therapy and to improve the therapeutic efficacy of dendritic cells (DCs)-based vaccine, the protective and therapeutic effects of tumor antigen peptide-pulsed lymphotactin gene-modified dendritic cells were investigated. Methods In the tumor model of 3LL Lewis lung carcinoma, mouse bone marrow DCs transduced with mouse lymphotactin gene by adenovirus vector (Ltn-DC) were pulsed with MHC-I-restricted, 3LL cell-specific tumor peptide Mut 1 (FEQNTAQP), and used to vaccinate syngeneic mice or to treat the preestablished tumor-bearing mice with spontaneous pulmonary metastases.Results Immunization with Mut 1 peptide-pulsed Ltn-DC induced specific CTL against 3LL cells and induced protective antitumor immunity, which rendered the immunized mice resistant completely to 3LL tumor challenge. In vivo depletion of immune cell subsets with mAbs demonstrated that the protective immunity induced by Mut1 peptide-pulsed Ltn-DC in the induction phase was dependent on both CD4+ T cells and CD8+ T cells rather than NK cells, and in the effector phase on CD8+ T cells rather than CD4+ T cells or NK cells. CD28/CTLA4 pathway of T cell costimulation and IFN-γ were also necessary for induction of antitumor immunity by Ltn-DC pulsed with Mut1 peptide. Treatment with Mut1 peptide-pulsed Ltn-DC significantly inhibited the 3LL spontaneous pulmonary metastases of the preestablished tumor-bearing mice and exhibited obvious therapeutic effects. Conclusions Our data suggest that Ltn gene modified DCs are more potent in the induction of protective and therapeutic antitumor immunity through the preferential chemotaxis of DCs on T cells. Vaccination with tumor antigen-pulsed Ltn-DC may be a novel approach to immunotherapy of cancer.
, 百拇医药
【Key words】 Dendritic cells Antigens, neoplasm Gene transfer
(Natl Med J China, 1999, 79:170-173)
树突状细胞(dendritic cells, DC)作为体内的专职抗原提呈细胞,具有强大的激发初次免疫应答的独特功能,在肿瘤免疫治疗中具有潜在的应用价值,因而倍受关注[1-3]。体外经肿瘤抗原致敏的DC体内能有效诱导抗原特异性的抗肿瘤免疫反应,对荷瘤动物具有显著的治疗作用[4]。该途径进入临床试验,用于治疗B淋巴瘤、前列腺癌和结肠癌患者,并显示出初步的疗效[5]。考虑到DC的免疫刺激作用有赖于其体内与T细胞的相互作用,增强DC对T细胞的选择性趋化作用可能更有利于其诱导抗肿瘤免疫应答。我们在成功构建了小鼠Ltn重组腺病毒载体、并证实Ltn基因修饰的DC(Ltn-DC)体外能有效表达Ltn、对CD4+T 和CD8+T趋化活性增强的基础上[6],观察Ltn-DC体外经肿瘤抗原肽致敏后诱导的抗肿瘤免疫应答,并探讨其免疫机理。
, http://www.100md.com
材料与方法
一、材料
1.主要试剂:H-2Kb限制性的鸡卵蛋白(OVA)抗原多肽(SIINFEKL)和3LL小鼠Lewis肺癌细胞的组织相容抗原-1(MHC-Ⅰ)限制性的Mut1抗原八肽(FEQNTAQP[7])由美国CyberSyn公司合成、纯化,纯度>95%。蛋白细胞溶性T淋巴细胞A(CTLA)4-Ig由人B7的受体CTLA4膜外段和人IgG1的Fc段组成,其真核表达质粒(pCA-CTLA-Ig)转染的人骨髓瘤细胞P3U1持续分泌CTLA-Ig,培养上清经Proeint A亲和层析纯化。大鼠抗小鼠CD4(GK1.5)、CD8(2.43)、自然杀伤细胞(NK)细胞(PK136)、IFN-γ(R4-6A2)单抗腹水按常规方法制备。同位素51Cr购自英国Amersham公司。
2.动物和细胞株:3LL Lewis肺癌细胞(H-2Kb)来自美国ATCC公司,用DMEM培养基培养;B16黑色素瘤细胞本实验室保存。C57BL/6(H-2b)小鼠,雌性,5~6周龄,购自上海必凯动物有限公司。
, http://www.100md.com
二、方法
1.小鼠骨髓树突状细胞的体外扩增和基因修饰[7]及抗原肽的冲击致敏:收集培养第9~10天的小鼠骨髓DC,经腺病毒介导的基因修饰后4~6小时,进行多肽冲击致敏。2×106/ml DC悬于0.8 ml含100 μg/ml多肽的改良杜尔贝可培养基(IMDM),50 μmol/L 2-ME,置37 ℃、体积分数为5% CO2孵育3小时,间隔30分钟摇晃一次。冲击后的细胞用改良的最低必需介质(IMEM)洗两遍,经放射线照射灭活(60Co,50 Gys),重悬于平衡盐(HBSS)缓冲液中备用。经尾静脉或皮下注射0.2 ml含1×105或1×104经抗原肽刺激的DC进行体内免疫。
2.小鼠脾细胞CTL体外诱导及活性检测:正常C57BL/6小鼠(每组6~8只)经抗原致敏的DC免疫后1周,取其脾淋巴细胞体外诱导CTL活性5天后收集活细胞,采用4小时51Cr释放法 检测CTL杀伤活性。
, 百拇医药
3.抗原肽刺激的树突状细胞的体内免疫保护作用:正常C57BL/6小鼠(每组6~8只),经抗原致敏的DC一次性免疫后7天,皮下接种活的3LL肺癌细胞或B16黑色素瘤细胞(5×105/只),观察瘤体的生长。实验重复3次。
4.免疫细胞亚群及免疫分子的体内阻断试验:DC免疫前或接种肿瘤细胞前第4天始,间隔3天一次腹腔注射0.1 ml抗CD4(GK1.5)、CD8(2.43)、NK(PK136)或IFN-γ(R4-6A2)等相应单抗的杂交瘤腹水,共持续5次或DC与1 mg CTLA-Ig混合注射。1×104抗原肽刺激的DC免疫后第11天,皮下接种3LL肺癌细胞(5×105/只)。
5.Ltn基因转染的树突状细胞的免疫治疗作用:正常C57BL/6小鼠(每组6~8只),足垫皮下注射3LL肿瘤细胞(2×105/只。18天后(瘤体直径达7~8 mm),荷瘤下肢行截肢术,截肢死亡率低于2%。截肢后2天,皮下注射1×104或1×105经抗原肽刺激的DC,一周后重复注射一次。荷瘤后30~35天对照组小鼠开始死亡时,杀鼠称小鼠肺组织的重量。
, http://www.100md.com
6.统计学处理:数据用平均值表示,采用未配对计量资料的t检验分析,P<0.05时差异具有显著性意义。
结 果
1.抗原肽Mut1刺激的、Ltn基因修饰的骨髓DC能更有效地诱导特异CTL细胞毒活性:1×105剂量经Mut1抗原肽刺激的DC一次性免疫小鼠,1周后取脾细胞体外诱导CTL(图1),虽然Mut1刺激的、未经修饰的或LacZ基因修饰的DC能有效地诱导特异杀伤3LL细胞的CTL细胞毒活性,但是不如Mut1刺激的Ltn-DC更有效(图1a)。当以 1×104低剂量经Mut1抗原肽致敏的DC免疫小鼠后,体外诱导的CTL活性很弱,但同样剂量的Mut1致敏的Ltn-DC仍能明显诱导杀伤3LL细胞的细胞毒活性,与前一剂量组中未经修饰的Mut1致敏的DC效应相当(图1b)。HBSS处理组和OVA多肽致敏组不能有效诱导杀伤3LL细胞的细胞毒活性。这提示Ltn-DC体内能更有效地诱导特异CTL。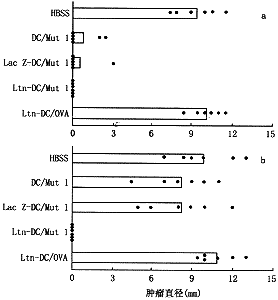
, http://www.100md.com
a. 1×105细胞/只;b.1×104细胞/只
图1 Mut1致敏的Ltn基因修饰的DC对3LL细胞的特异性CTL的体内诱导作用
2.抗原肽刺激的淋巴细胞趋化因子基因修饰的树突状细胞体内诱导的免疫保护作用:一次性免疫小鼠1周后,皮下接种(5×105细胞/只)活的肺癌细胞或B16细胞(图2),与上述CTL效应结果相符,1×105细胞/只剂量经Mut1抗原肽刺激的树突状细胞免疫小鼠能有效抵抗3LL肿瘤的生长,但不如Mut1刺激的、Ltn基因修饰的树突状细胞更有效(图2a)。1×104细胞/只低剂量经Mut1抗原肽刺激的树突状细胞免疫对3LL细胞的攻击无保护作用,所有小鼠均长出肿瘤。但同等剂量的Ltn基因修饰的DC经Mut1抗原刺激后,3LL肿瘤的生长受到明显抑制,瘤体出现延迟,同时生长减慢,接种后20天时仍未长出肿瘤,并且90天后83.3%的小鼠仍未长出肿瘤,提示其激发了强有效的抗肿瘤免疫应答。而经OVA刺激的DC免疫小鼠不能有效产生抗3LL肿瘤细胞的效应。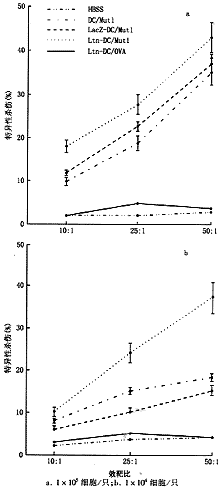
, http://www.100md.com
a. 1×105细胞/只;b. 1×104细胞/只
图2 Mut1致敏的Ltn基因修饰的DC体内诱导的对3LL细胞攻击的免疫保护作用
3.DC诱导抗肿瘤免疫反应的免疫机理分析:如图所示,在DC免疫过程中或肿瘤细胞攻击过程中,阻断CD8+细胞都导致免疫动物丧失对3LL肿瘤细胞的抵抗作用;在免疫过程中阻断CD4+细胞导致免疫动物不能排斥肿瘤细胞,但是在攻击过程中阻断CD4+细胞对其抗肿瘤免疫应答无明显影响。在免疫诱导阶段和免疫效应阶段阻断NK细胞对抗肿瘤免疫应答无明显影响,提示经抗原肽冲击的Ltn-DC诱导抗肿瘤免疫应答过程中,CD4+、CD8+T细胞的参与是必需的,而NK细胞则非必需。此外,在诱导过程中,用可溶性的CTLA-Ig阻断B7/CD28的共刺激信号途径或用抗IFN-γ阻断IFN-γ的作用都抑制Ltn-DC诱导的抗肿瘤免疫应答。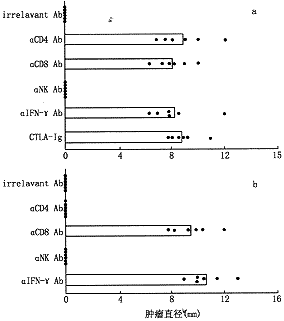
, 百拇医药
a. 诱导阶段的体内阻断;b. 效应阶段的体内阻断
图3 体内阻断细胞亚群和免疫分子对DC诱导抗肿瘤作用
4.抗原肽刺激的Ltn基因修饰的树突状细胞对自发性肺转移小鼠的治疗作用:正常C57BL/6小鼠的肺脏重为190~210 mg;足垫注射3LL细胞(2×105/只)30~35天后,HBSS对照组小鼠的肺脏约为600 mg。1×105剂量Mut1抗原肽刺激的DC或LacZ基因修饰的DC治疗组肺重只有轻度减轻(平均重量分别为436 mg和402 mg)(P>0.05), 而Mut1刺激的Ltn-DC治疗组肺重平均为256 mg (P<0.01);但以1×104剂量处理时,Mut1抗原肽刺激的DC或LacZ基因修饰的DC治疗组疗效丧失,而Mut1刺激的Ltn-DC治疗组肺重仍明显减轻,平均约为312 mg。OVA抗原肽刺激的DC或Ltn-DC治疗无效。此外,Mut1刺激的Ltn-DC治疗组小鼠较对照组小鼠的生存期明显延长。这表明Mut1抗原肽刺激的Ltn-DC能有效抑制肿瘤的自发性肺转移,具有明显的治疗作用。
, http://www.100md.com
讨论
T细胞介导的免疫排斥反应是机体抗肿瘤免疫应答的最重要组成部分,抗原提呈是诱导和调节T细胞免疫的中心环节。通过调节肿瘤抗原的提呈以增强抗肿瘤免疫应答是目前肿瘤免疫治疗的重要策略之一。树突状细胞作为功能最强的抗原提呈细胞和免疫反应的启动者,与机体的免疫状态密切相关,在肿瘤免疫治疗中已显示出其独特的应用价值[1-3]。
DC的抗原提呈有赖于其体内与T细胞的相互作用,而趋化因子在免疫细胞的体内迁移、分布等过程中发挥重要作用,参与机体炎症反应与免疫应答的调节。本研究首次着眼于体内的DC与T细胞作用的微环境,通过基因修饰使回输至体内的抗原致敏的DC释放的淋巴细胞趋化因子,有效地选择性招引T细胞,增强其与T细胞接触机率和相互作用,促进抗原的有效提呈,实验证明,能更有效地激活T细胞介导的抗肿瘤免疫应答,为树突状细胞介导的肿瘤免疫治疗开辟新的途径。
, 百拇医药
尽管MHC-Ⅱ限制性的Mut1抗原肽是由DC提呈给CD8+T细胞的,但在其T细胞免疫应答诱导过程中需CD4+T细胞的参与,这可能与DC体外培养体系中FCS或腺病毒的MHC-II限制性多肽的辅助作用有关,这与Porgador等[4]报道的结果相符。虽然Ltn对NK细胞也有趋化作用[8],但结果表明,在DC诱导的抗肿瘤免疫应答中NK细胞并非必需,而且也不是主要的效应细胞。T细胞的激活除接受抗原特异的第一信号外,同时还需有抗原非特异性的共刺激信号。我们的结果表明,B7/CD28共刺激途径是DC诱导T细胞免疫所必需。DC刺激静息期T细胞向Th1发育,而IFN-γ是介导Th1免疫应答的主要细胞因子,在DC诱导的免疫应答中有赖于IFN-γ的参与。
重组腺病毒载体已被证明能高效介导小鼠和人DC的基因转移[9-11],而并不影响DC诱导抗原特异性的免疫应答。Ltn基因修饰能增强DC诱导的抗肿瘤免疫应答,同时也有利于降低DC免疫治疗的有效剂量,从而降低引发自身免疫性疾病的危险。本研究为增强树突状细胞介导的肿瘤免疫治疗提供了新的思路和有效的新途径, 同时也为趋化因子在肿瘤免疫治疗中的应用提供新的模式。
, 百拇医药
本课题为国家自然科学基金资助项目(39730420)
参考文献
1 曹雪涛. 树突状细胞的基础与临床研究新进展,中国免疫学杂志,1998,3:222.
2 Banchereau J, Steinman R. Dendritic cells and the control of immunity. Nature. 1998; 392: 245-252.
3 Girolomoni G,Riccardi-Castagnoli P. Dendritic cells hold promise for immunotherapy. Immunol Today. 1997,18:102-104.
4 Porgador A,Gillboa E. Bone marrow-generated dendritic cells pulsed with a class I-restricted peptide are potent inducers of cytotoxic T lymphocytes. J Exp Med, 1995, 182:255.
, http://www.100md.com
5 Hsu Frank J C,Benike F. Fagnoni, Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed antigen-pulsed dendritic cells. Nature Med. 1996,2:52-58.
6 章卫平,曹雪涛,马施华,等.小鼠淋巴细胞趋化因子重组腺病毒载体的构建及其在骨髓树突状细胞中的表达.中国免疫学杂志,1998,14:2-6.
7 Mandelboim, O Berke G, Fridkin M, CTL induction by a tumor-associated antigen octapeptide derived from a murine lung carcinoma. Nature,1994,369:67-71.
, 百拇医药 8 Hedrick J, Saylor V, Figueroa D, et al. Lymphotactin is produced by NK cells and attracts both NK cells and T cells in vivo. J Immunol, 1997,158:1533-1540.
9 Cao XT, Zhang W, Huang X, et al. Enhanced antitumor effects of tumor antigen-pulsed dendritic cells by their transfection with GM-CSF.Sci Chi(Series C) 1997,40:539-545.
10 章卫平,曹雪涛,张明徽,等. GM-CSF重组腺病毒扩增的骨髓树突状细胞体外经肿瘤抗原刺激后诱导抗肿瘤免疫应答. 中国免疫学杂志,1997;13:29.
11 章卫平,曹雪涛,黄欣,等. GM-CSF基因修饰的树突状细胞融合后的肿瘤细胞体内诱导抗肿瘤免疫功能的实验研究. 中华医学杂志,1997;77:39-41.
(收稿:1998-06-23 修回:1998-10-12), 百拇医药
单位:200433 上海,第二军医大学免疫学教研室
关键词:树突状细胞;抗原,肿瘤;基因转移
中华医学杂志990303 【摘要】 目的 通过选择性增强树突状细胞(DC)与T细胞的体内相互作用,优化其体内抗原提呈的微环境,为进一步增强DC介导的肿瘤免疫治疗效果。方法 体外培养的小鼠骨髓树突状细胞体外经Ltn重组腺病毒感染后(Ltn-DC),用3LL Lewis肺癌细胞株的Mut1抗原肽冲击致敏,按不同剂量免疫正常同系小鼠体内,观察其体内诱导的细胞毒性T淋巴细胞(CTL)活性保护性免疫反应;通过体内阻断试验探讨免疫细胞亚群及免疫分子在DC诱导抗肿瘤免疫应答中的作用;建立肺癌的自发性肺转移模型,观察免疫治疗作用。结果 抗原肽Mut1刺激的Ltn-DC能更有效地诱导特异CTL活性,能使免疫动物产生更有效的免疫保护作用,抵抗肿瘤细胞的攻击。在抗肿瘤免疫排斥反应的诱导过程中,必需有CD4+T 和CD8+T细胞的参与;而在其效应阶段,则依赖于CD8+T细胞、B7/CD28的共刺激信号途径及γ干扰素(IFN-γ)的参与,并在诱导过程中起着重要作用。抗原肽刺激的Ltn-DC能有效抑制3LL细胞的自发性肺转移,具有更明显的治疗作用。结论 通过基因修饰增强树突状细胞对T细胞的体内选择性趋化活性,能更有效地诱导抗肿瘤免疫反应,为树突状细胞介导的肿瘤免疫治疗开辟了新的途径。
, 百拇医药
Enhanced antitumor effects induced by lymphotactin gene-modified dendritic cells after pulsed with tumor antigen peptide ZHANG Weiping, HE Long, CAO Xuetao. Department of Immunology, Second Military Medical University, Shanghai 200433
【Abstract】 Objective To evaluate the potent effects of lymphotactin on tumor immunogene therapy and to improve the therapeutic efficacy of dendritic cells (DCs)-based vaccine, the protective and therapeutic effects of tumor antigen peptide-pulsed lymphotactin gene-modified dendritic cells were investigated. Methods In the tumor model of 3LL Lewis lung carcinoma, mouse bone marrow DCs transduced with mouse lymphotactin gene by adenovirus vector (Ltn-DC) were pulsed with MHC-I-restricted, 3LL cell-specific tumor peptide Mut 1 (FEQNTAQP), and used to vaccinate syngeneic mice or to treat the preestablished tumor-bearing mice with spontaneous pulmonary metastases.Results Immunization with Mut 1 peptide-pulsed Ltn-DC induced specific CTL against 3LL cells and induced protective antitumor immunity, which rendered the immunized mice resistant completely to 3LL tumor challenge. In vivo depletion of immune cell subsets with mAbs demonstrated that the protective immunity induced by Mut1 peptide-pulsed Ltn-DC in the induction phase was dependent on both CD4+ T cells and CD8+ T cells rather than NK cells, and in the effector phase on CD8+ T cells rather than CD4+ T cells or NK cells. CD28/CTLA4 pathway of T cell costimulation and IFN-γ were also necessary for induction of antitumor immunity by Ltn-DC pulsed with Mut1 peptide. Treatment with Mut1 peptide-pulsed Ltn-DC significantly inhibited the 3LL spontaneous pulmonary metastases of the preestablished tumor-bearing mice and exhibited obvious therapeutic effects. Conclusions Our data suggest that Ltn gene modified DCs are more potent in the induction of protective and therapeutic antitumor immunity through the preferential chemotaxis of DCs on T cells. Vaccination with tumor antigen-pulsed Ltn-DC may be a novel approach to immunotherapy of cancer.
, 百拇医药
【Key words】 Dendritic cells Antigens, neoplasm Gene transfer
(Natl Med J China, 1999, 79:170-173)
树突状细胞(dendritic cells, DC)作为体内的专职抗原提呈细胞,具有强大的激发初次免疫应答的独特功能,在肿瘤免疫治疗中具有潜在的应用价值,因而倍受关注[1-3]。体外经肿瘤抗原致敏的DC体内能有效诱导抗原特异性的抗肿瘤免疫反应,对荷瘤动物具有显著的治疗作用[4]。该途径进入临床试验,用于治疗B淋巴瘤、前列腺癌和结肠癌患者,并显示出初步的疗效[5]。考虑到DC的免疫刺激作用有赖于其体内与T细胞的相互作用,增强DC对T细胞的选择性趋化作用可能更有利于其诱导抗肿瘤免疫应答。我们在成功构建了小鼠Ltn重组腺病毒载体、并证实Ltn基因修饰的DC(Ltn-DC)体外能有效表达Ltn、对CD4+T 和CD8+T趋化活性增强的基础上[6],观察Ltn-DC体外经肿瘤抗原肽致敏后诱导的抗肿瘤免疫应答,并探讨其免疫机理。
, http://www.100md.com
材料与方法
一、材料
1.主要试剂:H-2Kb限制性的鸡卵蛋白(OVA)抗原多肽(SIINFEKL)和3LL小鼠Lewis肺癌细胞的组织相容抗原-1(MHC-Ⅰ)限制性的Mut1抗原八肽(FEQNTAQP[7])由美国CyberSyn公司合成、纯化,纯度>95%。蛋白细胞溶性T淋巴细胞A(CTLA)4-Ig由人B7的受体CTLA4膜外段和人IgG1的Fc段组成,其真核表达质粒(pCA-CTLA-Ig)转染的人骨髓瘤细胞P3U1持续分泌CTLA-Ig,培养上清经Proeint A亲和层析纯化。大鼠抗小鼠CD4(GK1.5)、CD8(2.43)、自然杀伤细胞(NK)细胞(PK136)、IFN-γ(R4-6A2)单抗腹水按常规方法制备。同位素51Cr购自英国Amersham公司。
2.动物和细胞株:3LL Lewis肺癌细胞(H-2Kb)来自美国ATCC公司,用DMEM培养基培养;B16黑色素瘤细胞本实验室保存。C57BL/6(H-2b)小鼠,雌性,5~6周龄,购自上海必凯动物有限公司。
, http://www.100md.com
二、方法
1.小鼠骨髓树突状细胞的体外扩增和基因修饰[7]及抗原肽的冲击致敏:收集培养第9~10天的小鼠骨髓DC,经腺病毒介导的基因修饰后4~6小时,进行多肽冲击致敏。2×106/ml DC悬于0.8 ml含100 μg/ml多肽的改良杜尔贝可培养基(IMDM),50 μmol/L 2-ME,置37 ℃、体积分数为5% CO2孵育3小时,间隔30分钟摇晃一次。冲击后的细胞用改良的最低必需介质(IMEM)洗两遍,经放射线照射灭活(60Co,50 Gys),重悬于平衡盐(HBSS)缓冲液中备用。经尾静脉或皮下注射0.2 ml含1×105或1×104经抗原肽刺激的DC进行体内免疫。
2.小鼠脾细胞CTL体外诱导及活性检测:正常C57BL/6小鼠(每组6~8只)经抗原致敏的DC免疫后1周,取其脾淋巴细胞体外诱导CTL活性5天后收集活细胞,采用4小时51Cr释放法 检测CTL杀伤活性。
, 百拇医药
3.抗原肽刺激的树突状细胞的体内免疫保护作用:正常C57BL/6小鼠(每组6~8只),经抗原致敏的DC一次性免疫后7天,皮下接种活的3LL肺癌细胞或B16黑色素瘤细胞(5×105/只),观察瘤体的生长。实验重复3次。
4.免疫细胞亚群及免疫分子的体内阻断试验:DC免疫前或接种肿瘤细胞前第4天始,间隔3天一次腹腔注射0.1 ml抗CD4(GK1.5)、CD8(2.43)、NK(PK136)或IFN-γ(R4-6A2)等相应单抗的杂交瘤腹水,共持续5次或DC与1 mg CTLA-Ig混合注射。1×104抗原肽刺激的DC免疫后第11天,皮下接种3LL肺癌细胞(5×105/只)。
5.Ltn基因转染的树突状细胞的免疫治疗作用:正常C57BL/6小鼠(每组6~8只),足垫皮下注射3LL肿瘤细胞(2×105/只。18天后(瘤体直径达7~8 mm),荷瘤下肢行截肢术,截肢死亡率低于2%。截肢后2天,皮下注射1×104或1×105经抗原肽刺激的DC,一周后重复注射一次。荷瘤后30~35天对照组小鼠开始死亡时,杀鼠称小鼠肺组织的重量。
, http://www.100md.com
6.统计学处理:数据用平均值表示,采用未配对计量资料的t检验分析,P<0.05时差异具有显著性意义。
结 果
1.抗原肽Mut1刺激的、Ltn基因修饰的骨髓DC能更有效地诱导特异CTL细胞毒活性:1×105剂量经Mut1抗原肽刺激的DC一次性免疫小鼠,1周后取脾细胞体外诱导CTL(图1),虽然Mut1刺激的、未经修饰的或LacZ基因修饰的DC能有效地诱导特异杀伤3LL细胞的CTL细胞毒活性,但是不如Mut1刺激的Ltn-DC更有效(图1a)。当以 1×104低剂量经Mut1抗原肽致敏的DC免疫小鼠后,体外诱导的CTL活性很弱,但同样剂量的Mut1致敏的Ltn-DC仍能明显诱导杀伤3LL细胞的细胞毒活性,与前一剂量组中未经修饰的Mut1致敏的DC效应相当(图1b)。HBSS处理组和OVA多肽致敏组不能有效诱导杀伤3LL细胞的细胞毒活性。这提示Ltn-DC体内能更有效地诱导特异CTL。

, http://www.100md.com
a. 1×105细胞/只;b.1×104细胞/只
图1 Mut1致敏的Ltn基因修饰的DC对3LL细胞的特异性CTL的体内诱导作用
2.抗原肽刺激的淋巴细胞趋化因子基因修饰的树突状细胞体内诱导的免疫保护作用:一次性免疫小鼠1周后,皮下接种(5×105细胞/只)活的肺癌细胞或B16细胞(图2),与上述CTL效应结果相符,1×105细胞/只剂量经Mut1抗原肽刺激的树突状细胞免疫小鼠能有效抵抗3LL肿瘤的生长,但不如Mut1刺激的、Ltn基因修饰的树突状细胞更有效(图2a)。1×104细胞/只低剂量经Mut1抗原肽刺激的树突状细胞免疫对3LL细胞的攻击无保护作用,所有小鼠均长出肿瘤。但同等剂量的Ltn基因修饰的DC经Mut1抗原刺激后,3LL肿瘤的生长受到明显抑制,瘤体出现延迟,同时生长减慢,接种后20天时仍未长出肿瘤,并且90天后83.3%的小鼠仍未长出肿瘤,提示其激发了强有效的抗肿瘤免疫应答。而经OVA刺激的DC免疫小鼠不能有效产生抗3LL肿瘤细胞的效应。

, http://www.100md.com
a. 1×105细胞/只;b. 1×104细胞/只
图2 Mut1致敏的Ltn基因修饰的DC体内诱导的对3LL细胞攻击的免疫保护作用
3.DC诱导抗肿瘤免疫反应的免疫机理分析:如图所示,在DC免疫过程中或肿瘤细胞攻击过程中,阻断CD8+细胞都导致免疫动物丧失对3LL肿瘤细胞的抵抗作用;在免疫过程中阻断CD4+细胞导致免疫动物不能排斥肿瘤细胞,但是在攻击过程中阻断CD4+细胞对其抗肿瘤免疫应答无明显影响。在免疫诱导阶段和免疫效应阶段阻断NK细胞对抗肿瘤免疫应答无明显影响,提示经抗原肽冲击的Ltn-DC诱导抗肿瘤免疫应答过程中,CD4+、CD8+T细胞的参与是必需的,而NK细胞则非必需。此外,在诱导过程中,用可溶性的CTLA-Ig阻断B7/CD28的共刺激信号途径或用抗IFN-γ阻断IFN-γ的作用都抑制Ltn-DC诱导的抗肿瘤免疫应答。

, 百拇医药
a. 诱导阶段的体内阻断;b. 效应阶段的体内阻断
图3 体内阻断细胞亚群和免疫分子对DC诱导抗肿瘤作用
4.抗原肽刺激的Ltn基因修饰的树突状细胞对自发性肺转移小鼠的治疗作用:正常C57BL/6小鼠的肺脏重为190~210 mg;足垫注射3LL细胞(2×105/只)30~35天后,HBSS对照组小鼠的肺脏约为600 mg。1×105剂量Mut1抗原肽刺激的DC或LacZ基因修饰的DC治疗组肺重只有轻度减轻(平均重量分别为436 mg和402 mg)(P>0.05), 而Mut1刺激的Ltn-DC治疗组肺重平均为256 mg (P<0.01);但以1×104剂量处理时,Mut1抗原肽刺激的DC或LacZ基因修饰的DC治疗组疗效丧失,而Mut1刺激的Ltn-DC治疗组肺重仍明显减轻,平均约为312 mg。OVA抗原肽刺激的DC或Ltn-DC治疗无效。此外,Mut1刺激的Ltn-DC治疗组小鼠较对照组小鼠的生存期明显延长。这表明Mut1抗原肽刺激的Ltn-DC能有效抑制肿瘤的自发性肺转移,具有明显的治疗作用。
, http://www.100md.com
讨论
T细胞介导的免疫排斥反应是机体抗肿瘤免疫应答的最重要组成部分,抗原提呈是诱导和调节T细胞免疫的中心环节。通过调节肿瘤抗原的提呈以增强抗肿瘤免疫应答是目前肿瘤免疫治疗的重要策略之一。树突状细胞作为功能最强的抗原提呈细胞和免疫反应的启动者,与机体的免疫状态密切相关,在肿瘤免疫治疗中已显示出其独特的应用价值[1-3]。
DC的抗原提呈有赖于其体内与T细胞的相互作用,而趋化因子在免疫细胞的体内迁移、分布等过程中发挥重要作用,参与机体炎症反应与免疫应答的调节。本研究首次着眼于体内的DC与T细胞作用的微环境,通过基因修饰使回输至体内的抗原致敏的DC释放的淋巴细胞趋化因子,有效地选择性招引T细胞,增强其与T细胞接触机率和相互作用,促进抗原的有效提呈,实验证明,能更有效地激活T细胞介导的抗肿瘤免疫应答,为树突状细胞介导的肿瘤免疫治疗开辟新的途径。
, 百拇医药
尽管MHC-Ⅱ限制性的Mut1抗原肽是由DC提呈给CD8+T细胞的,但在其T细胞免疫应答诱导过程中需CD4+T细胞的参与,这可能与DC体外培养体系中FCS或腺病毒的MHC-II限制性多肽的辅助作用有关,这与Porgador等[4]报道的结果相符。虽然Ltn对NK细胞也有趋化作用[8],但结果表明,在DC诱导的抗肿瘤免疫应答中NK细胞并非必需,而且也不是主要的效应细胞。T细胞的激活除接受抗原特异的第一信号外,同时还需有抗原非特异性的共刺激信号。我们的结果表明,B7/CD28共刺激途径是DC诱导T细胞免疫所必需。DC刺激静息期T细胞向Th1发育,而IFN-γ是介导Th1免疫应答的主要细胞因子,在DC诱导的免疫应答中有赖于IFN-γ的参与。
重组腺病毒载体已被证明能高效介导小鼠和人DC的基因转移[9-11],而并不影响DC诱导抗原特异性的免疫应答。Ltn基因修饰能增强DC诱导的抗肿瘤免疫应答,同时也有利于降低DC免疫治疗的有效剂量,从而降低引发自身免疫性疾病的危险。本研究为增强树突状细胞介导的肿瘤免疫治疗提供了新的思路和有效的新途径, 同时也为趋化因子在肿瘤免疫治疗中的应用提供新的模式。
, 百拇医药
本课题为国家自然科学基金资助项目(39730420)
参考文献
1 曹雪涛. 树突状细胞的基础与临床研究新进展,中国免疫学杂志,1998,3:222.
2 Banchereau J, Steinman R. Dendritic cells and the control of immunity. Nature. 1998; 392: 245-252.
3 Girolomoni G,Riccardi-Castagnoli P. Dendritic cells hold promise for immunotherapy. Immunol Today. 1997,18:102-104.
4 Porgador A,Gillboa E. Bone marrow-generated dendritic cells pulsed with a class I-restricted peptide are potent inducers of cytotoxic T lymphocytes. J Exp Med, 1995, 182:255.
, http://www.100md.com
5 Hsu Frank J C,Benike F. Fagnoni, Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed antigen-pulsed dendritic cells. Nature Med. 1996,2:52-58.
6 章卫平,曹雪涛,马施华,等.小鼠淋巴细胞趋化因子重组腺病毒载体的构建及其在骨髓树突状细胞中的表达.中国免疫学杂志,1998,14:2-6.
7 Mandelboim, O Berke G, Fridkin M, CTL induction by a tumor-associated antigen octapeptide derived from a murine lung carcinoma. Nature,1994,369:67-71.
, 百拇医药 8 Hedrick J, Saylor V, Figueroa D, et al. Lymphotactin is produced by NK cells and attracts both NK cells and T cells in vivo. J Immunol, 1997,158:1533-1540.
9 Cao XT, Zhang W, Huang X, et al. Enhanced antitumor effects of tumor antigen-pulsed dendritic cells by their transfection with GM-CSF.Sci Chi(Series C) 1997,40:539-545.
10 章卫平,曹雪涛,张明徽,等. GM-CSF重组腺病毒扩增的骨髓树突状细胞体外经肿瘤抗原刺激后诱导抗肿瘤免疫应答. 中国免疫学杂志,1997;13:29.
11 章卫平,曹雪涛,黄欣,等. GM-CSF基因修饰的树突状细胞融合后的肿瘤细胞体内诱导抗肿瘤免疫功能的实验研究. 中华医学杂志,1997;77:39-41.
(收稿:1998-06-23 修回:1998-10-12), 百拇医药