神经元性一氧化氮合酶在强啡肽致瘫和镇痛中的作用
作者:李芳 胡文辉 刘娜 强文安 廖维宏 任民峰
单位:400042 重庆,第三军医大学大坪医院野战外科研究所(李芳、胡文辉、廖维宏);中国医学科学院基础医学研究所,中国协和医科大学基础医学院(刘娜、强文安、任民峰)
关键词:强啡肽类;一氧化氮;脊髓损伤;疼痛
中华医学杂志990325 【摘要】 目的 探讨神经元性原生型一氧化氮合酶(ncNOS)在强啡肽(Dyn)A(1-17)致瘫和镇痛中的不同作用。方法 采用ncNOS免疫组织化学和3H-左旋精氨酸转化技术,观测Dyn致瘫和镇痛过程中ncNOS活性和免疫活性(IR)变化,并探讨ncNOS选择性抑制剂7-硝基吲唑对Dyn致瘫和镇痛作用的影响。结果 Dyn A(1-17)蛛网膜下腔注射引起剂量相关性后肢和尾部瘫痪及甩尾甩足抑制;Dyn A(1-17)10 nmol明显抑制背角浅层ncNOS-IR,而腹角的ncNOS-IR与蛛网膜下腔注射对照无明显差异;Dyn A(1-17) 20 nmol明显诱导腹角细胞表达ncNOS-IR而抑制背角浅层ncNOS-IR,显著升高腹侧脊髓cNOS活性而不影响背侧脊髓cNOS活性。7-硝基吲唑可显著对抗Dyn A(1-17) 20 nmol致瘫,而甩尾甩足抑制仍然存在;可显著对抗Dyn A(1-17) 20 nmol/L引起的伤后4小时腹侧脊髓cNOS活性增加和ncNOS-IR增强,但不影响甚至加强Dyn A(1-17) 20 nmol/L对背侧脊髓cNOS活性和ncNOS-IR的抑制作用。结论 腹侧脊髓ncNOS过度激活与Dyn致脊髓损伤有关,背侧脊髓ncNOS活性下降可能与Dyn镇痛有关。
, 百拇医药
Role of neuronal nitric oxide synthase in dynorphin spinal neurotoxicity and analgesia in rats LI Fang*, HU Wenhui, LIU Na, et al. * Research Institute of Surgery and Daping Hospital, Third Military Medical University, Chongqing 400042
【Abstract】 Objective To investigate the different role of neuronal constitutive nitric oxide synthase (ncNOS) in dynorphin (Dyn) A(1-17) spinal neurotoxicity and analgesia.Methods The cNOS activity in ventral and dorsal spinal cord in rats was measured with 3H-L-arginine conversion, and ncNOS immunoreactivity(IR) was observed with strepavidin-peroxidase immunohisto-chemistry.Results Intrathecal administration of Dyn A(1-17) produced dose-dependent paralysis of hindlimbs and tail as well as inhibition of tail flick (TF) and foot flinch (FF) reflexes. Dyn A(1-17) 10 nmol induced only transient paralysis and apparently reduced the ncNOS-IR in the superficial dorsal horn but did not induce any change of ncNOS-IR in the ventral horn cells as compared with saline control. Dyn A(1-17) 20 nmol produced permanent paraplegia with irreversible spinal cord damage, characterized by central and progressive necrosis. Dyn A(1-17) 20 nmol remarkedly induced the expression of ncNOS-IR in the ventral horn cells whereas inhibited ncNOS-IR in the superficial dorsal horn. Dyn A(1-17) 20 nmol also significantly increased the activities of cNOS in the ventral spinal cord but did not affect cNOS activities in the dorsal spinal cord. Intrathecal pretreatment with 7-nitroindazole (7-NI) 1 μmol, a selective ncNOS inhibitor 10 min prior to i.t. Dyn A(1-17) 20 nmol significantly ameliorated Dyn-induced neurological outcome, but TF and FF remained inhibited. 7-nitroindazole also significantly antagonized the increases of cNOS activities and ncNOS-IR in the ventral spinal cord at 4 h after i.t. Dyn A(1-17) 20 nmol, but did not affect or even potentiated Dyn-induced inhibition of cNOS activity and ncNOS-IR in the dorsal spinal cord.Conclusions Over-expression or over-activation of ncNOS in the ventral spinal cord may be involved in Dyn spinal neurotoxicity, whereas as the reduction of ncNOS activities in the dorsal spinal cord might reflect Dyn spinal analgeisia or pain modulation.
, 百拇医药
【Key words】 Dynorphins Nitric oxide Spinal cord injury Pain
(Natl Med J China, 1999,79:217-220)
强啡肽(Dynorphin, Dyn) A (1-17)在蛛网膜下腔注射后产生强烈的镇痛作用,但大剂量时常伴一过性或持久性截瘫[1]。在外周神经病痛和脊髓损伤(spinal cord injury, SCI)后内源性Dyn含量和基因表达均明显升高,提示Dyn参与镇痛或痛调制及脊髓继发损伤[1,2]。但Dyn致SCI与镇痛作用的机制尚不十分清楚[3]。作者采用神经元性原生型NOS(Neuronal constitutive NOS, ncNOS)免疫组织化学和3H-左旋精氨酸(L-Arginine, L-Arg)转化技术,观测Dyn A(1-17)致瘫和镇痛过程中ncNOS活性和免疫活性(Immunoreactivity, IR)变化,并探讨ncNOS选择性抑制剂7-硝基吲唑(7-nitroindazole, 7-NI)对Dyn致SCI和镇痛作用的影响。
, http://www.100md.com
材料与方法
一、材料
1.药品与试剂:Dyn A(1-17)为Peninsula公司产品,批号:34523。3H-L-Arg为Amersham Lifescience公司产品。7-NI为RBI公司产品。抗鼠脑ncNOS纯化酶多克隆抗体,由John Hopkins大学医学院Snyder和Dawson教授惠赠。Strepavidin-Peroxidase (SP)试剂盒为Zimed公司产品。
2.动物、手术和药物引入:Wistar大鼠106只,雌雄各半,体重(270±15) g,由中日友好医院临床医学研究所动物室提供。按Yaksh(1976)改进法进行蛛网膜下腔注射(i.t)插管[4]。7-NI用0.5%Na2CO3溶解后(混悬状)用0.2 mol/L HCl调pH至7.4,临用前充分振荡混悬。其余药物均用生理盐水配制。
, 百拇医药
二、方法
1.后肢运动功能测定:根据Faden(1987)8点分级法和Behrmann(1993)5点分级法加以改进[4]。
2.热辐射甩尾潜伏期(TFL)和缩腿潜伏期(FFL)测定:用自制的热辐射疼痛测定仪测定TFL和FFL。将大鼠置于特制的大鼠固定笼中,让动物适应(安静)30分钟后进行实验。以离尾尖3 cm和5 cm处为TFL测试点,以足跖部中央为FFL测试点。每5~10分钟测定一次。用药前测定3次,取其平均值为基础潜伏期。调整热辐射刺激强度使基础潜伏期为4~5秒,以14秒为“Cut off”即完全抑制潜伏期。潜伏期延长率(抑制程度)=(测定值-基础值)÷基础值。
3.cNOS活性测定:断头处死大鼠,迅速(<20秒)取出T11~L6脊髓置于冰冷的石蜡板上,在放大镜下沿正中裂撕成左右两半,用刀片沿灰质中央均分成背腹两份,将背侧与腹侧脊髓分装于离心管中。置液氮中速冻后于-70 ℃保存备用,取材至速冻约2~3分钟,并保持在4 ℃条件下进行。按协和医科大学基础医学院3H-L-Arg转化法试剂盒测定cNOS活性[5]。
, 百拇医药
4.免疫组织(细胞)化学SP法:常规灌注固定脊髓。以i.t管尖端为中心,向上向下每0.5 cm为一段,横向切取脊髓。为确保形态学的可比性,根据实验设计,沿脊髓双侧或单侧进行纵行切口,将双切口、单切口和未切口脊髓合为一起进行冰冻切片,厚度为40 μm。根据常规SP免疫组织化学程序进行漂浮法染色。ncNOS多抗最佳滴度为1∶1 000 4 ℃过夜,生物素化的抗兔Ⅱ抗1∶200室温1小时,SP 1∶200室温30分钟,DAB呈色。
5.统计学方法:对运动功能分级资料进行Mann-Whitney U检验。对cNOS活性测定的数据进行单因素方差分析和Newman-Keuls检验以及非配对资料组间双侧t检验。结果以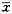 ±s表示。
±s表示。
结 果
一、Dyn致瘫与镇痛的量效关系
, http://www.100md.com
Dyn A(1-17) 1.25~20 nmol/L i.t(64只)引起剂量依赖性后肢和尾部瘫痪及脊髓病理损害,详见文献[4]。在i.t各剂量Dyn A(1-17)后,一直无瘫痪的大鼠,其TFL和FFL大多数无明显变化,个别动物有渐变性甩尾抑制,但均未见到完全性甩尾抑制。在有一过性瘫痪的大鼠均见明显甩尾抑制,并且呈现明显的渐变过程;FFL也见延长,但没有TFL明显。在一部分动物甩足抑制与甩尾抑制同步,且渐变过程明显;也有一部分动物,其甩足与甩尾抑制分离即甩尾抑制明显而甩足抑制不明显。甩尾抑制与尾瘫可见到分离现象,即尾部运动功能恢复后甩尾抑制仍然存在。
二、7-NI明显对抗Dyn致瘫,而甩尾抑制仍然存在
提前10分钟i.t ncNOS选择性抑制剂7-NI 1 μmol/L后,可显著对抗Dyn A(1-17) 20 nmol引起的持久瘫和神经元损伤,并具有明显的甩尾和甩足抑制作用。在7-NI与Dyn 20 nmol合用的6只大鼠中有3只一直不瘫,2只仅出现一过性瘫(30~60分钟内完全恢复),1只为严重瘫痪,在1~4小时恢复至1~2级。而单用Dyn A(1-17) 20 nmol后19只大鼠均出现严重瘫痪,其中16只在24小时均无明显恢复,仅1只在1小时内、2只在4小时内恢复至6~7级。二者比较,差异有非常显著意义(P<0.01)。
, http://www.100md.com
三、背侧与腹侧脊髓cNOS活性变化
在i.t对照正常大鼠,背侧脊髓的cNOS活性明显高于腹侧。在i.t Dyn A(1-17) 20 nmol致持久瘫后30分钟至48小时,cNOS活性在腹侧脊髓均明显升高,而在背侧均无显著的统计学变化(图1)。我们在预实验中初步观察了Dyn致持久瘫后总脊髓的cNOS活性变化,也获得类似结果。正常组5只大鼠总脊髓的cNOS活性为(28.5±3.3) fmol*mg-1*min-1;在Dyn A(1-17)致瘫后2小时和24小时,cNOS活性分别升高至(40.0±3.9)fmol*mg-1*min-1(7只,P<0.05)和(54.0±1.7)fmol*mg-1*min-1(5只,P<0.01)。
提前10分钟i.t 7-NI 1 μmol/L,可明显对抗Dyn 20 nmol/L引起的伤后4小时腹侧cNOS活性升高,同时也显著抑制背侧cNOS活性,较i.t对照下降了65.7%(图1)。
, http://www.100md.com
图1 强啡肽致瘫后腹侧(V)与背侧(D)脊髓cNOS活性变化及7-nitroindazole (7-NI)的影响
四、ncNOS免疫活性变化
在i.t对照大鼠,ncNOS免疫反应阳性的细胞和纤维主要分布在Ⅰ~Ⅱ、X层和中间外侧核(IML),为轻中度着色(图2A)。Ⅲ层几无阳性,在Ⅳ层可见散在数个中等(10~20 μm)多极性神经元,在Ⅴ~Ⅵ层很难见到阳性细胞。在腹角及中间带偶见1~3个阳性细胞,以中间神经元为主。在Dyn A(1-17)10 nmol/L致一过性瘫后30分钟、1和2小时,Ⅰ~Ⅱ和X层的ncNOS-IR阳性细胞数和着色程度明显下降,在4和24小时有所恢复。在Dyn A(1-17) 20 nmol/L致持久瘫后5分钟即见ncNOS-IR明显阳性,10、20、30分钟均明显阳性,1~2小时表达最强(图2B),3~4小时仍明显阳性。与i.t对照组相比,正常有ncNOS-IR的X和IML层在Dyn致瘫后ncNOS-IR增多增强,突起丰富广泛,相互网络,并伸向前根;而Ⅰ~Ⅱ层的ncNOS-IR也见增多增强但不如其它板层明显。正常对照很少阳性或无阳性的Ⅶ、Ⅷ、Ⅸ(中间带和腹角)及Ⅴ层在Dyn致瘫后ncNOS-IR被明显诱导表达,阳性数大大增多,着色特强,突起广泛;主要是Ⅶ的外侧细胞群(LG)和内侧细胞群(MG),及Ⅷ、Ⅸ层的少数运动神经元明显阳性,但并非全部运动神经元及中小型神经细胞均为阳性。在24~48小时,脊髓发生严重坏死,残留边缘区的存活细胞明显ncNOS-IR阳性。变化最显著的节段大多在L2~L3,主要取决于病理损伤节段;损伤最重的节段ncNOS表达最明显,但表达ncNOS-IR细胞最终也死亡。在某些节段,一侧脊髓明显坏死,ncNOS-IR细胞消失;而另一侧尚残留大量结构完整的ncNOS-IR神经元。腹侧纵束在正常时ncNOS-IR很弱或无,但Dyn致瘫后明显阳性或增强(图2B)。
, http://www.100md.com
7-NI 1 μmol与Dyn A(1-17)20 nmol/L合用可明显对抗Dyn引起的ncNOS-IR增强,其表现与i.t对照相似,主要分布在Ⅰ~Ⅱ和X层,其ncNOS-IR染色程度和细胞数较单用Dyn A(1-17) 20 nmol/L的弱(图2C)。提示7-NI可对抗Dyn诱发的腹角(Ⅶ、Ⅷ、Ⅸ)ncNOS-IR增强,并加强Dyn对背角(Ⅰ~Ⅱ)和X层ncNOS-IR的抑制作用。
图2 强啡肽致瘫与7-nitroindazole (7-NI)对抗强啡肽致瘫后脊髓神经元性cNOS免疫组织化学染色.A为对照 ×40, B为强啡肽致瘫后 ×100 C为7-NI治疗后 ×40
讨 论
腹侧脊髓主管运动功能,背侧脊髓主管感觉功能;腹侧与背侧脊髓的细胞构筑、信息传递方式、递质或调质分布与共存及受体特性等均有不同。因此,在SCI中,背侧与腹侧脊髓可能具有不同的作用和意义,但有关的对比研究尚未引起足够的重视。虽然Dyn致瘫作用阻碍了人们对Dyn镇痛效果的判定,但大多数资料表明Dyn在脊髓水平具有明显的镇痛或痛调制作用。Dyn小剂量(生理)镇痛大剂量(病理生理)致瘫可能分属两个不同的作用机制,并可能分别与背侧和腹侧脊髓有关。
, 百拇医药
Dyn A(1-17)致伤后数分钟内即见腹侧脊髓的ncNOS-IR明显增加,2~4小时达高峰,cNOS活性(可能主要代表ncNOS)在观测最早时间伤后30分钟也明显升高,均持续24~48小时以上;选择性ncNOS抑制剂7-NI,可显著对抗Dyn A(1-17) 20 nmol引起的运动功能障碍,以及伤后4小时腹侧脊髓cNOS活性增加和ncNOS-IR增强。表明ncNOS在Dyn致SCI后尤其在早期起重要作用。已有研究发现ncNOS基因“敲除”的小鼠能抵抗局部或全脑缺血损伤[6];7-NI可减轻脑缺血、脑创伤和兴奋毒性[7]。因左旋精氨酸类似物和L-NAME等对ncNOS和ecNOS无选择性,故L-NAME等治疗中枢神经损伤的疗效文献报道颇不一致[8,9]。我们也发现L-NAME不能对抗反而加重Dyn致瘫[4]。本研究证明,ncNOS与Dyn致SCI机制有关,这对SCI的临床救治具有一定指导意义。
作者亦观察到致瘫剂量Dyn诱发腹侧脊髓表达ncNOS的同时也抑制背侧脊髓ncNOS-IR;在7-NI对抗了Dyn致瘫后,甩尾抑制仍然存在。表明在Dyn镇痛和致瘫过程中背侧与腹侧脊髓的ncNOS变化并不相同,背侧脊髓ncNOS活性下降可能与Dyn镇痛或痛调制作用有关。因此,联合应用ncNOS抑制剂和阿片类镇痛药物,对防治SCI和减轻疼痛等并发症有重要参考价值。
, http://www.100md.com
Dyn引起腹侧脊髓ncNOS表达增加而背侧脊髓ncNOS表达降低的机制尚不清楚。我们设想在背侧脊髓,Dyn可能通过κ阿片受体(突触前水平)抑制Ca2+内流和谷氨酸释放,也可能对NMDA受体(突触后水平)有直接抑制作用,进而抑制ncNOS活性。在腹侧脊髓,Dyn可能直接调制NMDA受体(突触后,也可能含突触前)及通过促进谷氨酸释放(突触前)而间接引起NMDA受体过度兴奋和胞内Ca2+超负荷,进而激活ncNOS引起中毒性NO释放。同时κ阿片受体也可能参与Dyn过度激活腹侧脊髓NMDA-Ca2+-cNOS通路的作用[1]。
本课题为国家自然科学基金资助项目(39370786)
参考文献
1 Tian XF, Cheng B, Jen MF. The study on the mechanisms underlying dynorphin spinal neurotoxicity. Chin J Physiol Sci, 1994,10:289-297.
, 百拇医药
2 Long JB, Rigamonti DD, Oleshansky MA, et al. Dynorphin A-induced rat spinal cord injury: Evidence for excitatory amino acid involvement in a pharmacological model of ischemic spinsl cord injury. J Pharm Exp Therap, 1994,269:358-366.
3 Hu WH, Lee FCH, Wan XST, et al. Dynorhpin neurotoxicity induced nitric oxide synthase expression in ventral horn cells of rat spinal cord. Neurosci Lett, 1996,203:13-165.
4 胡文辉,刘娜,孙秀君,等.L-NAME加重强啡肽致脊髓损伤作用.神经科学,1997,4:115-118.
, 百拇医药
5 强文安,刘捷,吕芳玲,等.3H-精氨酸转化测定一氧化氮合酶活性.中华医学杂志,1996,76:567-571.
6 Zaharchuk G, Hara H, Huang PL, et al. Neuronal nitric oxide synthase mutant mice show smaller infarcts and attenuated apparent diffusion coefficient changes in the peri-infarct zone during focal cerebral ischemia. Magn Reson Med, 1997,37:170-175.
7 Mesenge C, Verrecchia C, Allix M, et al. Reduction of the neurological deficit in mice with traumatic brain injury by nitric oxide synthase inhibitors. J Neurotrauma, 1996,13:209-214.
8 Iadecola C. Bright and dark sides of nitric oxide in ischemic brain injury. TiNS, 1997,20:132-139.
9 赵立,李涛,孙锡超,等.一氧化氮合酶活性的变化对大鼠脊髓继发性损害的影响.中华医学杂志,1998,78:27-29.
(收稿:1998-04-22 修回:1998-12-10), 百拇医药
单位:400042 重庆,第三军医大学大坪医院野战外科研究所(李芳、胡文辉、廖维宏);中国医学科学院基础医学研究所,中国协和医科大学基础医学院(刘娜、强文安、任民峰)
关键词:强啡肽类;一氧化氮;脊髓损伤;疼痛
中华医学杂志990325 【摘要】 目的 探讨神经元性原生型一氧化氮合酶(ncNOS)在强啡肽(Dyn)A(1-17)致瘫和镇痛中的不同作用。方法 采用ncNOS免疫组织化学和3H-左旋精氨酸转化技术,观测Dyn致瘫和镇痛过程中ncNOS活性和免疫活性(IR)变化,并探讨ncNOS选择性抑制剂7-硝基吲唑对Dyn致瘫和镇痛作用的影响。结果 Dyn A(1-17)蛛网膜下腔注射引起剂量相关性后肢和尾部瘫痪及甩尾甩足抑制;Dyn A(1-17)10 nmol明显抑制背角浅层ncNOS-IR,而腹角的ncNOS-IR与蛛网膜下腔注射对照无明显差异;Dyn A(1-17) 20 nmol明显诱导腹角细胞表达ncNOS-IR而抑制背角浅层ncNOS-IR,显著升高腹侧脊髓cNOS活性而不影响背侧脊髓cNOS活性。7-硝基吲唑可显著对抗Dyn A(1-17) 20 nmol致瘫,而甩尾甩足抑制仍然存在;可显著对抗Dyn A(1-17) 20 nmol/L引起的伤后4小时腹侧脊髓cNOS活性增加和ncNOS-IR增强,但不影响甚至加强Dyn A(1-17) 20 nmol/L对背侧脊髓cNOS活性和ncNOS-IR的抑制作用。结论 腹侧脊髓ncNOS过度激活与Dyn致脊髓损伤有关,背侧脊髓ncNOS活性下降可能与Dyn镇痛有关。
, 百拇医药
Role of neuronal nitric oxide synthase in dynorphin spinal neurotoxicity and analgesia in rats LI Fang*, HU Wenhui, LIU Na, et al. * Research Institute of Surgery and Daping Hospital, Third Military Medical University, Chongqing 400042
【Abstract】 Objective To investigate the different role of neuronal constitutive nitric oxide synthase (ncNOS) in dynorphin (Dyn) A(1-17) spinal neurotoxicity and analgesia.Methods The cNOS activity in ventral and dorsal spinal cord in rats was measured with 3H-L-arginine conversion, and ncNOS immunoreactivity(IR) was observed with strepavidin-peroxidase immunohisto-chemistry.Results Intrathecal administration of Dyn A(1-17) produced dose-dependent paralysis of hindlimbs and tail as well as inhibition of tail flick (TF) and foot flinch (FF) reflexes. Dyn A(1-17) 10 nmol induced only transient paralysis and apparently reduced the ncNOS-IR in the superficial dorsal horn but did not induce any change of ncNOS-IR in the ventral horn cells as compared with saline control. Dyn A(1-17) 20 nmol produced permanent paraplegia with irreversible spinal cord damage, characterized by central and progressive necrosis. Dyn A(1-17) 20 nmol remarkedly induced the expression of ncNOS-IR in the ventral horn cells whereas inhibited ncNOS-IR in the superficial dorsal horn. Dyn A(1-17) 20 nmol also significantly increased the activities of cNOS in the ventral spinal cord but did not affect cNOS activities in the dorsal spinal cord. Intrathecal pretreatment with 7-nitroindazole (7-NI) 1 μmol, a selective ncNOS inhibitor 10 min prior to i.t. Dyn A(1-17) 20 nmol significantly ameliorated Dyn-induced neurological outcome, but TF and FF remained inhibited. 7-nitroindazole also significantly antagonized the increases of cNOS activities and ncNOS-IR in the ventral spinal cord at 4 h after i.t. Dyn A(1-17) 20 nmol, but did not affect or even potentiated Dyn-induced inhibition of cNOS activity and ncNOS-IR in the dorsal spinal cord.Conclusions Over-expression or over-activation of ncNOS in the ventral spinal cord may be involved in Dyn spinal neurotoxicity, whereas as the reduction of ncNOS activities in the dorsal spinal cord might reflect Dyn spinal analgeisia or pain modulation.
, 百拇医药
【Key words】 Dynorphins Nitric oxide Spinal cord injury Pain
(Natl Med J China, 1999,79:217-220)
强啡肽(Dynorphin, Dyn) A (1-17)在蛛网膜下腔注射后产生强烈的镇痛作用,但大剂量时常伴一过性或持久性截瘫[1]。在外周神经病痛和脊髓损伤(spinal cord injury, SCI)后内源性Dyn含量和基因表达均明显升高,提示Dyn参与镇痛或痛调制及脊髓继发损伤[1,2]。但Dyn致SCI与镇痛作用的机制尚不十分清楚[3]。作者采用神经元性原生型NOS(Neuronal constitutive NOS, ncNOS)免疫组织化学和3H-左旋精氨酸(L-Arginine, L-Arg)转化技术,观测Dyn A(1-17)致瘫和镇痛过程中ncNOS活性和免疫活性(Immunoreactivity, IR)变化,并探讨ncNOS选择性抑制剂7-硝基吲唑(7-nitroindazole, 7-NI)对Dyn致SCI和镇痛作用的影响。
, http://www.100md.com
材料与方法
一、材料
1.药品与试剂:Dyn A(1-17)为Peninsula公司产品,批号:34523。3H-L-Arg为Amersham Lifescience公司产品。7-NI为RBI公司产品。抗鼠脑ncNOS纯化酶多克隆抗体,由John Hopkins大学医学院Snyder和Dawson教授惠赠。Strepavidin-Peroxidase (SP)试剂盒为Zimed公司产品。
2.动物、手术和药物引入:Wistar大鼠106只,雌雄各半,体重(270±15) g,由中日友好医院临床医学研究所动物室提供。按Yaksh(1976)改进法进行蛛网膜下腔注射(i.t)插管[4]。7-NI用0.5%Na2CO3溶解后(混悬状)用0.2 mol/L HCl调pH至7.4,临用前充分振荡混悬。其余药物均用生理盐水配制。
, 百拇医药
二、方法
1.后肢运动功能测定:根据Faden(1987)8点分级法和Behrmann(1993)5点分级法加以改进[4]。
2.热辐射甩尾潜伏期(TFL)和缩腿潜伏期(FFL)测定:用自制的热辐射疼痛测定仪测定TFL和FFL。将大鼠置于特制的大鼠固定笼中,让动物适应(安静)30分钟后进行实验。以离尾尖3 cm和5 cm处为TFL测试点,以足跖部中央为FFL测试点。每5~10分钟测定一次。用药前测定3次,取其平均值为基础潜伏期。调整热辐射刺激强度使基础潜伏期为4~5秒,以14秒为“Cut off”即完全抑制潜伏期。潜伏期延长率(抑制程度)=(测定值-基础值)÷基础值。
3.cNOS活性测定:断头处死大鼠,迅速(<20秒)取出T11~L6脊髓置于冰冷的石蜡板上,在放大镜下沿正中裂撕成左右两半,用刀片沿灰质中央均分成背腹两份,将背侧与腹侧脊髓分装于离心管中。置液氮中速冻后于-70 ℃保存备用,取材至速冻约2~3分钟,并保持在4 ℃条件下进行。按协和医科大学基础医学院3H-L-Arg转化法试剂盒测定cNOS活性[5]。
, 百拇医药
4.免疫组织(细胞)化学SP法:常规灌注固定脊髓。以i.t管尖端为中心,向上向下每0.5 cm为一段,横向切取脊髓。为确保形态学的可比性,根据实验设计,沿脊髓双侧或单侧进行纵行切口,将双切口、单切口和未切口脊髓合为一起进行冰冻切片,厚度为40 μm。根据常规SP免疫组织化学程序进行漂浮法染色。ncNOS多抗最佳滴度为1∶1 000 4 ℃过夜,生物素化的抗兔Ⅱ抗1∶200室温1小时,SP 1∶200室温30分钟,DAB呈色。
5.统计学方法:对运动功能分级资料进行Mann-Whitney U检验。对cNOS活性测定的数据进行单因素方差分析和Newman-Keuls检验以及非配对资料组间双侧t检验。结果以
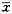 ±s表示。
±s表示。结 果
一、Dyn致瘫与镇痛的量效关系
, http://www.100md.com
Dyn A(1-17) 1.25~20 nmol/L i.t(64只)引起剂量依赖性后肢和尾部瘫痪及脊髓病理损害,详见文献[4]。在i.t各剂量Dyn A(1-17)后,一直无瘫痪的大鼠,其TFL和FFL大多数无明显变化,个别动物有渐变性甩尾抑制,但均未见到完全性甩尾抑制。在有一过性瘫痪的大鼠均见明显甩尾抑制,并且呈现明显的渐变过程;FFL也见延长,但没有TFL明显。在一部分动物甩足抑制与甩尾抑制同步,且渐变过程明显;也有一部分动物,其甩足与甩尾抑制分离即甩尾抑制明显而甩足抑制不明显。甩尾抑制与尾瘫可见到分离现象,即尾部运动功能恢复后甩尾抑制仍然存在。
二、7-NI明显对抗Dyn致瘫,而甩尾抑制仍然存在
提前10分钟i.t ncNOS选择性抑制剂7-NI 1 μmol/L后,可显著对抗Dyn A(1-17) 20 nmol引起的持久瘫和神经元损伤,并具有明显的甩尾和甩足抑制作用。在7-NI与Dyn 20 nmol合用的6只大鼠中有3只一直不瘫,2只仅出现一过性瘫(30~60分钟内完全恢复),1只为严重瘫痪,在1~4小时恢复至1~2级。而单用Dyn A(1-17) 20 nmol后19只大鼠均出现严重瘫痪,其中16只在24小时均无明显恢复,仅1只在1小时内、2只在4小时内恢复至6~7级。二者比较,差异有非常显著意义(P<0.01)。
, http://www.100md.com
三、背侧与腹侧脊髓cNOS活性变化
在i.t对照正常大鼠,背侧脊髓的cNOS活性明显高于腹侧。在i.t Dyn A(1-17) 20 nmol致持久瘫后30分钟至48小时,cNOS活性在腹侧脊髓均明显升高,而在背侧均无显著的统计学变化(图1)。我们在预实验中初步观察了Dyn致持久瘫后总脊髓的cNOS活性变化,也获得类似结果。正常组5只大鼠总脊髓的cNOS活性为(28.5±3.3) fmol*mg-1*min-1;在Dyn A(1-17)致瘫后2小时和24小时,cNOS活性分别升高至(40.0±3.9)fmol*mg-1*min-1(7只,P<0.05)和(54.0±1.7)fmol*mg-1*min-1(5只,P<0.01)。
提前10分钟i.t 7-NI 1 μmol/L,可明显对抗Dyn 20 nmol/L引起的伤后4小时腹侧cNOS活性升高,同时也显著抑制背侧cNOS活性,较i.t对照下降了65.7%(图1)。

, http://www.100md.com
图1 强啡肽致瘫后腹侧(V)与背侧(D)脊髓cNOS活性变化及7-nitroindazole (7-NI)的影响
四、ncNOS免疫活性变化
在i.t对照大鼠,ncNOS免疫反应阳性的细胞和纤维主要分布在Ⅰ~Ⅱ、X层和中间外侧核(IML),为轻中度着色(图2A)。Ⅲ层几无阳性,在Ⅳ层可见散在数个中等(10~20 μm)多极性神经元,在Ⅴ~Ⅵ层很难见到阳性细胞。在腹角及中间带偶见1~3个阳性细胞,以中间神经元为主。在Dyn A(1-17)10 nmol/L致一过性瘫后30分钟、1和2小时,Ⅰ~Ⅱ和X层的ncNOS-IR阳性细胞数和着色程度明显下降,在4和24小时有所恢复。在Dyn A(1-17) 20 nmol/L致持久瘫后5分钟即见ncNOS-IR明显阳性,10、20、30分钟均明显阳性,1~2小时表达最强(图2B),3~4小时仍明显阳性。与i.t对照组相比,正常有ncNOS-IR的X和IML层在Dyn致瘫后ncNOS-IR增多增强,突起丰富广泛,相互网络,并伸向前根;而Ⅰ~Ⅱ层的ncNOS-IR也见增多增强但不如其它板层明显。正常对照很少阳性或无阳性的Ⅶ、Ⅷ、Ⅸ(中间带和腹角)及Ⅴ层在Dyn致瘫后ncNOS-IR被明显诱导表达,阳性数大大增多,着色特强,突起广泛;主要是Ⅶ的外侧细胞群(LG)和内侧细胞群(MG),及Ⅷ、Ⅸ层的少数运动神经元明显阳性,但并非全部运动神经元及中小型神经细胞均为阳性。在24~48小时,脊髓发生严重坏死,残留边缘区的存活细胞明显ncNOS-IR阳性。变化最显著的节段大多在L2~L3,主要取决于病理损伤节段;损伤最重的节段ncNOS表达最明显,但表达ncNOS-IR细胞最终也死亡。在某些节段,一侧脊髓明显坏死,ncNOS-IR细胞消失;而另一侧尚残留大量结构完整的ncNOS-IR神经元。腹侧纵束在正常时ncNOS-IR很弱或无,但Dyn致瘫后明显阳性或增强(图2B)。
, http://www.100md.com
7-NI 1 μmol与Dyn A(1-17)20 nmol/L合用可明显对抗Dyn引起的ncNOS-IR增强,其表现与i.t对照相似,主要分布在Ⅰ~Ⅱ和X层,其ncNOS-IR染色程度和细胞数较单用Dyn A(1-17) 20 nmol/L的弱(图2C)。提示7-NI可对抗Dyn诱发的腹角(Ⅶ、Ⅷ、Ⅸ)ncNOS-IR增强,并加强Dyn对背角(Ⅰ~Ⅱ)和X层ncNOS-IR的抑制作用。

图2 强啡肽致瘫与7-nitroindazole (7-NI)对抗强啡肽致瘫后脊髓神经元性cNOS免疫组织化学染色.A为对照 ×40, B为强啡肽致瘫后 ×100 C为7-NI治疗后 ×40
讨 论
腹侧脊髓主管运动功能,背侧脊髓主管感觉功能;腹侧与背侧脊髓的细胞构筑、信息传递方式、递质或调质分布与共存及受体特性等均有不同。因此,在SCI中,背侧与腹侧脊髓可能具有不同的作用和意义,但有关的对比研究尚未引起足够的重视。虽然Dyn致瘫作用阻碍了人们对Dyn镇痛效果的判定,但大多数资料表明Dyn在脊髓水平具有明显的镇痛或痛调制作用。Dyn小剂量(生理)镇痛大剂量(病理生理)致瘫可能分属两个不同的作用机制,并可能分别与背侧和腹侧脊髓有关。
, 百拇医药
Dyn A(1-17)致伤后数分钟内即见腹侧脊髓的ncNOS-IR明显增加,2~4小时达高峰,cNOS活性(可能主要代表ncNOS)在观测最早时间伤后30分钟也明显升高,均持续24~48小时以上;选择性ncNOS抑制剂7-NI,可显著对抗Dyn A(1-17) 20 nmol引起的运动功能障碍,以及伤后4小时腹侧脊髓cNOS活性增加和ncNOS-IR增强。表明ncNOS在Dyn致SCI后尤其在早期起重要作用。已有研究发现ncNOS基因“敲除”的小鼠能抵抗局部或全脑缺血损伤[6];7-NI可减轻脑缺血、脑创伤和兴奋毒性[7]。因左旋精氨酸类似物和L-NAME等对ncNOS和ecNOS无选择性,故L-NAME等治疗中枢神经损伤的疗效文献报道颇不一致[8,9]。我们也发现L-NAME不能对抗反而加重Dyn致瘫[4]。本研究证明,ncNOS与Dyn致SCI机制有关,这对SCI的临床救治具有一定指导意义。
作者亦观察到致瘫剂量Dyn诱发腹侧脊髓表达ncNOS的同时也抑制背侧脊髓ncNOS-IR;在7-NI对抗了Dyn致瘫后,甩尾抑制仍然存在。表明在Dyn镇痛和致瘫过程中背侧与腹侧脊髓的ncNOS变化并不相同,背侧脊髓ncNOS活性下降可能与Dyn镇痛或痛调制作用有关。因此,联合应用ncNOS抑制剂和阿片类镇痛药物,对防治SCI和减轻疼痛等并发症有重要参考价值。
, http://www.100md.com
Dyn引起腹侧脊髓ncNOS表达增加而背侧脊髓ncNOS表达降低的机制尚不清楚。我们设想在背侧脊髓,Dyn可能通过κ阿片受体(突触前水平)抑制Ca2+内流和谷氨酸释放,也可能对NMDA受体(突触后水平)有直接抑制作用,进而抑制ncNOS活性。在腹侧脊髓,Dyn可能直接调制NMDA受体(突触后,也可能含突触前)及通过促进谷氨酸释放(突触前)而间接引起NMDA受体过度兴奋和胞内Ca2+超负荷,进而激活ncNOS引起中毒性NO释放。同时κ阿片受体也可能参与Dyn过度激活腹侧脊髓NMDA-Ca2+-cNOS通路的作用[1]。
本课题为国家自然科学基金资助项目(39370786)
参考文献
1 Tian XF, Cheng B, Jen MF. The study on the mechanisms underlying dynorphin spinal neurotoxicity. Chin J Physiol Sci, 1994,10:289-297.
, 百拇医药
2 Long JB, Rigamonti DD, Oleshansky MA, et al. Dynorphin A-induced rat spinal cord injury: Evidence for excitatory amino acid involvement in a pharmacological model of ischemic spinsl cord injury. J Pharm Exp Therap, 1994,269:358-366.
3 Hu WH, Lee FCH, Wan XST, et al. Dynorhpin neurotoxicity induced nitric oxide synthase expression in ventral horn cells of rat spinal cord. Neurosci Lett, 1996,203:13-165.
4 胡文辉,刘娜,孙秀君,等.L-NAME加重强啡肽致脊髓损伤作用.神经科学,1997,4:115-118.
, 百拇医药
5 强文安,刘捷,吕芳玲,等.3H-精氨酸转化测定一氧化氮合酶活性.中华医学杂志,1996,76:567-571.
6 Zaharchuk G, Hara H, Huang PL, et al. Neuronal nitric oxide synthase mutant mice show smaller infarcts and attenuated apparent diffusion coefficient changes in the peri-infarct zone during focal cerebral ischemia. Magn Reson Med, 1997,37:170-175.
7 Mesenge C, Verrecchia C, Allix M, et al. Reduction of the neurological deficit in mice with traumatic brain injury by nitric oxide synthase inhibitors. J Neurotrauma, 1996,13:209-214.
8 Iadecola C. Bright and dark sides of nitric oxide in ischemic brain injury. TiNS, 1997,20:132-139.
9 赵立,李涛,孙锡超,等.一氧化氮合酶活性的变化对大鼠脊髓继发性损害的影响.中华医学杂志,1998,78:27-29.
(收稿:1998-04-22 修回:1998-12-10), 百拇医药