实验性骨质疏松性骨折愈合方式的组织学观察
作者:郝永强 戴戎
单位:200011 上海第二医科大学附属第九人民医院骨科
关键词:骨质疏松性骨折;骨折愈合;组织学
郝永强 戴戎郝永强 戴 戎
戎
【摘要】 目的 动态观察骨质疏松性骨折愈合的组织学变化与特征,进一步阐明骨质疏松性骨折的愈合方式。方法 选择80只8月龄、雌性SD大鼠,手术方法为建立骨质疏松性骨折(OPFM)与一般骨折(CFM)的实验模型各40只,于术后5天、1、2、4、6、8、12、16周截取骨痂组织作光镜与偏光镜观察。结果 与一般骨折愈合方式相似,软骨内成骨与膜内成骨共同参与了骨质疏松性骨折的修复,且以软骨内成骨为主。但骨质疏松性骨折愈合过程中,软骨内成骨延缓,骨性骨痂改建(骨吸收>骨形成)加速,骨痂内胶原纤维疏松、排列紊乱,与主应力方向不一致,从而导致骨折愈合质量降低。结论 骨质疏松性骨折愈合质量较一般性骨折有所降低。
, 百拇医药
Histological observation on the mode of healing of experimental osteoporotic fracture
HAO Yongqiang, DAI Kerong
Department of Orthopaedics, Ninth People's Hospital, Shanghai Second Medical University, 200011
【Abstract】 Objective To dynamically observe the histological alterations and characteristics of osteoporotic fracture healing, and to further elucidate its mode of healing. Methods 80 female 8-month-old SD rats were randomized into two groups of 40 each: the osteoporotic fracture model(OPFM) and the common fracture model(CFM). The callus of each rat was examined by light microscope or polarized microscope in 5 days and 2,4,6,8,12 and 16 weeks postoperatively. Results In OPFM, both endochondral bone formation and intramembrane bone formation played their parts in osteoporotic fracture healing, the former played a major role. But during the healing process, endochondral bone formation delayed, while bony callus tissue remodeling accelerated(bone resorption>bone formation), collagenous fibers in callus tissue arranged loosely and irregularly in and being in consistent with the direction of the principal stress. Conclusion Compared with the common fracture healing, quality of the osteporotic fracture healing can decrease. (Shanghai Med J. 1999,22:137-139)
, 百拇医药
【Key words】 Osteoporotic fracture Fracture healing Histology
骨质疏松性骨折(Osteoporotic fracture)严重影响老年人的身体健康与生活质量,是老年人致残、致死的主要原因之一。但目前对骨质疏松性骨折愈合方式与机理尚缺乏应有的了解,临床上对骨质疏松性骨折的治疗均采用与一般骨折相同的方法与原则,因而疗效难以提高,且再次骨折发生率高[1,2]。为此,我们通过建立骨质疏松性骨折实验动物模型,动态观察骨质疏松性骨折愈合过程中组织学变化与特征,以进一步阐明骨质疏松性骨折的愈合方式。
材料与方法
一、骨质疏松性骨折实验模型的建立
选择8月龄、体重290~340g、雌性、SPF级(无特定病原体动物)SD大鼠(由中英合资上海BK实验动物中心提供),共80只,随机分为骨质疏松性骨折模型(OPFM)组与一般骨折模型(CFM)组,每组各40只。动物饲养于完全清洁级环境下(上海第二医科大学实验动物中心清洁级动物室),自由进食消毒颗粒饲料(Ca 0.1%, P 0.4%),饮消毒水,室温控制于23±0°C,湿度56,12~12小时间隔照明,定期紫外线消毒与排风。
, 百拇医药
实验动物在氯氨酮(0.1g/kg)腹腔注射麻醉满意后,OPFM组动物经双侧腰背侧切口进入腹腔,行双侧卵巢切除。CFM组行腰背部伪手术。术后3个月,两组实验动物均在氯氨酮麻醉下,建立骨折模型。取股外侧切口,经股前、外侧肌群间隔分离至股骨,手术刀切断股骨中段,然后行克氏针(直径1mm,上海医用缝合针厂,标准号Q/OYBA-03-1995)髓腔逆行内固定。手术过程均在严格无菌条件下进行,术后放至笼中自由活动与进食。
二、观察项目与方法
(一) 全身BMD测定 OPFM组随机抽取8只动物,在双侧卵巢切除前与术后3个月,分别在氯氨酮(0.1g/kg)麻醉下,以DPX-L型(LUNAR美国,能谱写38/7akev,高压稳定±0.05%,仪器精密度1%,附动物全身骨密度测定软件)双能X线骨密度仪作BMD测定,荧光屏显示测量图像,自动打印测量结果。数据均用均数±标准差(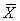 ±s)表示,显著性检验采用两样本均数比较的t检验,选定P<0.05为差异显著。
±s)表示,显著性检验采用两样本均数比较的t检验,选定P<0.05为差异显著。
, 百拇医药
(二) 光镜与偏光镜观察 分别于骨折模型建立后5天、1、2、4、6、8、12、16周,每组随机选取5只以急性大出血法处死后截取股骨中段骨痂组织,0.9%NaCl冲洗后立即置入4%多聚甲醛液(pH=7.4)固定(4°C)24~48小时,经10%EDTA-2Na(pH=7.4,4°C)脱钙3~5周,隔5~7天更换脱钙液,脱钙满意后,正中剖开,乙醇梯度脱水,二甲苯透明,纵向石蜡包埋,5μM连续切片,HE染色,Olympus BH-2型显微镜下作普通与偏光观察。
结果
一、全身BMD测定结果
全身BMD测定结果表明,OPFM组卵巢切除手术切除前后差异有显著性,术后全身BMD明显降低(P<0.02),见表1。
二、光镜与偏光镜观察
表1 全身BMD测定结果(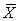 ±s),g/cm2)
±s),g/cm2)
, http://www.100md.com
时 间
BMD
双侧卵巢切除前(n=8)
0.30800±0.01467
双侧卵巢切除3个月后(n=8)
0.29063±0.01269
两组间相比P<0.02 骨折后5~7天,由于骨折创伤刺激,吸引了大量细胞聚集在断端周围形成纤维骨痂,可见间充质细胞、成纤维细胞;粒细胞、单核-巨噬细胞。同时,有大量新生毛细血管出现。断端附近骨外膜下由骨外膜间充质细胞增殖、分化为软骨细胞与成骨细胞,形成原始小梁状骨,同CFM组相比,OPFM组纤维骨痂疏松,毛细血管生成较少,断端血肿机化较迟缓。
术后2周,软骨性骨痂形成以取代纤维骨痂,早期纤维骨痂内软骨岛出现,不断扩展,血管周围软骨细胞多为体积较小的圆形幼稚软骨细胞,随着时间的推移,软骨痂周边部软骨细胞肥大,部分变性坏死,并出现少量原始(幼稚)小梁状骨,CFM组原始小梁状骨表面可见大量排列整齐的成骨细胞(图1),而OPFM组原始小梁状骨表面成骨细胞数较少(图2),原始骨小梁间为结缔组织(包括血细胞)。两组断端附近膜内成骨的小梁状骨已日趋成熟。偏光镜观察,CFM组小梁状骨排列方向与主应力方向渐趋于一致,折光性较OPFM组强,OPFM组小梁状骨及其小梁胶原纤维排列方向均紊乱。
, 百拇医药
术后4~6周,软骨痂周边部继续不断为原始小梁状骨(编织骨)取代,早期形成的原始小梁状骨内软骨细胞或变性坏死或分化、转化为骨细胞;同时,表面破骨细胞出现,并与成骨细胞相“耦合”(图3),使原始骨小梁不断改建成为成熟骨小梁(图4)。与CFM组相比,小梁状骨吸收快且被吸收数量多,小梁间距增宽,其间充满大量脂肪细胞(图5)。偏光镜观察,CFM组与OPFM组相比较,小梁状骨粗细均匀,排列方向一致,小梁连接处呈拱形,光滑且折光性强(图6)。而OPFM组,小梁排列杂乱,小梁粗细不等,折光强弱不均一(图7)。
术后8~16周,CFM组软骨性骨痂已逐渐被骨性骨痂取代。小梁状骨经改建成熟,与主应力方向一致,OPFM组软骨痂向骨性骨痂转化缓慢,同时原始小梁状骨向成熟小梁状骨转化亦较慢,且原已形成的成熟小梁状骨多吸收、消失。
讨论
骨质疏松性骨折与一般骨折实验动物骨折愈合的组织学过程均经历了炎性阶段、修复阶段与改建阶段,三个发展阶段有一定程度的相互重迭,其中修复阶段历经纤维骨痂、软骨性骨痂至骨性骨痂的演变。因而,观察骨折愈合过程中骨痂组织的有机组成,有助于加深对骨折愈合方式与愈合质量的认识。实验动物双侧卵巢切除可引致雌激素降低,而雌激素对调节成骨细胞、破骨细胞功能与两者之间的“耦合”意义重大[3],但对骨折愈合修复能力的影响尚不明确。实验中我们发现,在实验动物双侧卵巢切除后雌激素缺乏所诱发的骨质疏松性骨折愈合过程中,软骨性骨痂生成量多,但向骨性骨痂演变过程延缓。而在编织骨向成熟骨改建过程中,小梁状骨表面成骨细胞数量减少,成骨能力降低。相反,破骨细胞吸收能力旺盛,导致骨结构松散,骨痂质量下降。
, 百拇医药
软骨痂内的软骨细胞主要有两种来源[4] ,一是间充质细胞分化为软骨细胞;另一种则是已存在的软骨细胞的不断增殖。而目前多倾向于前者起主要作用[5]。骨髓与骨膜为未分化间充质细胞的重要来源,雌激素降低可能促进骨髓造血系统[6,7]与骨外膜内间充质细胞增殖[8],而骨折引致的创伤反应可吸引未分化间充质细胞至骨折断端周围,后者既可分化为成骨细胞,也可分化为软骨细胞,分化方式取决于局部的血供因素与应力因素[9]。贴近骨折端或在两断端之间的部位由于局部血供差、应力大,间充质细胞经确定性软骨祖细胞进而分化为软骨细胞,形成软骨性骨痂。但膜内成骨骨痂源性毛细血管进入软骨痂后,软骨内成骨即开始[10]。而组织学观察到软骨痂组织量的增多,恰是对其细胞功能降低的代偿。
与观察到的软骨内成骨迟缓不同,在骨质疏松性骨折愈合过程中,由膜内成骨与软骨内成骨形成的小梁状骨的骨吸收明显加快,而相应的骨形成作用却缓慢或不足。骨痂组织成熟后须不断地进行改建以适应外界应力与自身功能的需要,即适应性重建,这一过程由破骨细胞的激活而开始,并与成骨细胞相“耦合”共同完成。破骨细胞来源于多潜能造血干细胞所产生的粒巨祖细胞,在分化过程中,未定型的祖细胞(Uncommitted progenitors)增殖分化产生定型破骨细胞,然后沿破骨细胞特殊的分化并随血管迁移到骨组织。雌激素可通过受体调节机制[11]直接抑制其功能活性并诱导其凋亡[12],因而雌激素降低后使得破骨细胞数目增多[13]且功能活性增强,而雌激素降低可抑制成骨细胞增殖、分化与其基质蛋白的合成[14]。由此导致小梁状骨的过分丢失与骨吸收部位新生骨的相对不足,骨折愈合质量降低,再次骨折发生率增高。
, 百拇医药
图1 CFM组术后2周,软骨痂边缘已出现原始小梁骨(编织骨)〈A〉,其表面可见层状排列紧密的成骨细胞〈B〉HE×100
图2 OPFM组术后2周,软骨痂边缘生成原始小梁骨(编织骨)〈A〉,其表面成骨细胞数少〈B〉HE×200
图3 CFM组术后6周,软骨痂周边部软骨细胞肥大(编织骨)〈A〉,渐为原始小梁骨〈B〉替代,其表面可见大量排列紧密的成骨细胞〈C〉HE×100
图4 OPFM组术后6周,软骨痂周边部继续向原始小梁骨转化〈A〉,而成熟小梁骨已基本吸收消失〈B〉,周围充满大量脂肪组织与骨髓细胞HE,×40
图5 CFM组术后6周,小梁骨连接呈拱形,胶原排列一致,折光性较强、均匀。偏光,HE×100
图6 OPFM组术后6周,小梁骨粗细不等、排列方向不一致,折光性较弱、吵均一。偏光,HE×100
, http://www.100md.com
参考文献
[1] Schroder HM, Petersen KK, Erlandsen M. Occurrence and incidence of the second hip fracture. Clin Orthop and Rel Res,1993,289:166-169.
[2] Lauritzen JB, Lund B. Risk of hip fracture after osteoporosis fractures. Acta Orthop Scand, 1993,64:297-300.
[3] L B, Lujoseph M. Osteoporosis: etiology, diagnosis, and management, Second edition. New York: Lippincott-Raven Press:1995:XV.
, 百拇医药
[4] Minna MS, Hannu TA, Eero IV. Gene expression during bone repair. Clin Orthop and Rel Res.,1993,289:292-312.
[5] Minna S, Hannu A, Petleri M, et al. In situ localization of collagean production by chondroctes and osteoblasts in fracture callus. J of Bone and Joint Surg, 1989,71-A:69-77.
[6] Shevde NK, Pike JW. Estrogen modulates the recruitment of myelopoietic cell progenitors in rat through a stromal cell-independent mechanism involving apoptosis. Blood, 1996,87:2683-2692.
, 百拇医药
[7] Jilka RL, Passeri G, Girasole G, et al. Estrogen loss upregulates hematopoiesis in the mouse: a mediating role of IL-6. Exp Hematol, 1995,23:500-506.
[8] Carl C D, Lis M, Birgit S. Cortical bone mass, composition, and mechanical properties in female rats in relation to age, long-term ovariectomy, and Estrogen substitution. Calcif Tissue Int, 1993,52:26-33.
[9] Anders H. Current concepts of fracture healing. Clin Orthop and Rel Res, 1989,249:265-284.
, 百拇医药
[10] Henricson A, Hulth A, Johnell O. The cartilaginous fracture callus in rats. Acta Orthop Scand, 1987,58:244.
[11] Fiorelli G, Gori F, Petilli M, et al. Functional estrogen receptors in a human preosteoclastic cell line. Proc Nat1 Acad Sei USA, 1995,92:2672-2676.
[12] Hughes DE, Dai A, Tiffee JC, et al. Estrogen promote apotosis of murine osteoclasts mediated by TGF-beta. Nat Med,1996,2:1132-1136.
, 百拇医药
[13] Shevde NK, Pike JW. Estrogen modulates the recruimtment of myelopoietic cell progenitors in rat through a stromal cell-independent mechanism involving apoptosis. Blood,1996,87:2683-2692.
[14] Majeska RJ, Ryaby JT, Einhorn TA. Direat modulation of osteoblastic activity with estrogen. J Bone Joint Surg(Am),1994,76:713.
(收稿:1998-11-10), 百拇医药
单位:200011 上海第二医科大学附属第九人民医院骨科
关键词:骨质疏松性骨折;骨折愈合;组织学
郝永强 戴戎郝永强 戴
【摘要】 目的 动态观察骨质疏松性骨折愈合的组织学变化与特征,进一步阐明骨质疏松性骨折的愈合方式。方法 选择80只8月龄、雌性SD大鼠,手术方法为建立骨质疏松性骨折(OPFM)与一般骨折(CFM)的实验模型各40只,于术后5天、1、2、4、6、8、12、16周截取骨痂组织作光镜与偏光镜观察。结果 与一般骨折愈合方式相似,软骨内成骨与膜内成骨共同参与了骨质疏松性骨折的修复,且以软骨内成骨为主。但骨质疏松性骨折愈合过程中,软骨内成骨延缓,骨性骨痂改建(骨吸收>骨形成)加速,骨痂内胶原纤维疏松、排列紊乱,与主应力方向不一致,从而导致骨折愈合质量降低。结论 骨质疏松性骨折愈合质量较一般性骨折有所降低。
, 百拇医药
Histological observation on the mode of healing of experimental osteoporotic fracture
HAO Yongqiang, DAI Kerong
Department of Orthopaedics, Ninth People's Hospital, Shanghai Second Medical University, 200011
【Abstract】 Objective To dynamically observe the histological alterations and characteristics of osteoporotic fracture healing, and to further elucidate its mode of healing. Methods 80 female 8-month-old SD rats were randomized into two groups of 40 each: the osteoporotic fracture model(OPFM) and the common fracture model(CFM). The callus of each rat was examined by light microscope or polarized microscope in 5 days and 2,4,6,8,12 and 16 weeks postoperatively. Results In OPFM, both endochondral bone formation and intramembrane bone formation played their parts in osteoporotic fracture healing, the former played a major role. But during the healing process, endochondral bone formation delayed, while bony callus tissue remodeling accelerated(bone resorption>bone formation), collagenous fibers in callus tissue arranged loosely and irregularly in and being in consistent with the direction of the principal stress. Conclusion Compared with the common fracture healing, quality of the osteporotic fracture healing can decrease. (Shanghai Med J. 1999,22:137-139)
, 百拇医药
【Key words】 Osteoporotic fracture Fracture healing Histology
骨质疏松性骨折(Osteoporotic fracture)严重影响老年人的身体健康与生活质量,是老年人致残、致死的主要原因之一。但目前对骨质疏松性骨折愈合方式与机理尚缺乏应有的了解,临床上对骨质疏松性骨折的治疗均采用与一般骨折相同的方法与原则,因而疗效难以提高,且再次骨折发生率高[1,2]。为此,我们通过建立骨质疏松性骨折实验动物模型,动态观察骨质疏松性骨折愈合过程中组织学变化与特征,以进一步阐明骨质疏松性骨折的愈合方式。
材料与方法
一、骨质疏松性骨折实验模型的建立
选择8月龄、体重290~340g、雌性、SPF级(无特定病原体动物)SD大鼠(由中英合资上海BK实验动物中心提供),共80只,随机分为骨质疏松性骨折模型(OPFM)组与一般骨折模型(CFM)组,每组各40只。动物饲养于完全清洁级环境下(上海第二医科大学实验动物中心清洁级动物室),自由进食消毒颗粒饲料(Ca 0.1%, P 0.4%),饮消毒水,室温控制于23±0°C,湿度56,12~12小时间隔照明,定期紫外线消毒与排风。
, 百拇医药
实验动物在氯氨酮(0.1g/kg)腹腔注射麻醉满意后,OPFM组动物经双侧腰背侧切口进入腹腔,行双侧卵巢切除。CFM组行腰背部伪手术。术后3个月,两组实验动物均在氯氨酮麻醉下,建立骨折模型。取股外侧切口,经股前、外侧肌群间隔分离至股骨,手术刀切断股骨中段,然后行克氏针(直径1mm,上海医用缝合针厂,标准号Q/OYBA-03-1995)髓腔逆行内固定。手术过程均在严格无菌条件下进行,术后放至笼中自由活动与进食。
二、观察项目与方法
(一) 全身BMD测定 OPFM组随机抽取8只动物,在双侧卵巢切除前与术后3个月,分别在氯氨酮(0.1g/kg)麻醉下,以DPX-L型(LUNAR美国,能谱写38/7akev,高压稳定±0.05%,仪器精密度1%,附动物全身骨密度测定软件)双能X线骨密度仪作BMD测定,荧光屏显示测量图像,自动打印测量结果。数据均用均数±标准差(
, 百拇医药
(二) 光镜与偏光镜观察 分别于骨折模型建立后5天、1、2、4、6、8、12、16周,每组随机选取5只以急性大出血法处死后截取股骨中段骨痂组织,0.9%NaCl冲洗后立即置入4%多聚甲醛液(pH=7.4)固定(4°C)24~48小时,经10%EDTA-2Na(pH=7.4,4°C)脱钙3~5周,隔5~7天更换脱钙液,脱钙满意后,正中剖开,乙醇梯度脱水,二甲苯透明,纵向石蜡包埋,5μM连续切片,HE染色,Olympus BH-2型显微镜下作普通与偏光观察。
结果
一、全身BMD测定结果
全身BMD测定结果表明,OPFM组卵巢切除手术切除前后差异有显著性,术后全身BMD明显降低(P<0.02),见表1。
二、光镜与偏光镜观察
表1 全身BMD测定结果(
, http://www.100md.com
时 间
BMD
双侧卵巢切除前(n=8)
0.30800±0.01467
双侧卵巢切除3个月后(n=8)
0.29063±0.01269
两组间相比P<0.02 骨折后5~7天,由于骨折创伤刺激,吸引了大量细胞聚集在断端周围形成纤维骨痂,可见间充质细胞、成纤维细胞;粒细胞、单核-巨噬细胞。同时,有大量新生毛细血管出现。断端附近骨外膜下由骨外膜间充质细胞增殖、分化为软骨细胞与成骨细胞,形成原始小梁状骨,同CFM组相比,OPFM组纤维骨痂疏松,毛细血管生成较少,断端血肿机化较迟缓。
术后2周,软骨性骨痂形成以取代纤维骨痂,早期纤维骨痂内软骨岛出现,不断扩展,血管周围软骨细胞多为体积较小的圆形幼稚软骨细胞,随着时间的推移,软骨痂周边部软骨细胞肥大,部分变性坏死,并出现少量原始(幼稚)小梁状骨,CFM组原始小梁状骨表面可见大量排列整齐的成骨细胞(图1),而OPFM组原始小梁状骨表面成骨细胞数较少(图2),原始骨小梁间为结缔组织(包括血细胞)。两组断端附近膜内成骨的小梁状骨已日趋成熟。偏光镜观察,CFM组小梁状骨排列方向与主应力方向渐趋于一致,折光性较OPFM组强,OPFM组小梁状骨及其小梁胶原纤维排列方向均紊乱。
, 百拇医药
术后4~6周,软骨痂周边部继续不断为原始小梁状骨(编织骨)取代,早期形成的原始小梁状骨内软骨细胞或变性坏死或分化、转化为骨细胞;同时,表面破骨细胞出现,并与成骨细胞相“耦合”(图3),使原始骨小梁不断改建成为成熟骨小梁(图4)。与CFM组相比,小梁状骨吸收快且被吸收数量多,小梁间距增宽,其间充满大量脂肪细胞(图5)。偏光镜观察,CFM组与OPFM组相比较,小梁状骨粗细均匀,排列方向一致,小梁连接处呈拱形,光滑且折光性强(图6)。而OPFM组,小梁排列杂乱,小梁粗细不等,折光强弱不均一(图7)。
术后8~16周,CFM组软骨性骨痂已逐渐被骨性骨痂取代。小梁状骨经改建成熟,与主应力方向一致,OPFM组软骨痂向骨性骨痂转化缓慢,同时原始小梁状骨向成熟小梁状骨转化亦较慢,且原已形成的成熟小梁状骨多吸收、消失。
讨论
骨质疏松性骨折与一般骨折实验动物骨折愈合的组织学过程均经历了炎性阶段、修复阶段与改建阶段,三个发展阶段有一定程度的相互重迭,其中修复阶段历经纤维骨痂、软骨性骨痂至骨性骨痂的演变。因而,观察骨折愈合过程中骨痂组织的有机组成,有助于加深对骨折愈合方式与愈合质量的认识。实验动物双侧卵巢切除可引致雌激素降低,而雌激素对调节成骨细胞、破骨细胞功能与两者之间的“耦合”意义重大[3],但对骨折愈合修复能力的影响尚不明确。实验中我们发现,在实验动物双侧卵巢切除后雌激素缺乏所诱发的骨质疏松性骨折愈合过程中,软骨性骨痂生成量多,但向骨性骨痂演变过程延缓。而在编织骨向成熟骨改建过程中,小梁状骨表面成骨细胞数量减少,成骨能力降低。相反,破骨细胞吸收能力旺盛,导致骨结构松散,骨痂质量下降。
, 百拇医药
软骨痂内的软骨细胞主要有两种来源[4] ,一是间充质细胞分化为软骨细胞;另一种则是已存在的软骨细胞的不断增殖。而目前多倾向于前者起主要作用[5]。骨髓与骨膜为未分化间充质细胞的重要来源,雌激素降低可能促进骨髓造血系统[6,7]与骨外膜内间充质细胞增殖[8],而骨折引致的创伤反应可吸引未分化间充质细胞至骨折断端周围,后者既可分化为成骨细胞,也可分化为软骨细胞,分化方式取决于局部的血供因素与应力因素[9]。贴近骨折端或在两断端之间的部位由于局部血供差、应力大,间充质细胞经确定性软骨祖细胞进而分化为软骨细胞,形成软骨性骨痂。但膜内成骨骨痂源性毛细血管进入软骨痂后,软骨内成骨即开始[10]。而组织学观察到软骨痂组织量的增多,恰是对其细胞功能降低的代偿。
与观察到的软骨内成骨迟缓不同,在骨质疏松性骨折愈合过程中,由膜内成骨与软骨内成骨形成的小梁状骨的骨吸收明显加快,而相应的骨形成作用却缓慢或不足。骨痂组织成熟后须不断地进行改建以适应外界应力与自身功能的需要,即适应性重建,这一过程由破骨细胞的激活而开始,并与成骨细胞相“耦合”共同完成。破骨细胞来源于多潜能造血干细胞所产生的粒巨祖细胞,在分化过程中,未定型的祖细胞(Uncommitted progenitors)增殖分化产生定型破骨细胞,然后沿破骨细胞特殊的分化并随血管迁移到骨组织。雌激素可通过受体调节机制[11]直接抑制其功能活性并诱导其凋亡[12],因而雌激素降低后使得破骨细胞数目增多[13]且功能活性增强,而雌激素降低可抑制成骨细胞增殖、分化与其基质蛋白的合成[14]。由此导致小梁状骨的过分丢失与骨吸收部位新生骨的相对不足,骨折愈合质量降低,再次骨折发生率增高。

, 百拇医药
图1 CFM组术后2周,软骨痂边缘已出现原始小梁骨(编织骨)〈A〉,其表面可见层状排列紧密的成骨细胞〈B〉HE×100
图2 OPFM组术后2周,软骨痂边缘生成原始小梁骨(编织骨)〈A〉,其表面成骨细胞数少〈B〉HE×200
图3 CFM组术后6周,软骨痂周边部软骨细胞肥大(编织骨)〈A〉,渐为原始小梁骨〈B〉替代,其表面可见大量排列紧密的成骨细胞〈C〉HE×100
图4 OPFM组术后6周,软骨痂周边部继续向原始小梁骨转化〈A〉,而成熟小梁骨已基本吸收消失〈B〉,周围充满大量脂肪组织与骨髓细胞HE,×40
图5 CFM组术后6周,小梁骨连接呈拱形,胶原排列一致,折光性较强、均匀。偏光,HE×100
图6 OPFM组术后6周,小梁骨粗细不等、排列方向不一致,折光性较弱、吵均一。偏光,HE×100
, http://www.100md.com
参考文献
[1] Schroder HM, Petersen KK, Erlandsen M. Occurrence and incidence of the second hip fracture. Clin Orthop and Rel Res,1993,289:166-169.
[2] Lauritzen JB, Lund B. Risk of hip fracture after osteoporosis fractures. Acta Orthop Scand, 1993,64:297-300.
[3] L B, Lujoseph M. Osteoporosis: etiology, diagnosis, and management, Second edition. New York: Lippincott-Raven Press:1995:XV.
, 百拇医药
[4] Minna MS, Hannu TA, Eero IV. Gene expression during bone repair. Clin Orthop and Rel Res.,1993,289:292-312.
[5] Minna S, Hannu A, Petleri M, et al. In situ localization of collagean production by chondroctes and osteoblasts in fracture callus. J of Bone and Joint Surg, 1989,71-A:69-77.
[6] Shevde NK, Pike JW. Estrogen modulates the recruitment of myelopoietic cell progenitors in rat through a stromal cell-independent mechanism involving apoptosis. Blood, 1996,87:2683-2692.
, 百拇医药
[7] Jilka RL, Passeri G, Girasole G, et al. Estrogen loss upregulates hematopoiesis in the mouse: a mediating role of IL-6. Exp Hematol, 1995,23:500-506.
[8] Carl C D, Lis M, Birgit S. Cortical bone mass, composition, and mechanical properties in female rats in relation to age, long-term ovariectomy, and Estrogen substitution. Calcif Tissue Int, 1993,52:26-33.
[9] Anders H. Current concepts of fracture healing. Clin Orthop and Rel Res, 1989,249:265-284.
, 百拇医药
[10] Henricson A, Hulth A, Johnell O. The cartilaginous fracture callus in rats. Acta Orthop Scand, 1987,58:244.
[11] Fiorelli G, Gori F, Petilli M, et al. Functional estrogen receptors in a human preosteoclastic cell line. Proc Nat1 Acad Sei USA, 1995,92:2672-2676.
[12] Hughes DE, Dai A, Tiffee JC, et al. Estrogen promote apotosis of murine osteoclasts mediated by TGF-beta. Nat Med,1996,2:1132-1136.
, 百拇医药
[13] Shevde NK, Pike JW. Estrogen modulates the recruimtment of myelopoietic cell progenitors in rat through a stromal cell-independent mechanism involving apoptosis. Blood,1996,87:2683-2692.
[14] Majeska RJ, Ryaby JT, Einhorn TA. Direat modulation of osteoblastic activity with estrogen. J Bone Joint Surg(Am),1994,76:713.
(收稿:1998-11-10), 百拇医药