原代猪肝细胞的分离获取及培养*
作者:陈 柯 高 毅 潘玉先 杨继震
单位:第一军医大学附属珠江医院普通外科 广东省广州市 510282
关键词:人工肝;肝细胞;细胞分离;细胞,培养的
世界化人消化杂志990306 中国图书资料分类号 R318.14
摘 要
目的 研究猪肝细胞的获取率、活率. 观测普通培养过程中肝细胞形态变化过程.
方法 取用本地杂种小猪作为肝细胞供体. 用Seglen胶原酶二步灌注法,原位灌注分离获取肝细胞悬液,TB染色法计算细胞数及细胞活率. 在含100mL/L胎牛血清及其他附助因子的DMEM培养基中培养,光镜下观察培养过程中肝细胞形态变化过程,检测不同时期培养上清中清蛋白、尿素的浓度.
, http://www.100md.com
结果 平均猪肝重434g,每只猪肝平均可获取2.18×1010个肝细胞,平均活力为94.6%. 在DMEM培养基中普通培养可存活4wk~5wk,并具有生物活性.
结论 本方法分离获取肝细胞产率高、活性高,可作为人工肝较好的生物材料.
Separation and cultivation of porcine hepatocytes*
CHEN Ke, GAO Yi, PAN Yu-Xian and YANG Ji-Zhen
Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Subject headings artificial liver; hepatocytes; cell separation; cell, cultured
Abstract
AIM To study the yield and viability of porcine hepatocytes and observe the process of alteration of cell morphology in culture.
METHODS Porcine hepatocytes were isolated by the modified two-step method described by Seglen. The yield and viability were assessed by trypan blue exclusion. Hepatocytes were inoculated in the culture medium consisted of DMEM supplemented with insulin, glucagon, transferrin, dexamethasone and 100mL/L fetal calf serum. The morphologic change of cultured hepatocytes was observed and the concentrations of albumin and urea in the supernatant in different cultural period were examined.
, 百拇医药
RESULTS The average liver weight was 434g, the average yield of porcine hepatocytes was 2.18×1010 cells per pig with an average viability of 94.6%. Porcine hepatocytes were found to have differentiating function during in vitro culture for 4-5 weeks.
CONCLUSION These data indicate that pig hepatocytes can be harvested with high yields and can retain viability and differentiating function for at least 30 days in vitro culture. Therefore it is an excellent source of hepatocytes for bioartificial liver devices.
, 百拇医药
0 引言
怎样获取高密度、高功能活性的生物材料是目前生物人工肝研究的焦点. 生物人工肝的治疗作用怎样主要取决于以下两个方面[1]: ①即在数量上能否达到正常人肝细胞数的10%(约2.5×1010个);②在质量上作为生物材料的细胞其功能活性应高,能满足治疗需要. 针对上述情况,我们采用本地猪作为实验动物,采用胶原酶二步原位肝脏灌注法分离获取游离肝细胞,并计算肝细胞产率及肝细胞活力,探讨猪肝细胞作为生物人工肝的生物材料的优越性. 现报告如下.
1 材料和方法
1.1 材料 实验动物:采用5只本地杂种健康小猪作为肝细胞供体,由中山医科大学实验动物中心提供,1~2月龄,体重7kg~10kg,平均体重7.9kg,雌雄不限. 健康大白鼠一只体重256g(制备鼠尾胶用). 主要试剂:胶原酶Ⅰ、胰岛素、胰高血糖素、转铁蛋白、氢化可的松及苔盼蓝等均购于美国Sigma生物公司. 鼠尾胶自行配制. 主要器材设备:二氧化碳培养箱(Heraues, EK型,German),其他培养器皿均于北京天象人生物公司.
, http://www.100md.com
1.2 方法
1.2.1 猪肝细胞的分离培养 实验猪于术前12h禁食,用30g/L的戊巴比妥钠按50mg/kg ip麻醉,腹部备皮消毒,打开腹腔,暴露门静脉及下腔静脉,于下腔静脉内注射0.25mg (125IU)肝素. 分离门、下腔静脉,分别结扎其远心端,行近端插入硅胶管并固定(图1). 在肝静脉上端结扎下腔静脉. 分别用经37℃水浴预热的前灌注液、胶原酶灌注液经门、腔静脉循环灌注,灌注流速为50mL/min~60mL/min,至肝脏变为苍白或黄白色,灌注时间约20min左右. 取下消化成熟的肝脏,切开肝包膜,将消化分离的肝细胞刷入经37℃水浴预热的Hanks液中. 分别经150,100,80μm滤网过滤,制备成粗制肝细胞悬液. 后以1000r/min的离心速度离心3min~5min,共离心3次. 把沉淀的肝细胞加入定量的DMEM培养液中制备成肝细胞悬液备用.
猪肝细胞产率及活力测定 将肝细胞悬液取样在光镜下计数,计算肝细胞产率,并用台盼蓝染色排斥法测定肝细胞活力,具体方法如下:将0.5mL肝细胞悬液用1mL的DMEM培养液稀释后,加入0.5mL的4g/L TB混匀染色,此时死细胞由于细胞膜被破坏,细胞被染成紫蓝色,活体细胞不被染色. 在1min内计算100个细胞,计算活细胞的百分率.
, 百拇医药
普通培养瓶培养(n=5) 取肝细胞悬液1mL,约含肝细胞3×105个,播种于已经铺好鼠尾胶的100mL普通培养瓶中,并加20mL含有100mL/L胎牛血清、100μg/L胰高血糖素、100μg/L转铁蛋白、200μg/L氢化可的松、100μg/L胰岛素、200μg/L复达欣的DMEM培养基. 置于恒温37℃二氧化碳培养箱中培养,培养24h后倒去培养上清,用少量培养液冲洗培养瓶3次,加入10mL含上述各因子的DMEM培养基,定期换液. 收集每次换液中的培养上清并将其离心去除细胞碎片,将处理后的培养上清置于-20℃的冰箱中保存以备生化功能检查. 在光镜下动态观察培养中的肝细胞生长情况及其形态学改变.
1.2.2 肝细胞功能及形态学检查 光镜观察 Olmpus倒置相差生物显微镜及全自动显微摄影装置对培养中的肝细胞进行动态观察并摄影.
清蛋白及尿素合成功能检测 分别收取肝细胞培养过程中不同时间内培养上清液,用Beckman全自动生化分析仪测定上清中清蛋白及尿素含量.
, http://www.100md.com
2 结果
2.1 猪肝细胞产率、细胞总数及肝细胞活率 本实验成功的采用了改良Seglen二步胶原酶灌注法分离猪肝细胞,猪肝细胞获取的详细资料见表1. 平均每只猪肝重434g,平均每只猪肝获取2.18×1010个肝细胞,平均活力为94.6%,每克猪肝平均能获取5.2×107个肝细胞.
表1 分离获取的猪肝细胞数及其活力 动物
编号
细胞总数
(×109)
细胞活率
(%)
, 百拇医药 活细胞
(×109)
体重
(kg)
肝重
(g)
肝细胞数/g肝组织
(×106)
A
22.3
94.7
21.1
7.2
, http://www.100md.com
398
56.0
B
19.8
95.6
18.9
6.2
340
58.2
C
21.4
97.2
20.8
, 百拇医药
9.7
613
34.9
D
18.2
92.1
16.8
8.3
412
44.2
E
27.4
93.2
, http://www.100md.com
25.5
7.9
410
66.8
21.8
94.6
20.6
7.9
434
52.0
2.2 形态学观察 在相差倒置显微镜下观察见新鲜分离的离体肝细胞呈单个分散状态,活肝细胞呈透亮、具有立体感的圆形细胞. 细胞培养4h后开始出现贴壁现象,培养24h后大约有50%~60%的肝细胞贴壁,贴壁的肝细胞其形态上发生明显改变,细胞呈典型的上皮细胞样的多角形形态,胞体变平变薄,体积明显增大,细胞间开始出现岛状连接. 培养2d后,附壁生长的肝细胞的形态改变更加明显,肝细胞拉平、伸展,紧紧粘附于培养瓶壁,连接成片岛状,有的肝细胞类似于多角形薄膜粘附于培养瓶壁上,可见多个多核细胞. 培养3d后,肝细胞开始增殖,在老的肝细胞周围出现少数非常透明的,体积较小的上皮样的细胞,培养后6d,新增生的肝细胞明显增多,肝细胞与肝细胞呈多种形式的连接,如丘岛、类球体、弯曲条索状. 老肝细胞颜色变深并在细胞质中开始出现空泡. 培养后14d,培养瓶中肝细胞基本更新,新生肝细胞相互连接紧密,各细胞均呈多边形. 培养至18d,培养瓶壁已完全被新生肝细胞铺满. 此时的细胞数约为接种数的4~5倍. 培养至34d时可见肝细胞变粗糙,大部分肝细胞内有空泡出现. 培养后36d上述现象更加明显,细胞相对变圆,细胞贴壁疏松,部分肝细胞已开始脱落悬浮于培养液中. 培养38d,培养瓶中粘附生长的肝细胞基本脱落死亡(图1).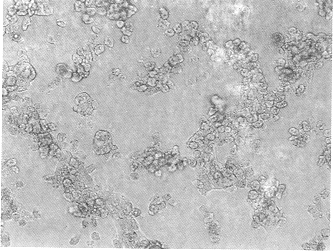
, 百拇医药
图1 培养6d肝细胞与肝细胞呈多种形式连接(如丘岛、条索状).
2.3 生化功能测定 用Beckman全自动生化分析仪分别检测各培养上清中清蛋白及尿素含量变化,结果显示清蛋白分泌及尿素合成逐渐增加,在7d~16d内保持较高的合成功能,培养12d后达到峰值,其后逐渐下降. 直至培养后32d仍高于基础水平(图2).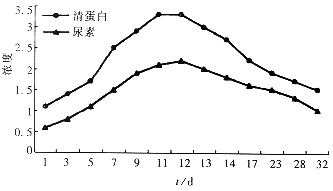
图2 示蛋白浓度(g/L)和尿素浓度(mmol/L)变化.
3 讨论
肝细胞分离与培养是生物人工肝研究的重要基础,从肝实质分离肝细胞早在20世纪40年代就已开始,主要的方法有机械法、螯合法和酶消化法,早期常用的细胞分离方法是机械法,但由于该法对细胞损伤严重及细胞间通过桥粒联接等多种联接方式紧密连接,一般的机械法很难使细胞分离,所以通过机械法获取的肝细胞数量少且功能活性低. 现在很少用机械法来分离获取肝细胞. 机械法以后的一段时期内,人们又用可结合Ca2+,Mg2+的螯合剂来分离肝细胞,常用的螯合剂有EDTA,EGTA及柠檬酸盐等,其分离肝细胞的基本原理是Ca2+,Mg2+等在细胞间桥粒联接中起主要作用,当Ca2+,Mg2+等被螯合剂结合后,可使细胞间的桥粒连接断开,有利于细胞分离. 但单独使用螯合剂分离细胞效果差,现在很少单独使用,常与酶消化法结合使用,可以提高细胞的获取率. 胶原酶消化法分离肝细胞现在已经成为获取游肝细胞的主要分离方法. 尤其是Seglen的改良二步胶原酶灌注法,是目前最为常用的细胞分离方法. 该方法对细胞膜的损伤小且细胞分离彻底,所以肝细胞获取率、活率都较其他方法高,据文献报道,肝细胞产量可达到75%~85%,游离肝细胞活率可达90%以上[2-4]. 目前虽然生物人工肝生物材料的获取方法基本成熟,但具体采用什么作为人工肝的生物材料的来源仍处于探讨阶段. 常用的主要有两种肝细胞来源:人肝细胞系[5-6]及原代肝细胞. 来源于肝癌或癌周的人肝细胞系具有来源丰富、体外培养增殖容易等特点,在数量上容易满足人工肝的需要. 但其具有癌肿转移的危险. 用它作为人工肝的生物单位尚有争议. 正常人肝细胞是最好的生物材料,但其来源困难,虽然可以从外科手术、活检标本及器官移植中获取,但总的来说是非常有限的. 于是人们把目光投向了其他异种哺乳类动物,如鼠[7]、犬、猪[8-10]、羊、牛等. 异种动物肝细胞作为人工肝生物材料虽然存在免疫问题,但由于人工合成半透膜的免疫屏障隔离作用、FHF患者免疫功能低下及现代免疫抑制剂的使用等因素的作用,大大提高了异种动物肝细胞作为人工肝生物材料的可能性. 在众多的异种哺乳动物中似乎猪肝细胞是生物人工肝脏生物材料最好的来源,这是因为以下几个方面的原因:①猪肝大小和体重与人似,猪的营养结构与人大致相仿,其生物功能也类似于人;②容易大量获取具有多种生物功能的肝细胞.
, 百拇医药
本实验采用改良Seglen二步胶原酶灌注法,以猪肝作为的供体获取肝细胞,实验结果表明,平均每只猪肝可获取2.18×1010个肝细胞,平均活力为94.6%,每克猪肝平均能获取5.2×107个肝细胞. 通过在培养瓶壁铺盖鼠尾胶原,以及在基础培养基中添加多种激素类生长辅助因子进行体外肝细胞培养,使离体肝细胞生存并保持生物功能达36d. 可满足作为生物人工肝生物材料的要求.
作者简介:
陈柯,男,1966-06-23生.江西瑞昌人,汉族.1990年江西医学院医疗系本科毕业.肝胆外科硕士,主治医师,主要从事肝胆疾病的外科治疗和研究.
*国家自然科学基金资助项目,No.39570212,广东省“五个一”重点课题.
通讯作者 陈柯,510282,第一军医大学附属珠江医院普通外科,广东省广州市工业大道中253号.
, 百拇医药
*Project supported by National Natural Science Fundation of China,NO.39570212,and Major project of Guangdong Province.
Correspondence to:CHEN Ke, Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
Tel. +86.20.87377881 ext 2306
4 参考文献
[1] Yarmush ML, Dunn JCY. Assessment of artificial liver support technology. Cell Transplant, 1992;1:1-19
, 百拇医药
[2] Rozga J, Williams F, Ro MS, Daniel FN, Todd D, Giorgio GB. Development of a bioartificial liver: properties and function of a follow-fiber module inculated with liver cells. Hepatology, 1993;17:258-265
[3] Berry MN, Grivell AR. Isolated hepatocytes-past, present and future. Cell Biol Toxicol, 1997;13:223-233
[4] Gerlach JC. Long-term liver cell culture in bioreactors and possible application for liver support. Cell Biol Toxicol, 1997;13:5349-5355
, 百拇医药
[5] Gerlach JC, Brombacher J, Kloppel K, Schnoy N, Niuhaus P. Comparison of four methods for mass hepatocyte isolation from pig and human livers. Transplantation, 1994;57:1318-1321
[6] Sussman N, Kelly J. Improved liver function following treatment with an extracorporeal liver assist device. Artif Organs, 1993;17:27-29
[7] Suzuki T. Application of porous bioceramics for a hybrid type artificial liver system. Nippon Rinsho, 1997;55:2140-2147
, 百拇医药
[8] Koebe HG, Pahernik SA. Porcine hepatocytes for biohybrid artificial liver devices: a comparison of hypothermic storage techniques. Artif Organs, 1996;20:1181-1190
[9] Sakai Y, Naruse K. Development of a bioartificial liver using porcine hepatocytes spheroids. Nippon Rinsho, 1997;55:2451-2457
[10] Sielaff TD, Nyberg SL. Characterization of the three-compartment gel-entrapment porcine hepatocyte bioartificial liver. Cell Biol Toxicol, 1997;13:357-364
收稿日期 1998-06-06 修回日期 1998-12-12, 百拇医药
单位:第一军医大学附属珠江医院普通外科 广东省广州市 510282
关键词:人工肝;肝细胞;细胞分离;细胞,培养的
世界化人消化杂志990306 中国图书资料分类号 R318.14
摘 要
目的 研究猪肝细胞的获取率、活率. 观测普通培养过程中肝细胞形态变化过程.
方法 取用本地杂种小猪作为肝细胞供体. 用Seglen胶原酶二步灌注法,原位灌注分离获取肝细胞悬液,TB染色法计算细胞数及细胞活率. 在含100mL/L胎牛血清及其他附助因子的DMEM培养基中培养,光镜下观察培养过程中肝细胞形态变化过程,检测不同时期培养上清中清蛋白、尿素的浓度.
, http://www.100md.com
结果 平均猪肝重434g,每只猪肝平均可获取2.18×1010个肝细胞,平均活力为94.6%. 在DMEM培养基中普通培养可存活4wk~5wk,并具有生物活性.
结论 本方法分离获取肝细胞产率高、活性高,可作为人工肝较好的生物材料.
Separation and cultivation of porcine hepatocytes*
CHEN Ke, GAO Yi, PAN Yu-Xian and YANG Ji-Zhen
Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Subject headings artificial liver; hepatocytes; cell separation; cell, cultured
Abstract
AIM To study the yield and viability of porcine hepatocytes and observe the process of alteration of cell morphology in culture.
METHODS Porcine hepatocytes were isolated by the modified two-step method described by Seglen. The yield and viability were assessed by trypan blue exclusion. Hepatocytes were inoculated in the culture medium consisted of DMEM supplemented with insulin, glucagon, transferrin, dexamethasone and 100mL/L fetal calf serum. The morphologic change of cultured hepatocytes was observed and the concentrations of albumin and urea in the supernatant in different cultural period were examined.
, 百拇医药
RESULTS The average liver weight was 434g, the average yield of porcine hepatocytes was 2.18×1010 cells per pig with an average viability of 94.6%. Porcine hepatocytes were found to have differentiating function during in vitro culture for 4-5 weeks.
CONCLUSION These data indicate that pig hepatocytes can be harvested with high yields and can retain viability and differentiating function for at least 30 days in vitro culture. Therefore it is an excellent source of hepatocytes for bioartificial liver devices.
, 百拇医药
0 引言
怎样获取高密度、高功能活性的生物材料是目前生物人工肝研究的焦点. 生物人工肝的治疗作用怎样主要取决于以下两个方面[1]: ①即在数量上能否达到正常人肝细胞数的10%(约2.5×1010个);②在质量上作为生物材料的细胞其功能活性应高,能满足治疗需要. 针对上述情况,我们采用本地猪作为实验动物,采用胶原酶二步原位肝脏灌注法分离获取游离肝细胞,并计算肝细胞产率及肝细胞活力,探讨猪肝细胞作为生物人工肝的生物材料的优越性. 现报告如下.
1 材料和方法
1.1 材料 实验动物:采用5只本地杂种健康小猪作为肝细胞供体,由中山医科大学实验动物中心提供,1~2月龄,体重7kg~10kg,平均体重7.9kg,雌雄不限. 健康大白鼠一只体重256g(制备鼠尾胶用). 主要试剂:胶原酶Ⅰ、胰岛素、胰高血糖素、转铁蛋白、氢化可的松及苔盼蓝等均购于美国Sigma生物公司. 鼠尾胶自行配制. 主要器材设备:二氧化碳培养箱(Heraues, EK型,German),其他培养器皿均于北京天象人生物公司.
, http://www.100md.com
1.2 方法
1.2.1 猪肝细胞的分离培养 实验猪于术前12h禁食,用30g/L的戊巴比妥钠按50mg/kg ip麻醉,腹部备皮消毒,打开腹腔,暴露门静脉及下腔静脉,于下腔静脉内注射0.25mg (125IU)肝素. 分离门、下腔静脉,分别结扎其远心端,行近端插入硅胶管并固定(图1). 在肝静脉上端结扎下腔静脉. 分别用经37℃水浴预热的前灌注液、胶原酶灌注液经门、腔静脉循环灌注,灌注流速为50mL/min~60mL/min,至肝脏变为苍白或黄白色,灌注时间约20min左右. 取下消化成熟的肝脏,切开肝包膜,将消化分离的肝细胞刷入经37℃水浴预热的Hanks液中. 分别经150,100,80μm滤网过滤,制备成粗制肝细胞悬液. 后以1000r/min的离心速度离心3min~5min,共离心3次. 把沉淀的肝细胞加入定量的DMEM培养液中制备成肝细胞悬液备用.
猪肝细胞产率及活力测定 将肝细胞悬液取样在光镜下计数,计算肝细胞产率,并用台盼蓝染色排斥法测定肝细胞活力,具体方法如下:将0.5mL肝细胞悬液用1mL的DMEM培养液稀释后,加入0.5mL的4g/L TB混匀染色,此时死细胞由于细胞膜被破坏,细胞被染成紫蓝色,活体细胞不被染色. 在1min内计算100个细胞,计算活细胞的百分率.
, 百拇医药
普通培养瓶培养(n=5) 取肝细胞悬液1mL,约含肝细胞3×105个,播种于已经铺好鼠尾胶的100mL普通培养瓶中,并加20mL含有100mL/L胎牛血清、100μg/L胰高血糖素、100μg/L转铁蛋白、200μg/L氢化可的松、100μg/L胰岛素、200μg/L复达欣的DMEM培养基. 置于恒温37℃二氧化碳培养箱中培养,培养24h后倒去培养上清,用少量培养液冲洗培养瓶3次,加入10mL含上述各因子的DMEM培养基,定期换液. 收集每次换液中的培养上清并将其离心去除细胞碎片,将处理后的培养上清置于-20℃的冰箱中保存以备生化功能检查. 在光镜下动态观察培养中的肝细胞生长情况及其形态学改变.
1.2.2 肝细胞功能及形态学检查 光镜观察 Olmpus倒置相差生物显微镜及全自动显微摄影装置对培养中的肝细胞进行动态观察并摄影.
清蛋白及尿素合成功能检测 分别收取肝细胞培养过程中不同时间内培养上清液,用Beckman全自动生化分析仪测定上清中清蛋白及尿素含量.
, http://www.100md.com
2 结果
2.1 猪肝细胞产率、细胞总数及肝细胞活率 本实验成功的采用了改良Seglen二步胶原酶灌注法分离猪肝细胞,猪肝细胞获取的详细资料见表1. 平均每只猪肝重434g,平均每只猪肝获取2.18×1010个肝细胞,平均活力为94.6%,每克猪肝平均能获取5.2×107个肝细胞.
表1 分离获取的猪肝细胞数及其活力 动物
编号
细胞总数
(×109)
细胞活率
(%)
, 百拇医药 活细胞
(×109)
体重
(kg)
肝重
(g)
肝细胞数/g肝组织
(×106)
A
22.3
94.7
21.1
7.2
, http://www.100md.com
398
56.0
B
19.8
95.6
18.9
6.2
340
58.2
C
21.4
97.2
20.8
, 百拇医药
9.7
613
34.9
D
18.2
92.1
16.8
8.3
412
44.2
E
27.4
93.2
, http://www.100md.com
25.5
7.9
410
66.8

21.8
94.6
20.6
7.9
434
52.0
2.2 形态学观察 在相差倒置显微镜下观察见新鲜分离的离体肝细胞呈单个分散状态,活肝细胞呈透亮、具有立体感的圆形细胞. 细胞培养4h后开始出现贴壁现象,培养24h后大约有50%~60%的肝细胞贴壁,贴壁的肝细胞其形态上发生明显改变,细胞呈典型的上皮细胞样的多角形形态,胞体变平变薄,体积明显增大,细胞间开始出现岛状连接. 培养2d后,附壁生长的肝细胞的形态改变更加明显,肝细胞拉平、伸展,紧紧粘附于培养瓶壁,连接成片岛状,有的肝细胞类似于多角形薄膜粘附于培养瓶壁上,可见多个多核细胞. 培养3d后,肝细胞开始增殖,在老的肝细胞周围出现少数非常透明的,体积较小的上皮样的细胞,培养后6d,新增生的肝细胞明显增多,肝细胞与肝细胞呈多种形式的连接,如丘岛、类球体、弯曲条索状. 老肝细胞颜色变深并在细胞质中开始出现空泡. 培养后14d,培养瓶中肝细胞基本更新,新生肝细胞相互连接紧密,各细胞均呈多边形. 培养至18d,培养瓶壁已完全被新生肝细胞铺满. 此时的细胞数约为接种数的4~5倍. 培养至34d时可见肝细胞变粗糙,大部分肝细胞内有空泡出现. 培养后36d上述现象更加明显,细胞相对变圆,细胞贴壁疏松,部分肝细胞已开始脱落悬浮于培养液中. 培养38d,培养瓶中粘附生长的肝细胞基本脱落死亡(图1).

, 百拇医药
图1 培养6d肝细胞与肝细胞呈多种形式连接(如丘岛、条索状).
2.3 生化功能测定 用Beckman全自动生化分析仪分别检测各培养上清中清蛋白及尿素含量变化,结果显示清蛋白分泌及尿素合成逐渐增加,在7d~16d内保持较高的合成功能,培养12d后达到峰值,其后逐渐下降. 直至培养后32d仍高于基础水平(图2).

图2 示蛋白浓度(g/L)和尿素浓度(mmol/L)变化.
3 讨论
肝细胞分离与培养是生物人工肝研究的重要基础,从肝实质分离肝细胞早在20世纪40年代就已开始,主要的方法有机械法、螯合法和酶消化法,早期常用的细胞分离方法是机械法,但由于该法对细胞损伤严重及细胞间通过桥粒联接等多种联接方式紧密连接,一般的机械法很难使细胞分离,所以通过机械法获取的肝细胞数量少且功能活性低. 现在很少用机械法来分离获取肝细胞. 机械法以后的一段时期内,人们又用可结合Ca2+,Mg2+的螯合剂来分离肝细胞,常用的螯合剂有EDTA,EGTA及柠檬酸盐等,其分离肝细胞的基本原理是Ca2+,Mg2+等在细胞间桥粒联接中起主要作用,当Ca2+,Mg2+等被螯合剂结合后,可使细胞间的桥粒连接断开,有利于细胞分离. 但单独使用螯合剂分离细胞效果差,现在很少单独使用,常与酶消化法结合使用,可以提高细胞的获取率. 胶原酶消化法分离肝细胞现在已经成为获取游肝细胞的主要分离方法. 尤其是Seglen的改良二步胶原酶灌注法,是目前最为常用的细胞分离方法. 该方法对细胞膜的损伤小且细胞分离彻底,所以肝细胞获取率、活率都较其他方法高,据文献报道,肝细胞产量可达到75%~85%,游离肝细胞活率可达90%以上[2-4]. 目前虽然生物人工肝生物材料的获取方法基本成熟,但具体采用什么作为人工肝的生物材料的来源仍处于探讨阶段. 常用的主要有两种肝细胞来源:人肝细胞系[5-6]及原代肝细胞. 来源于肝癌或癌周的人肝细胞系具有来源丰富、体外培养增殖容易等特点,在数量上容易满足人工肝的需要. 但其具有癌肿转移的危险. 用它作为人工肝的生物单位尚有争议. 正常人肝细胞是最好的生物材料,但其来源困难,虽然可以从外科手术、活检标本及器官移植中获取,但总的来说是非常有限的. 于是人们把目光投向了其他异种哺乳类动物,如鼠[7]、犬、猪[8-10]、羊、牛等. 异种动物肝细胞作为人工肝生物材料虽然存在免疫问题,但由于人工合成半透膜的免疫屏障隔离作用、FHF患者免疫功能低下及现代免疫抑制剂的使用等因素的作用,大大提高了异种动物肝细胞作为人工肝生物材料的可能性. 在众多的异种哺乳动物中似乎猪肝细胞是生物人工肝脏生物材料最好的来源,这是因为以下几个方面的原因:①猪肝大小和体重与人似,猪的营养结构与人大致相仿,其生物功能也类似于人;②容易大量获取具有多种生物功能的肝细胞.
, 百拇医药
本实验采用改良Seglen二步胶原酶灌注法,以猪肝作为的供体获取肝细胞,实验结果表明,平均每只猪肝可获取2.18×1010个肝细胞,平均活力为94.6%,每克猪肝平均能获取5.2×107个肝细胞. 通过在培养瓶壁铺盖鼠尾胶原,以及在基础培养基中添加多种激素类生长辅助因子进行体外肝细胞培养,使离体肝细胞生存并保持生物功能达36d. 可满足作为生物人工肝生物材料的要求.
作者简介:
陈柯,男,1966-06-23生.江西瑞昌人,汉族.1990年江西医学院医疗系本科毕业.肝胆外科硕士,主治医师,主要从事肝胆疾病的外科治疗和研究.
*国家自然科学基金资助项目,No.39570212,广东省“五个一”重点课题.
通讯作者 陈柯,510282,第一军医大学附属珠江医院普通外科,广东省广州市工业大道中253号.
, 百拇医药
*Project supported by National Natural Science Fundation of China,NO.39570212,and Major project of Guangdong Province.
Correspondence to:CHEN Ke, Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
Tel. +86.20.87377881 ext 2306
4 参考文献
[1] Yarmush ML, Dunn JCY. Assessment of artificial liver support technology. Cell Transplant, 1992;1:1-19
, 百拇医药
[2] Rozga J, Williams F, Ro MS, Daniel FN, Todd D, Giorgio GB. Development of a bioartificial liver: properties and function of a follow-fiber module inculated with liver cells. Hepatology, 1993;17:258-265
[3] Berry MN, Grivell AR. Isolated hepatocytes-past, present and future. Cell Biol Toxicol, 1997;13:223-233
[4] Gerlach JC. Long-term liver cell culture in bioreactors and possible application for liver support. Cell Biol Toxicol, 1997;13:5349-5355
, 百拇医药
[5] Gerlach JC, Brombacher J, Kloppel K, Schnoy N, Niuhaus P. Comparison of four methods for mass hepatocyte isolation from pig and human livers. Transplantation, 1994;57:1318-1321
[6] Sussman N, Kelly J. Improved liver function following treatment with an extracorporeal liver assist device. Artif Organs, 1993;17:27-29
[7] Suzuki T. Application of porous bioceramics for a hybrid type artificial liver system. Nippon Rinsho, 1997;55:2140-2147
, 百拇医药
[8] Koebe HG, Pahernik SA. Porcine hepatocytes for biohybrid artificial liver devices: a comparison of hypothermic storage techniques. Artif Organs, 1996;20:1181-1190
[9] Sakai Y, Naruse K. Development of a bioartificial liver using porcine hepatocytes spheroids. Nippon Rinsho, 1997;55:2451-2457
[10] Sielaff TD, Nyberg SL. Characterization of the three-compartment gel-entrapment porcine hepatocyte bioartificial liver. Cell Biol Toxicol, 1997;13:357-364
收稿日期 1998-06-06 修回日期 1998-12-12, 百拇医药