药物载体空白脂质体前体的制备及性质的研究
作者:全东琴 苏德森 顾学裘
单位:沈阳药科大学药学系, 沈阳 110015
关键词:空白脂质体前体;包裹率;药物载体
沈阳药科大学学报990302 摘 要 以蛋黄卵磷脂、胆固醇为膜材,加入适量的高分子表面活性剂,选择合适的支持剂,采用冷冻干燥法制备了空白脂质体前体,并用它作为药物载体,将药物溶液分散在载体中,制成药物脂质体.研究了空白脂质体前体的再分散性及物理稳定性.空白脂质体前体再分散性良好,平均粒径为0.75 μm,粒径分布比较集中,在室温下贮存7个月、9个月后再分散其平均粒径分别为0.81 μm、0.84 μm,对5-Fu的包裹率也没有发生显著改变。用5-Fu,阿霉素(ADM)等为模型药物,考察了影响药物脂质体包裹率的因素,并将最优条件固定.研究结果表明:空白脂质体水相的pH值、离子强度、再分散药物溶液的浓度(即药物与磷脂的重量比)对药物包裹率有显著影响.
, http://www.100md.com
分类号 R944.9
Studies on the Preparation and Characteristics of Empty Proliposomes as a Drug Carrier
Quan Dongqin,Su Desen,Gu Xueqiu
Department of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110015
Abstract The empty proliposomes were prepared by the freeze-dried method composed of EPC,Chol and surfactant in the presence of a proper cryoprotectant.We used this empty proliposomes as a drug carrier to entrap hydrophilic drugs and the effects of trap efficiency were investigated as well.The results showed that the trap efficiency was influenced significantly by pH,ion strength of the buffer solution and by the weight ratio of EPC to drug.The mean particle size of the proliposomes after redispersion was 0.75 μm and 0.81 μm,0.84 μm respectively after storing for 7 months and 9 months at room temperature.The trap efficiency to 5-Fu was not changed either after storing.The physical stability of this drug carrier was good.
, 百拇医药
Key words empty proliposomes;trap efficency;drug carrier
近年来,脂质体做为药物载体已被广泛研究,一部分工作已达到了临床应用阶段〔1〕.但是脂质体在溶液状态下仍存在着一些问题,脂质体分散系的不稳定性:如药物的渗漏、粒子的聚集以及磷脂在液态下的氧化、水解,影响了脂质体在临床上的应用〔2〕.为了保证脂质体在长期贮存中的稳定性,药学工作者们一直都在寻找解决的方法,其中脂质体前体的制备提供了一个行之有效的方法〔3,4〕,它使脂质体以固态形式贮存,只是在临用前加入分散介质即可再分散形成脂质体,这种方法不但解决了上述存在的问题,而且便于运输使用,也适用于工业生产.近年来国内外对冷冻干燥法制备脂质体前体的研究较多,主要集中在如何选择一个合适的支持剂,防止在冷冻干燥过程中药物的渗漏及粒子间的相互聚集〔5,6〕.本文从另外的角度研究用冷冻干燥法制备了空白脂质体前体,作为水溶性药物载体,将药物溶液分散在其中,形成药物脂质体.这与上述报道的研究角度不同,不是研究防止药物在脂质体冷冻干燥过程中的渗漏,而是研究药物如何包裹于空白脂质体前体中,且保证再分散后的药物脂质体的粒径及分布达到注射要求.这样不但解决了脂质体的物理稳定性和水溶性药物的渗漏问题,而且避免了不稳定药物在脂质体制备过程中失活、分解,以简化脂质体的制备过程,适用于大工业生产.
, 百拇医药
1 仪器与试药
5-Fu,FT-207(济南制药厂),盐酸阿霉素ADM(海门制药厂),盐酸阿糖胞苷Ara-C(锦州制药一厂).
干扰素IFN(沈阳新乐制药厂),水杨酸钠(SS),蛋黄卵磷脂EPC(自制),胆固醇CH(进口分装).
可见紫外分光光度计(日本岛津UV-260);高速匀浆机(江苏省江阴县祝塘仪器厂);显微分光图像分析仪(MPVⅢ TAS PLUS中科院生物物理研究所).
2 方法与结果
2.1 空白脂质体前体的制备
蛋黄卵磷脂(EPC),胆固醇(CH):高分子表面活性剂(P)按重量比4∶1∶2,采用融熔法制备〔9〕,即EPC、CH等脂溶性成分用少量乙醇溶解,加热至70℃左右,然后加入水相pH7.2磷酸盐缓冲液不断搅拌,再于匀浆机上以15 000 r/min匀化3次,加入支持剂,取1 mL分装于西林瓶中,进行冷冻干燥.冷冻干燥后的样品充氮气密封,避光贮存,待用.药物脂质体的制备是将药物溶液分散于空白脂质体前体中,用手振摇即可.
, 百拇医药
2.2 包裹率的测定方法
用Sephadex G-50柱层析法,柱30 cm,内径1 cm,流动相为pH7.2磷酸盐缓冲液,流速为0.8 mL/min,上样量为0.5 mL,流出液直接接于检测器上,由记录仪上可得到分离图谱.对5-Fu接取游离药物峰,定容后于265 nm处测定吸收度值,空白脂质体同法操作作为对照,代入N标准曲线方程,求得C游,包裹率按下式计算.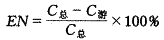
对阿霉素则接取脂质体峰,用10% Triton X-100以体积比1∶2加入脂质体中,使脂质体膜溶解,定容后于480 nm处测定吸收度值,空白脂质体同法操作作为对照.
对干扰素采用离心法,将上清液进行活性检测,得出游离药物浓度.
以上药物的测定方法的回收率均在98%~101%之间.
, 百拇医药
2.3 空白脂质体前体的性质研究
2.3.1 空白脂质体前体的再分散性取空白脂质体前体,加入适量水再分散后,用显微粒径图像分析测定其粒径及粒径分布,见图1.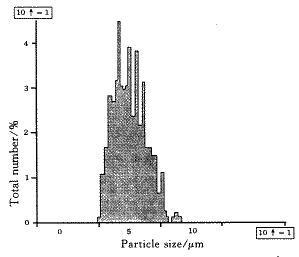
Fig.1 Size distribution of the proliposomesafter redispersion
2.3.2 空白脂质体前体的物理稳定性
取室温下放置7个月、9个月后的样品,加入适量水再分散后,用显微粒径图像分析仪测定其粒径及粒径分布,见图2,图3.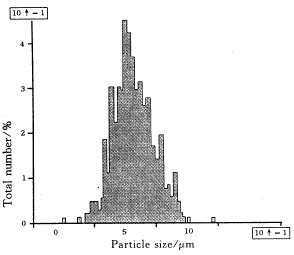
Fig.2 Size distribution of the proliposomes after storing 7 months at room temperature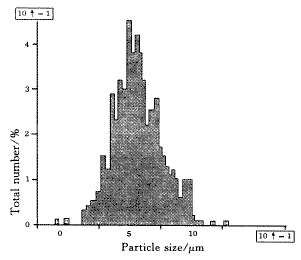
, 百拇医药
Fig.3 Size distribution of the proliposomes afterstoring 9 months at room temperature
从图上可以看出,空白脂质体前体再分散后,形成的脂质体粒子分布集中,平均粒径为0.75 μm,符合注射要求.室温下放置7个月、9个月后再分散其平均粒径分别为0.81 μm、0.84 μm,再分散性没有发生显著改变,粒径分布仍比较集中.
将样品分别于4℃、室温下放置,1、3、5、7、9个月取样,用5-Fu溶液再分散后测定包裹率,结果见表1.
空白脂质体前体4℃、室温下放置9个月后,对5-Fu的包裹率没有发生显著改变.
2.4 影响5-Fu、盐酸阿霉素包裹率的因素考察
2.4.1 水相介质pH值对药物包裹率的影响
, 百拇医药
按2项下制备空白脂质体前体,水相介质分别用不同pH的缓冲液,用一定浓度的5-Fu、阿霉素等药物水溶液(与磷脂重量比为1∶10)再分散后,测定包裹率.数据见表2.
水相介质pH值增加,对5-Fu、FT-207、盐酸阿霉素、盐酸阿糖胞苷的包裹率增加,对水杨酸钠的包裹率降低,对干扰素来说,在低于等电点时包裹率较高,在高于等电点时,包裹率较低.pH增加,5-Fu、FT-207的溶解度增大,有利于药物进入内水相中,同时pH增加,使磷脂双分子层与盐酸阿霉素、盐酸阿糖胞苷静电引力作用增强,也使弱碱性药物盐酸阿霉素、盐酸阿糖胞苷分子型比例增大,因而包裹率增大.对水杨酸钠来说,由于与磷脂双分子层静电斥力作用增强使包裹率下降.
Tab.1 The results of trap efficiency(E%)of 5-Fu after the empty proliposomes storing 9 months Storing time/
, 百拇医药
month
Trap efficiency/E%
at 4℃
at room temperature
0
25.4
25.9
1
26.5
26.8
3
24.7
, http://www.100md.com 27.1
5
25.1
27.3
7
26.7
26.2
9
25.8
25.6
Tab.2 The effect of pH of empty liposome on trap efficiency(E%)of liposome pH
E/%
, 百拇医药
5-Fu
ADM
Ara-C
FT-207
IFN
SS
5.15
18.9
64.2
38.6
18.6
40.7
32.2
, 百拇医药
6.24
23.6
74.6
45.3
24.2
33.3
26.3
7.20
26.5
85.6
51.3
27.4
28.0
, http://www.100md.com
21.5
8.02
30.1
94.3
56.2
29.4
ND*
16.8
ND* not determined
2.4.2 离子强度对药物包裹率的影响
按2项下制备空白脂质体前体,水相介质分别用不同离子强度的缓冲液,用一定浓度的5-Fu、阿霉素等药物水溶液再分散后,测定包裹率,结果见表3.
, http://www.100md.com
空白脂质体水相介质离子强度增加,对5-Fu、阿霉素等药物的包裹率降低.离子强度增加,脂质体的稳定性降低,当离子强度达到0.695时,空白脂质体在制备过程中已发生絮凝.
2.4.3 药物与磷脂的重量比对药物包裹率的影响
用不同浓度5-Fu、盐酸阿霉素(ADM)等药物溶液再分散后测定包裹率,结果见表4.
磷脂与药物的重量比增加,药物的包裹率提高.对盐酸阿霉素(ADM)的影响尤为显著.
Tab.3 The effect of ionic strength of empty liposome on the trap efficiency Ionic
strength
E/%
, 百拇医药
5-Fu
ADM
FT-207
Ara-C
SS
0.268
29.6
84.6
34.2
56.3
33.0
0.353
23.5
, 百拇医药
64.4
29.1
42.5
27.6
0.418
21.2
44.4
23.6
34.6
21.7
0.524
18.6
30.5
, 百拇医药
18.7
25.7
16.9
0.695
ND*
ND*
ND*
ND*
ND*
ND* not determinedTab.4 The effect of the ratio of drug to EPC(w/w) on the trap efficiency(E%) of liposome EPC/drug
, 百拇医药
(w/w)
E/%
5-Fu
FT-207
ADM
Ara-C
SS
1∶2
14.6
16.7
ND*
23.1
17.2
, 百拇医药
1∶1
17.2
20.5
ND*
27.4
20.8
2∶1
22.1
23.5
34.6
32.0
23.5
5∶1
, 百拇医药
26.8
27.9
44.5
37.2
25.6
10∶1
27.3
28.7
76.4
45.1
29.4
20∶1
28.6
, 百拇医药
30.4
94.6
54.7
33.6
ND* not determined
3 讨论
a.用空白脂质体前体作为水溶性药物载体制备的药物脂质体,与其他制备方法比较,有以下几个优点:a.制备方法简便;b.避免不稳定药物在制备过程中失活;c.药物浓度可以随时调节;d.药物与空白脂质体可以采用不同的方法灭菌.
b.对几种抗癌药物加入空白脂质体前体中,进行抑瘤实验的研究,结果表明:与游离药物相比,其抑瘤活性都有不同程度的提高,毒性降低.
, http://www.100md.com
c.在处方中,支持剂的选择很重要.它在冷冻干燥过程中起着骨架作用,使磷脂膜及其他油性物质分散开,按其结晶状态排列,有利于空白脂质体前体的再分散,它与高分子表面活性剂在空白脂质体前体再分散过程中起到了关键作用,保证空白脂质体前体再分散后的粒径及分布达到注射要求.
致谢 感谢中科院生物物理研究所胡匡祜老师协助测定粒径及分布;沈阳康利新乐制药有限公司也提供了大力帮助.
参考文献
1 Guo LSS.Novel anti-fungal drug delivery:stable amphotericin B-cholesteryl sulfate dies.Int J Pharm,1991,75:45
2 Crommelin DJA.Influence of lipid composition and ionic strength on the physical stability of liposome.J Pharm Sci,1984,7:1559~1663
, http://www.100md.com
3 Payle NI,Bowning I,Hynes CA.Characterization of prolipsome.J Pharm Sci,1986,75(4):330~333
4 杨志军,日野知证,川岛嘉明.黄芩前体脂质体再复水后的新脂质体粒径研究.中国药科大学学报,1994,24(3):161~164
5 Maria B,Richard ME.Efect of sugar alcohol and disaccharide in inducing the hexagonal hase and altering membrane properties:implications for diabetes mellitus.Biochim Biophys Acta,1988,843:485~492
6 Park YS,Huang L.Cryoprotective activity of synthetic glycophospholipids and their interactions with trehalose.Biochim Biophys Acta,1992,1124:241~248
, http://www.100md.com
7 Crowe LM,Robbert M,Crowe JH,et al.Efects of carbohydrates on membrane stability at low water activities.Biochim Biophys Acta,1984,769:141~150
8 Crowe LM,Womershy C,Peid D,et al.Prevention of fusion and leakage in freeze-dried liposome by carbohydrates.Biochim Biophys Acta,1986,861:131~140
9 顾学裘,马竹卿,辛顺妹,等.多相脂质体(139,76)混悬型静脉注射液的研究.中草药,1982,13(5):15~20
收稿日期:1990-02-01, 百拇医药
单位:沈阳药科大学药学系, 沈阳 110015
关键词:空白脂质体前体;包裹率;药物载体
沈阳药科大学学报990302 摘 要 以蛋黄卵磷脂、胆固醇为膜材,加入适量的高分子表面活性剂,选择合适的支持剂,采用冷冻干燥法制备了空白脂质体前体,并用它作为药物载体,将药物溶液分散在载体中,制成药物脂质体.研究了空白脂质体前体的再分散性及物理稳定性.空白脂质体前体再分散性良好,平均粒径为0.75 μm,粒径分布比较集中,在室温下贮存7个月、9个月后再分散其平均粒径分别为0.81 μm、0.84 μm,对5-Fu的包裹率也没有发生显著改变。用5-Fu,阿霉素(ADM)等为模型药物,考察了影响药物脂质体包裹率的因素,并将最优条件固定.研究结果表明:空白脂质体水相的pH值、离子强度、再分散药物溶液的浓度(即药物与磷脂的重量比)对药物包裹率有显著影响.
, http://www.100md.com
分类号 R944.9
Studies on the Preparation and Characteristics of Empty Proliposomes as a Drug Carrier
Quan Dongqin,Su Desen,Gu Xueqiu
Department of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110015
Abstract The empty proliposomes were prepared by the freeze-dried method composed of EPC,Chol and surfactant in the presence of a proper cryoprotectant.We used this empty proliposomes as a drug carrier to entrap hydrophilic drugs and the effects of trap efficiency were investigated as well.The results showed that the trap efficiency was influenced significantly by pH,ion strength of the buffer solution and by the weight ratio of EPC to drug.The mean particle size of the proliposomes after redispersion was 0.75 μm and 0.81 μm,0.84 μm respectively after storing for 7 months and 9 months at room temperature.The trap efficiency to 5-Fu was not changed either after storing.The physical stability of this drug carrier was good.
, 百拇医药
Key words empty proliposomes;trap efficency;drug carrier
近年来,脂质体做为药物载体已被广泛研究,一部分工作已达到了临床应用阶段〔1〕.但是脂质体在溶液状态下仍存在着一些问题,脂质体分散系的不稳定性:如药物的渗漏、粒子的聚集以及磷脂在液态下的氧化、水解,影响了脂质体在临床上的应用〔2〕.为了保证脂质体在长期贮存中的稳定性,药学工作者们一直都在寻找解决的方法,其中脂质体前体的制备提供了一个行之有效的方法〔3,4〕,它使脂质体以固态形式贮存,只是在临用前加入分散介质即可再分散形成脂质体,这种方法不但解决了上述存在的问题,而且便于运输使用,也适用于工业生产.近年来国内外对冷冻干燥法制备脂质体前体的研究较多,主要集中在如何选择一个合适的支持剂,防止在冷冻干燥过程中药物的渗漏及粒子间的相互聚集〔5,6〕.本文从另外的角度研究用冷冻干燥法制备了空白脂质体前体,作为水溶性药物载体,将药物溶液分散在其中,形成药物脂质体.这与上述报道的研究角度不同,不是研究防止药物在脂质体冷冻干燥过程中的渗漏,而是研究药物如何包裹于空白脂质体前体中,且保证再分散后的药物脂质体的粒径及分布达到注射要求.这样不但解决了脂质体的物理稳定性和水溶性药物的渗漏问题,而且避免了不稳定药物在脂质体制备过程中失活、分解,以简化脂质体的制备过程,适用于大工业生产.
, 百拇医药
1 仪器与试药
5-Fu,FT-207(济南制药厂),盐酸阿霉素ADM(海门制药厂),盐酸阿糖胞苷Ara-C(锦州制药一厂).
干扰素IFN(沈阳新乐制药厂),水杨酸钠(SS),蛋黄卵磷脂EPC(自制),胆固醇CH(进口分装).
可见紫外分光光度计(日本岛津UV-260);高速匀浆机(江苏省江阴县祝塘仪器厂);显微分光图像分析仪(MPVⅢ TAS PLUS中科院生物物理研究所).
2 方法与结果
2.1 空白脂质体前体的制备
蛋黄卵磷脂(EPC),胆固醇(CH):高分子表面活性剂(P)按重量比4∶1∶2,采用融熔法制备〔9〕,即EPC、CH等脂溶性成分用少量乙醇溶解,加热至70℃左右,然后加入水相pH7.2磷酸盐缓冲液不断搅拌,再于匀浆机上以15 000 r/min匀化3次,加入支持剂,取1 mL分装于西林瓶中,进行冷冻干燥.冷冻干燥后的样品充氮气密封,避光贮存,待用.药物脂质体的制备是将药物溶液分散于空白脂质体前体中,用手振摇即可.
, 百拇医药
2.2 包裹率的测定方法
用Sephadex G-50柱层析法,柱30 cm,内径1 cm,流动相为pH7.2磷酸盐缓冲液,流速为0.8 mL/min,上样量为0.5 mL,流出液直接接于检测器上,由记录仪上可得到分离图谱.对5-Fu接取游离药物峰,定容后于265 nm处测定吸收度值,空白脂质体同法操作作为对照,代入N标准曲线方程,求得C游,包裹率按下式计算.
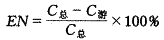
对阿霉素则接取脂质体峰,用10% Triton X-100以体积比1∶2加入脂质体中,使脂质体膜溶解,定容后于480 nm处测定吸收度值,空白脂质体同法操作作为对照.
对干扰素采用离心法,将上清液进行活性检测,得出游离药物浓度.
以上药物的测定方法的回收率均在98%~101%之间.
, 百拇医药
2.3 空白脂质体前体的性质研究
2.3.1 空白脂质体前体的再分散性取空白脂质体前体,加入适量水再分散后,用显微粒径图像分析测定其粒径及粒径分布,见图1.

Fig.1 Size distribution of the proliposomesafter redispersion
2.3.2 空白脂质体前体的物理稳定性
取室温下放置7个月、9个月后的样品,加入适量水再分散后,用显微粒径图像分析仪测定其粒径及粒径分布,见图2,图3.

Fig.2 Size distribution of the proliposomes after storing 7 months at room temperature

, 百拇医药
Fig.3 Size distribution of the proliposomes afterstoring 9 months at room temperature
从图上可以看出,空白脂质体前体再分散后,形成的脂质体粒子分布集中,平均粒径为0.75 μm,符合注射要求.室温下放置7个月、9个月后再分散其平均粒径分别为0.81 μm、0.84 μm,再分散性没有发生显著改变,粒径分布仍比较集中.
将样品分别于4℃、室温下放置,1、3、5、7、9个月取样,用5-Fu溶液再分散后测定包裹率,结果见表1.
空白脂质体前体4℃、室温下放置9个月后,对5-Fu的包裹率没有发生显著改变.
2.4 影响5-Fu、盐酸阿霉素包裹率的因素考察
2.4.1 水相介质pH值对药物包裹率的影响
, 百拇医药
按2项下制备空白脂质体前体,水相介质分别用不同pH的缓冲液,用一定浓度的5-Fu、阿霉素等药物水溶液(与磷脂重量比为1∶10)再分散后,测定包裹率.数据见表2.
水相介质pH值增加,对5-Fu、FT-207、盐酸阿霉素、盐酸阿糖胞苷的包裹率增加,对水杨酸钠的包裹率降低,对干扰素来说,在低于等电点时包裹率较高,在高于等电点时,包裹率较低.pH增加,5-Fu、FT-207的溶解度增大,有利于药物进入内水相中,同时pH增加,使磷脂双分子层与盐酸阿霉素、盐酸阿糖胞苷静电引力作用增强,也使弱碱性药物盐酸阿霉素、盐酸阿糖胞苷分子型比例增大,因而包裹率增大.对水杨酸钠来说,由于与磷脂双分子层静电斥力作用增强使包裹率下降.
Tab.1 The results of trap efficiency(E%)of 5-Fu after the empty proliposomes storing 9 months Storing time/
, 百拇医药
month
Trap efficiency/E%
at 4℃
at room temperature
0
25.4
25.9
1
26.5
26.8
3
24.7
, http://www.100md.com 27.1
5
25.1
27.3
7
26.7
26.2
9
25.8
25.6
Tab.2 The effect of pH of empty liposome on trap efficiency(E%)of liposome pH
E/%
, 百拇医药
5-Fu
ADM
Ara-C
FT-207
IFN
SS
5.15
18.9
64.2
38.6
18.6
40.7
32.2
, 百拇医药
6.24
23.6
74.6
45.3
24.2
33.3
26.3
7.20
26.5
85.6
51.3
27.4
28.0
, http://www.100md.com
21.5
8.02
30.1
94.3
56.2
29.4
ND*
16.8
ND* not determined
2.4.2 离子强度对药物包裹率的影响
按2项下制备空白脂质体前体,水相介质分别用不同离子强度的缓冲液,用一定浓度的5-Fu、阿霉素等药物水溶液再分散后,测定包裹率,结果见表3.
, http://www.100md.com
空白脂质体水相介质离子强度增加,对5-Fu、阿霉素等药物的包裹率降低.离子强度增加,脂质体的稳定性降低,当离子强度达到0.695时,空白脂质体在制备过程中已发生絮凝.
2.4.3 药物与磷脂的重量比对药物包裹率的影响
用不同浓度5-Fu、盐酸阿霉素(ADM)等药物溶液再分散后测定包裹率,结果见表4.
磷脂与药物的重量比增加,药物的包裹率提高.对盐酸阿霉素(ADM)的影响尤为显著.
Tab.3 The effect of ionic strength of empty liposome on the trap efficiency Ionic
strength
E/%
, 百拇医药
5-Fu
ADM
FT-207
Ara-C
SS
0.268
29.6
84.6
34.2
56.3
33.0
0.353
23.5
, 百拇医药
64.4
29.1
42.5
27.6
0.418
21.2
44.4
23.6
34.6
21.7
0.524
18.6
30.5
, 百拇医药
18.7
25.7
16.9
0.695
ND*
ND*
ND*
ND*
ND*
ND* not determinedTab.4 The effect of the ratio of drug to EPC(w/w) on the trap efficiency(E%) of liposome EPC/drug
, 百拇医药
(w/w)
E/%
5-Fu
FT-207
ADM
Ara-C
SS
1∶2
14.6
16.7
ND*
23.1
17.2
, 百拇医药
1∶1
17.2
20.5
ND*
27.4
20.8
2∶1
22.1
23.5
34.6
32.0
23.5
5∶1
, 百拇医药
26.8
27.9
44.5
37.2
25.6
10∶1
27.3
28.7
76.4
45.1
29.4
20∶1
28.6
, 百拇医药
30.4
94.6
54.7
33.6
ND* not determined
3 讨论
a.用空白脂质体前体作为水溶性药物载体制备的药物脂质体,与其他制备方法比较,有以下几个优点:a.制备方法简便;b.避免不稳定药物在制备过程中失活;c.药物浓度可以随时调节;d.药物与空白脂质体可以采用不同的方法灭菌.
b.对几种抗癌药物加入空白脂质体前体中,进行抑瘤实验的研究,结果表明:与游离药物相比,其抑瘤活性都有不同程度的提高,毒性降低.
, http://www.100md.com
c.在处方中,支持剂的选择很重要.它在冷冻干燥过程中起着骨架作用,使磷脂膜及其他油性物质分散开,按其结晶状态排列,有利于空白脂质体前体的再分散,它与高分子表面活性剂在空白脂质体前体再分散过程中起到了关键作用,保证空白脂质体前体再分散后的粒径及分布达到注射要求.
致谢 感谢中科院生物物理研究所胡匡祜老师协助测定粒径及分布;沈阳康利新乐制药有限公司也提供了大力帮助.
参考文献
1 Guo LSS.Novel anti-fungal drug delivery:stable amphotericin B-cholesteryl sulfate dies.Int J Pharm,1991,75:45
2 Crommelin DJA.Influence of lipid composition and ionic strength on the physical stability of liposome.J Pharm Sci,1984,7:1559~1663
, http://www.100md.com
3 Payle NI,Bowning I,Hynes CA.Characterization of prolipsome.J Pharm Sci,1986,75(4):330~333
4 杨志军,日野知证,川岛嘉明.黄芩前体脂质体再复水后的新脂质体粒径研究.中国药科大学学报,1994,24(3):161~164
5 Maria B,Richard ME.Efect of sugar alcohol and disaccharide in inducing the hexagonal hase and altering membrane properties:implications for diabetes mellitus.Biochim Biophys Acta,1988,843:485~492
6 Park YS,Huang L.Cryoprotective activity of synthetic glycophospholipids and their interactions with trehalose.Biochim Biophys Acta,1992,1124:241~248
, http://www.100md.com
7 Crowe LM,Robbert M,Crowe JH,et al.Efects of carbohydrates on membrane stability at low water activities.Biochim Biophys Acta,1984,769:141~150
8 Crowe LM,Womershy C,Peid D,et al.Prevention of fusion and leakage in freeze-dried liposome by carbohydrates.Biochim Biophys Acta,1986,861:131~140
9 顾学裘,马竹卿,辛顺妹,等.多相脂质体(139,76)混悬型静脉注射液的研究.中草药,1982,13(5):15~20
收稿日期:1990-02-01, 百拇医药