单糖氧化脱水反应中酮糖活性高于醛糖的解释
作者:苏宇 冉利
单位:川北医学院化学教研室 南充 637000
关键词:酮糖;醛糖;烯醇化速率;α—H解离
川北医学院学报990313 摘 要 决定单糖在稀HCl下脱水、在稀碱下被弱氧化剂氧化的反应速率是烯二醇形成一步的速率,烯二醇形成难易的关键是α—H的离解。酮糖α—H不仅比醛糖多2倍,而且大多数α—H(c1—H)比醛糖活泼,无论在H+还是在OH-条件下,酮糖α—H离解几率比醛糖大 故烯醇化速率比醛糖大。
文章编号:1005-3697(1999)03-0021-03 中图分类号:R313 文献标识码:A
单糖的化学性质是有机化学的教学重点之一。单糖在HCl作用下脱水生成α—呋喃甲醛或其衍生物和在稀碱作用下被弱氧化剂(如Tollens试剂、Benedict试剂等)氧化,酮糖的反应比醛糖快,为什么如此,这一直是单糖性质中未能解释清楚的问题,为此本文作如下解释:
, http://www.100md.com
单糖无论是醛糖还是酮糖,其开链结构可与烯二醇结构互变,酸、碱催化这一过程[1]。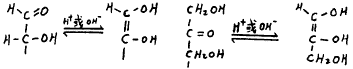
Singh M.P等人曾用同位素追踪,紫外光谱测定等方法对单糖与弱氧化剂反应的动力学进行了研究,结果发现,氧化反应的速率,取决于稀碱作用下,烯二醇形成一步的速率[2]。单糖在H+作用下脱水,实验证明反应速率也是取决于烯二醇形成一步的速率[3]。由此可见,对于这两类反应,酮糖和醛糖活性差异主要原因在于二者烯醇化速率不同,酮糖高于醛糖,关于这后一点,已有实验予以证实,有人曾在常温、碱性条件下,测得酮糖的烯醇化速率为醛糖的10倍以上[4]。
本文从反应机理出发以优势构象的葡萄糖和果糖为例,讨论酮糖和醛糖的烯醇化速率差异。
, 百拇医药
1、稀碱作用下
2、稀酸作用下
烯醇化难易的关键在于α—H的离去
葡萄糖:C2上的H即为α—H,有一定的活泼性,在开链结构中,可通过C2—C3键的旋转,与C5OH形成氢键。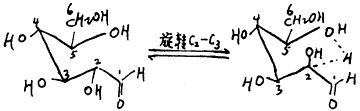
这是一个近似六元环系的结构,有一定的稳定性,氢键能稳定存在,无论是在碱,还是在酸作用下,α—H要解离下来,都要额外地付出能量来克服氢键。
, 百拇医药
果糖:α—H既有C3上的H,又有C1上的H,数目多于醛糖的。开链状的果糖,C3—H同葡萄糖C2—H类似,也可与C6—HOH形成氢键,但C1—H却有所不同,C1—H虽也可通过C1—C2键旋转与C6—OH形成氢键,但这样形成一个近似八元环系的结构,且环上一个C原子还为SP2杂化(C2),这样的环系不稳定,体系能量高,氢键不能稳定存在。C1—H若被离解,较近似六元环系的结构所需能量少,容易离解下来。更主要的原因是,C1有两个α—H,若其中一个与C6—OH形成氢键,另一个则没有这种束缚不需要额外付出能量,便可离解下来,所以C1—H较C3—H更容易离解。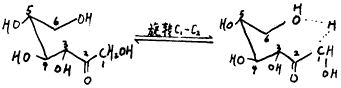
, 百拇医药
由此可见,酮糖α—H不仅在数目上比醛糖的多2倍,而且在活性上高于醛糖α—H,离解的几率自然就大于醛糖的,因而烯醇化速率大于醛糖。
参考文献
1 俞凌 .基础理论有机化学.北京:人民教育出版社,1983;318
.基础理论有机化学.北京:人民教育出版社,1983;318
2 Singh M.P et al. Indian J.chem.1975;13(8):819
3 洪 盈.有机化学.北京:人民卫生出版社,1987;600
4 伍越寰,等.有机化学.合肥:中国科技大学出版社,1994
(收稿日期:1999-06-09), http://www.100md.com
单位:川北医学院化学教研室 南充 637000
关键词:酮糖;醛糖;烯醇化速率;α—H解离
川北医学院学报990313 摘 要 决定单糖在稀HCl下脱水、在稀碱下被弱氧化剂氧化的反应速率是烯二醇形成一步的速率,烯二醇形成难易的关键是α—H的离解。酮糖α—H不仅比醛糖多2倍,而且大多数α—H(c1—H)比醛糖活泼,无论在H+还是在OH-条件下,酮糖α—H离解几率比醛糖大 故烯醇化速率比醛糖大。
文章编号:1005-3697(1999)03-0021-03 中图分类号:R313 文献标识码:A
单糖的化学性质是有机化学的教学重点之一。单糖在HCl作用下脱水生成α—呋喃甲醛或其衍生物和在稀碱作用下被弱氧化剂(如Tollens试剂、Benedict试剂等)氧化,酮糖的反应比醛糖快,为什么如此,这一直是单糖性质中未能解释清楚的问题,为此本文作如下解释:
, http://www.100md.com
单糖无论是醛糖还是酮糖,其开链结构可与烯二醇结构互变,酸、碱催化这一过程[1]。
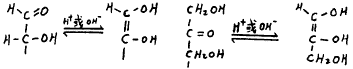
Singh M.P等人曾用同位素追踪,紫外光谱测定等方法对单糖与弱氧化剂反应的动力学进行了研究,结果发现,氧化反应的速率,取决于稀碱作用下,烯二醇形成一步的速率[2]。单糖在H+作用下脱水,实验证明反应速率也是取决于烯二醇形成一步的速率[3]。由此可见,对于这两类反应,酮糖和醛糖活性差异主要原因在于二者烯醇化速率不同,酮糖高于醛糖,关于这后一点,已有实验予以证实,有人曾在常温、碱性条件下,测得酮糖的烯醇化速率为醛糖的10倍以上[4]。
本文从反应机理出发以优势构象的葡萄糖和果糖为例,讨论酮糖和醛糖的烯醇化速率差异。
, 百拇医药
1、稀碱作用下

2、稀酸作用下

烯醇化难易的关键在于α—H的离去
葡萄糖:C2上的H即为α—H,有一定的活泼性,在开链结构中,可通过C2—C3键的旋转,与C5OH形成氢键。

这是一个近似六元环系的结构,有一定的稳定性,氢键能稳定存在,无论是在碱,还是在酸作用下,α—H要解离下来,都要额外地付出能量来克服氢键。
, 百拇医药
果糖:α—H既有C3上的H,又有C1上的H,数目多于醛糖的。开链状的果糖,C3—H同葡萄糖C2—H类似,也可与C6—HOH形成氢键,但C1—H却有所不同,C1—H虽也可通过C1—C2键旋转与C6—OH形成氢键,但这样形成一个近似八元环系的结构,且环上一个C原子还为SP2杂化(C2),这样的环系不稳定,体系能量高,氢键不能稳定存在。C1—H若被离解,较近似六元环系的结构所需能量少,容易离解下来。更主要的原因是,C1有两个α—H,若其中一个与C6—OH形成氢键,另一个则没有这种束缚不需要额外付出能量,便可离解下来,所以C1—H较C3—H更容易离解。
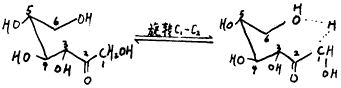
, 百拇医药
由此可见,酮糖α—H不仅在数目上比醛糖的多2倍,而且在活性上高于醛糖α—H,离解的几率自然就大于醛糖的,因而烯醇化速率大于醛糖。
参考文献
1 俞凌
 .基础理论有机化学.北京:人民教育出版社,1983;318
.基础理论有机化学.北京:人民教育出版社,1983;3182 Singh M.P et al. Indian J.chem.1975;13(8):819
3 洪 盈.有机化学.北京:人民卫生出版社,1987;600
4 伍越寰,等.有机化学.合肥:中国科技大学出版社,1994
(收稿日期:1999-06-09), http://www.100md.com