睫状体色素上皮培养液的选择和超微结构观察
作者:熊新春 杜蜀华 张泺
单位:430020 湖北武汉,同济医科大学附属协和医院眼科
关键词:睫状体色素上皮;体外培养;超微结构
眼科新进展990306 摘要 目的 探讨兔睫状体色素上皮细胞体外培养的最适培养液并观察培养前后的超微结构改变。方法 采用下列培养液对睫状体色素上皮细胞进行体外培养:DMEM、F12、M199、RPMI-1640以及DMEM和F12的等量混合液。观察接种后3~10d贴壁生长的组织片增长面积。采用透射电镜观察培养前后的超微结构。结果 兔睫状体色素上皮在RPMI-1640培养液中生长最快。培养的睫状体色素上皮细胞色素减少,细胞器丰富,但细胞连接存在,表面微绒毛形态一致。结论 RPMI-1640是兔睫状体色素上皮体外培养的最适培养液。培养后的睫状体色素上皮可用于研究房水分泌和测试抗青光眼药物等体外实验。
, http://www.100md.com
[眼科新进展 1999;19(3)∶162-164]
Choice of medium for ciliary pigmented epithelial culture and the observation of its ultrastructural characteristics
XIONG Xin-Chun,DU Shu-Hua,ZHANG Luo
Abstract Objective To explore the best medium for rabbit ciliary pigmented epithelium(CPE) culture and the ultrastructural changes of CPE before and after cultured.Methods The growth areas of CPE were measured in the following media:DMEM,F12,M199,RPMI-1640 and the mixture of DMEM and F12.The ultrastructure of CPE was observed by electron microscopy before and after cultured.Results RPMI-1640 was the best medium for CPE culture.The cultured CPE cells manifested more mitochondria,ribosome,reticula and less granules of melanin than the uncultured,whereas the cell junction and microvilli kept the same.Conclusion RPMI-1640 is the most ideal medium for ciliary pigmented epithelial culture.
, 百拇医药
Key words ciliary pigmented epithelium;culture;ultrastructure
[Rec Adv Ophthalmol 1999;19(3)∶162-164] 睫状体色素上皮(ciliary pigmented epithelium,CPE)是覆盖在睫状体上靠近基底膜一侧的上皮细胞,它同面向房水一侧的非色素上皮一起参与房水的分泌[1]。CPE因很少参与体内的损伤修复过程而在体外难于培养。本实验探讨其培养条件中培养液的选择,并观察其培养前后形态结构改变,以便使该细胞在体外高效而迅速培养。
1 材料和方法
1.1 培养方法 按参考文献[2]取材方法用胶原酶消化组织,分别接种于下列培养液:DMEM、F12、M199、RPMI-1640(Gibco,USA)、及DMEM和F12等比例混合液5种培养液,置二氧化碳培养箱37℃恒温培养。
, http://www.100md.com
1.2 细胞增长面积测定 全部采用15mL玻璃培养瓶为培养基质,同一批号小牛血清(上海浦东生物材料厂)含量100g3.L-1,每3d更换培养液1次,量为4mL,将1只黑兔2只眼获得的睫状体上皮接种入1瓶。选取瓶中初始直径为0.5mm的组织片作上记号并记录2片4个方向的生长晕边缘半径转换为面积,记录接种后3~10d,每种培养液测量3瓶。1.3 超微结构观察 用25g.L-1戊二醛固定培养前后的CPE,10g.L-1锇酸后固定,包埋后作60~80nm的超薄切片,用透射电镜(Opton FM 10cr)观察拍照。
2 结果
2.1 CPE在不同培养液中的生长 CPE在各种培养液中的面积增长见图1。细胞在RPMI-1640培养液中生长最快,其次为DMEM培养液,DMEM和F12的混合培养液在早期有促进生长作用。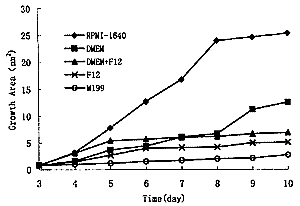
, 百拇医药
Figure 1 Growth area of pigmented ciliary epithelia cultured in different media
细胞在不同营养液中增长面积
2.2 培养前后的CPE超微结构特点 CPE培养后,其平均直径由8~10nm增加到20~30nm,呈上皮样或成纤维细胞样2种形态。细胞经培养后下列结构增多:表面微绒毛、线粒体、粗面内浆网、高尔基器、核糖体以及细胞骨架中的微管。培养前后的CPE细胞均可见典型的上皮细胞连接:桥粒连接和缝隙连接。培养后的CPE细胞黑色素颗粒减少(见图2~3)。
Figure 2 More ribosomes(R) and reticulae in cultured ciliary pigmented epithelia,TEM×16 000
, 百拇医药
培养的CPE细胞可见大量核糖体(R)和内质网,透射电镜×16 000。
Figure 3 Clear membrane of neuclear(N),Less granules of melanin(P) and more mitochondia(M) in cultured ciliary pigmented epithelial cell,TEM×16 000
体外培养的CPE核膜清晰,色素(P)减少,线粒体(M)增多,透射电镜×16 000
3 讨论
3.1 培养液的选择及其意义 近10a来国外开展CPE细胞培养选用的培养液主要有:DMEM、F12、F10、M199、RPMI-1640、DMEM、L-15加入不同浓度的小牛血清可以培养出多种动物的CPE[3~5],但成功率(54%)不高。因培养的CPE为贴壁生长而非悬浮生长,故本实验采用测定组织片生长面积方法来观察细胞生长情况。该方法与氚标放射测定相比,不仅可以测定细胞的增殖,而且还可以观察细胞的移动能力。曲线表明:CPE细胞在RPMI-1640培养液中生长移动最快。该培养液起初是针对淋巴细胞设计的,含有全部的必需氨基酸且含量较高,细胞合成核酸和蛋白质的谷氨酰胺含量也较高,能适用多种细胞培养的要求。用DMEM培养CPE时,细胞生长仅次于RPMI-1640,其生长形态呈上皮样居多。DMEM同RPMI-1640一样具有成分简单的特点,含有高糖和高浓度的谷氨酰胺,可能对合成维持细胞形态的骨架系统有利。F12氨基酸成分含量少,增加了Cu2+,Zn2+等一些微量元素,观察表明对该细胞的生长并无促进作用。DMEM与F12的等量混合培养液只在早期对CPE具有一定的生长刺激作用。M199是问世最早,含有69种复杂成分的培养基,但其比例并不适合CPE生长的要求,观察结果效果最差[6]。
, http://www.100md.com
3.2 CPE细胞培养前后形态变化的意义 培养后的CPE最显著的变化是黑色素减少,可能是培养液中某些营养物质的缺乏或细胞本身酪氨酸蛋白激酶活性降低所致[7]。培养后的CPE平均直径增加,具有丰富的细胞器,表明细胞功能活跃。
培养前后的CPE细胞均可见到桥粒连接、缝隙连接和相似的微绒毛,且已有实验证明培养的CPE具有与青光眼密切相关的碳酸酐酶及其同功酶系统[8],因此本实验培养液的选择和形态观察将有助于CPE的体外高效培养和促进房水分泌等基础研究。
作者简介:熊新春,男,1966年生,湖北枝江市人,1995年毕业于同济医科大学,获医学博士学位。硕士和博士学位攻读方向为眼科青光眼,率先在国内开展睫状体色素上皮细胞的培养并获得成功。同时还进行了干扰素类药物作为青光眼滤过术后辅助用药的实验研究。1997年赴德国柏林自由大学进行博士后研究1年,主要从事受体介导的细胞内信号转导的研究。现在同济医科大学附属协和医院眼科任主治医师、讲师。电话:027-85726081
, http://www.100md.com
Accepted for publication Apr 20,1998
From the Department of Ophthalmology,Xiehe Hospital,Tongji Medical University,Wuhan 430020,Hubei Province,China
参考文献
1 Helbig H,Korbmacher C,Nawrath M,et al.Sodium bicarbonate cotransport in cultured pigmented ciliary epithelial cells.Curr Eye Res 1989;8∶595-598.
2 熊新春,杜蜀华,张 泺.人、兔睫状色素上皮细胞的体外培养.眼科 1994;3(2)∶114-117.
, http://www.100md.com
3 Kondo K,Coca-Prados M,Sears ML.Ciliary epithelial of the mammalian eye in cultured explant.Cell Tissue Res 1983;233∶629-638.
4 Helbig H,Korbmacher C,Wohlfarth J,et al.Electrogenic Na+-ascorbate cotransport in cultured bovine pigmented ciliary epithelial cells.Am J Physiol 1989;156∶44-49.
5 Runyan TE,Mccombs WB,Holton CD,et al.Human ciliary body epithelial in culture.Invest Ophthalmol Vis Sci 1983;24∶687-696.
, http://www.100md.com
6 鄂征.组织培养和分子细胞学技术.第2版.北京:北京出版社 1997∶28-31.
7 Helbig H.K+ conductance and electrogenic Na+/K+ transport of cultured bovine pigmented ciliary epithelium.J Membrane Biol 1987;99∶173-186.
8 Helbig H,Korbmacher C,Erb C,et al.Coupling of 22 Na and 38 Cl uptake in cultured pigmented ciliary epithelial cells:a proposed role for the isoenzymes of carbonic anhydrase.Curr Eye Res 1989;8∶1111-1119.
收稿 1998-04-20 修回 1998-06-18, http://www.100md.com
单位:430020 湖北武汉,同济医科大学附属协和医院眼科
关键词:睫状体色素上皮;体外培养;超微结构
眼科新进展990306 摘要 目的 探讨兔睫状体色素上皮细胞体外培养的最适培养液并观察培养前后的超微结构改变。方法 采用下列培养液对睫状体色素上皮细胞进行体外培养:DMEM、F12、M199、RPMI-1640以及DMEM和F12的等量混合液。观察接种后3~10d贴壁生长的组织片增长面积。采用透射电镜观察培养前后的超微结构。结果 兔睫状体色素上皮在RPMI-1640培养液中生长最快。培养的睫状体色素上皮细胞色素减少,细胞器丰富,但细胞连接存在,表面微绒毛形态一致。结论 RPMI-1640是兔睫状体色素上皮体外培养的最适培养液。培养后的睫状体色素上皮可用于研究房水分泌和测试抗青光眼药物等体外实验。
, http://www.100md.com
[眼科新进展 1999;19(3)∶162-164]
Choice of medium for ciliary pigmented epithelial culture and the observation of its ultrastructural characteristics
XIONG Xin-Chun,DU Shu-Hua,ZHANG Luo
Abstract Objective To explore the best medium for rabbit ciliary pigmented epithelium(CPE) culture and the ultrastructural changes of CPE before and after cultured.Methods The growth areas of CPE were measured in the following media:DMEM,F12,M199,RPMI-1640 and the mixture of DMEM and F12.The ultrastructure of CPE was observed by electron microscopy before and after cultured.Results RPMI-1640 was the best medium for CPE culture.The cultured CPE cells manifested more mitochondria,ribosome,reticula and less granules of melanin than the uncultured,whereas the cell junction and microvilli kept the same.Conclusion RPMI-1640 is the most ideal medium for ciliary pigmented epithelial culture.
, 百拇医药
Key words ciliary pigmented epithelium;culture;ultrastructure
[Rec Adv Ophthalmol 1999;19(3)∶162-164] 睫状体色素上皮(ciliary pigmented epithelium,CPE)是覆盖在睫状体上靠近基底膜一侧的上皮细胞,它同面向房水一侧的非色素上皮一起参与房水的分泌[1]。CPE因很少参与体内的损伤修复过程而在体外难于培养。本实验探讨其培养条件中培养液的选择,并观察其培养前后形态结构改变,以便使该细胞在体外高效而迅速培养。
1 材料和方法
1.1 培养方法 按参考文献[2]取材方法用胶原酶消化组织,分别接种于下列培养液:DMEM、F12、M199、RPMI-1640(Gibco,USA)、及DMEM和F12等比例混合液5种培养液,置二氧化碳培养箱37℃恒温培养。
, http://www.100md.com
1.2 细胞增长面积测定 全部采用15mL玻璃培养瓶为培养基质,同一批号小牛血清(上海浦东生物材料厂)含量100g3.L-1,每3d更换培养液1次,量为4mL,将1只黑兔2只眼获得的睫状体上皮接种入1瓶。选取瓶中初始直径为0.5mm的组织片作上记号并记录2片4个方向的生长晕边缘半径转换为面积,记录接种后3~10d,每种培养液测量3瓶。1.3 超微结构观察 用25g.L-1戊二醛固定培养前后的CPE,10g.L-1锇酸后固定,包埋后作60~80nm的超薄切片,用透射电镜(Opton FM 10cr)观察拍照。
2 结果
2.1 CPE在不同培养液中的生长 CPE在各种培养液中的面积增长见图1。细胞在RPMI-1640培养液中生长最快,其次为DMEM培养液,DMEM和F12的混合培养液在早期有促进生长作用。

, 百拇医药
Figure 1 Growth area of pigmented ciliary epithelia cultured in different media
细胞在不同营养液中增长面积
2.2 培养前后的CPE超微结构特点 CPE培养后,其平均直径由8~10nm增加到20~30nm,呈上皮样或成纤维细胞样2种形态。细胞经培养后下列结构增多:表面微绒毛、线粒体、粗面内浆网、高尔基器、核糖体以及细胞骨架中的微管。培养前后的CPE细胞均可见典型的上皮细胞连接:桥粒连接和缝隙连接。培养后的CPE细胞黑色素颗粒减少(见图2~3)。

Figure 2 More ribosomes(R) and reticulae in cultured ciliary pigmented epithelia,TEM×16 000
, 百拇医药
培养的CPE细胞可见大量核糖体(R)和内质网,透射电镜×16 000。

Figure 3 Clear membrane of neuclear(N),Less granules of melanin(P) and more mitochondia(M) in cultured ciliary pigmented epithelial cell,TEM×16 000
体外培养的CPE核膜清晰,色素(P)减少,线粒体(M)增多,透射电镜×16 000
3 讨论
3.1 培养液的选择及其意义 近10a来国外开展CPE细胞培养选用的培养液主要有:DMEM、F12、F10、M199、RPMI-1640、DMEM、L-15加入不同浓度的小牛血清可以培养出多种动物的CPE[3~5],但成功率(54%)不高。因培养的CPE为贴壁生长而非悬浮生长,故本实验采用测定组织片生长面积方法来观察细胞生长情况。该方法与氚标放射测定相比,不仅可以测定细胞的增殖,而且还可以观察细胞的移动能力。曲线表明:CPE细胞在RPMI-1640培养液中生长移动最快。该培养液起初是针对淋巴细胞设计的,含有全部的必需氨基酸且含量较高,细胞合成核酸和蛋白质的谷氨酰胺含量也较高,能适用多种细胞培养的要求。用DMEM培养CPE时,细胞生长仅次于RPMI-1640,其生长形态呈上皮样居多。DMEM同RPMI-1640一样具有成分简单的特点,含有高糖和高浓度的谷氨酰胺,可能对合成维持细胞形态的骨架系统有利。F12氨基酸成分含量少,增加了Cu2+,Zn2+等一些微量元素,观察表明对该细胞的生长并无促进作用。DMEM与F12的等量混合培养液只在早期对CPE具有一定的生长刺激作用。M199是问世最早,含有69种复杂成分的培养基,但其比例并不适合CPE生长的要求,观察结果效果最差[6]。
, http://www.100md.com
3.2 CPE细胞培养前后形态变化的意义 培养后的CPE最显著的变化是黑色素减少,可能是培养液中某些营养物质的缺乏或细胞本身酪氨酸蛋白激酶活性降低所致[7]。培养后的CPE平均直径增加,具有丰富的细胞器,表明细胞功能活跃。
培养前后的CPE细胞均可见到桥粒连接、缝隙连接和相似的微绒毛,且已有实验证明培养的CPE具有与青光眼密切相关的碳酸酐酶及其同功酶系统[8],因此本实验培养液的选择和形态观察将有助于CPE的体外高效培养和促进房水分泌等基础研究。
作者简介:熊新春,男,1966年生,湖北枝江市人,1995年毕业于同济医科大学,获医学博士学位。硕士和博士学位攻读方向为眼科青光眼,率先在国内开展睫状体色素上皮细胞的培养并获得成功。同时还进行了干扰素类药物作为青光眼滤过术后辅助用药的实验研究。1997年赴德国柏林自由大学进行博士后研究1年,主要从事受体介导的细胞内信号转导的研究。现在同济医科大学附属协和医院眼科任主治医师、讲师。电话:027-85726081
, http://www.100md.com
Accepted for publication Apr 20,1998
From the Department of Ophthalmology,Xiehe Hospital,Tongji Medical University,Wuhan 430020,Hubei Province,China
参考文献
1 Helbig H,Korbmacher C,Nawrath M,et al.Sodium bicarbonate cotransport in cultured pigmented ciliary epithelial cells.Curr Eye Res 1989;8∶595-598.
2 熊新春,杜蜀华,张 泺.人、兔睫状色素上皮细胞的体外培养.眼科 1994;3(2)∶114-117.
, http://www.100md.com
3 Kondo K,Coca-Prados M,Sears ML.Ciliary epithelial of the mammalian eye in cultured explant.Cell Tissue Res 1983;233∶629-638.
4 Helbig H,Korbmacher C,Wohlfarth J,et al.Electrogenic Na+-ascorbate cotransport in cultured bovine pigmented ciliary epithelial cells.Am J Physiol 1989;156∶44-49.
5 Runyan TE,Mccombs WB,Holton CD,et al.Human ciliary body epithelial in culture.Invest Ophthalmol Vis Sci 1983;24∶687-696.
, http://www.100md.com
6 鄂征.组织培养和分子细胞学技术.第2版.北京:北京出版社 1997∶28-31.
7 Helbig H.K+ conductance and electrogenic Na+/K+ transport of cultured bovine pigmented ciliary epithelium.J Membrane Biol 1987;99∶173-186.
8 Helbig H,Korbmacher C,Erb C,et al.Coupling of 22 Na and 38 Cl uptake in cultured pigmented ciliary epithelial cells:a proposed role for the isoenzymes of carbonic anhydrase.Curr Eye Res 1989;8∶1111-1119.
收稿 1998-04-20 修回 1998-06-18, http://www.100md.com