热损伤诱导单核细胞株Raw264.7细胞p38蛋白激酶的转位
作者:张璐 张琳 姜勇 赵克森
单位:
关键词:热损伤;p38蛋白激酶;转位
热损伤诱导单核细胞株Raw264
【摘 要】 目的 探讨p38通路在热损伤刺激细胞中的特异性传导作用。方法 应用共聚焦激光扫描技术观察热损伤刺激前后p38蛋白激酶在单核细胞株Raw264.7中的分布特征。结果 未受刺激的细胞中,p38在胞浆和胞核中荧光强度呈弥散性分布;热损伤作用5 min后,细胞核区的荧光强度即明显增强,而胞浆区域的荧光强度降低。结论 单核细胞株受热损伤刺激激活后,其p38蛋白激酶由胞浆转位到胞核。
【中图号】 R454.5
Translocation of p38 mitogen-activated protein kinase in Raw264.7
, http://www.100md.com
cells on the stimulation of heating
ZHANG Lu,ZHANG Lin,JIANG Yong,et al.
Key Lab for Shock and Microcirculation of PLA and Experimental Center,First Military Medical University ,Guangzhou 510515
【Abstract】 Objective To elucidate the mechanism of specific signal transduction of p38 MAPK.Methods Confocal laser scan technique was used to check the distribution of p38 MAPK in monocytic cell line Raw264.7 before and after heating.Results It was found that p38 labeled with fluorescence spreaded all over the cytosol and nuclear in the rest cells , while the fluorescent intensity in the cytosol area decreased and the fluorescent intensity in the nuclear area increased markedly 5 minutes after heating.Conclusion p38 MAPK moved to the nuclear of Raw264.7 on the stimulation of heating.
, 百拇医药
【Key Words】 Heating p38 mitogen-activated protein kinase Translocation
蛋白质的磷酸化与去磷酸化作为传递外界各种信息的重要传导机制,在细胞的生物学活动中起重要作用。一系列的蛋白激酶及其磷酸化活化构成了信号传导级联反应。丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)信号通路是近年来研究引人注目的蛋白激酶级联通路。p38蛋白激酶通路是其目前已确定的四条通路之一。该通路参与了细胞生长、发育、分裂及细胞间的功能同步等多种细胞过程。业已证明,在外界应激刺激,如热损伤、UV、高渗、炎性因子等作用下,p38蛋白激酶被磷酸化活化,并通过磷酸化活化转录因子调控特定基因的表达,从而将信号从细胞外传导到细胞核[1,2]。p38蛋白激酶在细胞中的定位有助于阐明其特异性传导机制。但迄今,这方面的研究鲜有报道。热损伤作为一项外界应激刺激,其对组织细胞产生的生物学效应已有广泛的研究,近年来热损伤诱导细胞凋亡的研究引人注目。我们拟对p38 通路在热损伤诱导凋亡中的作用进行系列研究。本研究应用激光扫描共聚焦显微镜,观察热损伤作用前后p38蛋白激酶在单核细胞株Raw264.7中的分布与移位,探讨p38通路在热损伤刺激中的特异性传导机制。
, http://www.100md.com
1 材 料 与 方 法
1.1 实验仪器和材料
激光扫描共聚焦显微镜ACAS570、35 mm Petri细胞培养皿(美国Meridian Instrument产品);鼠抗人p38 IgG、单核细胞株Raw264.7(美国The Scripps Research Institute J.Han 教授馈赠);羊抗鼠FITC-IgG(军事医学科学院产品)。
1.2 单核细胞株Raw264.7的培养及分组
用质量浓度为0.25%的胰酶消化对数生长期的单核细胞株Raw264.7,用DMEM完全培养基调节细胞浓度为1×106/ml,接种于Petri皿中。实验分四组:第1组细胞为热损伤刺激(43 ℃水浴,5 min);第2组细胞为热损伤刺激(43 ℃水浴,30 min),第3组细胞为不加任何刺激的阴性对照组;第4组细胞为不加单抗的空白对照组。
, 百拇医药
1.3 抗原抗体反应
用PBS(pH7.2)于 4℃清洗细胞两遍。固定液(质量浓度1%多聚甲醛+质量浓度0.025%戊二醛)固定2 h,PBS洗5 min,放入湿盒,滴加稀释的p38单抗(1∶2 000),4 ℃过夜。PBS振动洗涤10 min,加入FITC标记的羊抗鼠IgG二抗,于37 ℃湿盒避光孵育30~60 min,吸出染液,PBS冲洗10 min,Petri皿底留少许缓冲液待测。
1.4 激光扫描共聚焦显微镜检测
ACAS570型激光扫描共聚焦显微镜包括倒置显微镜、共聚焦激光扫描器和计算机图像分析仪,能对生物样品的任何一点进行非侵入式断层扫描,获得细胞内任意层面的荧光图像,可通过计算机对图像进行三维立体重组和数据分析处理。将荧光标记的细胞置于该系统倒置显微镜的载物台上,选择适当的参数对细胞进行激光断层扫描。
, http://www.100md.com 2 结 果
2.1 p38蛋白激酶在细胞中分布的大体扫描观察
培养状态的单核细胞株,细胞生长良好,呈梭形或多角形,胞浆致密呈颗粒状或网状,胞核圆形,颜色较深。对多个细胞进行整体扫描观察发现,热损伤刺激前p38蛋白激酶在细胞中均匀弥散分布;而热刺激5 min后荧光强度呈点状局部增强,向细胞中心集中;热刺激30 min荧光强度局部增强更加明显。空白对照组胞质内无荧光,说明该荧光探针间接与胞内抗原结合(图1)。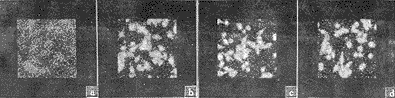
a 空白对照组 b 阴性对照组 c 热损伤刺激 30min d 热损伤刺激 5min
图1 单核细胞株 Raw264.7单激发波长大体扫描图
, http://www.100md.com
2.2 p38蛋白激酶在细胞中分布的断层扫描观察
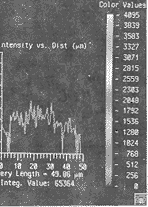
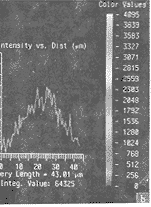
接着用SFP(simulated fluorescence process)法对热刺激前与热刺激30 min 的细胞进行重组,并确定细胞内荧光强度曲线分布。结果显示,未受刺激的细胞,p38散在性均匀性分布(图2a);而热损伤刺激30 min的细胞,p38向核区集中,致使核区荧光亮度增强,胞浆区荧光强度减弱,p38分布曲线呈峰形(图2b),提示p38在胞核区明显增加。

, 百拇医药
a 阴性对照组 b 热损伤刺激组
图2 SFP方法重组的细胞内三维荧光图像及断层荧光含量的分布曲线
3 讨 论
迄今,真核细胞中,已确定出4条MAPK信号传导通路,即细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路、p38通路及ERK5通路。它们参与了细胞生长、发育、分裂及细胞间的功能同步等多种生理过程,并在细胞恶性转化等病理过程中起重要作用。MAPK可调节细胞浆靶物质,但其主要功效是将信号从细胞外传导到细胞核,通过磷酸化活化转录因子而调控特定基因的表达。
p38蛋白激酶包括p38α、p38β、p38γ、p38δ,这些亚型之间具有不同上游激酶和下游底物选择性[3-5]。现普遍认为激活的MAPK进入细胞,激活有关的转录因子,使相关基因表达,这是MAPK介导细胞反应的重要机制之一。已知p38α的下游底物包括:转录因子CHOP10[6],MEF2C[7],SAP1[8]等,而四种亚型皆可磷酸化活化ATF2[9]。已知p38通路参与了炎症、应激等病理生理反应,并有研究报道这条通路调节着细胞凋亡过程。
, 百拇医药
本研究应用激光共聚焦显微镜观察热损伤前后p38在单核细胞株中的分布特征,发现未受刺激的细胞,其荧光强度呈弥散性分布,胞浆和胞核中的荧光强度分布均衡;而热损伤刺激的细胞,细胞核荧光强度明显增强,细胞浆荧光强度降低,这种现象在热损伤5 min即可以观察到,并且在30 min细胞核荧光强度增强趋势更加明显,这提示p38蛋白激酶在未激活前散在、均匀性地分布于细胞中;而热损伤作用后,其p38迅速由胞浆移位到胞核。
我们已证实热损伤可以诱导单核细胞株Raw264.7凋亡。本实验观察到p38在热损伤作用下由胞浆转位到细胞核,提示p38被激活。p38蛋白激酶是否参与热损伤诱导凋亡的调控及其激活后入核对细胞凋亡是否有意义,目前正在研究之中。
参 考 文 献
1 Seger R,Krebs EG.The MAPK signaling cascade.FASEB J,1995,9:726-735.
, 百拇医药
2 Han J,Lee JD,Bibbs L,et al.A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells.Science,1994,265:808-811.
3 Jiang Y,Chen C,Li Z,et al.Characterization of the structure and function of a new mitogen-activated protein kinase(p38β).J Biol Chem,1996,271:17920-17926.
4 Li Z,Jiang Y,Ulevitch RJ,et al.The primary structure of p38 gamma:a new member of p38 group of MAP kinase.Biochem Biophys Res Comm,1996,228:334-340.
, http://www.100md.com
5 Jiang Y,Gram H,Padova FD,et al.Characterization of the structure and function of the fourth member of p38 group MAP kinases-p38 delta.J Biol Chem,1997,272:30122-30128.
6 Wang XZ,Ron D.Stress-induced phosphorylation and activation of the transcription factor CHOP by p38 MAP kinase.Science,1996,272:1347-1349.
7 Han J,Jiang Y,Li Z,et al.Activation of the transcription factor MEF2C by thr MAP kinase p38 in inflammation.Nature,1997,386:296-299.
, http://www.100md.com
8 Janknecht R,Hunter T.Convergence of MAP kinase pathways on the ternary complex factor Sap-1a.EMBO J,1997,16:1620-1627.
9 Goedert M,Cuenda A,Craxton M,et al.Activation of the novel stress-activated protein kinase SAPK4 cytokines and cellular stresses is mediated by SKK3:comparison of its substrate specificity with that of other SAP kinase.EMBO J,1997,16:3563-35710.
10 Huang S,Jiang Y,Li Z,et al.Apoptosis signaling pathway in T cells is composed of ICE/Ced-3 family proteases and MAP kinase kinase 6b.Immunity,1997,6:739-749.
(收稿 1998-07-01 修回 1999-05-01), 百拇医药
单位:
关键词:热损伤;p38蛋白激酶;转位
热损伤诱导单核细胞株Raw264
【摘 要】 目的 探讨p38通路在热损伤刺激细胞中的特异性传导作用。方法 应用共聚焦激光扫描技术观察热损伤刺激前后p38蛋白激酶在单核细胞株Raw264.7中的分布特征。结果 未受刺激的细胞中,p38在胞浆和胞核中荧光强度呈弥散性分布;热损伤作用5 min后,细胞核区的荧光强度即明显增强,而胞浆区域的荧光强度降低。结论 单核细胞株受热损伤刺激激活后,其p38蛋白激酶由胞浆转位到胞核。
【中图号】 R454.5
Translocation of p38 mitogen-activated protein kinase in Raw264.7
, http://www.100md.com
cells on the stimulation of heating
ZHANG Lu,ZHANG Lin,JIANG Yong,et al.
Key Lab for Shock and Microcirculation of PLA and Experimental Center,First Military Medical University ,Guangzhou 510515
【Abstract】 Objective To elucidate the mechanism of specific signal transduction of p38 MAPK.Methods Confocal laser scan technique was used to check the distribution of p38 MAPK in monocytic cell line Raw264.7 before and after heating.Results It was found that p38 labeled with fluorescence spreaded all over the cytosol and nuclear in the rest cells , while the fluorescent intensity in the cytosol area decreased and the fluorescent intensity in the nuclear area increased markedly 5 minutes after heating.Conclusion p38 MAPK moved to the nuclear of Raw264.7 on the stimulation of heating.
, 百拇医药
【Key Words】 Heating p38 mitogen-activated protein kinase Translocation
蛋白质的磷酸化与去磷酸化作为传递外界各种信息的重要传导机制,在细胞的生物学活动中起重要作用。一系列的蛋白激酶及其磷酸化活化构成了信号传导级联反应。丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)信号通路是近年来研究引人注目的蛋白激酶级联通路。p38蛋白激酶通路是其目前已确定的四条通路之一。该通路参与了细胞生长、发育、分裂及细胞间的功能同步等多种细胞过程。业已证明,在外界应激刺激,如热损伤、UV、高渗、炎性因子等作用下,p38蛋白激酶被磷酸化活化,并通过磷酸化活化转录因子调控特定基因的表达,从而将信号从细胞外传导到细胞核[1,2]。p38蛋白激酶在细胞中的定位有助于阐明其特异性传导机制。但迄今,这方面的研究鲜有报道。热损伤作为一项外界应激刺激,其对组织细胞产生的生物学效应已有广泛的研究,近年来热损伤诱导细胞凋亡的研究引人注目。我们拟对p38 通路在热损伤诱导凋亡中的作用进行系列研究。本研究应用激光扫描共聚焦显微镜,观察热损伤作用前后p38蛋白激酶在单核细胞株Raw264.7中的分布与移位,探讨p38通路在热损伤刺激中的特异性传导机制。
, http://www.100md.com
1 材 料 与 方 法
1.1 实验仪器和材料
激光扫描共聚焦显微镜ACAS570、35 mm Petri细胞培养皿(美国Meridian Instrument产品);鼠抗人p38 IgG、单核细胞株Raw264.7(美国The Scripps Research Institute J.Han 教授馈赠);羊抗鼠FITC-IgG(军事医学科学院产品)。
1.2 单核细胞株Raw264.7的培养及分组
用质量浓度为0.25%的胰酶消化对数生长期的单核细胞株Raw264.7,用DMEM完全培养基调节细胞浓度为1×106/ml,接种于Petri皿中。实验分四组:第1组细胞为热损伤刺激(43 ℃水浴,5 min);第2组细胞为热损伤刺激(43 ℃水浴,30 min),第3组细胞为不加任何刺激的阴性对照组;第4组细胞为不加单抗的空白对照组。
, 百拇医药
1.3 抗原抗体反应
用PBS(pH7.2)于 4℃清洗细胞两遍。固定液(质量浓度1%多聚甲醛+质量浓度0.025%戊二醛)固定2 h,PBS洗5 min,放入湿盒,滴加稀释的p38单抗(1∶2 000),4 ℃过夜。PBS振动洗涤10 min,加入FITC标记的羊抗鼠IgG二抗,于37 ℃湿盒避光孵育30~60 min,吸出染液,PBS冲洗10 min,Petri皿底留少许缓冲液待测。
1.4 激光扫描共聚焦显微镜检测
ACAS570型激光扫描共聚焦显微镜包括倒置显微镜、共聚焦激光扫描器和计算机图像分析仪,能对生物样品的任何一点进行非侵入式断层扫描,获得细胞内任意层面的荧光图像,可通过计算机对图像进行三维立体重组和数据分析处理。将荧光标记的细胞置于该系统倒置显微镜的载物台上,选择适当的参数对细胞进行激光断层扫描。
, http://www.100md.com 2 结 果
2.1 p38蛋白激酶在细胞中分布的大体扫描观察
培养状态的单核细胞株,细胞生长良好,呈梭形或多角形,胞浆致密呈颗粒状或网状,胞核圆形,颜色较深。对多个细胞进行整体扫描观察发现,热损伤刺激前p38蛋白激酶在细胞中均匀弥散分布;而热刺激5 min后荧光强度呈点状局部增强,向细胞中心集中;热刺激30 min荧光强度局部增强更加明显。空白对照组胞质内无荧光,说明该荧光探针间接与胞内抗原结合(图1)。

a 空白对照组 b 阴性对照组 c 热损伤刺激 30min d 热损伤刺激 5min
图1 单核细胞株 Raw264.7单激发波长大体扫描图
, http://www.100md.com
2.2 p38蛋白激酶在细胞中分布的断层扫描观察
接着用SFP(simulated fluorescence process)法对热刺激前与热刺激30 min 的细胞进行重组,并确定细胞内荧光强度曲线分布。结果显示,未受刺激的细胞,p38散在性均匀性分布(图2a);而热损伤刺激30 min的细胞,p38向核区集中,致使核区荧光亮度增强,胞浆区荧光强度减弱,p38分布曲线呈峰形(图2b),提示p38在胞核区明显增加。




, 百拇医药
a 阴性对照组 b 热损伤刺激组
图2 SFP方法重组的细胞内三维荧光图像及断层荧光含量的分布曲线
3 讨 论
迄今,真核细胞中,已确定出4条MAPK信号传导通路,即细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路、p38通路及ERK5通路。它们参与了细胞生长、发育、分裂及细胞间的功能同步等多种生理过程,并在细胞恶性转化等病理过程中起重要作用。MAPK可调节细胞浆靶物质,但其主要功效是将信号从细胞外传导到细胞核,通过磷酸化活化转录因子而调控特定基因的表达。
p38蛋白激酶包括p38α、p38β、p38γ、p38δ,这些亚型之间具有不同上游激酶和下游底物选择性[3-5]。现普遍认为激活的MAPK进入细胞,激活有关的转录因子,使相关基因表达,这是MAPK介导细胞反应的重要机制之一。已知p38α的下游底物包括:转录因子CHOP10[6],MEF2C[7],SAP1[8]等,而四种亚型皆可磷酸化活化ATF2[9]。已知p38通路参与了炎症、应激等病理生理反应,并有研究报道这条通路调节着细胞凋亡过程。
, 百拇医药
本研究应用激光共聚焦显微镜观察热损伤前后p38在单核细胞株中的分布特征,发现未受刺激的细胞,其荧光强度呈弥散性分布,胞浆和胞核中的荧光强度分布均衡;而热损伤刺激的细胞,细胞核荧光强度明显增强,细胞浆荧光强度降低,这种现象在热损伤5 min即可以观察到,并且在30 min细胞核荧光强度增强趋势更加明显,这提示p38蛋白激酶在未激活前散在、均匀性地分布于细胞中;而热损伤作用后,其p38迅速由胞浆移位到胞核。
我们已证实热损伤可以诱导单核细胞株Raw264.7凋亡。本实验观察到p38在热损伤作用下由胞浆转位到细胞核,提示p38被激活。p38蛋白激酶是否参与热损伤诱导凋亡的调控及其激活后入核对细胞凋亡是否有意义,目前正在研究之中。
参 考 文 献
1 Seger R,Krebs EG.The MAPK signaling cascade.FASEB J,1995,9:726-735.
, 百拇医药
2 Han J,Lee JD,Bibbs L,et al.A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells.Science,1994,265:808-811.
3 Jiang Y,Chen C,Li Z,et al.Characterization of the structure and function of a new mitogen-activated protein kinase(p38β).J Biol Chem,1996,271:17920-17926.
4 Li Z,Jiang Y,Ulevitch RJ,et al.The primary structure of p38 gamma:a new member of p38 group of MAP kinase.Biochem Biophys Res Comm,1996,228:334-340.
, http://www.100md.com
5 Jiang Y,Gram H,Padova FD,et al.Characterization of the structure and function of the fourth member of p38 group MAP kinases-p38 delta.J Biol Chem,1997,272:30122-30128.
6 Wang XZ,Ron D.Stress-induced phosphorylation and activation of the transcription factor CHOP by p38 MAP kinase.Science,1996,272:1347-1349.
7 Han J,Jiang Y,Li Z,et al.Activation of the transcription factor MEF2C by thr MAP kinase p38 in inflammation.Nature,1997,386:296-299.
, http://www.100md.com
8 Janknecht R,Hunter T.Convergence of MAP kinase pathways on the ternary complex factor Sap-1a.EMBO J,1997,16:1620-1627.
9 Goedert M,Cuenda A,Craxton M,et al.Activation of the novel stress-activated protein kinase SAPK4 cytokines and cellular stresses is mediated by SKK3:comparison of its substrate specificity with that of other SAP kinase.EMBO J,1997,16:3563-35710.
10 Huang S,Jiang Y,Li Z,et al.Apoptosis signaling pathway in T cells is composed of ICE/Ced-3 family proteases and MAP kinase kinase 6b.Immunity,1997,6:739-749.
(收稿 1998-07-01 修回 1999-05-01), 百拇医药