外源性同型半胱氨酸对肾小球系膜细胞的影响
作者:李健 李晓玫 王海燕
单位:北京医科大学第一医院肾内科 北京医科大学肾脏病研究所(北京,100034)
关键词:同型半胱氨酸;系膜细胞;肾脏
肾脏病与透析肾移植杂志990309
摘 要 目的:研究外源性同型半胱氨酸对体外培养的肾小球系膜细胞增殖、表型转化和产生细胞外基质的影响。方法:采用放射性同位素测定3H-TdR掺入和细胞外信号调节激酶活性,流式细胞仪分析细胞周期,Western blot方法进行α-平滑肌肌动蛋白检测,ELISA方法检测细胞上清液中细胞外基质含量。结果:不同浓度的同型半胱氨酸(0.005,0.05,0.5和1.0mmol/L)不同作用时间(8,16和24 h)对肾小球系膜细胞、细胞外信号调节激酶活性、α-平滑肌肌动蛋白表达和分泌型纤粘连蛋白、层粘连蛋白产生无明显作用。结论:同型半胱氨酸对体外培养的肾小球系膜细胞增殖、表型转化和细胞外基质产生无明显影响。
, 百拇医药
EFFECTS OF EXOGENOUS HOMOCYSTEINE ON RENAL MESANGIALS CELLS
Li Jian,Li Ziaomei,Wang Haiyan
(Institute of Nephrology,the First Teaching Hospital,Beijing Medical University,Beijing 100034)
OBJECTIVE To study the effect of exogenous homocysteine(HCY)on proliferation,phenotype change and extracellular matrix production of cultured rat glomerular mesangial cells(MC).
, 百拇医药
METHODOLOGY Rat mesangial cells was treated by exogenous HCY.3H-TdR incoporation and the activity of extracellular signal-regulated kinase(ERK)were assayed with isotopic methods,cell cycle analysed by flow cytometry.The expression of α-smooth muscle actin(α-SM actin)was detected by Western blot.Fibronectin(FN)and laminin(LN)in supernatant of culture media were assayed by inhibition ELISA methods.
RESULTS No effect on MC 3H-TdR incoporation(1733±308~1849±448 vs control 1709±368,P>0.05)was found when HCY incubated with MC at different concentrations(0.005,0.05,0.5 and 1.0 mmol/L)or of different time courses(8,16 and 24 hours).The activity of extracellular signal-regulated kinase(ERK)were not increased(246±47~404±137 vs control 362+91,P>0.05)。When cells were treated with 0.5mmol/L HCY at 2 to 60 minutes.cell cycles detected by flow cytometry were not changed by HCY at different concentrations.α-SM actin expression was not enhanced by HCY detected by Western blot.FN and LN in supernatant of culture media were not affected when mesangial cells incubated with HCY at the concentration of 0.5mmol/L.
, http://www.100md.com
CONCLUSION HCY has no effects on proliferation,phenotype and ECM production of MC.
Key words homocysteine kidney mesangial cells
同型半胱氨酸(Homocysteine,HCY)是蛋氨酸循环的中间产物,属含硫氨基酸。实验研究和临床观察表明,血浆中HCY升高可引起动脉粥样硬化和血栓形成,是一种独立致病的危险因素[1,2]。近年研究又发现,HCY可刺激大鼠血管平滑肌增殖和胶原合成增加[3,4]。在多数慢性肾功能不全患者中也存在高HCY血症[5],但是它在肾脏进行性病变中的作用目前仍不清楚。基于肾小球系膜细胞(MC)具有血管平滑肌细胞特性和其在肾小球硬化病变中的重要地位,我们观察HCY对MC生长、表型转化以及产生细胞外基质的作用和可能存在的机制。
, http://www.100md.com
1 材料和方法
1.1 材料来源 纯种SD大鼠由北京医科大学实验动物中心提供。HCY,髓碱性磷酸酶(MBP)和各种蛋白酶抑制剂购自Sigma公司。小鼠抗α-SM actin单克隆抗体购自Boehringer Bannheim公司,ECL Kit购自Du Pont公司。γ-32P-ATP购自北京亚辉公司。
1.2 方法
1.2.1 MC培养 取雄性SD大鼠双肾,以本研究所建立方法[6]培养MC,用20%胎牛血清的RPMI 1640培养液培养及传代。血管平滑肌细胞(VSMC)来源于Wistar-Kyoto大鼠,培养液同MC,VSMC由北京医科大学第一临床医学院心血管疾病研究所唐朝枢教授惠赠。
1.2.2 3H-TdR掺入试验 将1×107/L细胞悬液接种于96孔板内,加20%胎牛血清的RPMI 1640培养液培养48h,换用0.5%血清的RPMI 1640培养液培养24h,使细胞同步化于静止期,然后加入HCY(0.005、0.05、0.5、1.0mmol/L),空白对照只加培养液,不加HCY。另外,以20%胎牛血清的RPMI 1640培养液刺激细胞,作为细胞反应状况的对照。培养结束前8h每孔内加入3H-TdR(终浓度1mCi/L)。实验结束时加入冷PBS终止反应,用ZT-Ⅲ型多头细胞收集器收获细胞于49型玻璃纤维滤膜上。LKB1209型液闪计数仪计数,以每分钟计数率(min-1)反映MC增殖状态。采用噻唑蓝(MTT)方法及乳酸脱氢酶(LDH)释放试验观察不同浓度HCY对MC活力的影响。
, http://www.100md.com
1.2.3 细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)活性测定 参照Kribben等[7]及本室方法[8]进行。过程如下:细胞经0.5%血清的RPMI 1640培养液培养24h,使细胞同步化于静止期。加入HCY 0.5mmol/L孵育2、5、10、30和60min,随后细胞经裂解、离心后提取酶样品,考马斯亮蓝方法测定样品蛋白含量。ERK活性根据对其特异性底物MBP的磷酸化作用测定。反应体系中含MgCl2 12.5mmol/L,蛋白酶抑制剂50mg/L,MBP 1g/L和γ-32P-ATP 50μmol/L,水浴摇床30℃反应15min后以25%三氯醋酸终止反应。取25μl反应终产物点于P81磷酸纤维素膜上,经75mmol/L磷酸洗膜并干燥后于液闪仪上测定放射活性。ERK活性用pmol/min.mg蛋白表示。样本均为双管重复测定,同一实验重复3次。
, 百拇医药
1.2.4 细胞周期分析 同步化于静止期的MC与HCY共孵育后,PI染色,流式细胞仪分析细胞各周期,采用机器附带软件进行数据处理。
1.2.5 α-型平滑肌肌动蛋白(α-SM actin)检测 采用小鼠抗α-SM actin单克隆抗体,Western blot方法进行测定[9]。
1.2.6 培养细胞上清液中纤粘连蛋白(Fibronectin,FN)和层粘连蛋白(Laminin,LN)检测 以间接竞争抑制酶联免疫吸附(ELISA)方法测定[10]。
1.3 统计学处理 实验结果以(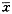 +s)表示,组间比较采用方差分析。
+s)表示,组间比较采用方差分析。
2 结果
, 百拇医药
2.1 HCY对MC增殖的影响 HCY对MC增殖的影响如表1,表2所示。各浓度HCY作用24h或HCY 0.5mmol/L作用8、16、24h均不能增加MC 3H-TdR掺入率。同时以血管平滑肌细胞(VSMC)作为阳性对照时,不同浓度HCY可显著增加3H-TdR在VSMC中的掺入量。当用20%胎牛血清的RPMI 1640培养液刺激细胞时,呈现良好反应状态。
表1 不同浓度HCY对MC及VSMC 3H-TdR掺入的影响(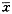 ±s) HCY浓度
±s) HCY浓度
MC(min-1)
VSMC(min-1)
0
, http://www.100md.com
1709±368*
815±117#
0.005
1810±318
1071±126
0.05
1822±191
1131±115
0.5
1849±448
1444±229
1.0
, 百拇医药
1733±308
1274±114
*与各浓度比较P>0.05 #与各浓度比较P<0.05
表2 HCY 0.5 mmol/L孵育不同时间对MC 3H-TdR掺入的影响(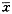 ±s) 作用时间(h)
±s) 作用时间(h)
3H-TdR(min-1)
8
1837±481
16
1931±292
, 百拇医药
24
1806±683*
*与各时间点比较P>0.05
HCY 1.0 mmol/L和2.0 mmol/L分别与MC孵育36h,用MTT显色后测定光密度(A值),HCY 1.0 mmol/L组(0.35±0.01)与对照组(0.35±0.014)间差异不明显(P>0.10),而HCY 2.0mmol/L组(0.293±0.008)则显著低于对照组(0.35±0.014)(P<0.05),表明该浓度引起细胞活力下降或数量减少。HCY 1.0 mmol/L组的LDH释放率(15.1%)与对照组(17.5%)间差异不明显。
2.2 HCY对MC ERK活性的影响 HCY 0.5mmol/L与MC孵育2、5、10、30及60min后测定ERK活性,各个时间点之间以及和对照组间MC的ERK活性无明显差异。而同时以血小板来源生长因子(PDGF)10μg/L作为阳性对照进行ERK活性测定时,MC细胞ERK活性明显升高,表明MC细胞具有良好的反应性,结果见表3。
, 百拇医药
表3 HCY对ERK活性的影响(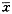 +s) 作用时间
+s) 作用时间
(min)
ERK活性(pmol/min.protein)
HCY
PDGF
0
362±91*
2
324±46
-
5
, http://www.100md.com
404±137
513±47#
10
286±75
611±45#
30
258±93
532±35#
60
246±47
-
*与HCY各时间点比较P>0.05 #与基础状态时比较P<0.05
, 百拇医药
2.3 HCY对MC细胞周期的影响 HCY 0.05、0.5和1.0mmol/L与MC共孵育24h,PI染色后分析细胞周期,细胞各周期比例无明显变化。结果见表4。
表4 HCY对MC细胞周期的影响(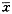 +s) HCY(mmol/L)
+s) HCY(mmol/L)
G0-G1(%)
S(%)
G2-M(%)
0
75.92±1.16*
8.76±2.31*
, http://www.100md.com
0.31±1.86*
0.05
72.41±2.15
8.01±1.54
19.58±0.61
0.5
70.77±2.64
9.09±2.71
20.44±0.24
1.0
72.91±1.16
6.96±1.52
, 百拇医药
19.83±0.66
*与各浓度比较P>0.05
2.4 HCY对MC α-SM actin蛋白质产生的影响 HCY 0.5mmol/L与MC共孵育6、12、18、24和36h,标志MC表型改变的α-SM actin蛋白[11]有一定基础表达量,但是HCY刺激时间点与各自未予以HCY刺激的对照比较时,α-SM actin蛋白表达未见明显升高(见附图)。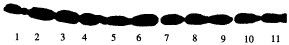
附图 MC受HCY刺激前、后不同时间处理组与相应对照α-SM actin蛋白质表达情况
1为对照组,2、3为6h刺激与对照组,4、5,6、7,8、9和10、11分别为12h、18h、24h和36h的刺激与对照组。
, http://www.100md.com
2.5 HCY对MC产生FN和LN的影响 HCY 0.5mmol/L与MC共孵育2、4、6、8天,分别测定细胞上清液中FN、LN含量无明显增加,结果见表5。
表5 HCY对MC产生FN及LN的影响(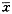 6±s,A值) HCY作用
6±s,A值) HCY作用
时间(天)
对照组
刺激组
FN
LN
FN
LN
, http://www.100md.com 2
0.42±0.17
0.51±0.18
0.45±0.18
0.51±0.05
4
0.49±0.22
0.45±0.08
0.49±0.11
0.52±0.07
6
0.50±0.17
, 百拇医药
0.55±0.08
0.44±0.13
0.55±0.11
8
0.52±0.16
0.50±0.05
0.47±0.17
0.52±0.11*
*与各时间点及对照组比较P>0.05
3 讨论
HCY作为蛋氨酸代谢过程中的一个重要产物,已被实验研究和临床观察证实是一种引起动脉粥样硬化病变的独立危险因素。以往采用体外培养内皮细胞开展的研究发现,HCY不但具有细胞毒性作用[12]而且可导致内皮细胞功能紊乱[13]。90年代中期以来的研究结果又进一步表明,HCY能够刺激VSMC增殖和胶原成分产生增加[3,4]。因此,HCY在动脉粥样硬化病变发生机制中的作用倍受人们关注。以往的临床观察已经证实,慢性肾功能衰竭患者多数有HCY水平升高,并且也被认为是此类患者产生心血管并发症的独立危险因素之一[14]。作为慢性肾功能衰竭主要病理改变的肾小球硬化过程是否也遭受高HCY血症的影响,迄今仍无公开的研究报道。由于肾小球MC不但具有平滑肌细胞的部分特性,而且又是肾小球病变的主要参与者,因此HCY是否能够导致MC生长和功能变化值得探讨。
, 百拇医药
本研究中,HCY不同浓度及不同作用时间与MC共孵育时,3H-TdR掺入和细胞周期无明显变化,该结果提示,HCY无促进MC DNA合成的效应。ERK作为细胞外信号引起细胞增殖反应的细胞内信号传递共同通路或汇聚点的丝裂素活化蛋白激酶[15]亚类之一,其活性在本实验中亦未受影响,进一步表明HCY不促进MC增殖。为确定HCY的有效性和MC的反应性,我们以VSMC及PDGF分别作为阳性对照进行研究,结果显示:本实验条件下,HCY能够呈剂量依赖性地促进VSMC 3H-TdR掺入,PDGF可使MC ERK活性显著增高,这些结果均具有显著的统计学差异(P值均<0.05),表明HCY有效,MC反应状态良好。
本研究中,HCY未引起MC出现类似于VSMC的促增殖效应[16],造成这种细胞间反应不一的原因尚不清楚。我们采用MTT和LDH释放试验进行的观察表明,实验时应用的HCY浓度(1.0mmol/L)无明显的细胞毒性作用,从而除外了因HCY导致MC反应性不佳所造成的后果。另外,以往Matthias等[17]在应用外源性HCY造成大鼠动脉粥样硬化病变的模型中也发现,HCY能够引起主动脉产生显著的动脉粥样硬化病变,但是,并未导致肾脏以及其它脏器血管和组织病变。这些研究结果提示,HCY的促增殖作用可能具有组织或细胞选择性,所涉及的有关机制尚有待于进一步研究和探讨。
, 百拇医药
肾小球疾病时存在MC表型改变和细胞外基质(ECM)产生增加,为全面了解HCY对MC功能的影响,在开展HCY对细胞增殖影响研究的同时,我们对HCY能否影响MC表型改变和细胞外基质产生也进行了观察。有关实验结果显示:HCY对于MC表型转化及ECM产生无明显影响。然而,HCY能否通过作用于其它物质影响MC或其直接作用于其它肾脏细胞继而在肾脏进行性病变中产生作用尚有待进一步研究。
参考文献
1 Glueck CJ,Shaw P,Lang JE et al.Evidence that homocysteine is an independent risk factor for atherosclerosis in hyperlipidemic patients.Am J Cardiol,1995,75:132
2 Malinow MR,Nieto FJ,Szklo M et al.Carotid artery intimal medial wall thicking and plasma homocysteine in asymptomatic adults:the atherosclerosis risk in communities study.Circulation,1993,87:1107
, http://www.100md.com
3 Tsai JC,Perrella MA,Yoshizum M et al.Promotion of vascular smooth muscle cell growth by homocystine:a link to atherosclerosis.Proc Natl Acad Sci USA,1994,91:6369
4 Majors A,Ehrhart LA,Pezacka EH.Homocysteine as a risk factor for vascular disease:Enhanced collagen production and accumulation by smooth muscle cells.Arterioscler Thromb Vas Biol,1991,17:2074
5 Hultberg B,Andersson A,Sterner G.Plasma homocysteine in renal failure.Clin Nephrol,1993,40:230
, 百拇医药
6 谌贻璞,高进,王海燕等.肾小球系膜细胞培养.北京医科大学学报,1989,21:335
7 Kribben A,Weider ED,Li Xiaomei et al.AVP-induced activation of MAP Kinase in vascular smooth muscle cells is mediated through protein kinase C.Am J Physiol,1993,265:c939
8 唐嘉薇,李晓玫.血管紧张素Ⅱ对肾系膜细胞丝裂原活化蛋白激酶的作用.北京医科大学学报,1998,30:375
9 Li Xaomei,Putten VV,Zarinetchi F et al.Suppression of smooth muscle α-actin expression by platelet-drived growth factor in vascular smooth muscle cells involves Ras and cytosolic phosphlipase A2.Biochem J,1997,327:709
, 百拇医药
10 Nahman NS,Leonhart KL,Cosio FG et al.Effects of high glucose on cellular proliferation and fibronectin production by cultured human mesangial cells.Kidney Int,1992,41:396
11 Johnson RJ,Lida H,Alpers CE et al.Expression of smooth muscle cell phenotype by rat mesangial cells in immune complex nephritis.J Clin Invest,1991,87:847
12 Blundell G,Jones BG,Rose FA et al.Homocysteine mediated endothelial cell toxicity and its amelioration.Atherosclerosis,1996,122:163
, http://www.100md.com
13 Nishinaga M,Ozawa T,Shimada K.Homocysteine,a thrombogenic agent,suppresses anticoagulant heparan sulfate expression in cultured porcine aortic endothelial cells.J Clin Invest,1993,92:1381
14 Bostom AG,Shemin D,Lapane KL et al.Hyperhomocysteinemia and traditional cardiovascular disease risk factor in end stage renal disease patients on dialysis:a case-control study.Atherosclerosis,1995,114:93
15 Pelech SL,Sanghera JS.MAP Kinase:Charting the regulatory pathways.Science,1993,257:1355
, 百拇医药
16 田清平,刘乃奎,朱燕清等.丝裂素活化蛋白激酶介导同型半胱氨酸诱导的血管平滑肌细胞增生.北京医科大学学报,1998,30:197
17 Matthias D,Becker CH,Riezler R et al.Homocysteine induced arteriosclerosis-like alteration of the aora in nomotensive and hypertensive rats following application of high doses of methionine.Atherosclerosis,1996,122:201
(1999-02-15收稿,1999-04-02修回), 百拇医药
单位:北京医科大学第一医院肾内科 北京医科大学肾脏病研究所(北京,100034)
关键词:同型半胱氨酸;系膜细胞;肾脏
肾脏病与透析肾移植杂志990309
摘 要 目的:研究外源性同型半胱氨酸对体外培养的肾小球系膜细胞增殖、表型转化和产生细胞外基质的影响。方法:采用放射性同位素测定3H-TdR掺入和细胞外信号调节激酶活性,流式细胞仪分析细胞周期,Western blot方法进行α-平滑肌肌动蛋白检测,ELISA方法检测细胞上清液中细胞外基质含量。结果:不同浓度的同型半胱氨酸(0.005,0.05,0.5和1.0mmol/L)不同作用时间(8,16和24 h)对肾小球系膜细胞、细胞外信号调节激酶活性、α-平滑肌肌动蛋白表达和分泌型纤粘连蛋白、层粘连蛋白产生无明显作用。结论:同型半胱氨酸对体外培养的肾小球系膜细胞增殖、表型转化和细胞外基质产生无明显影响。
, 百拇医药
EFFECTS OF EXOGENOUS HOMOCYSTEINE ON RENAL MESANGIALS CELLS
Li Jian,Li Ziaomei,Wang Haiyan
(Institute of Nephrology,the First Teaching Hospital,Beijing Medical University,Beijing 100034)
OBJECTIVE To study the effect of exogenous homocysteine(HCY)on proliferation,phenotype change and extracellular matrix production of cultured rat glomerular mesangial cells(MC).
, 百拇医药
METHODOLOGY Rat mesangial cells was treated by exogenous HCY.3H-TdR incoporation and the activity of extracellular signal-regulated kinase(ERK)were assayed with isotopic methods,cell cycle analysed by flow cytometry.The expression of α-smooth muscle actin(α-SM actin)was detected by Western blot.Fibronectin(FN)and laminin(LN)in supernatant of culture media were assayed by inhibition ELISA methods.
RESULTS No effect on MC 3H-TdR incoporation(1733±308~1849±448 vs control 1709±368,P>0.05)was found when HCY incubated with MC at different concentrations(0.005,0.05,0.5 and 1.0 mmol/L)or of different time courses(8,16 and 24 hours).The activity of extracellular signal-regulated kinase(ERK)were not increased(246±47~404±137 vs control 362+91,P>0.05)。When cells were treated with 0.5mmol/L HCY at 2 to 60 minutes.cell cycles detected by flow cytometry were not changed by HCY at different concentrations.α-SM actin expression was not enhanced by HCY detected by Western blot.FN and LN in supernatant of culture media were not affected when mesangial cells incubated with HCY at the concentration of 0.5mmol/L.
, http://www.100md.com
CONCLUSION HCY has no effects on proliferation,phenotype and ECM production of MC.
Key words homocysteine kidney mesangial cells
同型半胱氨酸(Homocysteine,HCY)是蛋氨酸循环的中间产物,属含硫氨基酸。实验研究和临床观察表明,血浆中HCY升高可引起动脉粥样硬化和血栓形成,是一种独立致病的危险因素[1,2]。近年研究又发现,HCY可刺激大鼠血管平滑肌增殖和胶原合成增加[3,4]。在多数慢性肾功能不全患者中也存在高HCY血症[5],但是它在肾脏进行性病变中的作用目前仍不清楚。基于肾小球系膜细胞(MC)具有血管平滑肌细胞特性和其在肾小球硬化病变中的重要地位,我们观察HCY对MC生长、表型转化以及产生细胞外基质的作用和可能存在的机制。
, http://www.100md.com
1 材料和方法
1.1 材料来源 纯种SD大鼠由北京医科大学实验动物中心提供。HCY,髓碱性磷酸酶(MBP)和各种蛋白酶抑制剂购自Sigma公司。小鼠抗α-SM actin单克隆抗体购自Boehringer Bannheim公司,ECL Kit购自Du Pont公司。γ-32P-ATP购自北京亚辉公司。
1.2 方法
1.2.1 MC培养 取雄性SD大鼠双肾,以本研究所建立方法[6]培养MC,用20%胎牛血清的RPMI 1640培养液培养及传代。血管平滑肌细胞(VSMC)来源于Wistar-Kyoto大鼠,培养液同MC,VSMC由北京医科大学第一临床医学院心血管疾病研究所唐朝枢教授惠赠。
1.2.2 3H-TdR掺入试验 将1×107/L细胞悬液接种于96孔板内,加20%胎牛血清的RPMI 1640培养液培养48h,换用0.5%血清的RPMI 1640培养液培养24h,使细胞同步化于静止期,然后加入HCY(0.005、0.05、0.5、1.0mmol/L),空白对照只加培养液,不加HCY。另外,以20%胎牛血清的RPMI 1640培养液刺激细胞,作为细胞反应状况的对照。培养结束前8h每孔内加入3H-TdR(终浓度1mCi/L)。实验结束时加入冷PBS终止反应,用ZT-Ⅲ型多头细胞收集器收获细胞于49型玻璃纤维滤膜上。LKB1209型液闪计数仪计数,以每分钟计数率(min-1)反映MC增殖状态。采用噻唑蓝(MTT)方法及乳酸脱氢酶(LDH)释放试验观察不同浓度HCY对MC活力的影响。
, http://www.100md.com
1.2.3 细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)活性测定 参照Kribben等[7]及本室方法[8]进行。过程如下:细胞经0.5%血清的RPMI 1640培养液培养24h,使细胞同步化于静止期。加入HCY 0.5mmol/L孵育2、5、10、30和60min,随后细胞经裂解、离心后提取酶样品,考马斯亮蓝方法测定样品蛋白含量。ERK活性根据对其特异性底物MBP的磷酸化作用测定。反应体系中含MgCl2 12.5mmol/L,蛋白酶抑制剂50mg/L,MBP 1g/L和γ-32P-ATP 50μmol/L,水浴摇床30℃反应15min后以25%三氯醋酸终止反应。取25μl反应终产物点于P81磷酸纤维素膜上,经75mmol/L磷酸洗膜并干燥后于液闪仪上测定放射活性。ERK活性用pmol/min.mg蛋白表示。样本均为双管重复测定,同一实验重复3次。
, 百拇医药
1.2.4 细胞周期分析 同步化于静止期的MC与HCY共孵育后,PI染色,流式细胞仪分析细胞各周期,采用机器附带软件进行数据处理。
1.2.5 α-型平滑肌肌动蛋白(α-SM actin)检测 采用小鼠抗α-SM actin单克隆抗体,Western blot方法进行测定[9]。
1.2.6 培养细胞上清液中纤粘连蛋白(Fibronectin,FN)和层粘连蛋白(Laminin,LN)检测 以间接竞争抑制酶联免疫吸附(ELISA)方法测定[10]。
1.3 统计学处理 实验结果以(
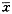 +s)表示,组间比较采用方差分析。
+s)表示,组间比较采用方差分析。2 结果
, 百拇医药
2.1 HCY对MC增殖的影响 HCY对MC增殖的影响如表1,表2所示。各浓度HCY作用24h或HCY 0.5mmol/L作用8、16、24h均不能增加MC 3H-TdR掺入率。同时以血管平滑肌细胞(VSMC)作为阳性对照时,不同浓度HCY可显著增加3H-TdR在VSMC中的掺入量。当用20%胎牛血清的RPMI 1640培养液刺激细胞时,呈现良好反应状态。
表1 不同浓度HCY对MC及VSMC 3H-TdR掺入的影响(
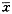 ±s) HCY浓度
±s) HCY浓度MC(min-1)
VSMC(min-1)
0
, http://www.100md.com
1709±368*
815±117#
0.005
1810±318
1071±126
0.05
1822±191
1131±115
0.5
1849±448
1444±229
1.0
, 百拇医药
1733±308
1274±114
*与各浓度比较P>0.05 #与各浓度比较P<0.05
表2 HCY 0.5 mmol/L孵育不同时间对MC 3H-TdR掺入的影响(
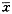 ±s) 作用时间(h)
±s) 作用时间(h)3H-TdR(min-1)
8
1837±481
16
1931±292
, 百拇医药
24
1806±683*
*与各时间点比较P>0.05
HCY 1.0 mmol/L和2.0 mmol/L分别与MC孵育36h,用MTT显色后测定光密度(A值),HCY 1.0 mmol/L组(0.35±0.01)与对照组(0.35±0.014)间差异不明显(P>0.10),而HCY 2.0mmol/L组(0.293±0.008)则显著低于对照组(0.35±0.014)(P<0.05),表明该浓度引起细胞活力下降或数量减少。HCY 1.0 mmol/L组的LDH释放率(15.1%)与对照组(17.5%)间差异不明显。
2.2 HCY对MC ERK活性的影响 HCY 0.5mmol/L与MC孵育2、5、10、30及60min后测定ERK活性,各个时间点之间以及和对照组间MC的ERK活性无明显差异。而同时以血小板来源生长因子(PDGF)10μg/L作为阳性对照进行ERK活性测定时,MC细胞ERK活性明显升高,表明MC细胞具有良好的反应性,结果见表3。
, 百拇医药
表3 HCY对ERK活性的影响(
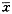 +s) 作用时间
+s) 作用时间(min)
ERK活性(pmol/min.protein)
HCY
PDGF
0
362±91*
2
324±46
-
5
, http://www.100md.com
404±137
513±47#
10
286±75
611±45#
30
258±93
532±35#
60
246±47
-
*与HCY各时间点比较P>0.05 #与基础状态时比较P<0.05
, 百拇医药
2.3 HCY对MC细胞周期的影响 HCY 0.05、0.5和1.0mmol/L与MC共孵育24h,PI染色后分析细胞周期,细胞各周期比例无明显变化。结果见表4。
表4 HCY对MC细胞周期的影响(
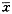 +s) HCY(mmol/L)
+s) HCY(mmol/L)G0-G1(%)
S(%)
G2-M(%)
0
75.92±1.16*
8.76±2.31*
, http://www.100md.com
0.31±1.86*
0.05
72.41±2.15
8.01±1.54
19.58±0.61
0.5
70.77±2.64
9.09±2.71
20.44±0.24
1.0
72.91±1.16
6.96±1.52
, 百拇医药
19.83±0.66
*与各浓度比较P>0.05
2.4 HCY对MC α-SM actin蛋白质产生的影响 HCY 0.5mmol/L与MC共孵育6、12、18、24和36h,标志MC表型改变的α-SM actin蛋白[11]有一定基础表达量,但是HCY刺激时间点与各自未予以HCY刺激的对照比较时,α-SM actin蛋白表达未见明显升高(见附图)。
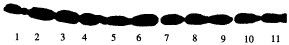
附图 MC受HCY刺激前、后不同时间处理组与相应对照α-SM actin蛋白质表达情况
1为对照组,2、3为6h刺激与对照组,4、5,6、7,8、9和10、11分别为12h、18h、24h和36h的刺激与对照组。
, http://www.100md.com
2.5 HCY对MC产生FN和LN的影响 HCY 0.5mmol/L与MC共孵育2、4、6、8天,分别测定细胞上清液中FN、LN含量无明显增加,结果见表5。
表5 HCY对MC产生FN及LN的影响(
 6±s,A值) HCY作用
6±s,A值) HCY作用时间(天)
对照组
刺激组
FN
LN
FN
LN
, http://www.100md.com 2
0.42±0.17
0.51±0.18
0.45±0.18
0.51±0.05
4
0.49±0.22
0.45±0.08
0.49±0.11
0.52±0.07
6
0.50±0.17
, 百拇医药
0.55±0.08
0.44±0.13
0.55±0.11
8
0.52±0.16
0.50±0.05
0.47±0.17
0.52±0.11*
*与各时间点及对照组比较P>0.05
3 讨论
HCY作为蛋氨酸代谢过程中的一个重要产物,已被实验研究和临床观察证实是一种引起动脉粥样硬化病变的独立危险因素。以往采用体外培养内皮细胞开展的研究发现,HCY不但具有细胞毒性作用[12]而且可导致内皮细胞功能紊乱[13]。90年代中期以来的研究结果又进一步表明,HCY能够刺激VSMC增殖和胶原成分产生增加[3,4]。因此,HCY在动脉粥样硬化病变发生机制中的作用倍受人们关注。以往的临床观察已经证实,慢性肾功能衰竭患者多数有HCY水平升高,并且也被认为是此类患者产生心血管并发症的独立危险因素之一[14]。作为慢性肾功能衰竭主要病理改变的肾小球硬化过程是否也遭受高HCY血症的影响,迄今仍无公开的研究报道。由于肾小球MC不但具有平滑肌细胞的部分特性,而且又是肾小球病变的主要参与者,因此HCY是否能够导致MC生长和功能变化值得探讨。
, 百拇医药
本研究中,HCY不同浓度及不同作用时间与MC共孵育时,3H-TdR掺入和细胞周期无明显变化,该结果提示,HCY无促进MC DNA合成的效应。ERK作为细胞外信号引起细胞增殖反应的细胞内信号传递共同通路或汇聚点的丝裂素活化蛋白激酶[15]亚类之一,其活性在本实验中亦未受影响,进一步表明HCY不促进MC增殖。为确定HCY的有效性和MC的反应性,我们以VSMC及PDGF分别作为阳性对照进行研究,结果显示:本实验条件下,HCY能够呈剂量依赖性地促进VSMC 3H-TdR掺入,PDGF可使MC ERK活性显著增高,这些结果均具有显著的统计学差异(P值均<0.05),表明HCY有效,MC反应状态良好。
本研究中,HCY未引起MC出现类似于VSMC的促增殖效应[16],造成这种细胞间反应不一的原因尚不清楚。我们采用MTT和LDH释放试验进行的观察表明,实验时应用的HCY浓度(1.0mmol/L)无明显的细胞毒性作用,从而除外了因HCY导致MC反应性不佳所造成的后果。另外,以往Matthias等[17]在应用外源性HCY造成大鼠动脉粥样硬化病变的模型中也发现,HCY能够引起主动脉产生显著的动脉粥样硬化病变,但是,并未导致肾脏以及其它脏器血管和组织病变。这些研究结果提示,HCY的促增殖作用可能具有组织或细胞选择性,所涉及的有关机制尚有待于进一步研究和探讨。
, 百拇医药
肾小球疾病时存在MC表型改变和细胞外基质(ECM)产生增加,为全面了解HCY对MC功能的影响,在开展HCY对细胞增殖影响研究的同时,我们对HCY能否影响MC表型改变和细胞外基质产生也进行了观察。有关实验结果显示:HCY对于MC表型转化及ECM产生无明显影响。然而,HCY能否通过作用于其它物质影响MC或其直接作用于其它肾脏细胞继而在肾脏进行性病变中产生作用尚有待进一步研究。
参考文献
1 Glueck CJ,Shaw P,Lang JE et al.Evidence that homocysteine is an independent risk factor for atherosclerosis in hyperlipidemic patients.Am J Cardiol,1995,75:132
2 Malinow MR,Nieto FJ,Szklo M et al.Carotid artery intimal medial wall thicking and plasma homocysteine in asymptomatic adults:the atherosclerosis risk in communities study.Circulation,1993,87:1107
, http://www.100md.com
3 Tsai JC,Perrella MA,Yoshizum M et al.Promotion of vascular smooth muscle cell growth by homocystine:a link to atherosclerosis.Proc Natl Acad Sci USA,1994,91:6369
4 Majors A,Ehrhart LA,Pezacka EH.Homocysteine as a risk factor for vascular disease:Enhanced collagen production and accumulation by smooth muscle cells.Arterioscler Thromb Vas Biol,1991,17:2074
5 Hultberg B,Andersson A,Sterner G.Plasma homocysteine in renal failure.Clin Nephrol,1993,40:230
, 百拇医药
6 谌贻璞,高进,王海燕等.肾小球系膜细胞培养.北京医科大学学报,1989,21:335
7 Kribben A,Weider ED,Li Xiaomei et al.AVP-induced activation of MAP Kinase in vascular smooth muscle cells is mediated through protein kinase C.Am J Physiol,1993,265:c939
8 唐嘉薇,李晓玫.血管紧张素Ⅱ对肾系膜细胞丝裂原活化蛋白激酶的作用.北京医科大学学报,1998,30:375
9 Li Xaomei,Putten VV,Zarinetchi F et al.Suppression of smooth muscle α-actin expression by platelet-drived growth factor in vascular smooth muscle cells involves Ras and cytosolic phosphlipase A2.Biochem J,1997,327:709
, 百拇医药
10 Nahman NS,Leonhart KL,Cosio FG et al.Effects of high glucose on cellular proliferation and fibronectin production by cultured human mesangial cells.Kidney Int,1992,41:396
11 Johnson RJ,Lida H,Alpers CE et al.Expression of smooth muscle cell phenotype by rat mesangial cells in immune complex nephritis.J Clin Invest,1991,87:847
12 Blundell G,Jones BG,Rose FA et al.Homocysteine mediated endothelial cell toxicity and its amelioration.Atherosclerosis,1996,122:163
, http://www.100md.com
13 Nishinaga M,Ozawa T,Shimada K.Homocysteine,a thrombogenic agent,suppresses anticoagulant heparan sulfate expression in cultured porcine aortic endothelial cells.J Clin Invest,1993,92:1381
14 Bostom AG,Shemin D,Lapane KL et al.Hyperhomocysteinemia and traditional cardiovascular disease risk factor in end stage renal disease patients on dialysis:a case-control study.Atherosclerosis,1995,114:93
15 Pelech SL,Sanghera JS.MAP Kinase:Charting the regulatory pathways.Science,1993,257:1355
, 百拇医药
16 田清平,刘乃奎,朱燕清等.丝裂素活化蛋白激酶介导同型半胱氨酸诱导的血管平滑肌细胞增生.北京医科大学学报,1998,30:197
17 Matthias D,Becker CH,Riezler R et al.Homocysteine induced arteriosclerosis-like alteration of the aora in nomotensive and hypertensive rats following application of high doses of methionine.Atherosclerosis,1996,122:201
(1999-02-15收稿,1999-04-02修回), 百拇医药