脾细胞诱导大鼠移植肾耐受性的研究
作者:庄建平 郭震华 侯健全
单位:郭震华 侯健全 (苏州医学院附属第一人民医院泌尿外科 苏州,215007);庄建平(苏州市第二人民医院泌尿外科)
关键词:肾移植;免疫耐受;动物实验
肾脏病与透析肾移植杂志990307
摘 要 目的:建立一种确实可行的诱导肾移植免疫耐受的动物模型,以探讨肾移植后的免疫耐受情况。方法:采用供体SD大鼠脾细胞,经过处理后注入受体Wistar大鼠的门静脉内,同时进行肾移植,然后用环孢素治疗一周的方法。结果:实验组大鼠平均成活时间为72.2±32天,对照组为10.5±2.1天,实验组与对照组比较P<0.01。实验组在肾移植60天后,再用SD大鼠和Lewis大鼠的皮肤进行移植,发现SD大鼠的皮肤不被排斥,Lewis大鼠的皮肤出现排斥。结论:门静脉内注射供体脾细胞可诱导肾移植免疫耐受,并且这种耐受具有特异性。
AN EXPERIMENTAL STUDY ON THE EFFECT OF INTROPORTAL INJECTION OF THE DONOR SPLENOCYTE ON THE RENAL ALLOGRAFT SURVIVAL
Zhuang Jianping
(Department of Urology,Suzhou Number 2 People's Hospital,Suzhou,215002)
Guo Zhenghua,Hou Jianquan
OBJECTIVE To study the mechanism of immune tolerance in renal allograft transplantation.
METHODOLOGY An animal model of specific immune tolerance of renal allograft was established,with the processed spleen cells of donor DS rats injected into the portal vein of the recipient Wilstar rats simultaneously.After transplantation,cyclosporin A was administraed for one week in the recipients.Skin grafts of SD rats and Lewis rats were transplanted to Wilstar rats 60 days after renal graft transplantation.For the control rats(n=10),normal saline were injected into the portal vain.
RESULTS As compared to that in the control group,the median survival of the rats in experimental group was significantly prolonged(72.2±32.0 days vs.10.5±2.1days,P<0.01).As for the result of skin grafts transplantation,SD rats skin graft survived significantly longer than Lewis rats skin graft.
CONCLUSION Intraportal injection of donor spleen cells can induce specific tolerance to renal allograft recipients.
Key words transplantation immune tolerance animal model
本研究采用供体SD大鼠的脾细胞,经过处理后注入受体Wistar大鼠的门静脉内,同时进行肾移植,然后用环孢素治疗一周的方法建立大鼠肾移植免疫耐受模型,现报告如下。
1 材料和方法
1.1 动物 供体SD大鼠,受体Wistar大鼠由苏州医学院实验动物中心提供。皮肤供体之一Lewis大鼠购自上海实验动物中心,各种大鼠均为近交系,雄性,6~14周,体重200~400g。
1.2 实验分组及移植方案 受体Wistar大鼠共20只分为2组,对照组10只,门静脉内注射生理盐水;实验组10只,门静脉内注射处理过的供体SD大鼠的脾细胞2ml,浓度2.5×1011/L,脾细胞注射与肾移植同时进行。各组大鼠分别在实验前1天,实验当天,及实验后1、3、4、5天按10mg/kg口服环孢素A。实验组在术后60天,用SD大鼠和Lewis大鼠的皮肤移植给受体Wistar大鼠。
1.3 供体脾细胞的制备 在供体SD大鼠取下肾脏的同时取下大鼠脾脏,剪碎,通过200目筛网,用0.83%Tris-NH4Cl溶解红细胞,以RPMI 1640液清洗脾细胞3次,再加入淋巴细胞分离液进行离心,吸取中层制成2.5×1011/L脾细胞悬液备用,台盼蓝染色测定细胞活性≥90%。
1.4 肾移植 参照Buamis等[1]报道的方法进行适当改变。乙醚麻醉后,进行取肾和肾移植,术中用冰保持供肾处于低温状态,整个移植需时125 min,热缺血小于3s,冷缺血时间为60min,血管吻合为25min,修肾为25min。供体肾静脉与受体肾静脉进行端端吻合,供体肾动脉与受体腹主动脉进行了端侧吻合(供体肾动脉带有部分腹主动脉壁),供体输尿管连带部分膀胱壁与受体膀胱进行双层缝合,切除受体双侧肾脏。
1.5 混合淋巴细胞培养 采用受体与供体脾细胞间的混合淋巴细胞培养,在移植后40天随机抽取样本鼠受体Wistar大鼠4只(采自实验组),供体SD大鼠2只,Lewis大鼠2只,分别取脾脏制成悬液,浓度为2×108/L,以SD大鼠、Lewis大鼠的淋巴细胞作为刺激细胞,Wistar大鼠的淋巴细胞作为反应细胞,用丝裂霉素C处理刺激细胞和部分反应细胞(用作对照),然后加入96孔板,按50μl/孔进行培养4天后,每孔加1μl 3H-TdR,然后测定每分计数(min-1),计算出刺激指数。实验组:未处理的反应细胞和处理后的刺激细胞。对照组:未处理的反应细胞和处理后的反应细胞。均设3个复孔。
1.6 皮肤移植 在移植60天后实验组6只Wistar大鼠分成二组,分别给予SD大鼠的皮肤与Lewis大鼠的皮肤移植于大鼠的尾部,以观察皮肤排斥情况。
1.7 统计学方法 统计学处理采用χ2检验,组间进行t检验,P≤0.05为差异显著。
2 结果
2.1 门静脉注射供体脾细胞可诱导大鼠移植肾免疫耐受 对照组大鼠平均成活时间为10.5±2.1天,实验组为72.2±32天,实验组平均成活时间与对照组平均成活时间差异显著(P<0.01)。
2.2 血清肌酐变化 20只Wistar大鼠受体在移植前抽取颈静脉血测得基础血清肌酐为32.6±0.21 μmol/L,移植后变化见图1。
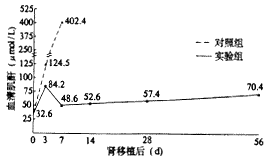
图1 肾移植后大鼠血清肌酐
2.3 移植肾的病理变化 肾脏病理提示,对照组移植肾肾间质水肿,并有淋巴细胞浸润,浸润细胞多见于间质小血管周围,肾小管上皮细胞变性坏死、脱落,血管内皮细胞肿胀,有纤维素样坏死,并可见微血栓形成(见图2)。同期实验组未见此变化(见图3)。实验组在移植后70天随机取2只样本鼠进行移植肾病理检查,发现有轻度肾小球毛细胞血管壁皱缩,基底膜增厚,局灶间质纤维化,有少量淋巴细胞浸润等表现(见图4)。
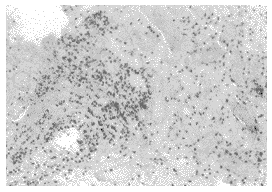
图2 术后第十天,对照组,急性排斥反应,肾间质水肿,淋巴细胞浸润,血管周围多量淋巴细胞浸润,肾小管上皮变性坏死。(200×HE染色)
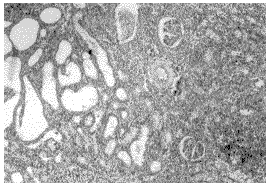
图3 术后第十天,实验组,肾未见急性排斥反应,仅见肾间质少量淋巴细胞浸润。(100×HE染色)
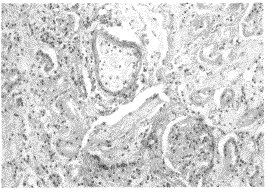
图4 术后第70天,实验组,肾慢性排斥反应,肾小球基底膜增厚,肾小囊后纤维化,血管周围淋巴细胞浸润等变化。(200×HE染色)
2.4 混和淋巴细胞培养 见附表
附表 混合淋巴细胞培养结果(min-1)
反应细胞
刺激细胞
Ⅰa
Ⅱa
Ⅲa
均值
SIb
实验组
Wistar
SD
450
645
530
542
1.8
对照组
Wistar(m)c
Wistar
385
247
271
301
实验组
Wistar
Lewis
1875
1658
1757
1763
5.8
对照组
Wistar(m)c
Wistar
375
282
257
304
a.二次培养的平均数,b.刺激指标(SI)=实验组min-1均值/对照组min-1均值,c.处理过的反应细胞
2.5 皮肤移植反应 6只受体Wistar大鼠均来自实验组,3只给予SD大鼠皮肤移植后,移植皮肤成活时间为18,20,27天。3只给予Lewis大鼠皮肤移植,移植皮肤成活时间为7,10,12天。P=0.05,有统计学意义。
3 讨论
免疫耐受是指器官移植受体在不应用或停用免疫抑制剂的条件下,对移植的异体器官特异性地不产生免疫排斥,而使其获得长期成活,它是以克隆无反应和免疫抑制等外周耐受机制为主[2]。Qian等[3]用供体鼠脾细胞通过门静脉注入受体,受体对移植肾不发生排斥。Fujiwarn等[4]认为,脾脏主要由淋巴细胞组成,有着大量的供体抗原,当供体抗原进入肝脏后被肝细胞获得。与供体发生反应的淋巴细胞克隆就聚集在肝脏内,肝脏细胞产生一种急性期蛋白,它可破坏与供体发生反应的淋巴细胞克隆,导致克隆清除,产生免疫耐受,Callery等[5]认为,肝脏内的Kupffer细胞具有抑制迟发性超敏反应(DTH)功能,在肝脏内它对淋巴细胞的免疫耐受有着重要的作用。我们在肾移植同时采用供体脾细胞经门静脉注入受体,一方面可使供体抗原进入肝脏发生反应,产生克隆清除,另一方面,脾细胞内的单核细胞进入血液中,可以特异性地抑制针对同种异体单核细胞的DTH反应[3],从而诱导耐受。另外还有些学者在对免疫抑制药的研究中发现,短期用环孢素A可显著增加免疫无反应性发生率并加深其程度,它可阻止对移植物的反应,同时环孢素A可赦免抑制性T细胞的作用,使供体的抑制性T细胞得以增殖[6]。因此,我们在术前1天,移植当天,术后第1,3,4,5天按10 mg/kg给予受体Wistar大鼠口服环孢素A。
本实验结果表明,实验组Wistar鼠平均成活时间比对照组明显延长,差异具有统计学意义,(P<0.01)。说明脾细胞经门静脉注射给供体可有效诱导免疫耐受。移植后血肌酐测定表明移植后3天,实验组与对照组相差不大,7天后(停服环孢素A 2天后)实验组肌酐水平仍变化不大,说明移植肾功能良好;而对照组肌酐明显升高,出现氮质血症,在10天左右基本死亡,说明环孢素A可以抑制排斥反应,但停药后仍然会产生排斥,同时说明环孢素A虽然对诱导耐受有一定的作用,但是单用环孢素A不容易诱导出稳定的免疫耐受,而应用脾细胞产生耐受,可在停服环孢素A后继续存在,这种耐受在术后一周就已经产生。从而表明,对于大鼠的免疫耐受可以在肾移植同时进行,不一定要在移植前进行。但是要说明一点,环孢素A的应用还是必须的,因为我们曾在预实验时不用环孢素A,受体一般在3天内死亡,这与国外报道一致[7]。对照组大鼠移植肾病理改变表明发生了急性排斥反应,而形成耐受的大鼠在术后70天对移植肾病理检查只出现了轻度的慢性排斥情况。混和淋巴细胞培养表明,受体Wistar大鼠只对供体SD发生耐受,刺激指标SI=1.8,而对另一品系Lewis大鼠仍发生增殖反应,刺激指标SI=5.8,进一步证实了实验组Wistar大鼠发生了免疫耐受。皮肤移植结果表明在活体上同样出现免疫耐受,并且这种耐受具有特异性。本研究建立的免疫耐受动物模型具有方便实用,成活率高,特异性强等特点,在肾移植免疫耐受的研究中具有很大的应用价值。
参考文献
1 Buamis TP.Microsurgical renal transplantation techniques in small animals.Invest Urol,1977,15:143
2 Starzl TE,Demertris AJ,Marase N et al.Cell migration,chimerism and graft acceptance.Lancet,1992,339:1579
3 Qian J-H,Hashimoto T,Fujinars H et al.Studies on the induction of tolerance to alloantigens:I.The abrogation of delayed-type hypersensitivity response to alloantigens by portal veneus inoculation with allogenic cells.J Immunol,1985,134:3656
4 Fujiwara H.Studies on the induction of tolerance to alloantigens:Ⅱ.The generation of serumfactors able to transfer alloantigen-specific tolerance for delayed-type hypersensitivity by portal venous inoculation with allogeneic cell.J Immunol,1986,136:2736
5 Callery MP,Kamer T,Flye MW.Kupffer cell blockade inhibition of tolerance by the portal venous route.Transplantation,1989,47:1092
6 Wood ML,Gotlschalk K,Monalo AP et al.The effect of cyclosporine on The induction of unresponsiveness in antilymphocyte serum treated marrow injected mice.Transplantation,1988,46:449
7 Li SJ,Hart ME,Bloom A et al.The impact of ultraviolet B irradiaated leukocyte and cyclosporin in rat kidney transplantation.Transplantation,1996,61:320
(1999-01-04收稿,1999-01-22修回)