透析膜和内毒素对尿毒症患者单个核细胞白细胞介素-1β产生的影响*
作者:丁峰 顾勇 郑秀娟 陈枫 林善锬
单位:丁 峰 顾 勇 林善锬 (上海医科大学华山医院肾脏科 上海,200040);郑秀娟 (上海医科大学基础医学院免疫学教研室 上海,200032);陈 枫 (上海第二医科大学生物化学教研室分子生物学实验室 上海,200025)
关键词:透析膜;内毒素;白细胞介素-1
肾脏病与透析肾移植杂志990306
摘 要 目的:研究不同透析膜和内毒素对尿毒症患者外周血单个核细胞白细胞介素-1β(IL-1β)基因表达和蛋白质合成的影响。方法:细胞和不同透析膜孵育后采用原位杂交检测mRNA水平,单个核细胞培养后酶联免疫吸附试验法测定细胞总蛋白质水平。结果:不同透析膜孵育后的单个核细胞在未用内毒素刺激情况下IL-1β mRNA水平有显著差别,但蛋白质合成量无差异,其中正常人仅有极微量IL-1β合成;内毒素刺激下的单个核细胞IL-1β合成量明显高于未刺激组,且铜仿膜孵育后的细胞明显高于聚砜膜和对照组。结论:正常人单个核细胞IL-1β合成需双信号诱导,在尿毒症患者中内毒素和透析膜对单个核细胞IL-1合成有协同作用。
EFFECT OF DIALYZER MEMBRANE AND LPS ON PERIPHERAL BLOOD MONONUCLEAR CELLS INTERLEUKIN-1 β PRODUCTION IN UREMIC PATIENTS
Ding Feng,Gu Yong,Lin Shayan
(Department of Nephrology,Huashan Hospital,Shanghai Medical University,Shanghai 200040)
Zheng Ziujuan
(Department of Immunology,School of Basic Medical Sciences,Shanghai Medical University,Shanghai 200032)
Chen Feng
(Department of Biochemistry and Molecular Biology,Shanghai Second Medical University,Shanghai 200025)
OBJECTIVE To investigate the effect of LPS and dialyzer membrane on interleukin-1 β(IL-1β)gene expression and protein production in uremic patients on continuous ambulatory peritonal dialysis(CAPD),patients on regular hemodialysis(HD)and healthy controls.
METHODOLOGY IL-1β production by cultured peripheral blood mononuclear cells(PBMC)after exposure to cuprammonium(Cup)membrane,polysulfone(PS)membranes or endotoxin was detected using ELISA.IL-1β mRNA expression was determined simultaneously by in situ hybridization.
RESULTS In the absence of endotoxin,a small amount of IL-1β was produced by PBMC harvested form HD and CAPD patients after incubation with Cup or PS during subsequent 24 hour culture.For healthy controls,IL-1β was barely detectable just above the detection limit.Although no difference in protein synthesis could be found between Cup and PS treatment,in situ hybridization showed that Cup induced markedly higher level of IL-1β mRNA.In contrast,when subsequently stimulated with PLS,PBMC incubated with Cub could produce significantly higher amount of IL-1β compared with either not-stimulated cells or PBMC incubated with PS.
CONCLUSION Two steps are required in healthy control for IL-1β production:induction of mRNA transcription by membrane contact,followed by LPS-induced translation,while in uremic patients on HD or CAPD bioincompatibility-membrane and LPS have a synergetic effect on IL-β production.
Key words dialyzer membrane endotoxin IL-1β
血液透析中患者血液与“异己材料”接触后导致机体的炎症反应,即“生物不相容性”。除透析材料外,透析液细菌产物的污染问题近年来渐引起人们的关注[1]。Schindler等[2]认为,完全去除内毒素及其片段的透析液并不能诱导正常人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)细胞因子蛋白质的合成,此即细胞因子“双信号诱导学说”(priming/second signal theory)。但目前尚不清楚在尿毒症患者中是否也存在类似情况。因此,我们采用原位杂交和细胞培养等技术观察了尿毒症血透和腹透患者PBMC在接受不同透析膜和内毒素刺激后白细胞介素-1β(Interleukin-1β,IL-1β)mRNA转录和蛋白质翻译水平的变化,为超净水透析的临床应用奠定理论基础。
1 对象和方法
1.1 研究对象 尿毒症血透组9例,男性6例,女性3例,平均年龄48.4(32~68)岁;尿毒症CAPD组9例,男性7例,女性2例,平均年龄51.2(35~66)岁。上述患者均除外近一月内有急性感染,输血,慢性感染(乙型肝炎、丙型肝炎等),活动性自身免疫性疾病(系统性红斑狼疮、类风关等),服用免疫抑制剂和恶性肿瘤等情况。血透患者进入本研究前均已采用碳酸氢盐透析液及复用的聚砜膜透析器(F6,Fresenius AG,德国)至少四周,碳酸氢盐透析液为本透析中心新鲜配制。正常对照组10例,为年龄、性别匹配的本透析中心健康工作人员。
1.2 全血孵育和PBMC分离 肝素化全血(20U/ml)在硅化试管内分别和20 μg/L内毒素(LPS E.Coli,sigma,美国)、铜仿膜(B.Braun Co.,德国)、聚砜膜(Fresenius AG,德国)在300 r/min的37℃恒温水平摇床上共同孵育2h,对照组为未加任何刺激物全血。每毫升全血中加入20cm透析膜,透析膜在加入前切割成1cm长短,并用生理盐水反复冲洗。用相比密度为1.077的Ficoll/Hypaque淋巴细胞分离液分离PBMC,生理盐水洗涤2次后采样作瑞氏染色。上述及以下实验中所有试剂均采用聚砜膜滤器(F40,Fresenius AG,德国)进行超滤以去除内毒素成份。
1.3 PBMC原位杂交 原位杂交的寡核苷酸探针采用DNA自动合成仪合成,其序列为5’-TTA GGA AGA CAC AAA TTG CAT GGT。 采用3’-末端地高辛标记法(Bochringer Mannhein Biochemicals,德国)进行标记。5μl新鲜PBMC晾干后,3%多聚甲醛固定,室温下预杂交1h,加0.1μl标记探针37℃过夜。2×SSC至0.5×SSC洗涤4次,1∶1000地高辛抗体反应2h后进行颜色反应和HE复染。统计1000个PBMC中含阳性颗粒细胞百分数,并采用计算机图像分析系统进行相对定量。
1.4 PBMC培养 PBMC悬浮在RPMI 1640培养液(含2mmolL-谷氨酰胺,100 kU/L青霉素,100mg/L链霉素,2%加热灭活AB型人血清)中,调整细胞浓度至1×109/L,取1ml分别加或不加10 μg/L内毒素,在37℃、5%CO2的潮湿环境下培养24h。采用-70℃和37℃三步反复冻融法破碎细胞,用酶联免疫吸附试验法(Enzyme-linked Immunoabsorbent Assay,ELISA)测定细胞总IL-1β。ELISA药盒购自美国Genzyme公司,按说明书步骤进行测定,测定的敏感度为10 ng/L。
1.5 统计学方法 所有数据均用
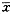 ±s表示。采用方差分析进行检验,P<0.05为差异显著。
±s表示。采用方差分析进行检验,P<0.05为差异显著。2 结果
2.1 不同孵育条件对PBMC中所含的多型核白细胞比例的影响 各种不同孵育条件之间,尿素症血透组、CAPD组和正常对照组之间取血分离得到的PBMC中所含的多形核白细胞(polymorphonuclear cells,PMN)比例差异均不显著。
2.2 不同孵育条件对PBMC IL-1βmRNA表达的影响 20 μg/L LPS刺激后的PBMC阳性颗粒百分比在尿毒症血透、CAPD和正常人三组中均属最高,其次为铜仿膜刺激组,该两组均显著高于聚砜膜刺激组和对照组。聚砜膜组和对照组除正常人外,IL-1βmRNA表达差异不显著(在正常人组,聚砜膜仅诱导极微量阳性颗粒,而对照组未见阳性颗粒)。采用计算机图像分析进行相对定量基本上得到相似的结果。(表1,表2)(图1,图2)
表1 不同孵育条件下含阳性颗粒的PBMC比例(
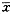 ±s)
±s)正常人
血透患者
CAPD患者
LPS
64.8±4.86***
33.4±2.98**
35.5±3.87**
铜仿膜
31.3±3.18**
27.8±2.65**
32.4±2.76**
聚砜膜
2.45±1.21*
6.98±1.87
6.02±1.79
对照组
0.1±0.01
4.98±1.27
4.34±1.01
***和铜仿膜、聚砜膜、对照组相比P<0.05;
**和聚砜膜、对照组相比P<0.05;
*和对照组相比P<0.05
表2 IL-1β基因表达的相对定量分析(
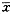 ±s)
±s)颗粒面积/细胞面积
正常人
血透患者
CAPD患者
LPS
19.8±3.46*
21.4±2.83*
20.7±2.97*
铜仿膜
15.6±3.24*
18.4±3.42*
17.9±3.41*
聚砜膜
0.45±0.21
2.48±0.87
2.02±1.79
*和聚砜膜组相比P<0.05
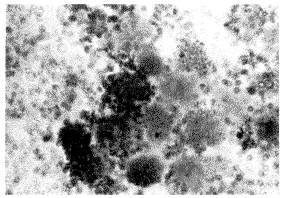
图1 与铜仿膜孵育后的血透患者PBMC用IL-1β寡核苷酸探针原位杂交结果(见阳性颗粒,×1000)

图2 与聚砜膜孵育后的正常人PBMC用IL-1β寡核苷酸探针原位杂交结果(未见阳性颗粒,×1000)
2.3 LPS和透析膜对PBMC IL-1β产生的影响 正常人PBMC在未用内毒素刺激情况下仅有极微量IL-1β产生(接近药盒的检测敏感下限),而尿毒症血透和CAPD患者可见自发性的IL-1β产生,但不同膜材料和对照组之间无明显差别。内毒素刺激后的PBMC所产生的IL-1β要明显高于相应的未用内毒素刺激组,其中铜仿膜刺激组又要显著大于聚砜膜和对照组,后二组之间差异不显著(表3)。
表3 培养的PBMC在内毒素刺激及未刺激情况下IL-1β的产量(
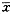 ±s,ng/L×109细胞/L)
±s,ng/L×109细胞/L)未刺激
内毒素刺激
铜仿膜
聚砜膜
对照组
铜仿膜
聚砜膜
对照组
正常人
16.78±4.55
19.08±3.1
21.75±4.3
6763.2±2400*△
3389±505.9*
3432±1167*
血透患者
290.2±153.1**
344.8±139.5**
292.4±124.2**
3640.8±1495*△
2244±546.6*
2229±682*
CAPD患者
356.4±116.3**
318.4±105.9**
393.2±60.9**
4275.2±1876*△
2804±539.8*
2503±682*
*和各相应的未刺激组相比P<0.05;
△和聚砜膜、对照组相比P<0.05;
**和未刺激正常人组相比P<0.05;
正常人PBMC受内毒素刺激后IL-1β产生量较未刺激前升高165.4±28.67倍,明显高于尿毒症血透和CAPD患者(分别为7.54±1.32和6.23±1.11倍)。
3 讨论
随着对血液透析生物相容性研究的深入,人们认识到除了透析膜材料外,其它成分如透析管路、添加剂成分、吸附的环氧乙烷、醋酸盐透析液乃至患者自身的代谢状况等等,都是导致生物不相容性的因素[3]。近年来的研究还发现,透析液中污染的细菌内毒素及其片段可穿过高通量甚至常规低通量透析器膜,刺激机体白细胞产生各种前炎症性细胞因子,引起透析患者各种急性和慢性并发症,影响尿毒症患者的生存质量[1]。
Schindler等[2]在其著名的细胞因子“双信号诱导学说”中提出:血液-透析膜直接接触或活化的补体片段可诱导IL-1β、TNFα等细胞因子mRNA转录水平的明显增加,但在缺乏内毒素等第二信号的情况下,mRNA并不能翻译成相应的蛋白质。临床研究也证实[4,5],采用超滤去除内毒素的超净水透析3个月,患者血浆IL-1β、TNFα和β2微球蛋白水平显著降低,心血管稳定性提高,淀粉样变发生率也明显降低。在我们的实验中也证实,正常人PBMC单用铜仿膜刺激虽有IL-1β mRNA的表达,但并无蛋白质合成的增加;相反,只有在给予内毒素刺激后,铜仿膜组IL-1β合成量方明显高于聚砜膜和对照组。在尿毒症血透和CAPD组,PBMC在不同透析膜作用下mRNA表达水平虽高低不一,但只有在内毒素继发刺激下方有不同水平的蛋白质表达。可以这样认为,在这里透析膜起到一个预刺激(Priming)的作用,透析膜和内毒素的共同刺激对细胞因子产生的影响要远远大于单用任何一种,也即两者有协同作用,而透析膜生物相容性的概念只有在内毒素存在情况下才有意义。有人提出[6],生物相容性差的透析膜(如铜仿膜)和超净水的联合要优于生物相容性佳的透析膜(如聚砜膜)和普通透析水的联合。因此,我们认为超净水透析值得在临床上推广应用。
在以往的研究报道中,不同刺激下PBMC产生细胞因子的结果并不一致,表现为增强、无变化甚至降低的报告均有,我们认为可能和研究所采用的实验条件有关[7]。本实验采用肝素化全血孵育、水平摇床等实验环境和体内情况比较接近。更重要的是,实验中所有的液体试剂均经过超滤处理,以去除可能存在的极微量内毒素,因有报告即使是10~20 ng/L的微量内毒素已足够诱导白细胞产生细胞因子。我们还采用人AB型血清替代10%小牛血清作为培养基,因后者也是内毒素的一个重要来源,导致高背景水平的IL-1β。
尿毒症患者中常伴发免疫功能异常,如皮肤移植存活时间延长、感染和肿瘤发生率增高、以疫苗反应减弱等[8]。我们发现尿毒症患者虽有基础情况下PBMC自发性的前炎症性细胞因子合成,但这些细胞对内毒素等刺激的反应要远小于正常人,表现为刺激后IL-1β合成的增加倍数远小于正常人。IL-1β为细胞产生IL-2和表达IL-2受体所必需,已知IL-2对T淋巴细胞和胸腺细胞的分化成熟及生长,自然杀伤细胞、B淋巴细胞和巨噬细胞的活性均有强大的激活作用。我们推测PBMC对刺激的低反应可能和尿毒症患者免疫功能异常有一定关系。
总之,本研究证实了正常人PBMC中存在着双信号诱导,在尿毒症血透和CAPD患者中内毒素和透析膜对PBMC细胞因子的合成有协同作用,预示着超净水透析的临床应用价值。但晚近有报道[9,10]认为单次或短期(<1月)超净水透析并未改变各种炎症因子的合成情况。因此,确切的结论尚有待于中长期的前瞻性临床研究结果。
*本课题受上海市卫生局“百人计划”资助(编号:98BR038)
参考文献
1 Vienken J,Diamantoglou M,Hnh C et al.Considerations on developmental aspects of biocompatible dialysis membranes.Artif Organs,1995,19:398
2 Schindler R,Lonnemann G,Shaldon S et al.Transcription,not synthesis,of interleukin-l and tumor necrosis factor by complement.Kidney Int,1990,37:85
3 Lonnemann G.Dialysate bacteriological quality and the permeability of dialyzer membranes to pyrogens.Kidney Int,1993,43(suppl.41):S195
4 Bambauer R,Walther J,Meyer S et al.Bacteria- and endotoxin-free dialysis fluid for use in chronic hemodialysis.Artif Organs,1994,18:188
5 Baz M,Durand C,Jaber K et al.The impact of 12 years of ultrapure dialysate use on hemodialysis related amyloidosis.Int J Artif Organs,1990,13:547
6 Shaldon S,Koch KM.Biocompatibility in hemodialysis: clinical relevance in 1995.Artif Organs,1995,19:395
7 Schaefer RM,Paczek L,Heidland A.Cytokine production by monocytes during hemodialysis.Nephrol Dial Transplant,1991,2(suppl):14
8 Descamps-Latscha B,Herbelin A.Long-term dialysis and cellular immunity:A critical survey.Kidney Int,1993,43(suppl 41):s135
9 Grooteman M,Nube M,Daha M et al.Cytokine profiles during clinical high-flux dialysis:No evidence for cytokine generation by circulation monocytes.J Am Soc Nephrol,1997,8:1745
10 Tielemans C,Husson C,Schurmans T et al.Effects of ultrapure and non-sterile dialysate on the inflammatory response during in vitro hemodialysis.Kidney Int,1996,49:236
(1999-03-15收稿,1994-04-05修回)
|
瀵邦喕淇婇弬鍥╃彿
閸忚櫕鏁為惂鐐
鐠囧嫯顔戦崙鐘插綖
閹兼粎鍌ㄩ弴鏉戭樋
|