人工皮肤培养模型的建立
作者:伍津津 刘荣卿 叶庆佾 唐书谦 钟白玉
单位:第三军医大学西南医院皮肤科(400038)
关键词:人工皮肤;成纤维细胞;角朊细胞;三维培养
重庆医学990404 摘 要 模拟体内生理条件,采用细胞三维培养技术将角朊细胞接种在一活性真皮替代物(即成纤维细胞胶原凝胶)上,然后行气液界面培养,使角朊细胞的一些正常生长和分化的特征得以再现,从而形成一种能应用于临床的人工皮肤。而且这一培养模型使角朊细胞、成纤维细胞和细胞外基质构成了一有机的整体,因而也是研究表皮分化、真表皮间相互关系的良好模型。
A Model of Artificial Skin Estabished by Three-dimension Culfure
Wu Jinjin,Liu Rongqing,Ye Qingyi,Tang Shuqian,Zhong Baiyu
, http://www.100md.com
Department of Dermatology,Southwest Hospital,Third Military Medical University,Chongqing 4000038
Abstract:Using three-dimension culture technique imitating in vivo natural condition of skin,epidermal keratinocytes were plated on a dermal equivealent made up of fibroblasts in a collagen matrix that was contracted and modified by the resident cells,then exposed to the air-liquid interface.So keratinocytes could express the normal growth and differentiation.This is a living skin equivalent called artificial skin which can be used in Clinic.Since keratinocytes,fibroblasts and matrix all are in entity,this is a good model for studying the epidermal differentiation,epidermal-dermal interaction.
, http://www.100md.com
Key word:Artificial Skin,Fibroblast,Keratinocyte,Three-dimension culture.
如何促进和加速伤口的愈合,减少疤痕的形成是人们历来关注的重要课题,尤其是在大面积烧伤后自体皮源不足的情况下,如何及时覆盖创面、减轻创面收缩和疤痕增生,是临床一个急需解决的问题[1]。近20年来随着组织工程学的创立,人工皮肤、人工软骨、人工肝、人工血管等的研究正在迅速发展,其中尤以人工皮肤的研究最快[2]。近来我们也成功地建立了人工皮肤的培养模型,现报告如下。
1 材料与方法
1.1 头皮或包皮成纤维细胞培养 头皮取自急症创伤病人尸体或良性头皮肿瘤病人边缘的正常头皮,或是去皱整形的正常头皮,包皮取自包皮环切术后的正常包皮,头皮或包皮真皮成纤维细胞采用组织培养法按我科常规方法[3]进行。取第15代处于生长指数期的成纤维细胞制作细胞凝胶。
, http://www.100md.com
1.2 提前1天准备滋养细胞 包皮或头皮真皮成纤维细胞半融合时倒掉旧培养基,加入丝裂霉素C(6.7μg/ml)培养基3ml,37℃,10小时,然后换液,加入常规培养基,培养一天,以准备传代。
1.3 细胞凝胶的制备 提前2~5天准备细胞凝胶,方法参见前文报道[4],简述如下,在冰浴的青霉素小瓶中加入4ml鼠尾胶原(1.0~1.5mg/ml),0.5ml浓缩10倍的DMEM,混匀,加0.1ml 1N NaOH,混匀,立即加入成纤维细胞的小牛血清细胞悬液0.5ml,快速混合,制成间质细胞凝胶,如制作无细胞的凝胶,只加0.5ml小牛血清,然后吸到24孔板中。当凝胶收缩到0.8~1.0cm时,加入一自行设计的玻璃导管(内径为0.8或1.0cm,高均为1.0cm),压住胶原凝胶以防止它继续收缩。
1.4 表皮器官型培养 包皮无菌处理后剪成小皮片,用0.25%胰蛋白酶冷消化,分离表真皮,在5%新生牛血清D-Hanks液中将表皮细胞吹散,过筛,计数,离心。每孔接种1×105个细胞(0.2ml),加入10%新生牛血清DMEM培养基(加有EGF10ng/ml,氢化可的松0.4μg/ml,胰岛素5μg/ml)1ml培养,每二天换液一次。约十分钟后表皮细胞粘贴于胶原凝胶上后立即取掉玻璃导管。浸没培养一周,待角朊细胞融合后进行气液界面培养,在真皮替代物下加入用不锈钢筛网制成的衬垫,再培养1~2周。部分凝胶上不加3T3细胞或凝胶中不加间质细胞,以资对照。
, http://www.100md.com
1.5 组织学检查 培养组织一部分用Bouin's液固定24小时,常规石蜡切片,H.E.染色,另一部分用2.5%戊二醛固定,JEM-200EX电镜观察。
2 结 果
器官型培养后重建的表皮有15层以上,有基底层、基底上层和颗粒层,基底层为扁平形细胞,而非立方形,基底以上各层亦为扁平形细胞,浸没培养时表皮不出现角化层,气液界面培养时形成了数层角化层。如照片1,细胞间缺乏紧密连接和缝隙连接,颗粒层的细胞还可见到角质透明颗粒。如照片2,上层细胞有较多的成束状的张力微丝,越接近角质层,张力微丝束越粗,角质层为弥漫的成平行排列的张力微丝束。如照片3,真表皮交界处没有完整的基底膜形成,有短的线状致密物质沉积,没有见到半桥粒。
3 讨 论
人工皮肤就是采用细胞三维培养[即器官型培养(organotypic culture)]技术,将表皮细胞接种于一生物活性基质上作气液界面培养,生物活性基质有去表皮的死真皮,间质细胞胶原凝胶和基质凝胶(Matrigel)等。将培养物升至气液界面,主要是在其下加入一层衬垫,最常用的是加不锈钢筛网[5]和死真皮[6]。间质细胞胶原凝胶具有很强的收缩性[7],培养数天后出现收缩,这便导致了接种表皮细胞悬液时会流入四周孔壁,而能粘附于胶原凝胶的细胞很少,因此我们设计了一种玻璃管,目的是将胶原凝胶固定,一是阻止其继续收缩,二是防止细胞悬液流向四周,从我们的研究结果来看,这两个目的都达到了。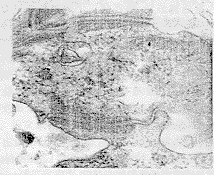
, 百拇医药
图1 重建皮肤后角朊细胞间的桥粒结构×40000
图2 重建皮肤后角朊细胞电镜观察×40000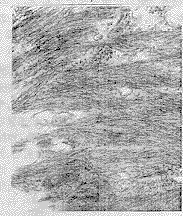
图3 角质层为弥漫平行排列的纤力微丝×20000
我们的研究发现,表皮细胞直接接种到胶原凝胶上后贴壁很快,但在细胞胶原凝胶上生长差,不易融合,融合后细胞层数少,只有3~5层,因此,我们采用了滋养细胞,以前有文献用3T3细胞或人真皮成纤维细胞(HDF)做滋养层细胞[8,9],据此我们也是采用HDF做滋养细胞,从实验中可以肯定,用滋养层细胞有利于表皮细胞的生长和层化。单纯胶原认为是角朊细胞最好的基质,胶原能改善细胞的粘附、贴壁效果,是基底板层粘连素(lamina)形成所必需的。活细胞加到胶原基质中后它们的物理和化学性质得到修饰,使之具有真皮组织的重要特征。这种真皮替代物具有一定的机械性特性:恒定的张力、弹性、伸缩性和休克抵抗(Shock resistance)[7]。
, http://www.100md.com
胶原凝胶中的成纤维细胞重新组织胶原纤维,诱导出很强的收缩,收缩的强弱与成纤维细胞的数量成反比,与胶原浓度成正比[5,7]。本研究中凝胶收缩较强,前6天可达2mm/d。器官型培养的最大特点是层化后的表皮细胞层相似于活体表皮,有基底层、基底上层、颗粒层和角质层[8、9],厚可达10~15层。基底层呈立方形[9,10]或扁平形[11],这可能与培养基不同有关,在MSBM培养基(3∶1的DMEM/H12培养基加一些因子)中能使维持基底细胞保持立方形。本研究中表皮层可达15层以上,基底细胞呈扁平形,比在胶原凝胶上培养,表皮的形态有了很大的改善。
组织学检查表明人工皮肤没能形成完整的基底膜。培养时间过短是其主要的原因,有研究认为基底膜的形成在体外培养的周期至少需要1~2月。Bell报道在鼠皮肤的器官型培养中是有完整的基底膜形成的,但用人皮肤培养时也不能形成基底膜[5]。近来有研究报道[10]真表皮交界处有线状基底膜形成,表皮侧有半桥粒,电镜检查为透明层和致密层组成,膜上有锚丝(anchoring fibril)伸到胶原基质中,经抗体检测Ⅵ、Ⅶ型胶原。另有报道为Ⅳ型胶原沉积[8]。从超微结构来看,表皮细胞成熟的许多特征都可见到,有桥粒、角质透明颗粒和粗张力微丝束等,这与以前的报道相符。
, http://www.100md.com
在细胞胶原凝胶中还可见到表皮陷窝或球形体(向中心角化)形成。Bell认为成纤维细胞是隐窝形成的基础[5],但确切的机理还不清楚,是被动地进入已存在的腔中或是主动地侵入(涉及到胶原降解活性的增高),还有待于研究[8]。
参考文献
[1] Linares.From wound to scar.Burns, 1996,22:339
[2] Brown RA,et al.Wound Rep Reg, 1997,5;212
[3] 伍津津,刘荣卿,叶庆佾,等.重建皮肤组织学研究,第三军医大学学报,1998,20(2):114
[4] 伍津津,刘荣卿,叶庆佾,等.真皮替代物培养模型的建立,中华皮肤科杂志,1998,31(4):256
, 百拇医药
[5] Bell E,Sher S,Hull I BE,et al.J Invest Dermatol,1983,81:2S
[6] Lenoir MC,Bernard BA,Pautrat G,et al.Dev Biol,1988,130:610
[7] Valle LCA,Auger FA,Rompre P,et al.Br J Dermatol,1992,127:365
[8] Smola H,Thiekotter G,Fusenig NE.J Cell Biol,1993,122:417
[9] Limat A,Breitkreutz D,Hunziker T,et al.Exp Cell Res,1991,194:218
[10] Harriger MD,Hull BE.J Burn Care Rehabil,1992,13:187
[11] Michel M,Germain L,Auger FA.In Vitro Cell Dev Biol,1993,29A:834
, 百拇医药
单位:第三军医大学西南医院皮肤科(400038)
关键词:人工皮肤;成纤维细胞;角朊细胞;三维培养
重庆医学990404 摘 要 模拟体内生理条件,采用细胞三维培养技术将角朊细胞接种在一活性真皮替代物(即成纤维细胞胶原凝胶)上,然后行气液界面培养,使角朊细胞的一些正常生长和分化的特征得以再现,从而形成一种能应用于临床的人工皮肤。而且这一培养模型使角朊细胞、成纤维细胞和细胞外基质构成了一有机的整体,因而也是研究表皮分化、真表皮间相互关系的良好模型。
A Model of Artificial Skin Estabished by Three-dimension Culfure
Wu Jinjin,Liu Rongqing,Ye Qingyi,Tang Shuqian,Zhong Baiyu
, http://www.100md.com
Department of Dermatology,Southwest Hospital,Third Military Medical University,Chongqing 4000038
Abstract:Using three-dimension culture technique imitating in vivo natural condition of skin,epidermal keratinocytes were plated on a dermal equivealent made up of fibroblasts in a collagen matrix that was contracted and modified by the resident cells,then exposed to the air-liquid interface.So keratinocytes could express the normal growth and differentiation.This is a living skin equivalent called artificial skin which can be used in Clinic.Since keratinocytes,fibroblasts and matrix all are in entity,this is a good model for studying the epidermal differentiation,epidermal-dermal interaction.
, http://www.100md.com
Key word:Artificial Skin,Fibroblast,Keratinocyte,Three-dimension culture.
如何促进和加速伤口的愈合,减少疤痕的形成是人们历来关注的重要课题,尤其是在大面积烧伤后自体皮源不足的情况下,如何及时覆盖创面、减轻创面收缩和疤痕增生,是临床一个急需解决的问题[1]。近20年来随着组织工程学的创立,人工皮肤、人工软骨、人工肝、人工血管等的研究正在迅速发展,其中尤以人工皮肤的研究最快[2]。近来我们也成功地建立了人工皮肤的培养模型,现报告如下。
1 材料与方法
1.1 头皮或包皮成纤维细胞培养 头皮取自急症创伤病人尸体或良性头皮肿瘤病人边缘的正常头皮,或是去皱整形的正常头皮,包皮取自包皮环切术后的正常包皮,头皮或包皮真皮成纤维细胞采用组织培养法按我科常规方法[3]进行。取第15代处于生长指数期的成纤维细胞制作细胞凝胶。
, http://www.100md.com
1.2 提前1天准备滋养细胞 包皮或头皮真皮成纤维细胞半融合时倒掉旧培养基,加入丝裂霉素C(6.7μg/ml)培养基3ml,37℃,10小时,然后换液,加入常规培养基,培养一天,以准备传代。
1.3 细胞凝胶的制备 提前2~5天准备细胞凝胶,方法参见前文报道[4],简述如下,在冰浴的青霉素小瓶中加入4ml鼠尾胶原(1.0~1.5mg/ml),0.5ml浓缩10倍的DMEM,混匀,加0.1ml 1N NaOH,混匀,立即加入成纤维细胞的小牛血清细胞悬液0.5ml,快速混合,制成间质细胞凝胶,如制作无细胞的凝胶,只加0.5ml小牛血清,然后吸到24孔板中。当凝胶收缩到0.8~1.0cm时,加入一自行设计的玻璃导管(内径为0.8或1.0cm,高均为1.0cm),压住胶原凝胶以防止它继续收缩。
1.4 表皮器官型培养 包皮无菌处理后剪成小皮片,用0.25%胰蛋白酶冷消化,分离表真皮,在5%新生牛血清D-Hanks液中将表皮细胞吹散,过筛,计数,离心。每孔接种1×105个细胞(0.2ml),加入10%新生牛血清DMEM培养基(加有EGF10ng/ml,氢化可的松0.4μg/ml,胰岛素5μg/ml)1ml培养,每二天换液一次。约十分钟后表皮细胞粘贴于胶原凝胶上后立即取掉玻璃导管。浸没培养一周,待角朊细胞融合后进行气液界面培养,在真皮替代物下加入用不锈钢筛网制成的衬垫,再培养1~2周。部分凝胶上不加3T3细胞或凝胶中不加间质细胞,以资对照。
, http://www.100md.com
1.5 组织学检查 培养组织一部分用Bouin's液固定24小时,常规石蜡切片,H.E.染色,另一部分用2.5%戊二醛固定,JEM-200EX电镜观察。
2 结 果
器官型培养后重建的表皮有15层以上,有基底层、基底上层和颗粒层,基底层为扁平形细胞,而非立方形,基底以上各层亦为扁平形细胞,浸没培养时表皮不出现角化层,气液界面培养时形成了数层角化层。如照片1,细胞间缺乏紧密连接和缝隙连接,颗粒层的细胞还可见到角质透明颗粒。如照片2,上层细胞有较多的成束状的张力微丝,越接近角质层,张力微丝束越粗,角质层为弥漫的成平行排列的张力微丝束。如照片3,真表皮交界处没有完整的基底膜形成,有短的线状致密物质沉积,没有见到半桥粒。
3 讨 论
人工皮肤就是采用细胞三维培养[即器官型培养(organotypic culture)]技术,将表皮细胞接种于一生物活性基质上作气液界面培养,生物活性基质有去表皮的死真皮,间质细胞胶原凝胶和基质凝胶(Matrigel)等。将培养物升至气液界面,主要是在其下加入一层衬垫,最常用的是加不锈钢筛网[5]和死真皮[6]。间质细胞胶原凝胶具有很强的收缩性[7],培养数天后出现收缩,这便导致了接种表皮细胞悬液时会流入四周孔壁,而能粘附于胶原凝胶的细胞很少,因此我们设计了一种玻璃管,目的是将胶原凝胶固定,一是阻止其继续收缩,二是防止细胞悬液流向四周,从我们的研究结果来看,这两个目的都达到了。

, 百拇医药
图1 重建皮肤后角朊细胞间的桥粒结构×40000

图2 重建皮肤后角朊细胞电镜观察×40000

图3 角质层为弥漫平行排列的纤力微丝×20000
我们的研究发现,表皮细胞直接接种到胶原凝胶上后贴壁很快,但在细胞胶原凝胶上生长差,不易融合,融合后细胞层数少,只有3~5层,因此,我们采用了滋养细胞,以前有文献用3T3细胞或人真皮成纤维细胞(HDF)做滋养层细胞[8,9],据此我们也是采用HDF做滋养细胞,从实验中可以肯定,用滋养层细胞有利于表皮细胞的生长和层化。单纯胶原认为是角朊细胞最好的基质,胶原能改善细胞的粘附、贴壁效果,是基底板层粘连素(lamina)形成所必需的。活细胞加到胶原基质中后它们的物理和化学性质得到修饰,使之具有真皮组织的重要特征。这种真皮替代物具有一定的机械性特性:恒定的张力、弹性、伸缩性和休克抵抗(Shock resistance)[7]。
, http://www.100md.com
胶原凝胶中的成纤维细胞重新组织胶原纤维,诱导出很强的收缩,收缩的强弱与成纤维细胞的数量成反比,与胶原浓度成正比[5,7]。本研究中凝胶收缩较强,前6天可达2mm/d。器官型培养的最大特点是层化后的表皮细胞层相似于活体表皮,有基底层、基底上层、颗粒层和角质层[8、9],厚可达10~15层。基底层呈立方形[9,10]或扁平形[11],这可能与培养基不同有关,在MSBM培养基(3∶1的DMEM/H12培养基加一些因子)中能使维持基底细胞保持立方形。本研究中表皮层可达15层以上,基底细胞呈扁平形,比在胶原凝胶上培养,表皮的形态有了很大的改善。
组织学检查表明人工皮肤没能形成完整的基底膜。培养时间过短是其主要的原因,有研究认为基底膜的形成在体外培养的周期至少需要1~2月。Bell报道在鼠皮肤的器官型培养中是有完整的基底膜形成的,但用人皮肤培养时也不能形成基底膜[5]。近来有研究报道[10]真表皮交界处有线状基底膜形成,表皮侧有半桥粒,电镜检查为透明层和致密层组成,膜上有锚丝(anchoring fibril)伸到胶原基质中,经抗体检测Ⅵ、Ⅶ型胶原。另有报道为Ⅳ型胶原沉积[8]。从超微结构来看,表皮细胞成熟的许多特征都可见到,有桥粒、角质透明颗粒和粗张力微丝束等,这与以前的报道相符。
, http://www.100md.com
在细胞胶原凝胶中还可见到表皮陷窝或球形体(向中心角化)形成。Bell认为成纤维细胞是隐窝形成的基础[5],但确切的机理还不清楚,是被动地进入已存在的腔中或是主动地侵入(涉及到胶原降解活性的增高),还有待于研究[8]。
参考文献
[1] Linares.From wound to scar.Burns, 1996,22:339
[2] Brown RA,et al.Wound Rep Reg, 1997,5;212
[3] 伍津津,刘荣卿,叶庆佾,等.重建皮肤组织学研究,第三军医大学学报,1998,20(2):114
[4] 伍津津,刘荣卿,叶庆佾,等.真皮替代物培养模型的建立,中华皮肤科杂志,1998,31(4):256
, 百拇医药
[5] Bell E,Sher S,Hull I BE,et al.J Invest Dermatol,1983,81:2S
[6] Lenoir MC,Bernard BA,Pautrat G,et al.Dev Biol,1988,130:610
[7] Valle LCA,Auger FA,Rompre P,et al.Br J Dermatol,1992,127:365
[8] Smola H,Thiekotter G,Fusenig NE.J Cell Biol,1993,122:417
[9] Limat A,Breitkreutz D,Hunziker T,et al.Exp Cell Res,1991,194:218
[10] Harriger MD,Hull BE.J Burn Care Rehabil,1992,13:187
[11] Michel M,Germain L,Auger FA.In Vitro Cell Dev Biol,1993,29A:834
, 百拇医药