大鼠局灶性脑缺血后一氧化氮与细胞凋亡关系的研究
作者:史树贵 邵淑琴 陈康宁
单位:史树贵 邵淑琴 陈康宁 第三军医大学附属西南医院神经内科) 重庆,400038
关键词:一氧化氮合酶;脑缺血;细胞凋亡
提要 目的提要 目的:研究脑缺血后一氧化氮合酶(Nitric Oxide Synthase,NOS)表达与细胞凋亡的关系。方法:采用大鼠右侧大脑中动脉闭塞(Middle cerebral artery occlusion,MCAO)模型,观察脑梗塞体积、NOS表达、细胞凋亡及NOS抑制剂硝基-L-精氨酸(L-NA)、NO供体硝普钠(SNP)对上述结果的影响。结果:NOS表达与缺血再灌流(IR)早期细胞凋亡有关,SNP增加IR早期细胞凋亡,L-NA能够抑制IR早期的细胞凋亡,但使脑梗塞体积增大。结论:IR早期NOS表达对细胞凋亡有促进作用。
中图法分类号 R329.25;R743.31
, http://www.100md.com
Study of the relationship between the quantity of nitric oxide and neuronal apoptosis after focal cerebral ischemia in rats
Shi Shugui, Shao Shuqin, Chen Kangning
Department of Neurology, Southwest Hospital, Third Military Medical University, Chongqing,400038
Abstract Objective: To study the relationship between the quantity of nitric oxide (in term of the expression of NO synthase) and neuronal apoptosis after focal cerebral ischemia. Methods: Focal cerebral ischemia was induced in adult wistar rats by ligating the right middle cerebral artery. The area of brain infarct was measured with TTC staining. NO synthase (NOS) was determined with NADPHd histochemistry. Neuronal apoptosis was measured with TUNEL technique and the proportion of apoptotic neurons with FCM. Results: The number of NADPHd positive cells was positively correlated to the number of apoptotic neurons in the early stage. SNP, a donor of NO, increased not only the number of NOS expressing cells but also the proportion of TUNEL positive cells 30 minutes to 6 hours after reperfusion. L-NA, an inhibitor of NOS, decreased the number of NOS expressing cells and the apoptotic neurons but enlarged the area of infarct. Conclusion: NO may be involved to neuronal apoptosis in the early stage after the onset of focal cerebral ischemia.
, 百拇医药
Key words nitric oxide synthase; cerebral ischemia; apoptosis; rat
近年研究证明细胞凋亡是缺血性脑损伤细胞死亡方式之一,NO参与多种组织和细胞的凋亡过程已有诸多文献报道。但NO是否在脑缺血性细胞死亡过程中发挥作用尚不清楚。本研究通过观察大鼠局灶性脑缺血后脑梗塞体积、NOS表达及细胞凋亡的时空分布,对此进行系统研究。
1 材料与方法
1.1 实验动物分组及用药
Wistar大鼠,体重280~320 g,随机分成IR组,SNP组,L-NA组,均于缺血后30 min再灌流。每组设缺血前(Pre),IR30 min,IR6 h,IR24 h,IR4 d共5个时相点,每组每个时相点各6只动物。放入线栓前30 min和术后30 min分别经腹腔给药各一次。SNP(Sigma公司)组:5 mg/kg,L-NA(Sigma公司)组:20 mg/kg。
, 百拇医药
1.2 大鼠右侧MCAO模型的制作
参照Laing等[1]法制作大鼠MCAO模型,线栓直径0.2 mm,放入深度为17~18 mm。以动物清醒后爬行时向左侧转圈,左前肢不能伸展为入组标准。缺血病灶在预实验阶段经10%印度墨汁灌注染色证实,见图1。
1.3 溴化2,3,5-三苯基四氮唑染色(TTC)染色
大鼠断头取脑,经前联合冠状切片,层厚5 mm,2%TTC(重庆化玻公司)37℃孵育60 min,置4%多聚甲醛中固定,计算体积百分比[2]。
1.4 尼克酰胺腺嘌呤二核苷酸磷酸黄递酶(NADPHd)组化染色
模型同上,4%多聚甲醛灌注固定,取脑,20%蔗糖浸泡过夜,冰冻切片,0.1 MPB漂洗,0.3%TritonX-100的PBS液孵育后取出加入含0.1 mg/ml硝基四氮唑蓝和1.0 mg/ml NADPHd的作用液中,37℃孵育45 min,终止染色。
, 百拇医药
1.5 末端脱氧核苷酸转移酶介导的dUTP切口末端标记(TUNEL)染色
灌注固定,取脑,石蜡包埋,经前联合冠状切片厚6 μm,脱蜡至水,20 μg/ml蛋白酶K 37℃作用15 min,0.3%甲醇/H2O2中室温作用30 min,浸入TdT缓冲液中37℃作用60 min行细胞凋亡染色,DAB显色。
1.6 神经细胞凋亡比率分析
活体断头取脑,取前额叶缺血区脑组织约10 g,胰蛋白酶消化,梯度离心法制成细胞悬液,加入荧光素标记的末端脱氧核苷酸转移酶37℃作用60 min,流式细胞仪测荧光比率。
1.7 统计学处理
采用双因素方差分析。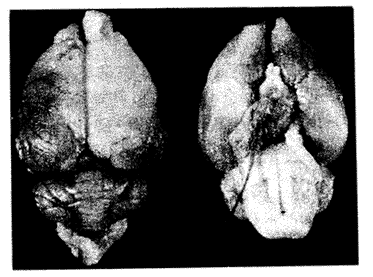
, 百拇医药
图1 右侧大脑中动脉闭塞24 h
印度墨汁灌注所示脑缺血灶,其中白色区域为病灶
Fig 1 Photograph of rat brain at autopsy after 24 hof right MCAO
The ischemic area can't be stained by Indian Ink
2 结果
2.1 TTC染色
梗塞区脑组织呈白色,非梗塞区呈红色,见图2;与IR组相比,L-NA和SNP明显增大脑梗塞积(P<0.05)。
, 百拇医药
图2 TTC染色所示脑缺血灶,其中白色区域为病灶(IR 6 h)
Fig 2 Photographs of coronal sections of rat brain removed 6 h after right MCAO and reperfusion. The infarct area can't be stained by TTC
2.2 各组NADPHd染色见表1
IR30 min时NADPHd表达明显增加,IR 6 h时达高峰,IR 24 h时有所下降,至IR 4 d时大致与缺血前水平相近(P>0.05)。L-NA组:NADPHd表达比IR组显著减少(P<0.05),IR 4 d时,NADPHd水平与IR组无显著差别;SNP组:各时相点NADPHd表达较IR组显著增多(P<0.05),IR 6 h时,还见血管壁有少量着色,见图3,IR 24 h时,病灶中心NADPHd表达显著减少,甚至低于IR组,但病灶周围血管壁有大量着色。
, 百拇医药
表1* 各组不同时相NADPHd图像分析结果(x±s)
Tab 1* Expression of NADPHd in rat forebrain(x±s)
Group
n
Pre
IR 30 min
IR 6 h
IR 24 h
IR 4 d
IR
6
, 百拇医药
25±8
99±9★
106±8★
51±11★
25±6
L-NA
6
22±4
59±20★ ▲
48±5★ ▲
9±11★ ▲
, http://www.100md.com
26±6
SNP
6
41±8▲
126±16★ ▲
143±23★ ▲
6±9★ ▲
0※
*:not include blood vessel wall staining;※:occured tissue necrosis, can′t be stained;★:P<0.05 vs Pre;▲:P<0.05 vs IR2.3 各组TUNEL染色结果见表2
, http://www.100md.com
缺血前及缺血对侧脑区仅见0~4/HP TUNEL细胞;IR 30 min时缺血区出现大量TUNEL细胞,主要分布在大脑皮层及纹状体,细胞核为圆形或卵圆形,大小较一致,周边深染,中心浅染;随IR时间延长,TUNEL细胞分布范围逐渐扩大,但IR后期C区与B区阳性细胞形态有差异,C区表现为多角形或不规则形,均匀深染,至IR 24 h时,病灶中心出现坏死灶,其中少量TUNEL细胞,核形态不规则,深染。SNP组,IR 30 min至IR 6 h时,病灶中TUNEL细胞数较IR组显著增多,且C区阳性细胞的形态在IR 6 h时已经发生改变,出现多角形和不规则形的均匀深染的凋亡细胞,见图4;在IR 24 h至IR 4 d期间,B区阳性细胞数目逐渐增多,且分布范围较IR组大,C区阳性细胞数目较IR组减少(P<0.05)。L-NA组:IR 30 min至IR 6 h,C区阳性细胞较IR组显著减少(P<0.05),B区阳性细胞与对照组相比无显著差别,IR 24 h至IR 4 d,C区阳性细胞数目与IR组相比无显著差别,但B区阳性细胞数目均较对照组减少(P<0.05)。
, 百拇医药
图3 SNP组IR 6 h,NADPHd阳性细胞大量增加,小血管壁有轻度着色
Fig 3 Increased NADPHd positive cells accompanied by mild staining of small vessels after 6 h of right MCAO and reperfusion in SNP group
图4 SNP组IR 6 h,病灶中心较早出现坏死,并伴有TUNEL阳性细胞形态改变
(TUNEL染色×400)
Fig 4 Cell apoptosis showed by TUNEL staining in the infarct core of rat after 6 h of right MCAO and reperfusion (TUNEL×400)
, 百拇医药
表2 各组TUNEL染色图像处理结果(x±s,n=6)
Tab 2 Apoptotic cells by TUNEL staining (x±s,n=6)
Pre
IR 30 min
IR 6 h
IR 24 h
IR 4 d
IR
C
0~4
172±12★
, 百拇医药
209±14★
129±14★
77±6★
B
155±17★
131±13★
136±21★
37±5★
L-NA
C
149±11★▲
, http://www.100md.com
179±22★▲
118±14★
80±17★
B
127±25★▲
123±12★
92±12★▲
48±7★
SNP
C
210±24★▲
, 百拇医药
244±27★▲
78±17★▲
12±8★▲
B
155±19★
174±4★▲
129±16★
32±6★▲
★:P<0.05 vs Pre;▲:P<0.05 vs the same area of the same time point;C:infarct center;B:infarct boundary
, 百拇医药
2.4 各处理因素对细胞荧光比率的变化
随着再灌流时间的延长,各组凋亡细胞阳性率明显升高,与IR组相比,SNP在IR 6~24 h期间明显增加凋亡细胞阳性率(P<0.05),L-NA使凋亡细胞阳性率降低,但仅在IR 24 h时与IR组差异显著(P<0.05)。
3 讨论
3.1 NADPHd组化作为NOS代表的可行性
NOS有神经性、内皮细胞性和巨噬细胞性3种异构体,均必需还原性NADPH作为辅酶,尽管在嗅上皮和梨鼻骨区等部位,NADPHd表达并不依赖于NOS[3],但在神经系统的大脑皮层、纹状体和许多其它组织中,NOS和NADPHd的分布是一致的。因此,本研究采用NADPHd代表NOS在脑组织中的存在部位有很好的可行性。
, 百拇医药 3.2 NO参与IR后细胞凋亡
近来研究发现,NO参与多种细胞的凋亡过程,NOS抑制剂如L-NA,NMMA,地塞米松等除了抑制NOS的表达外,还能抑制NO诱导的细胞凋亡作用,NO供体SNP能增强上述作用[4]。但另一些作者认为NO及其供体能抑制细胞凋亡,如由人的B淋巴细胞生成的NO能够抑制凋亡和EB病毒在人体中的再活化[5];破坏了IFN-γ受体A链基因的小鼠由于NO生成减少,对抗CD3抗体引起的疾病综合征更为敏感[6]。NO与神经细胞凋亡之间的关系尚不明确,有作者发现NO能诱导培养的皮层神经元凋亡[1]。但Mitrovic等[8]用不同浓度的NO孵育胶质细胞,发现NO引起少突胶质细胞的坏死而非凋亡,而小胶质细胞和星形细胞的DNA和细胞器均保持完整。
本研究发现,IR 30 min时,NADPHd阳性细胞大量增加,此时脑缺血区已有细胞凋亡,IR 30 min至24 h,NADPHd阳性细胞进一步增加,TUNEL阳性细胞亦进一步增加;SNP增加NOS表达,并增加IR早期细胞凋亡,说明NO参与了IR后神经细胞的凋亡过程,L-NA尽管在IR早期增加脑梗塞体积,但明显抑制NOS活性,并抑制IR早期的细胞凋亡,说明抑制NOS的活性可在IR早期减轻细胞凋亡,上述结果均证明NO参与了脑缺血和IR早期脑细胞的凋亡过程。
, 百拇医药
L-NA增加脑梗塞体积,与许多报道一致[9]。其机制为:①NO具有扩血管作用,抑制NO生成减少了rCBF;②NO抑制血小板的聚集,减少缺血区微血栓的形成;③NO能调节几种递质的释放,而这些递质中有的能拮抗L-谷氨酸的神经毒性;④NO与ET-1互相作用调节血管舒缩,使用L-NA后脑组织中ET-1含量明显增多。
3.3 NO参与脑缺血后细胞凋亡的可能机制
NOS在体内有cNOS和iNOS两种存在方式,cNOS主要表达于神经元,血管内皮细胞和平滑肌细胞,该酶属Ca2+和钙调素依赖蛋白,激活时立即合成释放NO,主要参与信使调控、扩血管等功能,正常情况下具有脑保护作用,在大量生成时具有细胞毒性;iNOS主要存在于胶质细胞、中性白细胞和巨噬细胞,为非钙依赖性酶,生理条件下iNOS活性可忽略不计,其诱导激活约需4~6 h,一旦激活则大量合成NO,且持续时间长,其合成释放的NO是造成组织损伤的主要原因[10]。在我们的研究中,NO对脑缺血后早期细胞凋亡的作用可能与脑缺血后该期cNOS的大量表达有关。血管内皮细胞可表达cNOS和iNOS,我们发现,SNP使IR 24 h后血管壁NOS表达明显增加,说明SNP除使IR早期cNOS表达增加外,还使IR晚期iNOS的表达增加,且后者可能是其主要作用。由于iNOS表达生成的NO持续时间长,是组织损伤的主要形式,因此,该长时间的严重损伤也可能为IR后期病灶中心出现以坏死而非凋亡为主的原因之一。这与Bonfoco等[11]得出“就同一种损伤因素而言,决定细胞是凋亡还是坏死取决于损伤因素的严重程度”的结论相一致。SNP增加脑梗塞体积亦可能与此有关,使用SNP后系统血压下降减少脑灌注使脑梗塞体积增加是否为脑梗塞体积增大的原因之一,还需要进一步研究。
, 百拇医药
至于NO与IR后期(IR 24 h至4 d)细胞凋亡的关系,从本研究的结果看,此时,NADPHd细胞明显减少,但组织中凋亡细胞仍较明显,FCM测定显示细胞凋亡荧光率明显升高,其原因可能为:①NO生成和NOS的表达均为一短暂过程,而在短时间内已发生凋亡的细胞不能恢复;②NADPHd阳性细胞是3种NOS阳性细胞的总和,而本研究所示之细胞凋亡与nNOS关系较密切;③细胞凋亡与许多因素有关,除NO外,Ca2+,兴奋性氨基酸等均与脑缺血后细胞凋亡有关,在不能肯定NO起主要作用的情况下,探讨NO与细胞凋亡的关系较为困难;④FCM所测定的凋亡细胞阳性率是样本中凋亡细胞的总和,而NADPHd阳性细胞数系图像分析所得的某一局部区域细胞数。
基金项目:国家自然科学基金资助项目,No.39670269
作者简介:史树贵,男,30岁,主治医师,硕士
参考文献
, 百拇医药
1 Laing R T, Jakubowski J, Laing R W. Middle cerebral artery occlusion without craniectomy in rats:which method works best? Stroke,1993,24(2):294
2 李敬诚,董为伟,傅雅各.Sprague-Dawley鼠局部脑缺血后脑电功率及电位分布图研究.重庆医科大学学报,1992,17(1):38
3 Kishimoto J, Keverne E B, Hardwick J, et al. Localization of nitric oxide synthase in the mouse olfactory and vomeronasal system: a histochemical, immunological and in situ hybridization study. Eur J Neurosci,1993,5(9):1684
, http://www.100md.com
4 Maciejewski J P, Selleri C, Sato T, et al. Nitric oxide suppression of human hematopoiesis in vitro. Contribution to inhibitory action of interferon-gamma and tumor necrosis factoralpha. J Clin Invest,1995,96(2):1085
5 Mannick J B, Asano K, Izumi K, et al. Nitric oxide produced by human B lymphocytes inhibits apoptosis and Epstein-Barr virus reactivation. Cell,1994,79(7):1137
6 Matthys P, Froyen G, Verdot L, et al. FN-gamma receptor-dificient mice are hypersensitive to the anti-CD3-induced cytokine release syndrome and thymocyte apoptosis. Protective role of endogenous nitric oxide. J Immunol,1995,155(8):3823
, http://www.100md.com
7 P O, Rigaud M. Nitric oxide induces cultured cortical neuron apoptosis. Neurosci Lett,1996,208(1):1
8 Mirtrovic B, Ignarro L S, Vinters H V, et al. Nitric oxide induces necrotic but not apoptic cell death in oligodendrocytes. Neurosci,1995,65(2):531
9 田恒力,赵卫国,张天锡,等.兔大脑中动脉阻断后脑缺血一氧化氮与内皮素的变化.神经生化学通讯,1995,8(2):62
10 Faraci F M, Brian J E. Nitric oxide and the cerebral circulation. Stroke,1994,25(3):692
11 Bonfoco E, Krainc D, Ankarcrina M, et al. Apoptosis and necrosis:two distinct events induced,respectively by mild and intence insults with N-methyl-D-aspartate or nitric oxide/suprexide in cortical cell cultures. Proc Natl Acad Sci USA,1995,92(16):7162
收稿:1998-06-25
修回:1998-12-11, http://www.100md.com
单位:史树贵 邵淑琴 陈康宁 第三军医大学附属西南医院神经内科) 重庆,400038
关键词:一氧化氮合酶;脑缺血;细胞凋亡
提要 目的提要 目的:研究脑缺血后一氧化氮合酶(Nitric Oxide Synthase,NOS)表达与细胞凋亡的关系。方法:采用大鼠右侧大脑中动脉闭塞(Middle cerebral artery occlusion,MCAO)模型,观察脑梗塞体积、NOS表达、细胞凋亡及NOS抑制剂硝基-L-精氨酸(L-NA)、NO供体硝普钠(SNP)对上述结果的影响。结果:NOS表达与缺血再灌流(IR)早期细胞凋亡有关,SNP增加IR早期细胞凋亡,L-NA能够抑制IR早期的细胞凋亡,但使脑梗塞体积增大。结论:IR早期NOS表达对细胞凋亡有促进作用。
中图法分类号 R329.25;R743.31
, http://www.100md.com
Study of the relationship between the quantity of nitric oxide and neuronal apoptosis after focal cerebral ischemia in rats
Shi Shugui, Shao Shuqin, Chen Kangning
Department of Neurology, Southwest Hospital, Third Military Medical University, Chongqing,400038
Abstract Objective: To study the relationship between the quantity of nitric oxide (in term of the expression of NO synthase) and neuronal apoptosis after focal cerebral ischemia. Methods: Focal cerebral ischemia was induced in adult wistar rats by ligating the right middle cerebral artery. The area of brain infarct was measured with TTC staining. NO synthase (NOS) was determined with NADPHd histochemistry. Neuronal apoptosis was measured with TUNEL technique and the proportion of apoptotic neurons with FCM. Results: The number of NADPHd positive cells was positively correlated to the number of apoptotic neurons in the early stage. SNP, a donor of NO, increased not only the number of NOS expressing cells but also the proportion of TUNEL positive cells 30 minutes to 6 hours after reperfusion. L-NA, an inhibitor of NOS, decreased the number of NOS expressing cells and the apoptotic neurons but enlarged the area of infarct. Conclusion: NO may be involved to neuronal apoptosis in the early stage after the onset of focal cerebral ischemia.
, 百拇医药
Key words nitric oxide synthase; cerebral ischemia; apoptosis; rat
近年研究证明细胞凋亡是缺血性脑损伤细胞死亡方式之一,NO参与多种组织和细胞的凋亡过程已有诸多文献报道。但NO是否在脑缺血性细胞死亡过程中发挥作用尚不清楚。本研究通过观察大鼠局灶性脑缺血后脑梗塞体积、NOS表达及细胞凋亡的时空分布,对此进行系统研究。
1 材料与方法
1.1 实验动物分组及用药
Wistar大鼠,体重280~320 g,随机分成IR组,SNP组,L-NA组,均于缺血后30 min再灌流。每组设缺血前(Pre),IR30 min,IR6 h,IR24 h,IR4 d共5个时相点,每组每个时相点各6只动物。放入线栓前30 min和术后30 min分别经腹腔给药各一次。SNP(Sigma公司)组:5 mg/kg,L-NA(Sigma公司)组:20 mg/kg。
, 百拇医药
1.2 大鼠右侧MCAO模型的制作
参照Laing等[1]法制作大鼠MCAO模型,线栓直径0.2 mm,放入深度为17~18 mm。以动物清醒后爬行时向左侧转圈,左前肢不能伸展为入组标准。缺血病灶在预实验阶段经10%印度墨汁灌注染色证实,见图1。
1.3 溴化2,3,5-三苯基四氮唑染色(TTC)染色
大鼠断头取脑,经前联合冠状切片,层厚5 mm,2%TTC(重庆化玻公司)37℃孵育60 min,置4%多聚甲醛中固定,计算体积百分比[2]。
1.4 尼克酰胺腺嘌呤二核苷酸磷酸黄递酶(NADPHd)组化染色
模型同上,4%多聚甲醛灌注固定,取脑,20%蔗糖浸泡过夜,冰冻切片,0.1 MPB漂洗,0.3%TritonX-100的PBS液孵育后取出加入含0.1 mg/ml硝基四氮唑蓝和1.0 mg/ml NADPHd的作用液中,37℃孵育45 min,终止染色。
, 百拇医药
1.5 末端脱氧核苷酸转移酶介导的dUTP切口末端标记(TUNEL)染色
灌注固定,取脑,石蜡包埋,经前联合冠状切片厚6 μm,脱蜡至水,20 μg/ml蛋白酶K 37℃作用15 min,0.3%甲醇/H2O2中室温作用30 min,浸入TdT缓冲液中37℃作用60 min行细胞凋亡染色,DAB显色。
1.6 神经细胞凋亡比率分析
活体断头取脑,取前额叶缺血区脑组织约10 g,胰蛋白酶消化,梯度离心法制成细胞悬液,加入荧光素标记的末端脱氧核苷酸转移酶37℃作用60 min,流式细胞仪测荧光比率。
1.7 统计学处理
采用双因素方差分析。

, 百拇医药
图1 右侧大脑中动脉闭塞24 h
印度墨汁灌注所示脑缺血灶,其中白色区域为病灶
Fig 1 Photograph of rat brain at autopsy after 24 hof right MCAO
The ischemic area can't be stained by Indian Ink
2 结果
2.1 TTC染色
梗塞区脑组织呈白色,非梗塞区呈红色,见图2;与IR组相比,L-NA和SNP明显增大脑梗塞积(P<0.05)。

, 百拇医药
图2 TTC染色所示脑缺血灶,其中白色区域为病灶(IR 6 h)
Fig 2 Photographs of coronal sections of rat brain removed 6 h after right MCAO and reperfusion. The infarct area can't be stained by TTC
2.2 各组NADPHd染色见表1
IR30 min时NADPHd表达明显增加,IR 6 h时达高峰,IR 24 h时有所下降,至IR 4 d时大致与缺血前水平相近(P>0.05)。L-NA组:NADPHd表达比IR组显著减少(P<0.05),IR 4 d时,NADPHd水平与IR组无显著差别;SNP组:各时相点NADPHd表达较IR组显著增多(P<0.05),IR 6 h时,还见血管壁有少量着色,见图3,IR 24 h时,病灶中心NADPHd表达显著减少,甚至低于IR组,但病灶周围血管壁有大量着色。
, 百拇医药
表1* 各组不同时相NADPHd图像分析结果(x±s)
Tab 1* Expression of NADPHd in rat forebrain(x±s)
Group
n
Pre
IR 30 min
IR 6 h
IR 24 h
IR 4 d
IR
6
, 百拇医药
25±8
99±9★
106±8★
51±11★
25±6
L-NA
6
22±4
59±20★ ▲
48±5★ ▲
9±11★ ▲
, http://www.100md.com
26±6
SNP
6
41±8▲
126±16★ ▲
143±23★ ▲
6±9★ ▲
0※
*:not include blood vessel wall staining;※:occured tissue necrosis, can′t be stained;★:P<0.05 vs Pre;▲:P<0.05 vs IR2.3 各组TUNEL染色结果见表2
, http://www.100md.com
缺血前及缺血对侧脑区仅见0~4/HP TUNEL细胞;IR 30 min时缺血区出现大量TUNEL细胞,主要分布在大脑皮层及纹状体,细胞核为圆形或卵圆形,大小较一致,周边深染,中心浅染;随IR时间延长,TUNEL细胞分布范围逐渐扩大,但IR后期C区与B区阳性细胞形态有差异,C区表现为多角形或不规则形,均匀深染,至IR 24 h时,病灶中心出现坏死灶,其中少量TUNEL细胞,核形态不规则,深染。SNP组,IR 30 min至IR 6 h时,病灶中TUNEL细胞数较IR组显著增多,且C区阳性细胞的形态在IR 6 h时已经发生改变,出现多角形和不规则形的均匀深染的凋亡细胞,见图4;在IR 24 h至IR 4 d期间,B区阳性细胞数目逐渐增多,且分布范围较IR组大,C区阳性细胞数目较IR组减少(P<0.05)。L-NA组:IR 30 min至IR 6 h,C区阳性细胞较IR组显著减少(P<0.05),B区阳性细胞与对照组相比无显著差别,IR 24 h至IR 4 d,C区阳性细胞数目与IR组相比无显著差别,但B区阳性细胞数目均较对照组减少(P<0.05)。

, 百拇医药
图3 SNP组IR 6 h,NADPHd阳性细胞大量增加,小血管壁有轻度着色
Fig 3 Increased NADPHd positive cells accompanied by mild staining of small vessels after 6 h of right MCAO and reperfusion in SNP group

图4 SNP组IR 6 h,病灶中心较早出现坏死,并伴有TUNEL阳性细胞形态改变
(TUNEL染色×400)
Fig 4 Cell apoptosis showed by TUNEL staining in the infarct core of rat after 6 h of right MCAO and reperfusion (TUNEL×400)
, 百拇医药
表2 各组TUNEL染色图像处理结果(x±s,n=6)
Tab 2 Apoptotic cells by TUNEL staining (x±s,n=6)
Pre
IR 30 min
IR 6 h
IR 24 h
IR 4 d
IR
C
0~4
172±12★
, 百拇医药
209±14★
129±14★
77±6★
B
155±17★
131±13★
136±21★
37±5★
L-NA
C
149±11★▲
, http://www.100md.com
179±22★▲
118±14★
80±17★
B
127±25★▲
123±12★
92±12★▲
48±7★
SNP
C
210±24★▲
, 百拇医药
244±27★▲
78±17★▲
12±8★▲
B
155±19★
174±4★▲
129±16★
32±6★▲
★:P<0.05 vs Pre;▲:P<0.05 vs the same area of the same time point;C:infarct center;B:infarct boundary
, 百拇医药
2.4 各处理因素对细胞荧光比率的变化
随着再灌流时间的延长,各组凋亡细胞阳性率明显升高,与IR组相比,SNP在IR 6~24 h期间明显增加凋亡细胞阳性率(P<0.05),L-NA使凋亡细胞阳性率降低,但仅在IR 24 h时与IR组差异显著(P<0.05)。
3 讨论
3.1 NADPHd组化作为NOS代表的可行性
NOS有神经性、内皮细胞性和巨噬细胞性3种异构体,均必需还原性NADPH作为辅酶,尽管在嗅上皮和梨鼻骨区等部位,NADPHd表达并不依赖于NOS[3],但在神经系统的大脑皮层、纹状体和许多其它组织中,NOS和NADPHd的分布是一致的。因此,本研究采用NADPHd代表NOS在脑组织中的存在部位有很好的可行性。
, 百拇医药 3.2 NO参与IR后细胞凋亡
近来研究发现,NO参与多种细胞的凋亡过程,NOS抑制剂如L-NA,NMMA,地塞米松等除了抑制NOS的表达外,还能抑制NO诱导的细胞凋亡作用,NO供体SNP能增强上述作用[4]。但另一些作者认为NO及其供体能抑制细胞凋亡,如由人的B淋巴细胞生成的NO能够抑制凋亡和EB病毒在人体中的再活化[5];破坏了IFN-γ受体A链基因的小鼠由于NO生成减少,对抗CD3抗体引起的疾病综合征更为敏感[6]。NO与神经细胞凋亡之间的关系尚不明确,有作者发现NO能诱导培养的皮层神经元凋亡[1]。但Mitrovic等[8]用不同浓度的NO孵育胶质细胞,发现NO引起少突胶质细胞的坏死而非凋亡,而小胶质细胞和星形细胞的DNA和细胞器均保持完整。
本研究发现,IR 30 min时,NADPHd阳性细胞大量增加,此时脑缺血区已有细胞凋亡,IR 30 min至24 h,NADPHd阳性细胞进一步增加,TUNEL阳性细胞亦进一步增加;SNP增加NOS表达,并增加IR早期细胞凋亡,说明NO参与了IR后神经细胞的凋亡过程,L-NA尽管在IR早期增加脑梗塞体积,但明显抑制NOS活性,并抑制IR早期的细胞凋亡,说明抑制NOS的活性可在IR早期减轻细胞凋亡,上述结果均证明NO参与了脑缺血和IR早期脑细胞的凋亡过程。
, 百拇医药
L-NA增加脑梗塞体积,与许多报道一致[9]。其机制为:①NO具有扩血管作用,抑制NO生成减少了rCBF;②NO抑制血小板的聚集,减少缺血区微血栓的形成;③NO能调节几种递质的释放,而这些递质中有的能拮抗L-谷氨酸的神经毒性;④NO与ET-1互相作用调节血管舒缩,使用L-NA后脑组织中ET-1含量明显增多。
3.3 NO参与脑缺血后细胞凋亡的可能机制
NOS在体内有cNOS和iNOS两种存在方式,cNOS主要表达于神经元,血管内皮细胞和平滑肌细胞,该酶属Ca2+和钙调素依赖蛋白,激活时立即合成释放NO,主要参与信使调控、扩血管等功能,正常情况下具有脑保护作用,在大量生成时具有细胞毒性;iNOS主要存在于胶质细胞、中性白细胞和巨噬细胞,为非钙依赖性酶,生理条件下iNOS活性可忽略不计,其诱导激活约需4~6 h,一旦激活则大量合成NO,且持续时间长,其合成释放的NO是造成组织损伤的主要原因[10]。在我们的研究中,NO对脑缺血后早期细胞凋亡的作用可能与脑缺血后该期cNOS的大量表达有关。血管内皮细胞可表达cNOS和iNOS,我们发现,SNP使IR 24 h后血管壁NOS表达明显增加,说明SNP除使IR早期cNOS表达增加外,还使IR晚期iNOS的表达增加,且后者可能是其主要作用。由于iNOS表达生成的NO持续时间长,是组织损伤的主要形式,因此,该长时间的严重损伤也可能为IR后期病灶中心出现以坏死而非凋亡为主的原因之一。这与Bonfoco等[11]得出“就同一种损伤因素而言,决定细胞是凋亡还是坏死取决于损伤因素的严重程度”的结论相一致。SNP增加脑梗塞体积亦可能与此有关,使用SNP后系统血压下降减少脑灌注使脑梗塞体积增加是否为脑梗塞体积增大的原因之一,还需要进一步研究。
, 百拇医药
至于NO与IR后期(IR 24 h至4 d)细胞凋亡的关系,从本研究的结果看,此时,NADPHd细胞明显减少,但组织中凋亡细胞仍较明显,FCM测定显示细胞凋亡荧光率明显升高,其原因可能为:①NO生成和NOS的表达均为一短暂过程,而在短时间内已发生凋亡的细胞不能恢复;②NADPHd阳性细胞是3种NOS阳性细胞的总和,而本研究所示之细胞凋亡与nNOS关系较密切;③细胞凋亡与许多因素有关,除NO外,Ca2+,兴奋性氨基酸等均与脑缺血后细胞凋亡有关,在不能肯定NO起主要作用的情况下,探讨NO与细胞凋亡的关系较为困难;④FCM所测定的凋亡细胞阳性率是样本中凋亡细胞的总和,而NADPHd阳性细胞数系图像分析所得的某一局部区域细胞数。
基金项目:国家自然科学基金资助项目,No.39670269
作者简介:史树贵,男,30岁,主治医师,硕士
参考文献
, 百拇医药
1 Laing R T, Jakubowski J, Laing R W. Middle cerebral artery occlusion without craniectomy in rats:which method works best? Stroke,1993,24(2):294
2 李敬诚,董为伟,傅雅各.Sprague-Dawley鼠局部脑缺血后脑电功率及电位分布图研究.重庆医科大学学报,1992,17(1):38
3 Kishimoto J, Keverne E B, Hardwick J, et al. Localization of nitric oxide synthase in the mouse olfactory and vomeronasal system: a histochemical, immunological and in situ hybridization study. Eur J Neurosci,1993,5(9):1684
, http://www.100md.com
4 Maciejewski J P, Selleri C, Sato T, et al. Nitric oxide suppression of human hematopoiesis in vitro. Contribution to inhibitory action of interferon-gamma and tumor necrosis factoralpha. J Clin Invest,1995,96(2):1085
5 Mannick J B, Asano K, Izumi K, et al. Nitric oxide produced by human B lymphocytes inhibits apoptosis and Epstein-Barr virus reactivation. Cell,1994,79(7):1137
6 Matthys P, Froyen G, Verdot L, et al. FN-gamma receptor-dificient mice are hypersensitive to the anti-CD3-induced cytokine release syndrome and thymocyte apoptosis. Protective role of endogenous nitric oxide. J Immunol,1995,155(8):3823
, http://www.100md.com
7 P O, Rigaud M. Nitric oxide induces cultured cortical neuron apoptosis. Neurosci Lett,1996,208(1):1
8 Mirtrovic B, Ignarro L S, Vinters H V, et al. Nitric oxide induces necrotic but not apoptic cell death in oligodendrocytes. Neurosci,1995,65(2):531
9 田恒力,赵卫国,张天锡,等.兔大脑中动脉阻断后脑缺血一氧化氮与内皮素的变化.神经生化学通讯,1995,8(2):62
10 Faraci F M, Brian J E. Nitric oxide and the cerebral circulation. Stroke,1994,25(3):692
11 Bonfoco E, Krainc D, Ankarcrina M, et al. Apoptosis and necrosis:two distinct events induced,respectively by mild and intence insults with N-methyl-D-aspartate or nitric oxide/suprexide in cortical cell cultures. Proc Natl Acad Sci USA,1995,92(16):7162
收稿:1998-06-25
修回:1998-12-11, http://www.100md.com