抑制NO生物合成对肝硬变大鼠血流动力学的影响
作者:王承泰 戴坤扬 林擎天 邝耀麟
单位:王承泰 戴坤扬 林擎天 上海市第六人民医院外科(200233);邝耀麟 上海第二医科大学附属仁济医院(200001)
关键词:肝硬变;门静脉高压症;高动力循环;一氧化氮
肝胆胰外科杂志990410 摘 要 目的 探讨NO在肝硬变门脉高压血流动力学中的作用。方法 用SD大鼠制备肝硬变门脉高压(CPH)模型,正常鼠做为对照组。每一组实验动物再分成三个亚组:NO生物合成抑制剂L-NMMA组、L-NMMA+NO生物合成底物L-arginine组和生理盐水安慰剂组。血流动力学研究用放射性微球检测技术。结果 CPH鼠出现心输出量和内脏血流量增加,平均动脉压、外周和内脏血管阻力降低等高血流动力学特征。L-NMMA可以纠正CPH鼠的高血流动力学状态,各指标达到正常鼠基础水平。先给予L-arginine,则L-NMMA对CPH鼠的作用消失。结论 肝硬变门脉高压中NO过量形成在高动力循环中起重要作用。
, 百拇医药
Effects of endogenous nitric oxide inhibition on the hemodynamic changes of cirrhotic portal hypertensive rats
Wang Chengtai,Dai Kunyang,Lin Qingtian,et al.
Department of Surgery,Shanghai Sixth Hospital,Shanghai,200233
Abstract Objective To evaluate the role of nitric oxide(NO) in hyperdynamic circulation in cirrhotic portal hypertension.Methods Forty-three male SD rats were divided into two groups:Cirrhotic portal hypertension(CPH,n=22) by percutaneous administration of CCl4 and normal control(n=21).Both groups were divided into three subgroups:L-NMMA(50mg/kgBW),L-NMMA plus L-arginine(30mg/kgBW) and normal saline solution.The hemodynamics were measured by radioactive microsphere techniques.Results The characteristics of hyperdynamic circulation state are shown by increased cardiac output and splanchnic blood flow,decreased mean arterial blood pressure,portal peripheral vascular resistance and splanchnic vascular resistance in CPH rats,which were effectively corrected by L-NMMA.These effects of L-NMMA in CPH rats were reversed by prior administration of L-arginine.Conclusion NO plays an important role in hyperdynamic circulation in cirrhotic portal hypertension.
, 百拇医药
Key word Cirrhosis Portal hypertension Hyperdynamic circulation Nitric oxide
我们曾应用NO合成酶抑制剂(L-NMMA)观察了对门静脉部分结扎(PVL)大鼠血流动力学的影响[1],证实NO具有调节PVL大鼠全身和内脏高动力循环的作用。本实验用同样方法观察了对肝内型门静脉高压症(CPH)大鼠的影响,结果报道如下。
1 材料和方法
1.1 实验动物和模型制备 雄性SD大鼠,体重200~250g,平均223g。皮下注射60%CCl4油性溶液(60%CCl4、40%中性茶油),0.3ml/100g体重(首次剂量0.5ml/100g体重),每周注射两次,共注射8周,10%乙醇代替饮水,食用普通颗粒饲料,对照组大鼠在同等条件下饲养,不注射药物,正常饮水。两周后进行血流动力学实验。
, http://www.100md.com
1.2 实验动物分组 CPH和正常对照组大鼠分成:①L-NMMA组,给予NO抑制剂NG-甲基-L-精氨酸(L-NMMA)50mg/kg,iv;②安慰剂组,生理盐水1ml,iv;CPH大鼠又分成,③L-精氨酸(L-arg)+L-NMMA组,在给予L-NMMA前5分钟,先给L-arg 300mg/kg,iv。每组7只鼠。以上试剂均由Sigma Chemical Co提供。
1.3 血流动力学研究方法[2] 盐酸氯胺酮麻醉(100mg/kg,im.),右侧颈动脉和左侧股动脉各插入一根PE-50导管,分别插到左心室和腹主动脉,导管与生理记录仪连接(VSM-1,美国),左颈外静脉插入另一根PE-50导管,连接微量输液泵(IVAC-500,美国),实验的全过程中输入乳酸林格氏液(0.1ml/min)。于左侧腋前线腹部纵行切口1.5~2cm,暴露脾脏。大鼠被固定在装有温度控制的实验台上(自制),直肠温度保持在37±0.5℃,室温22~24℃。
, 百拇医药
以上操作结束后,稳定10min,然后记录平均动脉压(MAP),用4号针头(连接生理记录仪)刺入脾脏实质内,间接测量门静脉压力(PP)。从左颈外静脉导管注入实验试剂(生理盐水、L-NMMA、L-arg),注入试剂10min后,再次记录MAP和PP。经左心室导管注入大约5万51Cr-微球(直径15±0.5μm,Du Pont Co),在注入微球前10秒钟从股静脉导管抽取参考血样,速度1ml/min,取血75秒钟(WZ微量注射机,浙江医科大学医学仪器厂)。脾实质穿刺注入大约3万57Co-微球(直径15±0.5μm,Du Pont Co),脾脏穿刺部位压迫止血5min,然后把脾脏送回腹腔,10min后静脉注射KCl处死动物。取下肺、肝、脾、胰、大小肠和肠系膜,分别称重后,用γ-能谱仪(GP-1型,上海电子仪器厂)检测各脏器51Cr和57Co的1分钟脉冲数(cpm)。
1.4 血流动力学指标计算方法
, 百拇医药
心输出量(CO)(ml/min)=[注入51Cr(cpm)×参考血样(ml/min)]/[参考血样51Cr(cpm)]
心脏指数(CI)(ml.min-1.100gBW-1)=CO(ml/min)/体重%
脏器血流量(ml/min)=[脏器51Cr(cpm)×参考血样(ml/min)]/参考血样51Cr(cpm)
门静脉血流量(PVI)等于胃、胰、脾、肠和肠系膜血流量之和。
门体分流量(PSS%)={[肺57Co(cpm)]/[肺57Co(cpm)+肝57Co(cpm)]}×100
, http://www.100md.com
血管阻力(kPa.ml-1.min-1)=[P1-P2(kPa)]/Q(ml/min)
外周血管阻力(TRR)是MAP(P1)减去右心房压(P2)与CO(Q)之间计算,内脏血管阻力(SVR)是MAP(P1)减去PP(P2)与PVJ(Q)之间计算,门静脉血管阻力(PVR)是PP(P1)减去下腔静脉压力(P2)与PVI(Q)之间计算。右心房和下腔静脉压力很低(0~1mmHg),计算时被忽略。
1.5 统计方法 结果用X±S表示,配对和非配对t检验比较组间显著性差异。
2 结果
, http://www.100md.com
2.1 CPH鼠形成了高动力循环状态 在实验结束解剖内脏时,可见肝脏已形成肝硬变结节,光镜下见到假小叶形成的组织学特征。在基础状态时(Resting或Vehicle),与对照组比较,CPH鼠心输出量(CO)和心脏指数(CI)显著增大(P<0.05),平均动脉压(MAP)和总外周血管阻力(TRR)显著性降低(P<0.05);内脏血流动力学情况显示,门静脉压力(PP)明显增高(P<0.05),门静脉血流量(PVI)增加了22%(P<0.05),内脏血管阻力(SVR)明显下降(P<0.05),而门静脉血管阻力(PVR)无显著性变化,CPH鼠形成了大量的门体分流(PSS,38%±16%)(表1~表3)。
表1 L-NMMA对门静脉压力(PP)和平均动脉压力(MAP)的影响 (kPa,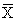 ±s)
±s)
Resting
, http://www.100md.com
Vehicle
Resting
L-NMMA
L-NMMA+L-arg
PP
Con
1.24±0.07
1.28±0.11
1.29±0.09
1.29±0.13
CPH
1.56±0.12*
, 百拇医药
1.54±0.14*
1.53±0.11*
1.47±0.16*
1.53±0.13
MAP
Con
16.8±0.74
17.2±1.68
16.7±0.79
19.1±0.91
CPH
, 百拇医药
13.5±0.82*
13.5±1.1*
13.6±0.89*
18.9±1.67△
14.4±1.51
与对照组(Control)比较:*P<0.05;与同组Resting比较:△P<0.05。
表2 L-NMMA对全身血流动力学的影响
Control rats
CPH rats
, 百拇医药 L-NMMA+L-arg
Vehicle
L-NMMA
Vehicle
L-NMMA
CO(ml/min)
93.6±6.3
87.1±7.7
125±7.2*
116±8.3*
128±12.7
, 百拇医药 CI(ml.min-1.100gBW-1)
37.9±3.7
36.0±6.0
45.5±4.1*
36.4±3.0△
43.4±5.6
TRR(kPa.ml-1.min-1.100gBW-1)
, 百拇医药
0.08±0.01
0.084±0.01
0.039±0.01*
0.06±0.01*△
0.04±0.01
与对照组(Control)比较:*P<0.05;与同组Vehicle比较:△P<0.05。
表3 L-NMMA对内脏血流动力学的影响
Control rats
CPH rats
L-NMMA+L-arg
, http://www.100md.com
Vehicle
L-NMMA
Vehicle
L-NMMA
PVI(ml.min-1.100gBW-1)
5.84±0.31
5.39±0.6
7.14±0.88*
6.06±0.83+
7.08±0.91
, 百拇医药
PVR(kPa.ml-1.min-1)
0.088±0.008
0.091±0.012
0.083±0.007
0.096±0.01+
0.084±0.008
SVR(kPa.ml-1.min-1.100gBW-1)
, 百拇医药
0.48±0.04
0.6±0.07
0.28±0.03*
0.37±0.06+
0.2±0.05+
PSS(%)
0.87±0.19
0.86±0.15
38±16*
13.8±6.18+
, 百拇医药 33.8±17
与对照组(Control)比较:*P<0.05;与同组Vehicle比较:+P<0.05。
2.2 L-NMMA对CPH鼠全身血流动力学的影响 静脉注入L-NMMA后CPH鼠的MAP明显升高,与肝前型门静脉高压鼠(PVL)相比[1],升高MAP的作用产生缓慢,升高幅度低于PVL鼠,药物作用时间长于PVL鼠,给药后10min测得MAP的作用产生缓慢,1.67kPa,比Vehicle组显著升高(P<0.05),已达到对照组水平:TRR显著性升高(P<0.05),CO和CI明显下降(P<0.05),CI达到对照组水平。对照组在给L-NMMA后各指标也有轻度变化,但均未达到统计学差异(表1、表2)。
2.3 L-NMMA对CPH鼠内脏血流动力学的影响 L-NMMA使PVI明显下降(P<0.05),SVR和PVR显著升高(P<0.05),PSS下降24%,PP轻度下降,但无统计学意义(表1、表3)。
, 百拇医药
先给予L-arg后5min,再注入L-NMMA,则L-NMMA升高MAP和对其他心血管系统的影响消失。单独注入L-arg对CPH大鼠的影响与PVL基本类似[1]。
3 讨论
3.1 CPH大鼠内脏高动力循环形成 Groszmann用同样方法诱导的肝硬变大鼠全部形成了门静脉高压和不同程度的PSS,内脏血流量增加,内脏和外周血管阻力下降,形成内脏高动力循环状态。全身血流动力学变化包括心输出量增加,血管阻力下降和低平均动脉压。文献报道在出现腹水以前30%~50%的肝硬变病人和全部门静脉高压动物模型已经出现高动力循环状态。本文肝硬变门静脉高压症大鼠出现心输出量和内脏血流量增多,门静脉压力增高和低平均动脉压,外周和内脏血管阻力下降,与文献相一致[3~5]。
3.2 NO在肝硬变大鼠内脏高动力循环中的调节作用 内源性NO具有舒张血管平滑肌和扩张动、静脉,对调节血管状态起重要作用。有资料表明肝硬变时全身和内脏血管扩张是由于对内源性血管收缩物质的敏感性降低或/和内源性血管舒张物质活性增高所至。还有资料表明诱导内源性NO分泌可导致末稍血管扩张,低血压和心率加快,类似门静脉高压高动力循环的反应。另有实验证明NO可以调节CCl4诱导的肝硬变鼠的低血压[6,7]。已经证实,内皮合成NO与摄取L-arg的胍基氮原子有关,L-arg是NO合成的前体,而作为异构体的L-NMMA,可与L-arg发生竞争拮抗作用,抑制NO合成分泌。本文应用L-NMMA观察对CPH大鼠的影响,抑制NO生物合成后,可以提高平均动脉压,降低心输出量和内脏血流量,还观察到降低门体分流和增加血管阻力,具有改善肝硬变大鼠高动力循环的作用,说明在肝硬变内脏高动力循环形成中,NO可能是重要的调节物质。
, 百拇医药
3.3 门体分流、内毒素与肝硬变血管舒张的关系 在动物实验中,NO的启动是被乙酰胆碱或其它激动剂所引起,导致末梢血管扩张和低血压。肝硬变时如果某物质启动了内皮细胞NO合成酶,使之合成分泌增多,就可以使血管扩张并导致高动力循环状态。一些实验结果提示在肝硬变高动力循环中,NO的启动和作用与细菌内毒素和脂多糖有关,这些物质可能是内皮细胞合成NO的触发者。在体外把血管暴露于内毒素或胞质中,在内皮细胞和血管平滑肌中有NO合成酶表达[8~10]。肝硬变门静脉高压症时,由于门体分流异常,使正常情况下可被肝脏清除的肠道细菌释出的内毒素进入体循环。大多数肝硬变病人,即使在无明显感染时,体循环中也可测到较高水平的内毒素[11]。本文肝硬变鼠存在大量门体分流,且分流量越大者(PVL大鼠),内脏和全身高动力循环越严重,提示细菌内毒素和脂多糖可能是门静脉高压时NO合成分泌增多的触发者。
3.4 阻断NO的作用可能对门静脉高压症的治疗有益 从临床的角度推测,如果肝硬变内毒素血症导致NO合成酶产生增多,而NO合成分泌增多又是肝硬变高动力循环产生的原因,则提示阻断该途径可以防止和逆转与血管扩张有关的并发症,诸如食道胃底静脉曲张破裂出血、腹水、浮肿和肝肾综合症。选择性的给予肠道抗生素,也可以防止NO合成酶产生,对预防和治疗门静脉高压症高动力循环的发生和发展有重要意义。
, 百拇医药
参考文献
1 王承泰,邝耀麟,陈治平等.抑制NO的生物合成对肝前型门静脉高压症大鼠血流动力学的影响.中华实验外科杂志,1994,11(增刊)∶23~25
2 Roberto J,Groszmann RJ,Vorobioff J,et al.Splanchnic hemodynamics in portal-hypertensive rats:measurement with γ-labeled microspheres.Am J Physiol,1982,242∶G156~160
3 王承泰,邝耀麟,陈治平等.肝内型门静脉高压大鼠内脏高动力循环状态.中华消化杂志,1995,15∶209~211
4 Vorobioff J,Bredfeldt JE,Groszmann RJ.Increased blood flow through the portal system in cirrhotic rats.Gastroenterology,1984,87∶1120~1126
, 百拇医药
5 王承泰,邝耀麟,陈治平.肝前型门静脉高压大鼠高动力循环状态.中华外科杂志,1994,32∶573~575
6 Palmer RM,Ferrige AG,Moncada S.Nitric oxide release accounts for the biological activity of endothelium-devived relaxion factor.Nature,1987,327∶524~526
7 Claria J,Jimenez W,Ros J.Pathogenesis of arterial hypotension in cirrhotic rats with ascites:role of endogeneus nitric oxide.Hepatology,1992,15∶343~349
8 Busse R,Musch A.Induction of nitric oxide synthase by cytokines in vascular smooth muscle cells.FEBS Lett,1990,275∶87~90
, 百拇医药
9 Rees DD,Cellek S,Palmer RM,et al.Dexamethasone prevents the induction by endotoxin of a nitric into entotoxin shock.Biochem Biophys Res Commun,1990,173∶541~547
10 Beasley D,Schwartz JH,Brenner BM.Interleukin 1 induces prolonged L-arginine dependent cyclic guanosine monophosphate and nitrite production in rat vascular smooth muscle cells.J Clin Invest,1991,87∶602~608
11 Lumsden AB,Henderson JM,Kutner MH.Endotoxin levels measured by achromogenic assay in portal,hepatic and peripgeral venous blood in patient with cirrhosis.Hepatology,1988,8∶232~236
(收稿:1999-06-20), 百拇医药
单位:王承泰 戴坤扬 林擎天 上海市第六人民医院外科(200233);邝耀麟 上海第二医科大学附属仁济医院(200001)
关键词:肝硬变;门静脉高压症;高动力循环;一氧化氮
肝胆胰外科杂志990410 摘 要 目的 探讨NO在肝硬变门脉高压血流动力学中的作用。方法 用SD大鼠制备肝硬变门脉高压(CPH)模型,正常鼠做为对照组。每一组实验动物再分成三个亚组:NO生物合成抑制剂L-NMMA组、L-NMMA+NO生物合成底物L-arginine组和生理盐水安慰剂组。血流动力学研究用放射性微球检测技术。结果 CPH鼠出现心输出量和内脏血流量增加,平均动脉压、外周和内脏血管阻力降低等高血流动力学特征。L-NMMA可以纠正CPH鼠的高血流动力学状态,各指标达到正常鼠基础水平。先给予L-arginine,则L-NMMA对CPH鼠的作用消失。结论 肝硬变门脉高压中NO过量形成在高动力循环中起重要作用。
, 百拇医药
Effects of endogenous nitric oxide inhibition on the hemodynamic changes of cirrhotic portal hypertensive rats
Wang Chengtai,Dai Kunyang,Lin Qingtian,et al.
Department of Surgery,Shanghai Sixth Hospital,Shanghai,200233
Abstract Objective To evaluate the role of nitric oxide(NO) in hyperdynamic circulation in cirrhotic portal hypertension.Methods Forty-three male SD rats were divided into two groups:Cirrhotic portal hypertension(CPH,n=22) by percutaneous administration of CCl4 and normal control(n=21).Both groups were divided into three subgroups:L-NMMA(50mg/kgBW),L-NMMA plus L-arginine(30mg/kgBW) and normal saline solution.The hemodynamics were measured by radioactive microsphere techniques.Results The characteristics of hyperdynamic circulation state are shown by increased cardiac output and splanchnic blood flow,decreased mean arterial blood pressure,portal peripheral vascular resistance and splanchnic vascular resistance in CPH rats,which were effectively corrected by L-NMMA.These effects of L-NMMA in CPH rats were reversed by prior administration of L-arginine.Conclusion NO plays an important role in hyperdynamic circulation in cirrhotic portal hypertension.
, 百拇医药
Key word Cirrhosis Portal hypertension Hyperdynamic circulation Nitric oxide
我们曾应用NO合成酶抑制剂(L-NMMA)观察了对门静脉部分结扎(PVL)大鼠血流动力学的影响[1],证实NO具有调节PVL大鼠全身和内脏高动力循环的作用。本实验用同样方法观察了对肝内型门静脉高压症(CPH)大鼠的影响,结果报道如下。
1 材料和方法
1.1 实验动物和模型制备 雄性SD大鼠,体重200~250g,平均223g。皮下注射60%CCl4油性溶液(60%CCl4、40%中性茶油),0.3ml/100g体重(首次剂量0.5ml/100g体重),每周注射两次,共注射8周,10%乙醇代替饮水,食用普通颗粒饲料,对照组大鼠在同等条件下饲养,不注射药物,正常饮水。两周后进行血流动力学实验。
, http://www.100md.com
1.2 实验动物分组 CPH和正常对照组大鼠分成:①L-NMMA组,给予NO抑制剂NG-甲基-L-精氨酸(L-NMMA)50mg/kg,iv;②安慰剂组,生理盐水1ml,iv;CPH大鼠又分成,③L-精氨酸(L-arg)+L-NMMA组,在给予L-NMMA前5分钟,先给L-arg 300mg/kg,iv。每组7只鼠。以上试剂均由Sigma Chemical Co提供。
1.3 血流动力学研究方法[2] 盐酸氯胺酮麻醉(100mg/kg,im.),右侧颈动脉和左侧股动脉各插入一根PE-50导管,分别插到左心室和腹主动脉,导管与生理记录仪连接(VSM-1,美国),左颈外静脉插入另一根PE-50导管,连接微量输液泵(IVAC-500,美国),实验的全过程中输入乳酸林格氏液(0.1ml/min)。于左侧腋前线腹部纵行切口1.5~2cm,暴露脾脏。大鼠被固定在装有温度控制的实验台上(自制),直肠温度保持在37±0.5℃,室温22~24℃。
, 百拇医药
以上操作结束后,稳定10min,然后记录平均动脉压(MAP),用4号针头(连接生理记录仪)刺入脾脏实质内,间接测量门静脉压力(PP)。从左颈外静脉导管注入实验试剂(生理盐水、L-NMMA、L-arg),注入试剂10min后,再次记录MAP和PP。经左心室导管注入大约5万51Cr-微球(直径15±0.5μm,Du Pont Co),在注入微球前10秒钟从股静脉导管抽取参考血样,速度1ml/min,取血75秒钟(WZ微量注射机,浙江医科大学医学仪器厂)。脾实质穿刺注入大约3万57Co-微球(直径15±0.5μm,Du Pont Co),脾脏穿刺部位压迫止血5min,然后把脾脏送回腹腔,10min后静脉注射KCl处死动物。取下肺、肝、脾、胰、大小肠和肠系膜,分别称重后,用γ-能谱仪(GP-1型,上海电子仪器厂)检测各脏器51Cr和57Co的1分钟脉冲数(cpm)。
1.4 血流动力学指标计算方法
, 百拇医药
心输出量(CO)(ml/min)=[注入51Cr(cpm)×参考血样(ml/min)]/[参考血样51Cr(cpm)]
心脏指数(CI)(ml.min-1.100gBW-1)=CO(ml/min)/体重%
脏器血流量(ml/min)=[脏器51Cr(cpm)×参考血样(ml/min)]/参考血样51Cr(cpm)
门静脉血流量(PVI)等于胃、胰、脾、肠和肠系膜血流量之和。
门体分流量(PSS%)={[肺57Co(cpm)]/[肺57Co(cpm)+肝57Co(cpm)]}×100
, http://www.100md.com
血管阻力(kPa.ml-1.min-1)=[P1-P2(kPa)]/Q(ml/min)
外周血管阻力(TRR)是MAP(P1)减去右心房压(P2)与CO(Q)之间计算,内脏血管阻力(SVR)是MAP(P1)减去PP(P2)与PVJ(Q)之间计算,门静脉血管阻力(PVR)是PP(P1)减去下腔静脉压力(P2)与PVI(Q)之间计算。右心房和下腔静脉压力很低(0~1mmHg),计算时被忽略。
1.5 统计方法 结果用X±S表示,配对和非配对t检验比较组间显著性差异。
2 结果
, http://www.100md.com
2.1 CPH鼠形成了高动力循环状态 在实验结束解剖内脏时,可见肝脏已形成肝硬变结节,光镜下见到假小叶形成的组织学特征。在基础状态时(Resting或Vehicle),与对照组比较,CPH鼠心输出量(CO)和心脏指数(CI)显著增大(P<0.05),平均动脉压(MAP)和总外周血管阻力(TRR)显著性降低(P<0.05);内脏血流动力学情况显示,门静脉压力(PP)明显增高(P<0.05),门静脉血流量(PVI)增加了22%(P<0.05),内脏血管阻力(SVR)明显下降(P<0.05),而门静脉血管阻力(PVR)无显著性变化,CPH鼠形成了大量的门体分流(PSS,38%±16%)(表1~表3)。
表1 L-NMMA对门静脉压力(PP)和平均动脉压力(MAP)的影响 (kPa,
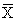 ±s)
±s)Resting
, http://www.100md.com
Vehicle
Resting
L-NMMA
L-NMMA+L-arg
PP
Con
1.24±0.07
1.28±0.11
1.29±0.09
1.29±0.13
CPH
1.56±0.12*
, 百拇医药
1.54±0.14*
1.53±0.11*
1.47±0.16*
1.53±0.13
MAP
Con
16.8±0.74
17.2±1.68
16.7±0.79
19.1±0.91
CPH
, 百拇医药
13.5±0.82*
13.5±1.1*
13.6±0.89*
18.9±1.67△
14.4±1.51
与对照组(Control)比较:*P<0.05;与同组Resting比较:△P<0.05。
表2 L-NMMA对全身血流动力学的影响
Control rats
CPH rats
, 百拇医药 L-NMMA+L-arg
Vehicle
L-NMMA
Vehicle
L-NMMA
CO(ml/min)
93.6±6.3
87.1±7.7
125±7.2*
116±8.3*
128±12.7
, 百拇医药 CI(ml.min-1.100gBW-1)
37.9±3.7
36.0±6.0
45.5±4.1*
36.4±3.0△
43.4±5.6
TRR(kPa.ml-1.min-1.100gBW-1)
, 百拇医药
0.08±0.01
0.084±0.01
0.039±0.01*
0.06±0.01*△
0.04±0.01
与对照组(Control)比较:*P<0.05;与同组Vehicle比较:△P<0.05。
表3 L-NMMA对内脏血流动力学的影响
Control rats
CPH rats
L-NMMA+L-arg
, http://www.100md.com
Vehicle
L-NMMA
Vehicle
L-NMMA
PVI(ml.min-1.100gBW-1)
5.84±0.31
5.39±0.6
7.14±0.88*
6.06±0.83+
7.08±0.91
, 百拇医药
PVR(kPa.ml-1.min-1)
0.088±0.008
0.091±0.012
0.083±0.007
0.096±0.01+
0.084±0.008
SVR(kPa.ml-1.min-1.100gBW-1)
, 百拇医药
0.48±0.04
0.6±0.07
0.28±0.03*
0.37±0.06+
0.2±0.05+
PSS(%)
0.87±0.19
0.86±0.15
38±16*
13.8±6.18+
, 百拇医药 33.8±17
与对照组(Control)比较:*P<0.05;与同组Vehicle比较:+P<0.05。
2.2 L-NMMA对CPH鼠全身血流动力学的影响 静脉注入L-NMMA后CPH鼠的MAP明显升高,与肝前型门静脉高压鼠(PVL)相比[1],升高MAP的作用产生缓慢,升高幅度低于PVL鼠,药物作用时间长于PVL鼠,给药后10min测得MAP的作用产生缓慢,1.67kPa,比Vehicle组显著升高(P<0.05),已达到对照组水平:TRR显著性升高(P<0.05),CO和CI明显下降(P<0.05),CI达到对照组水平。对照组在给L-NMMA后各指标也有轻度变化,但均未达到统计学差异(表1、表2)。
2.3 L-NMMA对CPH鼠内脏血流动力学的影响 L-NMMA使PVI明显下降(P<0.05),SVR和PVR显著升高(P<0.05),PSS下降24%,PP轻度下降,但无统计学意义(表1、表3)。
, 百拇医药
先给予L-arg后5min,再注入L-NMMA,则L-NMMA升高MAP和对其他心血管系统的影响消失。单独注入L-arg对CPH大鼠的影响与PVL基本类似[1]。
3 讨论
3.1 CPH大鼠内脏高动力循环形成 Groszmann用同样方法诱导的肝硬变大鼠全部形成了门静脉高压和不同程度的PSS,内脏血流量增加,内脏和外周血管阻力下降,形成内脏高动力循环状态。全身血流动力学变化包括心输出量增加,血管阻力下降和低平均动脉压。文献报道在出现腹水以前30%~50%的肝硬变病人和全部门静脉高压动物模型已经出现高动力循环状态。本文肝硬变门静脉高压症大鼠出现心输出量和内脏血流量增多,门静脉压力增高和低平均动脉压,外周和内脏血管阻力下降,与文献相一致[3~5]。
3.2 NO在肝硬变大鼠内脏高动力循环中的调节作用 内源性NO具有舒张血管平滑肌和扩张动、静脉,对调节血管状态起重要作用。有资料表明肝硬变时全身和内脏血管扩张是由于对内源性血管收缩物质的敏感性降低或/和内源性血管舒张物质活性增高所至。还有资料表明诱导内源性NO分泌可导致末稍血管扩张,低血压和心率加快,类似门静脉高压高动力循环的反应。另有实验证明NO可以调节CCl4诱导的肝硬变鼠的低血压[6,7]。已经证实,内皮合成NO与摄取L-arg的胍基氮原子有关,L-arg是NO合成的前体,而作为异构体的L-NMMA,可与L-arg发生竞争拮抗作用,抑制NO合成分泌。本文应用L-NMMA观察对CPH大鼠的影响,抑制NO生物合成后,可以提高平均动脉压,降低心输出量和内脏血流量,还观察到降低门体分流和增加血管阻力,具有改善肝硬变大鼠高动力循环的作用,说明在肝硬变内脏高动力循环形成中,NO可能是重要的调节物质。
, 百拇医药
3.3 门体分流、内毒素与肝硬变血管舒张的关系 在动物实验中,NO的启动是被乙酰胆碱或其它激动剂所引起,导致末梢血管扩张和低血压。肝硬变时如果某物质启动了内皮细胞NO合成酶,使之合成分泌增多,就可以使血管扩张并导致高动力循环状态。一些实验结果提示在肝硬变高动力循环中,NO的启动和作用与细菌内毒素和脂多糖有关,这些物质可能是内皮细胞合成NO的触发者。在体外把血管暴露于内毒素或胞质中,在内皮细胞和血管平滑肌中有NO合成酶表达[8~10]。肝硬变门静脉高压症时,由于门体分流异常,使正常情况下可被肝脏清除的肠道细菌释出的内毒素进入体循环。大多数肝硬变病人,即使在无明显感染时,体循环中也可测到较高水平的内毒素[11]。本文肝硬变鼠存在大量门体分流,且分流量越大者(PVL大鼠),内脏和全身高动力循环越严重,提示细菌内毒素和脂多糖可能是门静脉高压时NO合成分泌增多的触发者。
3.4 阻断NO的作用可能对门静脉高压症的治疗有益 从临床的角度推测,如果肝硬变内毒素血症导致NO合成酶产生增多,而NO合成分泌增多又是肝硬变高动力循环产生的原因,则提示阻断该途径可以防止和逆转与血管扩张有关的并发症,诸如食道胃底静脉曲张破裂出血、腹水、浮肿和肝肾综合症。选择性的给予肠道抗生素,也可以防止NO合成酶产生,对预防和治疗门静脉高压症高动力循环的发生和发展有重要意义。
, 百拇医药
参考文献
1 王承泰,邝耀麟,陈治平等.抑制NO的生物合成对肝前型门静脉高压症大鼠血流动力学的影响.中华实验外科杂志,1994,11(增刊)∶23~25
2 Roberto J,Groszmann RJ,Vorobioff J,et al.Splanchnic hemodynamics in portal-hypertensive rats:measurement with γ-labeled microspheres.Am J Physiol,1982,242∶G156~160
3 王承泰,邝耀麟,陈治平等.肝内型门静脉高压大鼠内脏高动力循环状态.中华消化杂志,1995,15∶209~211
4 Vorobioff J,Bredfeldt JE,Groszmann RJ.Increased blood flow through the portal system in cirrhotic rats.Gastroenterology,1984,87∶1120~1126
, 百拇医药
5 王承泰,邝耀麟,陈治平.肝前型门静脉高压大鼠高动力循环状态.中华外科杂志,1994,32∶573~575
6 Palmer RM,Ferrige AG,Moncada S.Nitric oxide release accounts for the biological activity of endothelium-devived relaxion factor.Nature,1987,327∶524~526
7 Claria J,Jimenez W,Ros J.Pathogenesis of arterial hypotension in cirrhotic rats with ascites:role of endogeneus nitric oxide.Hepatology,1992,15∶343~349
8 Busse R,Musch A.Induction of nitric oxide synthase by cytokines in vascular smooth muscle cells.FEBS Lett,1990,275∶87~90
, 百拇医药
9 Rees DD,Cellek S,Palmer RM,et al.Dexamethasone prevents the induction by endotoxin of a nitric into entotoxin shock.Biochem Biophys Res Commun,1990,173∶541~547
10 Beasley D,Schwartz JH,Brenner BM.Interleukin 1 induces prolonged L-arginine dependent cyclic guanosine monophosphate and nitrite production in rat vascular smooth muscle cells.J Clin Invest,1991,87∶602~608
11 Lumsden AB,Henderson JM,Kutner MH.Endotoxin levels measured by achromogenic assay in portal,hepatic and peripgeral venous blood in patient with cirrhosis.Hepatology,1988,8∶232~236
(收稿:1999-06-20), 百拇医药