心力衰竭病人β受体信号转导系统相关基因表达水平的变化
作者:余细勇 林曙光 汪晓梅 唐其东 陈颜芳 伍淑英 吴书林 陈泗林
单位:510080 广州,广东省心血管病研究所
关键词:心力衰竭,充血性;基因表达;聚合酶链反应
中华医学杂志/990407 【摘要】 目的 探讨慢性充血性心力衰竭时,β肾上腺素受体信号转导系统相关基因表达水平的变化。方法 以淋巴细胞为研究模型,采用逆转录聚合酶链反应(RT-PCR)技术定量检测了β2肾上腺素受体(β2-AR)、腺苷酸环化酶、β受体激酶(β-ARK)、β-arrestin和cAMP反应元素结合蛋白(CREB)基因的mRNA水平,在16例正常人体和30例心力衰竭患者中比较了β受体信号转导系统相关基因的变化。结果 心力衰竭患者腺苷酸环化酶和核转录因子CREB的 mRNA表达水平明显增加[分别为(1 931±1 011)mm-1和(523±194)mm-1],对照组均无表达。β2-AR的mRNA表达水平明显减少[心衰组(3430±1625)min-1,对照组(8 085±6317)min-1P<0.01],而受体的磷酸化脱偶联调节因子β-ARK和β-arrestin的mRNA表达水平没有显著改变(P>0.05)。结论 β受体基因的表达异常在心衰的受体脱敏过程中可能起着重要的调节作用。
, 百拇医药
Gene expression of β-adrenoceptor signal transmitters in heart failure YU Xiyong, LIN Shuguang,WANG Xiaomei, et al. Guangdong Provincial Cardiovascular Institute, Guangzhou 510080
【Abstract】 Objective To investigate the alteration in steady-state levels of messenger RNA(mRNA) of β-adrenoceptor signal transmitters in heart failure. Methods The reverse transcription polymerase chain reaction (RT-PCR) was used to assess gene expression in small quantity of circulatory lymphocytes. With selected oligonucleotide primers, we used quantitative RT-PCR to amplify mRNAs encoding β2-adrenergic receptor(β2-AR), adenylate cyclase (AC), β2-adrenergic receptor kinase(β-ARK), and β-arrestin and cAMP response element binding protein (CREB) in 16 healthy subjects and 30 heart-failing patients. Results The alteration of gene expression in heart failure appeared to be selective, the steady-state levels of mRNA increased significantly involving AC and the transcription factor, CREB; decreased significantly involving membrane receptor, β2-AR; unchanged significantly involving phosphorylating factors of β-AR uncoupling, β-ARK and β-arrestin. Conclusion The aberrant gene expression of β-adrenergic receptor might play an important role in the pathogenesis of heart failure.
, 百拇医药
【Key words】 Heart failure, Congestive gene expression polymerase chain reaction
(Natl Med J China, 1999, 79:264-267)
心力衰竭(心衰)的本质可能是心肌细胞基因异常表达的结果[1]。在心肌超负荷等病理刺激下,细胞内一系列基因发生异常表达,造成细胞膜上的受体、细胞内信号转导系统、收缩蛋白能量代谢和心肌内分泌等发生一系列改变[2]。而心衰时β受体信号转导系统功能改变的核心是β受体下调和磷酸化脱偶联[3]。由于心衰病程的迁延,β受体信号传递物质的变化是否牵涉到基因表达水平的改变?我们对此进行了深入的研究。
对象和方法
一、对象
, 百拇医药
1.健康对照组:健康志愿者16人,男12人、女4人,均为广东省人民医院职工,年龄23~45岁,平均(32±6)岁。体检心电图、血压、生化肝功能、肾功能检查未见异常。
2.心衰患者组:慢性充血性心力衰竭患者30例,男20例,女10例。均为广东省心血管病研究所心内科住院者,年龄17~72岁,平均(50±17)岁,心功能分级按纽约心脏学会(NYHA)1994年修订的标准进行评价,心功能Ⅲ级12例,Ⅳ级18例。
二、方法
1.PCR引物:所用引物均自行设计。β-actin基因:正义 5’-AAG GAT TCC TAT GTG GGC-3’,反义 5’-CAT CTC TTG CTC GAA GTC-3’,扩增片段532 bp;β2AR基因:正义 5’-ACT GCT ATG CCA ATG AGA CC-3’, 反义 5’-AGG TTA TCC TGG ATC ACA TG-3’,扩增片段343 bp;β受体激酶1(β-ARK)基因:正义 5’-AGC GAT AAG TTC ACA CG-3’, 反义 5’-CAC CGC TCC GAG ATG GT-3’,扩增片段1 050 bp;β-arrestin蛋白1(β-arrestin)基因:正义 5’-TTT GTG GCC AAC GTA CAG TC-3’, 反义 5'-GAG ACA CCA CCA GCT TCA CTT-3',扩增片段754 bp;cAMP反应序列结合蛋白(CREB)基因:正义5’-AAC GTG CAG GAA CCA AGA TG-3’,反义 5’-TCA TCC AAC GTG GTC AGA AG-3’,扩增片段767 bp;腺苷酸环化酶6(AC)基因:正义5’-TGC ACA TCA GTA GCA TCG-3’,反义5’-CAG TGA TGT GGG AGC GGC-3’,扩增片段520 bp。
, 百拇医药
2.淋巴细胞(LC)的制备:每个受试者取外周静脉抗凝血20 ml,采用淋巴细胞分离液进行密度梯度离心(4 ℃ 2 000 r/min,30 min),分离得到单个核细胞(含90%淋巴细胞)。
3.RNA抽提:按Quick Prep (瑞典Pharmacia公司)说明书进行。取悬浮的LC(5×106)离心3 000 r/min,5 min,沉淀加无菌PBS 0.5 ml洗1次,再离心3 000 r/min,5 min,去上清。加LiCl液350 μl,轻轻振荡,悬浮细胞。加β-巯基乙醇3 μl,混匀。加抽提buffer 150 μl,剧烈震荡30 s,离心3 000 r/min,5 min。上清液转移至二乙基焦碳酸盐(DEPC)处理的1.5 ml Eppendorf管。加三氟醋酸铯(CsTFA)液500 μl,颠倒混匀,剧烈震荡15秒,置冰上10 min,4 ℃离心12 000 r/min,15 min。连续真空吸去上清。 沉淀再加抽提buffer 75 μl,LiCl液175 μl和CsTFA 250 μl洗一次,4 ℃ 离心12 000 r/min,5 min,连续真空吸去上清。最后加70%乙醇1.0 ml贮存于-70 ℃冰箱。临用前4 ℃离心12 000 r/min,20 min,去乙醇,真空浓缩3~5 min,加DEPC水30 μl定容。
(瑞典Pharmacia公司)说明书进行。取悬浮的LC(5×106)离心3 000 r/min,5 min,沉淀加无菌PBS 0.5 ml洗1次,再离心3 000 r/min,5 min,去上清。加LiCl液350 μl,轻轻振荡,悬浮细胞。加β-巯基乙醇3 μl,混匀。加抽提buffer 150 μl,剧烈震荡30 s,离心3 000 r/min,5 min。上清液转移至二乙基焦碳酸盐(DEPC)处理的1.5 ml Eppendorf管。加三氟醋酸铯(CsTFA)液500 μl,颠倒混匀,剧烈震荡15秒,置冰上10 min,4 ℃离心12 000 r/min,15 min。连续真空吸去上清。 沉淀再加抽提buffer 75 μl,LiCl液175 μl和CsTFA 250 μl洗一次,4 ℃ 离心12 000 r/min,5 min,连续真空吸去上清。最后加70%乙醇1.0 ml贮存于-70 ℃冰箱。临用前4 ℃离心12 000 r/min,20 min,去乙醇,真空浓缩3~5 min,加DEPC水30 μl定容。
, http://www.100md.com
4.第一链cDNA合成:取0.2 ml薄壁PCR管,依次加入1 μl RNasin,10 μl RNA样品(约2 μg),1 μl Oligo(dT),70 ℃ 保温10 min(PTC-200型扩增仪,美国MJ Research公司);取出后迅速置冰上冷却,依次加入4 μl buffer(内含MgCl2),2 μl二硫苏糖醇,1 μl 10 mmol/L dNTP,轻轻混匀,简单离心。42 ℃保温5 min。加1 μl (200 U) SuperScriptTM Ⅱ逆转录酶(美国GibcoBRL公司),用吸头轻轻混匀,42 ℃ 50 min。灭活反应加热至70 ℃ 15 min后进入下列反应。
5.PCR扩增靶cDNA:取0.2 ml薄壁PCR管6只,同时扩增β-actin、β2-AR、βARK、β-arrestin、AC和CREB 6种基因。依次加入水38.2 μl, 10×PCR buffer(内含MgCl2) 5 μl, 10 mmol/L dNTP 1 μl,引物1 和引物2各1 μl,第一链cDNA 3 μl。热启动95 ℃,5 min,当温度降至80 ℃时维持,加入ExpandTM高保真PCR酶混合液(德国BM公司)0.8 μl(2.6 U),总体积50 μl。开始PCR循环,变性94 ℃ 45 s ,退火55 ℃ 45 s,延伸72 ℃ 1 min,共36个循环,最后72 ℃延伸10 min。迅速降至0 ℃终止反应。
, http://www.100md.com
6.PCR产物的电泳分离与检测:取10 μl PCR产物加2 μl 6×样品缓冲液混匀,上样。电泳100 V,45 min。电泳停止后取出凝胶,置于凝胶成像分析仪(美国Bio-Red公司)暗箱内,调节数码相机至最清晰处,电脑摄像存储,用Molecular AnalystTM软件作吸光度容积(Volume)定量分析。β-actin为参比对照。
三、数据处理
所有数值以均数±标准差表示,显著性检验采用t检验。
结果
一、PCR产物表达
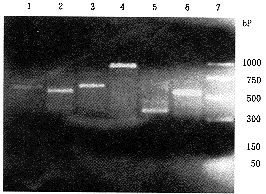
分别检测了正常人淋巴细胞4种基因(β-arrestin、β-ARK、β2-AR和β-actin)的表达;心衰患者淋巴细胞6种基因(CREB、AC、β-arrestin、β-ARK、β2-AR和β-actin)的表达(图1)。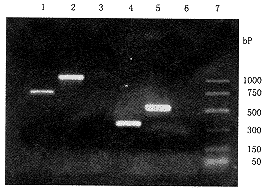
, http://www.100md.com
注:上图:正常人;1.β-arrestin;2.β-ARK;3.AC;4.β2-AR;5.β-actin;6.CREB;7.Marker.下图:心衰患者1.cREB;2.AC;3.β-arrestin;4.β-ARK;5.β2-AR;6.β-actin;7.Marker
图1 RT-PCR产物电泳图谱
二、基因表达水平的改变
1.β2-AR mRNA表达水平:对照组16例均有表达(100%),β2-AR/actin RT-PCR定量比值为1.2±0.9;心衰组30例有24例表达(80%),β2-AR/actin定量比值为0.4±0.3,与对照组比较,mRNA表达水平显著降低(P<0.01)。
2.AC mRNA表达水平:对照组16例均未测出(0%),心衰组有7例表达(23%),AC/actin定量比值为0.10±0.20。
, 百拇医药
3.β-ARK mRNA表达水平:对照组有6例表达(38%),β-ARK/actin定量比值为0.32±0.69,心衰组有9例表达(30%),β-ARK/actin定量比值为0.21±0.37(P>0.05)。
4.β-arrestin mRNA表达水平:对照组16例有8例表达(50%),β-arrestin/actin 定量比值为0.18±0.21;心衰组有15例表达(50%),β-arrestin/actin定量比值为0.53±0.77,较对照组升高但差异无显著意义(P=0.084)。
5.CREB mRNA表达水平:对照组16例均无表达,而心衰组有3例表达,CREB/actin定量比值为0.01±0.04,说明心衰时核转录因子被激活(表1)。
表1 正常人和心衰患者β受体信号转导相关基因mRNA表达水平的比较(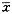 ±s) 组别
±s) 组别
, 百拇医药
例数
mRNA水平
β-actin
β2-AR
AC
β-ARK
β-arrestin
CREB
正常组
16
7 154±1 774
(16)
, http://www.100md.com 8 085±6 317
(16)
0
(0)
3 396±2 168
(6)
2 520±1 018
(8)
0
(0)
心衰组
30
6 702±1 278
, http://www.100md.com
(30)
3 430±1 625△
(24)
1 931±1 011
(7)
3 090±1 776
(9)
4 490±3 510*
(15)
523±194
(3)
注:与正常组比较 * P=0.08,△ P<0.01,括号内为检测出的例数;表中数字单位为吸光度容积计数(次/分)
, 百拇医药
讨论
真核细胞中cAMP的作用与转录因子的调节有关,即cAMP激活PKA后,后者对某些特异的转录因子进行磷酸化,磷酸化的转录因子再与被cAMP调控的某个特定调节序列结合,从而最终调控cAMP反应基因的表达。在cAMP相关的转录因子中,研究得最清楚且已被克隆的是CREB(cAMP response element binding protein)[4]。胞外配体与其受体结合后,通过G蛋白与活化AC产生cAMP,cAMP继而由细胞质进入细胞核内,然后使转录因子CREB在N端转录活化,磷酸化的CREB即可与DNA分子上的cAMP调节靶基因附近的一段称为CRE(cAMP response element)的回文序列(TGACGTCA)结合,从而起到调节靶基因的作用[5]。已有研究表明,原癌基因c-fos的表达调控与CREB的磷酸化有关[6]。于是,我们大胆假设:CREB可能参与了心衰的恶变质过程。为证明此假说,我们自行设计、合成了CREB的引物,并进行RT-PCR扩增mRNA水平,结果在3例心衰患者检测到了CREB的基因表达,而且这3例患者的心功能均较差,NYHA分级为Ⅳ级。
, 百拇医药
心衰患者的AC mRNA水平较对照组升高,而不是想象中的降低。原因是:(1) AC mRNA水平升高可能是β受体脱敏在基因表达水平的一种代偿性机制,因为即使在严重衰竭心肌内AC-cAMP仍然是调节心肌收缩的有力途径[7];(2) AC的多态性,至今已发现了8种AC[8],其中第5型和第6型分布最广[9],我们只是检测了第6型AC,可能未反映AC的全貌。AC可能同PKA一样,在心衰病程中只是活性部分降低,而胞内总酶量并未下降。另一有趣现象是,心衰患者的β-ARK和β-arrestin的 mRNA水平较对照组改变差异无显著意义。β-arrestin与文献报道[10]结果一致,而β-ARK与文献报道[10,11]结果不一致。β-ARK为G蛋白偶联受体激酶(GRKs)大家族中的一员,已发现的GRKs有6种[12]:GRK1,GRK2(即β-ARK1),GRK3(即β-ARK2),GRK4,GRK5和GRK6,其中GRK2为通常所指的β-ARK[13]。本实验中β-ARK基因表达水平未出现增高可能有两方面的原因:(1) β-ARK在心肌和淋巴细胞等不同组织中分布的差异;(2) 存在种族差异,即在中国人群中β-ARK不是导致β受体脱敏的主要原因。我们认为后者的可能性较大,因为β-ARK在正常人体淋巴细胞中的表达较丰富,组织分布差异的可能性较小。此结果有待进一步证实。
, 百拇医药
本课题为国家自然科学基金资助项目(39470823)
参考文献
[1] Lenfant C. Fixing the failure heart. Circulation,1997,95:771-772.
[2] Cohn JN, Bristow MR, Chien KR, et al. Report of the national heart, lung, and blood insitute special emphasis panel on heart failure research. Circulation,1997,95:766-770.
[3] Harding SE, Brown LA, Wynne DG, et al. Mechanisms of β-adrenoceptor desensitisation in the failing human heart. Cardiovasc Res,1994,28:1451-1460.
, 百拇医药
[4] Gonzalez GA, Yamamoto KK, Fischer WH, et al. A cluster of phosphorylation sites on the cyclic AMP-regulated nuclear factor CREB predicted by its sequence. Nature,1989,337:749-752.
[5] Nichols M. Weih F, Schimid W, et al. Phosphorylation of CREB affects its binding to high and low affinity sites: implications for cAMP induced gene transcription. EMBO J,1992,9:3337-3346.
[6] Ginty DD, Borni A, Greenbery ME. Nerve gronth factor activates a ras-dependent protein kinase that stimulates c-fos transciption via phosphorylation of CREB. Cell,1994,77:713-725.
, http://www.100md.com
[7] Morgan HE. Cellular aspects of cardiac failure. Circulation,1993,87(suppl Ⅳ):4-6.
[8] Iyengar R. Molecular and functional diversity of mammalian Gs-stimulated adenylyl cyclases. FASEB J,1993,7:768-775.
[9] Fremont RT, Chen J, Ma HW, et al. Two members of a widely expressed subfamily of hormone-stimulated adenylyl cyclases. Proc Natl Acad Sci USA,1992,89:9809-9813.
[10] Ungerer M, Parruti G, Bohm M, et al. Expression of β-adrenergic receptor kinases in the failing human heart. Circ Res,1994,74:206-213.
, http://www.100md.com
[11] Faldman Am, Ray PE, Silan CM, et al. Selective gene expression in failing human heart. Circulation 1991,83:1866-1872.
[12] Inglese J, Freedman NJ, Roch WJ, et al. Structure and mechanism of the G protein-coupled receptor kinases. J Biol Chem,1993,268:23735-23738.
[13] Kunapuli P ,Benovic J L. Cloning and expression of GRK5: A member of the G protein-coupled receptor kinases family. Proc Natl Acad Sci USA,1993,90:5588-5592.
(收稿:1998-06-23 修回:1999-01-04), 百拇医药
单位:510080 广州,广东省心血管病研究所
关键词:心力衰竭,充血性;基因表达;聚合酶链反应
中华医学杂志/990407 【摘要】 目的 探讨慢性充血性心力衰竭时,β肾上腺素受体信号转导系统相关基因表达水平的变化。方法 以淋巴细胞为研究模型,采用逆转录聚合酶链反应(RT-PCR)技术定量检测了β2肾上腺素受体(β2-AR)、腺苷酸环化酶、β受体激酶(β-ARK)、β-arrestin和cAMP反应元素结合蛋白(CREB)基因的mRNA水平,在16例正常人体和30例心力衰竭患者中比较了β受体信号转导系统相关基因的变化。结果 心力衰竭患者腺苷酸环化酶和核转录因子CREB的 mRNA表达水平明显增加[分别为(1 931±1 011)mm-1和(523±194)mm-1],对照组均无表达。β2-AR的mRNA表达水平明显减少[心衰组(3430±1625)min-1,对照组(8 085±6317)min-1P<0.01],而受体的磷酸化脱偶联调节因子β-ARK和β-arrestin的mRNA表达水平没有显著改变(P>0.05)。结论 β受体基因的表达异常在心衰的受体脱敏过程中可能起着重要的调节作用。
, 百拇医药
Gene expression of β-adrenoceptor signal transmitters in heart failure YU Xiyong, LIN Shuguang,WANG Xiaomei, et al. Guangdong Provincial Cardiovascular Institute, Guangzhou 510080
【Abstract】 Objective To investigate the alteration in steady-state levels of messenger RNA(mRNA) of β-adrenoceptor signal transmitters in heart failure. Methods The reverse transcription polymerase chain reaction (RT-PCR) was used to assess gene expression in small quantity of circulatory lymphocytes. With selected oligonucleotide primers, we used quantitative RT-PCR to amplify mRNAs encoding β2-adrenergic receptor(β2-AR), adenylate cyclase (AC), β2-adrenergic receptor kinase(β-ARK), and β-arrestin and cAMP response element binding protein (CREB) in 16 healthy subjects and 30 heart-failing patients. Results The alteration of gene expression in heart failure appeared to be selective, the steady-state levels of mRNA increased significantly involving AC and the transcription factor, CREB; decreased significantly involving membrane receptor, β2-AR; unchanged significantly involving phosphorylating factors of β-AR uncoupling, β-ARK and β-arrestin. Conclusion The aberrant gene expression of β-adrenergic receptor might play an important role in the pathogenesis of heart failure.
, 百拇医药
【Key words】 Heart failure, Congestive gene expression polymerase chain reaction
(Natl Med J China, 1999, 79:264-267)
心力衰竭(心衰)的本质可能是心肌细胞基因异常表达的结果[1]。在心肌超负荷等病理刺激下,细胞内一系列基因发生异常表达,造成细胞膜上的受体、细胞内信号转导系统、收缩蛋白能量代谢和心肌内分泌等发生一系列改变[2]。而心衰时β受体信号转导系统功能改变的核心是β受体下调和磷酸化脱偶联[3]。由于心衰病程的迁延,β受体信号传递物质的变化是否牵涉到基因表达水平的改变?我们对此进行了深入的研究。
对象和方法
一、对象
, 百拇医药
1.健康对照组:健康志愿者16人,男12人、女4人,均为广东省人民医院职工,年龄23~45岁,平均(32±6)岁。体检心电图、血压、生化肝功能、肾功能检查未见异常。
2.心衰患者组:慢性充血性心力衰竭患者30例,男20例,女10例。均为广东省心血管病研究所心内科住院者,年龄17~72岁,平均(50±17)岁,心功能分级按纽约心脏学会(NYHA)1994年修订的标准进行评价,心功能Ⅲ级12例,Ⅳ级18例。
二、方法
1.PCR引物:所用引物均自行设计。β-actin基因:正义 5’-AAG GAT TCC TAT GTG GGC-3’,反义 5’-CAT CTC TTG CTC GAA GTC-3’,扩增片段532 bp;β2AR基因:正义 5’-ACT GCT ATG CCA ATG AGA CC-3’, 反义 5’-AGG TTA TCC TGG ATC ACA TG-3’,扩增片段343 bp;β受体激酶1(β-ARK)基因:正义 5’-AGC GAT AAG TTC ACA CG-3’, 反义 5’-CAC CGC TCC GAG ATG GT-3’,扩增片段1 050 bp;β-arrestin蛋白1(β-arrestin)基因:正义 5’-TTT GTG GCC AAC GTA CAG TC-3’, 反义 5'-GAG ACA CCA CCA GCT TCA CTT-3',扩增片段754 bp;cAMP反应序列结合蛋白(CREB)基因:正义5’-AAC GTG CAG GAA CCA AGA TG-3’,反义 5’-TCA TCC AAC GTG GTC AGA AG-3’,扩增片段767 bp;腺苷酸环化酶6(AC)基因:正义5’-TGC ACA TCA GTA GCA TCG-3’,反义5’-CAG TGA TGT GGG AGC GGC-3’,扩增片段520 bp。
, 百拇医药
2.淋巴细胞(LC)的制备:每个受试者取外周静脉抗凝血20 ml,采用淋巴细胞分离液进行密度梯度离心(4 ℃ 2 000 r/min,30 min),分离得到单个核细胞(含90%淋巴细胞)。
3.RNA抽提:按Quick Prep
 (瑞典Pharmacia公司)说明书进行。取悬浮的LC(5×106)离心3 000 r/min,5 min,沉淀加无菌PBS 0.5 ml洗1次,再离心3 000 r/min,5 min,去上清。加LiCl液350 μl,轻轻振荡,悬浮细胞。加β-巯基乙醇3 μl,混匀。加抽提buffer 150 μl,剧烈震荡30 s,离心3 000 r/min,5 min。上清液转移至二乙基焦碳酸盐(DEPC)处理的1.5 ml Eppendorf管。加三氟醋酸铯(CsTFA)液500 μl,颠倒混匀,剧烈震荡15秒,置冰上10 min,4 ℃离心12 000 r/min,15 min。连续真空吸去上清。 沉淀再加抽提buffer 75 μl,LiCl液175 μl和CsTFA 250 μl洗一次,4 ℃ 离心12 000 r/min,5 min,连续真空吸去上清。最后加70%乙醇1.0 ml贮存于-70 ℃冰箱。临用前4 ℃离心12 000 r/min,20 min,去乙醇,真空浓缩3~5 min,加DEPC水30 μl定容。
(瑞典Pharmacia公司)说明书进行。取悬浮的LC(5×106)离心3 000 r/min,5 min,沉淀加无菌PBS 0.5 ml洗1次,再离心3 000 r/min,5 min,去上清。加LiCl液350 μl,轻轻振荡,悬浮细胞。加β-巯基乙醇3 μl,混匀。加抽提buffer 150 μl,剧烈震荡30 s,离心3 000 r/min,5 min。上清液转移至二乙基焦碳酸盐(DEPC)处理的1.5 ml Eppendorf管。加三氟醋酸铯(CsTFA)液500 μl,颠倒混匀,剧烈震荡15秒,置冰上10 min,4 ℃离心12 000 r/min,15 min。连续真空吸去上清。 沉淀再加抽提buffer 75 μl,LiCl液175 μl和CsTFA 250 μl洗一次,4 ℃ 离心12 000 r/min,5 min,连续真空吸去上清。最后加70%乙醇1.0 ml贮存于-70 ℃冰箱。临用前4 ℃离心12 000 r/min,20 min,去乙醇,真空浓缩3~5 min,加DEPC水30 μl定容。, http://www.100md.com
4.第一链cDNA合成:取0.2 ml薄壁PCR管,依次加入1 μl RNasin,10 μl RNA样品(约2 μg),1 μl Oligo(dT),70 ℃ 保温10 min(PTC-200型扩增仪,美国MJ Research公司);取出后迅速置冰上冷却,依次加入4 μl buffer(内含MgCl2),2 μl二硫苏糖醇,1 μl 10 mmol/L dNTP,轻轻混匀,简单离心。42 ℃保温5 min。加1 μl (200 U) SuperScriptTM Ⅱ逆转录酶(美国GibcoBRL公司),用吸头轻轻混匀,42 ℃ 50 min。灭活反应加热至70 ℃ 15 min后进入下列反应。
5.PCR扩增靶cDNA:取0.2 ml薄壁PCR管6只,同时扩增β-actin、β2-AR、βARK、β-arrestin、AC和CREB 6种基因。依次加入水38.2 μl, 10×PCR buffer(内含MgCl2) 5 μl, 10 mmol/L dNTP 1 μl,引物1 和引物2各1 μl,第一链cDNA 3 μl。热启动95 ℃,5 min,当温度降至80 ℃时维持,加入ExpandTM高保真PCR酶混合液(德国BM公司)0.8 μl(2.6 U),总体积50 μl。开始PCR循环,变性94 ℃ 45 s ,退火55 ℃ 45 s,延伸72 ℃ 1 min,共36个循环,最后72 ℃延伸10 min。迅速降至0 ℃终止反应。
, http://www.100md.com
6.PCR产物的电泳分离与检测:取10 μl PCR产物加2 μl 6×样品缓冲液混匀,上样。电泳100 V,45 min。电泳停止后取出凝胶,置于凝胶成像分析仪(美国Bio-Red公司)暗箱内,调节数码相机至最清晰处,电脑摄像存储,用Molecular AnalystTM软件作吸光度容积(Volume)定量分析。β-actin为参比对照。
三、数据处理
所有数值以均数±标准差表示,显著性检验采用t检验。
结果
一、PCR产物表达
分别检测了正常人淋巴细胞4种基因(β-arrestin、β-ARK、β2-AR和β-actin)的表达;心衰患者淋巴细胞6种基因(CREB、AC、β-arrestin、β-ARK、β2-AR和β-actin)的表达(图1)。


, http://www.100md.com
注:上图:正常人;1.β-arrestin;2.β-ARK;3.AC;4.β2-AR;5.β-actin;6.CREB;7.Marker.下图:心衰患者1.cREB;2.AC;3.β-arrestin;4.β-ARK;5.β2-AR;6.β-actin;7.Marker
图1 RT-PCR产物电泳图谱
二、基因表达水平的改变
1.β2-AR mRNA表达水平:对照组16例均有表达(100%),β2-AR/actin RT-PCR定量比值为1.2±0.9;心衰组30例有24例表达(80%),β2-AR/actin定量比值为0.4±0.3,与对照组比较,mRNA表达水平显著降低(P<0.01)。
2.AC mRNA表达水平:对照组16例均未测出(0%),心衰组有7例表达(23%),AC/actin定量比值为0.10±0.20。
, 百拇医药
3.β-ARK mRNA表达水平:对照组有6例表达(38%),β-ARK/actin定量比值为0.32±0.69,心衰组有9例表达(30%),β-ARK/actin定量比值为0.21±0.37(P>0.05)。
4.β-arrestin mRNA表达水平:对照组16例有8例表达(50%),β-arrestin/actin 定量比值为0.18±0.21;心衰组有15例表达(50%),β-arrestin/actin定量比值为0.53±0.77,较对照组升高但差异无显著意义(P=0.084)。
5.CREB mRNA表达水平:对照组16例均无表达,而心衰组有3例表达,CREB/actin定量比值为0.01±0.04,说明心衰时核转录因子被激活(表1)。
表1 正常人和心衰患者β受体信号转导相关基因mRNA表达水平的比较(
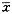 ±s) 组别
±s) 组别, 百拇医药
例数
mRNA水平
β-actin
β2-AR
AC
β-ARK
β-arrestin
CREB
正常组
16
7 154±1 774
(16)
, http://www.100md.com 8 085±6 317
(16)
0
(0)
3 396±2 168
(6)
2 520±1 018
(8)
0
(0)
心衰组
30
6 702±1 278
, http://www.100md.com
(30)
3 430±1 625△
(24)
1 931±1 011
(7)
3 090±1 776
(9)
4 490±3 510*
(15)
523±194
(3)
注:与正常组比较 * P=0.08,△ P<0.01,括号内为检测出的例数;表中数字单位为吸光度容积计数(次/分)
, 百拇医药
讨论
真核细胞中cAMP的作用与转录因子的调节有关,即cAMP激活PKA后,后者对某些特异的转录因子进行磷酸化,磷酸化的转录因子再与被cAMP调控的某个特定调节序列结合,从而最终调控cAMP反应基因的表达。在cAMP相关的转录因子中,研究得最清楚且已被克隆的是CREB(cAMP response element binding protein)[4]。胞外配体与其受体结合后,通过G蛋白与活化AC产生cAMP,cAMP继而由细胞质进入细胞核内,然后使转录因子CREB在N端转录活化,磷酸化的CREB即可与DNA分子上的cAMP调节靶基因附近的一段称为CRE(cAMP response element)的回文序列(TGACGTCA)结合,从而起到调节靶基因的作用[5]。已有研究表明,原癌基因c-fos的表达调控与CREB的磷酸化有关[6]。于是,我们大胆假设:CREB可能参与了心衰的恶变质过程。为证明此假说,我们自行设计、合成了CREB的引物,并进行RT-PCR扩增mRNA水平,结果在3例心衰患者检测到了CREB的基因表达,而且这3例患者的心功能均较差,NYHA分级为Ⅳ级。
, 百拇医药
心衰患者的AC mRNA水平较对照组升高,而不是想象中的降低。原因是:(1) AC mRNA水平升高可能是β受体脱敏在基因表达水平的一种代偿性机制,因为即使在严重衰竭心肌内AC-cAMP仍然是调节心肌收缩的有力途径[7];(2) AC的多态性,至今已发现了8种AC[8],其中第5型和第6型分布最广[9],我们只是检测了第6型AC,可能未反映AC的全貌。AC可能同PKA一样,在心衰病程中只是活性部分降低,而胞内总酶量并未下降。另一有趣现象是,心衰患者的β-ARK和β-arrestin的 mRNA水平较对照组改变差异无显著意义。β-arrestin与文献报道[10]结果一致,而β-ARK与文献报道[10,11]结果不一致。β-ARK为G蛋白偶联受体激酶(GRKs)大家族中的一员,已发现的GRKs有6种[12]:GRK1,GRK2(即β-ARK1),GRK3(即β-ARK2),GRK4,GRK5和GRK6,其中GRK2为通常所指的β-ARK[13]。本实验中β-ARK基因表达水平未出现增高可能有两方面的原因:(1) β-ARK在心肌和淋巴细胞等不同组织中分布的差异;(2) 存在种族差异,即在中国人群中β-ARK不是导致β受体脱敏的主要原因。我们认为后者的可能性较大,因为β-ARK在正常人体淋巴细胞中的表达较丰富,组织分布差异的可能性较小。此结果有待进一步证实。
, 百拇医药
本课题为国家自然科学基金资助项目(39470823)
参考文献
[1] Lenfant C. Fixing the failure heart. Circulation,1997,95:771-772.
[2] Cohn JN, Bristow MR, Chien KR, et al. Report of the national heart, lung, and blood insitute special emphasis panel on heart failure research. Circulation,1997,95:766-770.
[3] Harding SE, Brown LA, Wynne DG, et al. Mechanisms of β-adrenoceptor desensitisation in the failing human heart. Cardiovasc Res,1994,28:1451-1460.
, 百拇医药
[4] Gonzalez GA, Yamamoto KK, Fischer WH, et al. A cluster of phosphorylation sites on the cyclic AMP-regulated nuclear factor CREB predicted by its sequence. Nature,1989,337:749-752.
[5] Nichols M. Weih F, Schimid W, et al. Phosphorylation of CREB affects its binding to high and low affinity sites: implications for cAMP induced gene transcription. EMBO J,1992,9:3337-3346.
[6] Ginty DD, Borni A, Greenbery ME. Nerve gronth factor activates a ras-dependent protein kinase that stimulates c-fos transciption via phosphorylation of CREB. Cell,1994,77:713-725.
, http://www.100md.com
[7] Morgan HE. Cellular aspects of cardiac failure. Circulation,1993,87(suppl Ⅳ):4-6.
[8] Iyengar R. Molecular and functional diversity of mammalian Gs-stimulated adenylyl cyclases. FASEB J,1993,7:768-775.
[9] Fremont RT, Chen J, Ma HW, et al. Two members of a widely expressed subfamily of hormone-stimulated adenylyl cyclases. Proc Natl Acad Sci USA,1992,89:9809-9813.
[10] Ungerer M, Parruti G, Bohm M, et al. Expression of β-adrenergic receptor kinases in the failing human heart. Circ Res,1994,74:206-213.
, http://www.100md.com
[11] Faldman Am, Ray PE, Silan CM, et al. Selective gene expression in failing human heart. Circulation 1991,83:1866-1872.
[12] Inglese J, Freedman NJ, Roch WJ, et al. Structure and mechanism of the G protein-coupled receptor kinases. J Biol Chem,1993,268:23735-23738.
[13] Kunapuli P ,Benovic J L. Cloning and expression of GRK5: A member of the G protein-coupled receptor kinases family. Proc Natl Acad Sci USA,1993,90:5588-5592.
(收稿:1998-06-23 修回:1999-01-04), 百拇医药