血小板活化因子拮抗剂对急性重症胰腺炎后肺损伤的保护作用
作者:屠伟峰 黎介寿 朱维铭 祁晓萍 冯根宝 吴瑞萍 徐建国 肖光夏 黎鳌
单位:400038 重庆,第三军医大学西南医院全军烧伤研究所(屠伟峰、肖光夏、黎鳌);南京军区南京总医院(黎介寿、朱维铭、祁晓萍、冯根宝、吴瑞萍、徐建国)
关键词:
中华医学杂志/990431 血小板活化因子(PAF)在诸多炎症反应如急性重症胰腺炎(ASP)的病理损伤过程中起着重要作用[1,2],而预防性应用PAF拮抗剂如WEB2170、BN5021可以明 显减轻胰腺炎性肺损伤[2]。但有关PAF拮抗剂对ASP后肺损伤的保护机理仍不很清楚。作者对PAF受体拮抗剂BN50739在猪ASP后嗜中性粒细胞、弹性蛋白酶和PLA2介导性肺损伤保护作用的机理进行了研究,现报道如下。
一、材料和方法
, http://www.100md.com
1.动物分组:选健康长白种猪28只(南京军区动物实验中心提供),体重16~22 kg,雌雄不限,随机分为5组:Ⅰ组:即假手术对照组(5只);Ⅱ组:ASP组(6只);Ⅲ组:二甲亚砜(DMSO)组(5只);Ⅳ组:ASP+PAF受体拮抗剂预防组(6只);Ⅴ组即ASP+PAF受体拮抗剂治疗组(6只)。
2.BN50739的配制和使用:PAF受体拮抗剂BN50739由法国Braquet P博士所赠。PAF受体拮抗剂预防组,按10 mg/kg BN50739于ASP诱导前30分钟溶于64%~66%三甲亚砜,配成质量分数为3.2%~3.34%,缓慢从腔静脉内注入,速度根据平均动脉压(MAP)的变化调节,保持MAP的波动不大于3.75~7.5 mm Hg(1kPa=7.5 mm Hg)。PAF受体拮抗剂治疗组,于ASP诱导后6小时开始给予BN50739,首次用量为10 mg/kg,以后均为5 mg/kg,每8小时1次。以64%~66% DMSO取代BN50739,即为DMSO对照组。
, 百拇医药
3.急性重症胰腺炎的诱导和管理:参见文献[3]。
4.样本采集和处理:存活的猪在72小时后用10% KCl处死,立即留取胰腺、肺组织,部分用10%甲醛磷酸缓冲液(pH7.4)固定,常规石蜡切片、HE染色;部分组织块先用冰冷的生理盐水冲洗,除去血液,滤纸拭干,称重,用1∶9的匀浆介质(0.25 mol/L蔗糖,0.025 mol/L Tris/HCl,0.000 1 mol/L依地酸纳,pH7.5)制备组织匀浆,3 500 r/min离心15分钟(0~4 ℃),上清在-20 ℃以下保存备用,以检测组织PAF(生物活性检测法)[4]、弹性蛋白酶[5]、磷脂酶A2(PLA2)[6]和过氧化物酶(MPO)。
5.统计学处理:所列计量资料均采用均数±标准差表示,应用统计软件包stat 5.0作方差分析、Newman-Keuls′检验和t检验。
, 百拇医药
二、结果
1.组织PAF和弹性蛋白酶含量及PLA2和MPO活性的变化:Ⅱ组和Ⅲ组肺组织和气管粘膜PAF和弹性蛋白酶含量及PLA2活性较正常对照组明显升高(P均<0.01),但两组间差异无显著意义。预防或治疗性应用BN50739均可非常显著地减少ASP猪肺和气管粘膜中的PAF和弹性蛋白酶含量及PLA2活性,但仍高于正常对照组(P均<0.01)(表1)。Ⅳ组肺组织MPO水平明显低于Ⅱ组和Ⅲ组,(P均<0.01)。而Ⅴ组肺组织MPO活性仍很高,与Ⅱ组和Ⅲ组比较差别无显著意义(表1)。
表1 猪肺组织PAF、弹性蛋白酶及PLA2活性的变化(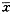 ±s) 组别
±s) 组别
例数
, 百拇医药
血小板活化因子
(ng.g-1)
弹性蛋白酶
(μg.mg-1)
磷脂酶A2
(μmol.min-1.mg-1)
过氧化物酶
(nmolH2O2.min-1.g-1)
, 百拇医药
肺
气管粘膜
肺
气管粘膜
肺
气管粘膜
肺
Ⅰ组
5
28± 3
44.5± 2.6
28± 3
44.5± 2.6
, 百拇医药
0.327±0.063
0.301±0.029
0.36±0.02
Ⅱ组
6
264±149
413.1±155.1
264±149
413.1±155.1
1.345±0.027
1.370±0.040
2.07±0.62
, 百拇医药
Ⅲ组
5
270±103
435.5±123.4
270±103
435.5±123.4
1.494±0.075
1.395±0.087
2.13±0.14
Ⅳ组
6
152± 64△*
, 百拇医药
379.1± 54.8△*
152± 64△*
379.1± 54.8△*
0.830±0.197△*
0.800±0.116△
1.05±0.62△*
Ⅴ组
6
174± 78△*
392.5±112.7△*
, 百拇医药
174± 78△*
392.5±112.7△*
0.810±0.128△*
0.480±0.168△*
2.05±0.83*
注:与Ⅱ组比较:△ P<0.01;与Ⅲ组比较:* P<0.01
2.干重比和组织含水量的变化:干湿重比(W/D)比和织组含水量(TTW)在Ⅲ组的变化与ASP组也基本一致,肺组织湿重两组间差异无统计学意义。预防或治疗性应用BN50739均可使W/D比和TTW明显降低,但仍要明显高于正常对照组(表2)。
, 百拇医药
表2 猪肺组织湿干重比和组织含水量的变化 组
别
例
数
W/D RATIO(%)
TTW(gH2O/g)
肺
气管粘膜
肺
气管粘膜
Ⅰ组
5
, 百拇医药 4.38±0.37
4.22±0.32
3.39±0.37
3.22±0.32
Ⅱ组
6
5.72±0.69
5.71±0.37
4.73±0.68
4.77±0.37
Ⅲ组
5
, 百拇医药
5.83±0.22
5.78±0.18
4.81±0.22
4.70±0.18
Ⅳ组
6
5.19±0.34△*
5.12±0.12△*
4.19±0.34△*
4.12±0.12△*
Ⅴ组
, 百拇医药
6
5.20±0.17△*
5.24±0.10△*
4.20±0.17△*
4.24±0.10△*
注:与Ⅱ组比较:△ P<0.01;与Ⅲ组比较:* P<0.01
3.组织形态学观察:预防或治疗性应用BN50739均可一定程度地减轻ASP所致的肺组织和气管粘膜损伤,肺组织虽有出血、炎性浸润、肺泡隔增厚、肺间质水肿,但均要明显轻于Ⅱ组和Ⅲ组。
三、讨论
, 百拇医药
1.PAF与PMN和弹性蛋白酶:本实验结果证实,ASP可引起肺组织和气管粘膜PAF水平明显升高,提示PAF在ASP所致的肺组织和气管粘膜器损伤中起着重要作用。已证实肺组织中巨噬细胞、尘细胞、肺泡上皮细胞、血管内皮细胞均可合成和释放PAF,但在胰腺炎性肺损伤中,何种细胞是合成和释放PAF的主要细胞尚不清楚?Zhou等[2]认为肺血管内皮细胞是合成和释放PAF的主要细胞,胰源性炎性介质释放入血直接损伤肺血管内皮细胞,可能是导致PAF在胰腺炎肺损伤中大量释放的启动因子。本研究结果显示,预防或治疗性应用BN50739不仅可明显降低ASP后肺组织和气管粘膜中高浓度的PAF水平,而且使肺和气管粘膜组织湿干重比和TTW改善、组织PMN扣压减少、弹性蛋白酶和MPO水平下降,从而减轻ASP后肺损伤。
PAF引起肺组织和气管粘膜损伤的确切机制尚不清楚,可能与下列因素有关:(1) 血管的直接损伤作用[7];(2) 中性粒细胞的激活;(3) 抑制了肺组织气管粘膜的抗氧化还原系统;(4) 促进氧自由基释放。
, http://www.100md.com
2.PAF与PLA2:Zhou等[2]发现静脉内给予PLA2可明显增加AP鼠的肺组织PAF水平,但不影响正常鼠的肺组织PAF水平,进一步证实PAF在AP性远离脏器如肺损伤中起着重要作用,而PLA2激活可能是导致PAF在肺局部大量蓄积的重要原因。本实验结果亦提示PAF和PLA2都是胰腺炎性肺损伤中的非常重要的炎性介质。两者之间有着相互放大或相互制约的作用。
参考文献
[1] Konturek SJ, Dembinski A, Konturek PJ, et al. Role of platelet-activating factor in pathogenesis of acute pancreatitis in rats. Gut, 1992, 33:1268-1274.
, 百拇医药 [2] Zhou WG, McCollum MO, Levine BA, et al. Role of platelet-activating factor in pancreatitis-associated acute lung injury in rats. Am J Pathol, 1992, 140:971-979.
[3] 屠伟峰,黎介寿,朱维铭,等.猪急性胰腺炎与肠源性细菌/内毒素易位.中国胃肠外科杂志,1998,1:22-25.
[4] Soerensen J, Kald B, Tagesson C, et al. Platelet-activating factor and phospholipase A2 in patients with septic shock and trauma, Intens Care Med, 1994, 20:555-561.
, 百拇医药
[5] Geiger R. Elastase. In: Bergmeyer J, Gioβ1 M-eds. Methods of enzymatic analysis. 3nd Vol V. Enzymes 3: peptidase, proteinase and their inhibitors. Weiheim: Nerlag Chemie, 1984. 170-184.
[6] 张文辉,李晓军,武建国,等.血清与精液磷脂酶A2的活力测定和初步应用.临床检验杂志,1996,14:250-252.
[7] Seale JP, Nourshargh S, Hellewell PG, et al. Mechanism of action of platelet-activating factor in the pulmonary circulation: An investigation using a novel isotopic system in rabbit isolated lung. Br J Pharmacol, 1991, 104:251.
(收稿:1998-04-16 修回:1998-12-03), 百拇医药
单位:400038 重庆,第三军医大学西南医院全军烧伤研究所(屠伟峰、肖光夏、黎鳌);南京军区南京总医院(黎介寿、朱维铭、祁晓萍、冯根宝、吴瑞萍、徐建国)
关键词:
中华医学杂志/990431 血小板活化因子(PAF)在诸多炎症反应如急性重症胰腺炎(ASP)的病理损伤过程中起着重要作用[1,2],而预防性应用PAF拮抗剂如WEB2170、BN5021可以明 显减轻胰腺炎性肺损伤[2]。但有关PAF拮抗剂对ASP后肺损伤的保护机理仍不很清楚。作者对PAF受体拮抗剂BN50739在猪ASP后嗜中性粒细胞、弹性蛋白酶和PLA2介导性肺损伤保护作用的机理进行了研究,现报道如下。
一、材料和方法
, http://www.100md.com
1.动物分组:选健康长白种猪28只(南京军区动物实验中心提供),体重16~22 kg,雌雄不限,随机分为5组:Ⅰ组:即假手术对照组(5只);Ⅱ组:ASP组(6只);Ⅲ组:二甲亚砜(DMSO)组(5只);Ⅳ组:ASP+PAF受体拮抗剂预防组(6只);Ⅴ组即ASP+PAF受体拮抗剂治疗组(6只)。
2.BN50739的配制和使用:PAF受体拮抗剂BN50739由法国Braquet P博士所赠。PAF受体拮抗剂预防组,按10 mg/kg BN50739于ASP诱导前30分钟溶于64%~66%三甲亚砜,配成质量分数为3.2%~3.34%,缓慢从腔静脉内注入,速度根据平均动脉压(MAP)的变化调节,保持MAP的波动不大于3.75~7.5 mm Hg(1kPa=7.5 mm Hg)。PAF受体拮抗剂治疗组,于ASP诱导后6小时开始给予BN50739,首次用量为10 mg/kg,以后均为5 mg/kg,每8小时1次。以64%~66% DMSO取代BN50739,即为DMSO对照组。
, 百拇医药
3.急性重症胰腺炎的诱导和管理:参见文献[3]。
4.样本采集和处理:存活的猪在72小时后用10% KCl处死,立即留取胰腺、肺组织,部分用10%甲醛磷酸缓冲液(pH7.4)固定,常规石蜡切片、HE染色;部分组织块先用冰冷的生理盐水冲洗,除去血液,滤纸拭干,称重,用1∶9的匀浆介质(0.25 mol/L蔗糖,0.025 mol/L Tris/HCl,0.000 1 mol/L依地酸纳,pH7.5)制备组织匀浆,3 500 r/min离心15分钟(0~4 ℃),上清在-20 ℃以下保存备用,以检测组织PAF(生物活性检测法)[4]、弹性蛋白酶[5]、磷脂酶A2(PLA2)[6]和过氧化物酶(MPO)。
5.统计学处理:所列计量资料均采用均数±标准差表示,应用统计软件包stat 5.0作方差分析、Newman-Keuls′检验和t检验。
, 百拇医药
二、结果
1.组织PAF和弹性蛋白酶含量及PLA2和MPO活性的变化:Ⅱ组和Ⅲ组肺组织和气管粘膜PAF和弹性蛋白酶含量及PLA2活性较正常对照组明显升高(P均<0.01),但两组间差异无显著意义。预防或治疗性应用BN50739均可非常显著地减少ASP猪肺和气管粘膜中的PAF和弹性蛋白酶含量及PLA2活性,但仍高于正常对照组(P均<0.01)(表1)。Ⅳ组肺组织MPO水平明显低于Ⅱ组和Ⅲ组,(P均<0.01)。而Ⅴ组肺组织MPO活性仍很高,与Ⅱ组和Ⅲ组比较差别无显著意义(表1)。
表1 猪肺组织PAF、弹性蛋白酶及PLA2活性的变化(
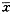 ±s) 组别
±s) 组别例数
, 百拇医药
血小板活化因子
(ng.g-1)
弹性蛋白酶
(μg.mg-1)
磷脂酶A2
(μmol.min-1.mg-1)
过氧化物酶
(nmolH2O2.min-1.g-1)
, 百拇医药
肺
气管粘膜
肺
气管粘膜
肺
气管粘膜
肺
Ⅰ组
5
28± 3
44.5± 2.6
28± 3
44.5± 2.6
, 百拇医药
0.327±0.063
0.301±0.029
0.36±0.02
Ⅱ组
6
264±149
413.1±155.1
264±149
413.1±155.1
1.345±0.027
1.370±0.040
2.07±0.62
, 百拇医药
Ⅲ组
5
270±103
435.5±123.4
270±103
435.5±123.4
1.494±0.075
1.395±0.087
2.13±0.14
Ⅳ组
6
152± 64△*
, 百拇医药
379.1± 54.8△*
152± 64△*
379.1± 54.8△*
0.830±0.197△*
0.800±0.116△
1.05±0.62△*
Ⅴ组
6
174± 78△*
392.5±112.7△*
, 百拇医药
174± 78△*
392.5±112.7△*
0.810±0.128△*
0.480±0.168△*
2.05±0.83*
注:与Ⅱ组比较:△ P<0.01;与Ⅲ组比较:* P<0.01
2.干重比和组织含水量的变化:干湿重比(W/D)比和织组含水量(TTW)在Ⅲ组的变化与ASP组也基本一致,肺组织湿重两组间差异无统计学意义。预防或治疗性应用BN50739均可使W/D比和TTW明显降低,但仍要明显高于正常对照组(表2)。
, 百拇医药
表2 猪肺组织湿干重比和组织含水量的变化 组
别
例
数
W/D RATIO(%)
TTW(gH2O/g)
肺
气管粘膜
肺
气管粘膜
Ⅰ组
5
, 百拇医药 4.38±0.37
4.22±0.32
3.39±0.37
3.22±0.32
Ⅱ组
6
5.72±0.69
5.71±0.37
4.73±0.68
4.77±0.37
Ⅲ组
5
, 百拇医药
5.83±0.22
5.78±0.18
4.81±0.22
4.70±0.18
Ⅳ组
6
5.19±0.34△*
5.12±0.12△*
4.19±0.34△*
4.12±0.12△*
Ⅴ组
, 百拇医药
6
5.20±0.17△*
5.24±0.10△*
4.20±0.17△*
4.24±0.10△*
注:与Ⅱ组比较:△ P<0.01;与Ⅲ组比较:* P<0.01
3.组织形态学观察:预防或治疗性应用BN50739均可一定程度地减轻ASP所致的肺组织和气管粘膜损伤,肺组织虽有出血、炎性浸润、肺泡隔增厚、肺间质水肿,但均要明显轻于Ⅱ组和Ⅲ组。
三、讨论
, 百拇医药
1.PAF与PMN和弹性蛋白酶:本实验结果证实,ASP可引起肺组织和气管粘膜PAF水平明显升高,提示PAF在ASP所致的肺组织和气管粘膜器损伤中起着重要作用。已证实肺组织中巨噬细胞、尘细胞、肺泡上皮细胞、血管内皮细胞均可合成和释放PAF,但在胰腺炎性肺损伤中,何种细胞是合成和释放PAF的主要细胞尚不清楚?Zhou等[2]认为肺血管内皮细胞是合成和释放PAF的主要细胞,胰源性炎性介质释放入血直接损伤肺血管内皮细胞,可能是导致PAF在胰腺炎肺损伤中大量释放的启动因子。本研究结果显示,预防或治疗性应用BN50739不仅可明显降低ASP后肺组织和气管粘膜中高浓度的PAF水平,而且使肺和气管粘膜组织湿干重比和TTW改善、组织PMN扣压减少、弹性蛋白酶和MPO水平下降,从而减轻ASP后肺损伤。
PAF引起肺组织和气管粘膜损伤的确切机制尚不清楚,可能与下列因素有关:(1) 血管的直接损伤作用[7];(2) 中性粒细胞的激活;(3) 抑制了肺组织气管粘膜的抗氧化还原系统;(4) 促进氧自由基释放。
, http://www.100md.com
2.PAF与PLA2:Zhou等[2]发现静脉内给予PLA2可明显增加AP鼠的肺组织PAF水平,但不影响正常鼠的肺组织PAF水平,进一步证实PAF在AP性远离脏器如肺损伤中起着重要作用,而PLA2激活可能是导致PAF在肺局部大量蓄积的重要原因。本实验结果亦提示PAF和PLA2都是胰腺炎性肺损伤中的非常重要的炎性介质。两者之间有着相互放大或相互制约的作用。
参考文献
[1] Konturek SJ, Dembinski A, Konturek PJ, et al. Role of platelet-activating factor in pathogenesis of acute pancreatitis in rats. Gut, 1992, 33:1268-1274.
, 百拇医药 [2] Zhou WG, McCollum MO, Levine BA, et al. Role of platelet-activating factor in pancreatitis-associated acute lung injury in rats. Am J Pathol, 1992, 140:971-979.
[3] 屠伟峰,黎介寿,朱维铭,等.猪急性胰腺炎与肠源性细菌/内毒素易位.中国胃肠外科杂志,1998,1:22-25.
[4] Soerensen J, Kald B, Tagesson C, et al. Platelet-activating factor and phospholipase A2 in patients with septic shock and trauma, Intens Care Med, 1994, 20:555-561.
, 百拇医药
[5] Geiger R. Elastase. In: Bergmeyer J, Gioβ1 M-eds. Methods of enzymatic analysis. 3nd Vol V. Enzymes 3: peptidase, proteinase and their inhibitors. Weiheim: Nerlag Chemie, 1984. 170-184.
[6] 张文辉,李晓军,武建国,等.血清与精液磷脂酶A2的活力测定和初步应用.临床检验杂志,1996,14:250-252.
[7] Seale JP, Nourshargh S, Hellewell PG, et al. Mechanism of action of platelet-activating factor in the pulmonary circulation: An investigation using a novel isotopic system in rabbit isolated lung. Br J Pharmacol, 1991, 104:251.
(收稿:1998-04-16 修回:1998-12-03), 百拇医药