利福霉素酶的分离纯化及主要性质1
作者:吴文芳 杨俊森 曾青 斯琴 吕安国 张成刚
单位:中科院沈阳应用生态研究所
关键词:利福霉素SV;利福霉素酶;分离纯化
沈阳药科大学学报990414 摘 要 利福霉素SV发酵液经盐析和透析后,再经DEAE52和Sephadex G-100进一步分离纯化,获得聚丙烯酰胺疑胶电泳均一的利福霉素酶,该酶最适反应温度为30~35℃,酶活性的最适pH值在7.0~7.5之间,其分子质量为2.8×104,由单一亚基组成.酶的氨基酸组成测试结果表明此酶含有咪唑基、巯基和α-氨基3个常见的活性功能团,而且每个酶分子中含有1个铜离子,为一金属酶.
分类号 Q503
The Study of Purifying and the Main Characteristics of Rifase
, 百拇医药
Wu Wenfang,Yang Junsen,Zeng Qing,Si Qin,Lu Anguo,Zhang Chenggang
Institute of Applied Ecology,Academia Sinica,Shenyang,110015
Abstract A rifase which is a single band electrophoresed by SDS-PAGE was separated and purified from the fermentation liquid of Rifamycin SV by means of salting out and dialysis,and then by DEAE52and Sephadex G-100 chromatograph.The specific activity of decreasing rifamycin biological activities of rifase was 66 003 U/mg .The optimum reaction temperature was 30~35℃.The optimum pH was between 7\^0~7\^5.The molecular weight was 2.8×104.It was comprised of a single subunit.Experimental results showed this enzyme contained imidazole,mercapto group,α-amino three common functional group.Every molecule contained a Cu2+ion,so it was a metal enzyme.
, 百拇医药
Key words rifamycin SV;rifase;seperation purification
利福霉素酶(rifase)是地中海拟无枝菌酸菌在生物合成利福霉素SV(rifsv)过程中产生的一种能降低rifsv活性的酶.研究此酶的性质及其对rifsv的作用,将对rifsv发酵过程的代谢调控及提高rifsv的产量具有重要意义.作者对其分离纯化及主要性质进行了较为详细的研究.
1 材料与仪器
Rifsv发酵液(东北制药总厂提供);DEAE52和Sephadex G-100(Pharmacia Fine Chemicals);rifsv标准品(中国药品生物制品鉴定所);D-101大孔树指(天津农药厂);ATP、细胞色素C、脱氧核糖核酸酶、过氧化物酶(辣根)、过氧化氢酶(单体)及牛血清白蛋白(上海东风生化试剂厂);菌层和下层培养基(见文献〔1〕).PE-Optima 300型电感偶等离子体发射光谱仪(美国PE公司);835-50型氨基酸自动分析仪(日本日立公司);M8500紫外可见自动分光光度计(江苏泰州无线电厂).
, 百拇医药
2 实验方法
2.1 利福霉素酶的分离纯化
利福霉素SV发酵液离心(25 000 r/min,20 min),取上清液加入(NH4)2SO4至55%饱和度,盐析3~4 h后,离心取其沉淀,用pH 7.4、0.025 mol/L Tris-HCl缓冲液溶解,再离心(28 000 r/min,20 min)取上清液透析过夜,经DEAE52纤维素柱(2.0 cm×25 cm)层析.用含不同浓度NaCl的Tris-HCl缓冲液进行阶段洗脱,收集0.8 mol/L NaCl洗脱液得利福霉素酶粗制品,再经Sephadex G-100柱(1.4 cm×80 cm)层析,用0.025 mol/L NaCl洗脱液洗脱,得利福霉素酶.
2.2 酶及其亚基分子量的测定
, 百拇医药
将分纯并浓缩的利福霉毒酶液和牛血清白蛋白(6.7×104)、细胞色素C(1.24×104)、脱氧核糖核酸酶(3.1×104)、过氧化物酶(辣根,4.0×104)、过氧化氢酶(单体,6.1×104)分别经Sephadex G-100柱层析,用0.025 mol/L Tris-HCl(pH 7.4)缓冲液洗脱(流速为15~17 mL/h),每3.0~3.5 mL部分收集后取样,用Folin酚法显色〔2〕,测680 nm吸光值.绘制测定分子质量的标准曲线,再根据利福霉素酶经Sephadex G-100柱层析后的洗脱体积通过分子质量标准曲线,确定其酶的分子质量〔3〕.
亚基分子质量用超薄SDS-PAGE测定,分离胶浓度为1.5%,参比用已知分子量为(1.75~9.4)×104的标准蛋白.
, 百拇医药 2.3 利福霉素酶分子中金属元素及氨基酸组成的分析
取2 mL利福霉素酶的纯制剂(蛋白1.2 mg/mL)经酸消化2 h后测其金属元素的组分及含量.
取干粉纯酶制剂5 mg,加入6 mol/L HCl 1 mL,于110℃水解18 h后,分析其氨基酸组成〔4〕.
2.4 pH值对利福霉素酶活性的影响
分别在pH值为4.0、5.0、6.0、6.5、7.0、7.5、8.0、8.5和9.5的Tris-HCl缓冲液中加入等量已纯化的酶液和适量的利福霉素SV(用微量甲醇溶解)及ATP、Mg2+,于30℃水浴中振荡反应2 h后,稀释50倍,于445 nm处测OD值(利福霉素SV在445nm处有特征吸收).
2.5 温度对利福霉素酶活性的影响
, 百拇医药
选择pH为7.5的上述反应系统,反应温度分别为10、20、30、35、40和50℃反应2 h后,于445 nm处测OD值.
2.6 利福霉素酶活性的测定
用生物效价法表示酶活性.利福霉素酶在一定条件下能降低利福霉素SV的生物效价,而失活的酶则无此作用,因此将有活性与经加热失去活性的利福霉素酶,分别在相同条件下与等量的利福霉素SV(作用底物)反应相同时间后,用单剂量杯碟法测利福霉素SV的剩余效价,用二者效价之差表示利福霉素酶的生物活性.
反应系统1:0.9 mL利福霉素酶液+30 mL ATP+30μL MgCl2+50μL利福霉素酶,rifsv浓度为40 mg/mL;ATP浓度为50 mg/mL;MgCl2浓度为30.5 mg/mL.
反应系统2:与系统1不同的是先将0.9 mL的利福霉素酶液煮沸5 min,使酶失活,而后加入相同系统中,将上述两系统同时放入30℃水浴中振荡3 h后,用杯碟法测各自的抑菌圈直径,按lgθ=lgk.〔(ε样小+ε样大)-(ε标小-ε标大)〕/〔(ε标大+ε样大)-(ε标小+ε样小)〕计算被酶作用后剩余的rifsv的抑菌活性〔5〕.
, http://www.100md.com
3 结果与讨论
3.1 利福霉素酶的纯化
利福霉素SV发酵液经分离纯化后,以0.8 mol/L NaCl洗脱得一峰与活性峰基本重合,因而可确定该峰为利福霉素酶(见图1).将此洗脱下的利福霉素酶经Sephadex G-100柱层析,以洗脱体积毫升数对A值(280 nm)及比活绘制洗脱曲线得3个峰,活性部分在第一峰(见图2).此酶分离纯化全过程见表1.分离纯化总蛋白、总活性主要集中在0.8 mol/L NaCl的洗脱液中,活性回收率达71%以上.经Sephadex G-100纯化后的利福霉素酶其纯化倍数达15倍以上.经SDS-PAGE的纯度检测为一条带(图3).
Fig.1 Separation of rifase by DEAE 52 chromatography

, 百拇医药
Fig.3 SDS-PAGE of purified rifase
1—Sample purified by sephadex G-100;2,3—Rifase fermented liquor
Fig.2 Separation of rifase by sephadex G-100 chromatography
Tab.1 Purification of rifase from fermented liquor Purification steps
Total
volume/mL
Total amount
, http://www.100md.com protein/mg
Total
activity/U
Specific activity
/U.mg-1
Purification
times
Activity
recovery/%
W〗Fermented liquor
100
, http://www.100md.com
740
32 300
43.65
1
100
55%(NH4)2So4
138
401.58
28 899
71.96
1.65
89.47
, http://www.100md.com
dialysate
185
375.55
26 818
71.41
1.64
83.02
DEAE520.15 mol/L NaCl
50
21.50
776
36.09
, 百拇医药
0.83
2.40
DEAE520.25 mol/L NaCl
48
14.88
601
40.39
0.93
1.86
DEAE520.40 mol/L NaCl
47
12.69
, 百拇医药
443
34.12
0.78
1.34
DEAE520.80 mol/L NaCl
62
110.36
23 049
208.85
4.78
71.36
Schadex G100
, 百拇医药
15
6.68
4 409
660.03
15.12
13.65
3.2 利福霉素酶的分子质量及亚基分子质量 利福霉素酶经Sephadex G-100柱纯化后,从分子质量标准曲线得该酶分子质量为2.8×104(图4).用超薄SDS-聚丙烯酰胺凝胶电泳测得该酶亚基分子质量约为3.0×104(图5).这一结果与图3结果相似,表明该酶是由单亚基组成.
Fig.4 Determination of rifase molecular weight by sephadex G-100 chromatography
, 百拇医药
Fig.5 SDS-PAGE of purified rifase
1—Rifase fermented liquor;
2,3—Sample purified by sephadex G-100
3.3 纯利福霉素酶的氨基酸组成及含量
纯化的利福霉素酶氨基酸组成测试结果(表2)表明,利福霉素酶中含有一定数量的胱氨酸、组氨酸和精氨酸,它们分别含有巯基、咪唑基和α-氨基.这些活性功能团是某些酶类具有催化能力的必需基团〔6,7,8〕.Tab.2 The amino acid composition and amount of rifase
Amino acid
, 百拇医药 Ser
Tyt
Gly
Phe
Leu
Arg
Thr
Lys
Glu
His
Ala
Iso
Asp
, 百拇医药 Cys
Val
Amount/%
5.3
0.4
6.6
8.3
6.0
4.8
4.2
5.3
8.7
3.9
, 百拇医药
4.7
3.7
7.6
4.5
6.3
3.4 纯利福霉素酶中金属元素的确定
表3中列出了利福霉素酶中金属元素的种类和数量,表明此酶为每个分子含一个铜原子的金属酶.据报道〔9〕,含有金属元素的蛋白质普遍具有一定的催化活性.金属元素一般是酶活性中心的组成部分,起络合底物或作为酶的辅基传递电子作用,在金属酶催化活性的研究中,铜是一种已被研究得较为详尽的元素.Tab.3 The kinds of metal elements and amounts of rifase contained
, 百拇医药 Metal elements
Zn
Cu
Fe
Mo
Ni
Co
K
Ca
Ba
Atom number/enzyme molecule
0.5
1.0
, 百拇医药
0.3
0.002
0.006
0.002
0.3
0.04
0.006
3.5 利福霉素酶作用的最适pH值
从pH值对利福霉素酶活性的影响曲线(图6)可以看出,该酶活性随pH值变化为一种罩形曲线,说明具有一般的酶类的典型特征,且在本实验条件下利福霉素酶作用最适pH值为7.0~7.5之间.
3.6 利福霉素酶的最适反应温度
, http://www.100md.com
利福霉素酶活性的温度曲线(图7)表明,温度在10~30℃之间时,利福霉素酶活性随温度升高而增加,成线性关系.温度在30~35℃之间时活性变化不大,超过35℃酶活性明显下降,说明该酶活性的最适温度为30~35℃之间.由此可推测,当温度在0~35℃范围之内时,该酶没有发生热构象变化〔10〕.
Fig.6 pH curve of rifase activity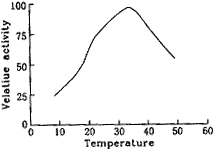
Fig.7 Optimum reaction temperature of rifase
3.7 利福霉素酶的生物活性测定
利用杯碟法,测得利福霉素酶的活性见表4.
, 百拇医药
表4说明利福霉素酶经加热失活以后,失去了钝化利福霉素SV的作用,因此B处理组的利福霉素SV抑菌圈大,生物效价高,说明有活性的利福霉素酶作用于利福霉素SV后,确实能降低利福霉素SV的效价.
Tab.4 Determination of rifase activities by the cup-plate method Sample
Treatment
Nalo area/mm
Residual titer
μg.mL-1
Activity unit/
μg.mL-1
, http://www.100md.com
1μg.mL-1
4μg.mL-1
1
A
15.16
20.38
1820.6
B
15.90
21.54
2311.9
491.8
, http://www.100md.com
2
A
14.82
20.64
1811.9
B
15.72
21.80
2321.3
509.4
3
A
15.16
, 百拇医药
21.16
2012.0
B
16.26
22.28
2621.3
618.7
A—有活性的利福霉素酶;B—加热灭活的利福霉素酶
国家自然科学基金资助项目
参考文献
1 吴文芳,张成刚,吕安国,等,利福霉素生产菌产生Rifsv物质的分离及性质研究.应用生态学报,1995,6(3):282~286
, 百拇医药
2 潘家秀,任梅轩,徐俊杰.蛋白质合成研究技术.北京:科学出版社,1962.12~13
3 Himmelhoch S R.Chromatography of protein of ion exchange.Method in Enzymology,1971,22:273~286
4 Piez K A,Saroff H A.Chromatography of amino acid and peptide in chromatography edited by E Hefemann.London:Reinhold Prblishing Corporation,1961.347~359
5 上海第三制药厂,上海第四制药厂,上海化工学院抗生素教研组.抗生素生产.北京:化学工业出版社,1979.351~372
6 Bittercourt H M,Schaimovicn H.Importance of SH groups in catalysis by bovine brain acid phosphatase.Biochim Biophys Acta,1976,438:153~158
, http://www.100md.com
7 Mles E W.Modification of histidyl residue in protein by diethyl pyrocarbonate.New York:E Academic Press,1977.431~442
8 Nakano M,Foucault G,Pudles J.Relationship between structure and chemical reactivity in D-glyceraldehyde-3-phosphate dehydrogenase trinitrophenylation of the lysine residues in yeast,sturgeon and rabit muscle enzyme.J Mol Biol,1976,105:275~291
9 金道森,童林荟.酶化学影响与应用.北京:科学出版社,1991.159~162
10 罗贵民,张学中,赵荧,等,生物化学技术的理论和实验.长春:吉林大学出版社,1991.189~190
收稿日期:1999-01-08, 百拇医药
单位:中科院沈阳应用生态研究所
关键词:利福霉素SV;利福霉素酶;分离纯化
沈阳药科大学学报990414 摘 要 利福霉素SV发酵液经盐析和透析后,再经DEAE52和Sephadex G-100进一步分离纯化,获得聚丙烯酰胺疑胶电泳均一的利福霉素酶,该酶最适反应温度为30~35℃,酶活性的最适pH值在7.0~7.5之间,其分子质量为2.8×104,由单一亚基组成.酶的氨基酸组成测试结果表明此酶含有咪唑基、巯基和α-氨基3个常见的活性功能团,而且每个酶分子中含有1个铜离子,为一金属酶.
分类号 Q503
The Study of Purifying and the Main Characteristics of Rifase
, 百拇医药
Wu Wenfang,Yang Junsen,Zeng Qing,Si Qin,Lu Anguo,Zhang Chenggang
Institute of Applied Ecology,Academia Sinica,Shenyang,110015
Abstract A rifase which is a single band electrophoresed by SDS-PAGE was separated and purified from the fermentation liquid of Rifamycin SV by means of salting out and dialysis,and then by DEAE52and Sephadex G-100 chromatograph.The specific activity of decreasing rifamycin biological activities of rifase was 66 003 U/mg .The optimum reaction temperature was 30~35℃.The optimum pH was between 7\^0~7\^5.The molecular weight was 2.8×104.It was comprised of a single subunit.Experimental results showed this enzyme contained imidazole,mercapto group,α-amino three common functional group.Every molecule contained a Cu2+ion,so it was a metal enzyme.
, 百拇医药
Key words rifamycin SV;rifase;seperation purification
利福霉素酶(rifase)是地中海拟无枝菌酸菌在生物合成利福霉素SV(rifsv)过程中产生的一种能降低rifsv活性的酶.研究此酶的性质及其对rifsv的作用,将对rifsv发酵过程的代谢调控及提高rifsv的产量具有重要意义.作者对其分离纯化及主要性质进行了较为详细的研究.
1 材料与仪器
Rifsv发酵液(东北制药总厂提供);DEAE52和Sephadex G-100(Pharmacia Fine Chemicals);rifsv标准品(中国药品生物制品鉴定所);D-101大孔树指(天津农药厂);ATP、细胞色素C、脱氧核糖核酸酶、过氧化物酶(辣根)、过氧化氢酶(单体)及牛血清白蛋白(上海东风生化试剂厂);菌层和下层培养基(见文献〔1〕).PE-Optima 300型电感偶等离子体发射光谱仪(美国PE公司);835-50型氨基酸自动分析仪(日本日立公司);M8500紫外可见自动分光光度计(江苏泰州无线电厂).
, 百拇医药
2 实验方法
2.1 利福霉素酶的分离纯化
利福霉素SV发酵液离心(25 000 r/min,20 min),取上清液加入(NH4)2SO4至55%饱和度,盐析3~4 h后,离心取其沉淀,用pH 7.4、0.025 mol/L Tris-HCl缓冲液溶解,再离心(28 000 r/min,20 min)取上清液透析过夜,经DEAE52纤维素柱(2.0 cm×25 cm)层析.用含不同浓度NaCl的Tris-HCl缓冲液进行阶段洗脱,收集0.8 mol/L NaCl洗脱液得利福霉素酶粗制品,再经Sephadex G-100柱(1.4 cm×80 cm)层析,用0.025 mol/L NaCl洗脱液洗脱,得利福霉素酶.
2.2 酶及其亚基分子量的测定
, 百拇医药
将分纯并浓缩的利福霉毒酶液和牛血清白蛋白(6.7×104)、细胞色素C(1.24×104)、脱氧核糖核酸酶(3.1×104)、过氧化物酶(辣根,4.0×104)、过氧化氢酶(单体,6.1×104)分别经Sephadex G-100柱层析,用0.025 mol/L Tris-HCl(pH 7.4)缓冲液洗脱(流速为15~17 mL/h),每3.0~3.5 mL部分收集后取样,用Folin酚法显色〔2〕,测680 nm吸光值.绘制测定分子质量的标准曲线,再根据利福霉素酶经Sephadex G-100柱层析后的洗脱体积通过分子质量标准曲线,确定其酶的分子质量〔3〕.
亚基分子质量用超薄SDS-PAGE测定,分离胶浓度为1.5%,参比用已知分子量为(1.75~9.4)×104的标准蛋白.
, 百拇医药 2.3 利福霉素酶分子中金属元素及氨基酸组成的分析
取2 mL利福霉素酶的纯制剂(蛋白1.2 mg/mL)经酸消化2 h后测其金属元素的组分及含量.
取干粉纯酶制剂5 mg,加入6 mol/L HCl 1 mL,于110℃水解18 h后,分析其氨基酸组成〔4〕.
2.4 pH值对利福霉素酶活性的影响
分别在pH值为4.0、5.0、6.0、6.5、7.0、7.5、8.0、8.5和9.5的Tris-HCl缓冲液中加入等量已纯化的酶液和适量的利福霉素SV(用微量甲醇溶解)及ATP、Mg2+,于30℃水浴中振荡反应2 h后,稀释50倍,于445 nm处测OD值(利福霉素SV在445nm处有特征吸收).
2.5 温度对利福霉素酶活性的影响
, 百拇医药
选择pH为7.5的上述反应系统,反应温度分别为10、20、30、35、40和50℃反应2 h后,于445 nm处测OD值.
2.6 利福霉素酶活性的测定
用生物效价法表示酶活性.利福霉素酶在一定条件下能降低利福霉素SV的生物效价,而失活的酶则无此作用,因此将有活性与经加热失去活性的利福霉素酶,分别在相同条件下与等量的利福霉素SV(作用底物)反应相同时间后,用单剂量杯碟法测利福霉素SV的剩余效价,用二者效价之差表示利福霉素酶的生物活性.
反应系统1:0.9 mL利福霉素酶液+30 mL ATP+30μL MgCl2+50μL利福霉素酶,rifsv浓度为40 mg/mL;ATP浓度为50 mg/mL;MgCl2浓度为30.5 mg/mL.
反应系统2:与系统1不同的是先将0.9 mL的利福霉素酶液煮沸5 min,使酶失活,而后加入相同系统中,将上述两系统同时放入30℃水浴中振荡3 h后,用杯碟法测各自的抑菌圈直径,按lgθ=lgk.〔(ε样小+ε样大)-(ε标小-ε标大)〕/〔(ε标大+ε样大)-(ε标小+ε样小)〕计算被酶作用后剩余的rifsv的抑菌活性〔5〕.
, http://www.100md.com
3 结果与讨论
3.1 利福霉素酶的纯化
利福霉素SV发酵液经分离纯化后,以0.8 mol/L NaCl洗脱得一峰与活性峰基本重合,因而可确定该峰为利福霉素酶(见图1).将此洗脱下的利福霉素酶经Sephadex G-100柱层析,以洗脱体积毫升数对A值(280 nm)及比活绘制洗脱曲线得3个峰,活性部分在第一峰(见图2).此酶分离纯化全过程见表1.分离纯化总蛋白、总活性主要集中在0.8 mol/L NaCl的洗脱液中,活性回收率达71%以上.经Sephadex G-100纯化后的利福霉素酶其纯化倍数达15倍以上.经SDS-PAGE的纯度检测为一条带(图3).

Fig.1 Separation of rifase by DEAE 52 chromatography


, 百拇医药
Fig.3 SDS-PAGE of purified rifase
1—Sample purified by sephadex G-100;2,3—Rifase fermented liquor
Fig.2 Separation of rifase by sephadex G-100 chromatography
Tab.1 Purification of rifase from fermented liquor Purification steps
Total
volume/mL
Total amount
, http://www.100md.com protein/mg
Total
activity/U
Specific activity
/U.mg-1
Purification
times
Activity
recovery/%
W〗Fermented liquor
100
, http://www.100md.com
740
32 300
43.65
1
100
55%(NH4)2So4
138
401.58
28 899
71.96
1.65
89.47
, http://www.100md.com
dialysate
185
375.55
26 818
71.41
1.64
83.02
DEAE520.15 mol/L NaCl
50
21.50
776
36.09
, 百拇医药
0.83
2.40
DEAE520.25 mol/L NaCl
48
14.88
601
40.39
0.93
1.86
DEAE520.40 mol/L NaCl
47
12.69
, 百拇医药
443
34.12
0.78
1.34
DEAE520.80 mol/L NaCl
62
110.36
23 049
208.85
4.78
71.36
Schadex G100
, 百拇医药
15
6.68
4 409
660.03
15.12
13.65
3.2 利福霉素酶的分子质量及亚基分子质量 利福霉素酶经Sephadex G-100柱纯化后,从分子质量标准曲线得该酶分子质量为2.8×104(图4).用超薄SDS-聚丙烯酰胺凝胶电泳测得该酶亚基分子质量约为3.0×104(图5).这一结果与图3结果相似,表明该酶是由单亚基组成.

Fig.4 Determination of rifase molecular weight by sephadex G-100 chromatography

, 百拇医药
Fig.5 SDS-PAGE of purified rifase
1—Rifase fermented liquor;
2,3—Sample purified by sephadex G-100
3.3 纯利福霉素酶的氨基酸组成及含量
纯化的利福霉素酶氨基酸组成测试结果(表2)表明,利福霉素酶中含有一定数量的胱氨酸、组氨酸和精氨酸,它们分别含有巯基、咪唑基和α-氨基.这些活性功能团是某些酶类具有催化能力的必需基团〔6,7,8〕.Tab.2 The amino acid composition and amount of rifase
Amino acid
, 百拇医药 Ser
Tyt
Gly
Phe
Leu
Arg
Thr
Lys
Glu
His
Ala
Iso
Asp
, 百拇医药 Cys
Val
Amount/%
5.3
0.4
6.6
8.3
6.0
4.8
4.2
5.3
8.7
3.9
, 百拇医药
4.7
3.7
7.6
4.5
6.3
3.4 纯利福霉素酶中金属元素的确定
表3中列出了利福霉素酶中金属元素的种类和数量,表明此酶为每个分子含一个铜原子的金属酶.据报道〔9〕,含有金属元素的蛋白质普遍具有一定的催化活性.金属元素一般是酶活性中心的组成部分,起络合底物或作为酶的辅基传递电子作用,在金属酶催化活性的研究中,铜是一种已被研究得较为详尽的元素.Tab.3 The kinds of metal elements and amounts of rifase contained
, 百拇医药 Metal elements
Zn
Cu
Fe
Mo
Ni
Co
K
Ca
Ba
Atom number/enzyme molecule
0.5
1.0
, 百拇医药
0.3
0.002
0.006
0.002
0.3
0.04
0.006
3.5 利福霉素酶作用的最适pH值
从pH值对利福霉素酶活性的影响曲线(图6)可以看出,该酶活性随pH值变化为一种罩形曲线,说明具有一般的酶类的典型特征,且在本实验条件下利福霉素酶作用最适pH值为7.0~7.5之间.
3.6 利福霉素酶的最适反应温度
, http://www.100md.com
利福霉素酶活性的温度曲线(图7)表明,温度在10~30℃之间时,利福霉素酶活性随温度升高而增加,成线性关系.温度在30~35℃之间时活性变化不大,超过35℃酶活性明显下降,说明该酶活性的最适温度为30~35℃之间.由此可推测,当温度在0~35℃范围之内时,该酶没有发生热构象变化〔10〕.

Fig.6 pH curve of rifase activity

Fig.7 Optimum reaction temperature of rifase
3.7 利福霉素酶的生物活性测定
利用杯碟法,测得利福霉素酶的活性见表4.
, 百拇医药
表4说明利福霉素酶经加热失活以后,失去了钝化利福霉素SV的作用,因此B处理组的利福霉素SV抑菌圈大,生物效价高,说明有活性的利福霉素酶作用于利福霉素SV后,确实能降低利福霉素SV的效价.
Tab.4 Determination of rifase activities by the cup-plate method Sample
Treatment
Nalo area/mm
Residual titer
μg.mL-1
Activity unit/
μg.mL-1
, http://www.100md.com
1μg.mL-1
4μg.mL-1
1
A
15.16
20.38
1820.6
B
15.90
21.54
2311.9
491.8
, http://www.100md.com
2
A
14.82
20.64
1811.9
B
15.72
21.80
2321.3
509.4
3
A
15.16
, 百拇医药
21.16
2012.0
B
16.26
22.28
2621.3
618.7
A—有活性的利福霉素酶;B—加热灭活的利福霉素酶
国家自然科学基金资助项目
参考文献
1 吴文芳,张成刚,吕安国,等,利福霉素生产菌产生Rifsv物质的分离及性质研究.应用生态学报,1995,6(3):282~286
, 百拇医药
2 潘家秀,任梅轩,徐俊杰.蛋白质合成研究技术.北京:科学出版社,1962.12~13
3 Himmelhoch S R.Chromatography of protein of ion exchange.Method in Enzymology,1971,22:273~286
4 Piez K A,Saroff H A.Chromatography of amino acid and peptide in chromatography edited by E Hefemann.London:Reinhold Prblishing Corporation,1961.347~359
5 上海第三制药厂,上海第四制药厂,上海化工学院抗生素教研组.抗生素生产.北京:化学工业出版社,1979.351~372
6 Bittercourt H M,Schaimovicn H.Importance of SH groups in catalysis by bovine brain acid phosphatase.Biochim Biophys Acta,1976,438:153~158
, http://www.100md.com
7 Mles E W.Modification of histidyl residue in protein by diethyl pyrocarbonate.New York:E Academic Press,1977.431~442
8 Nakano M,Foucault G,Pudles J.Relationship between structure and chemical reactivity in D-glyceraldehyde-3-phosphate dehydrogenase trinitrophenylation of the lysine residues in yeast,sturgeon and rabit muscle enzyme.J Mol Biol,1976,105:275~291
9 金道森,童林荟.酶化学影响与应用.北京:科学出版社,1991.159~162
10 罗贵民,张学中,赵荧,等,生物化学技术的理论和实验.长春:吉林大学出版社,1991.189~190
收稿日期:1999-01-08, 百拇医药