重组L-门冬酰胺酶空前体脂质体的研制及其包封率的测定
作者:王弘 吴梧桐 顾学裘
单位:中国药科大学生物制药学院(吴梧桐);沈阳药科大学药学系(顾学裘)
关键词:前体脂质体;重组L-门冬酰胺酶脂质体;包封率
沈阳药科大学学报990401 摘 要 采用乳化-挤压-冻干三步法完成空前体脂质体的制备.空前体脂质体以L-门冬酰胺酶为实验对象,测定了包封率.制得的前体脂质体水合形成的L-门冬酰胺酶脂质体形态圆整,粒径在(0.662±0.079 2) μm 范围内.3批前体脂质体对L-门冬酰胺酶的包封率分别为(48.2±0.99)%、(51.0±1.21)%、(52.2±1.25)%.3个批号的包封率变异系数(RSD%)均小于3%.结果说明制备的空前体脂质体水合形成的L-门冬酰胺酶脂质体粒度适宜,可用于L-门冬酰胺酶的包封.
分类号 R94
, 百拇医药
Preparation of Proliposomes and the Determination of Encapsulation
of Recombinant-L-asparaginase
Wang Hong,Wu Wutong,Gu Xueqiu
College of Biopharmaceutics,China Pharmaceutical University,Nanjing 210009
Abstract Proliposomes were prepared by the emulsification,extrusion and lyophilization methods.The experiments revealed that the L-asparaginase liposomes were regular in their morphology within diameters of (0.662±0.079 2) μm.The three batches of entrapment efficiency were(48.2±0.99)%,(51.0±1.21)%,(52.2±1625)% respectively.
, 百拇医药
Key words proliposomes;L-asparaginase liposomes;entrapment efficiency
L-门冬酰胺酶(L-asparaginase,L-ASNase)是治疗急性淋巴细胞白血病的有效药物,但静脉注射L-门冬酰胺酶常引起某些副作用,如过敏反应:发烧、皮疹和过敏性休克、血栓出血症等.以往脂质体混悬液以水分散体储存,易水解的药物稳定性受到很大影响.由于磷脂易被氧化、粒子沉降、聚集、融合导致包封药物泄漏等,这些因素使脂质体不能长期存放.虽然国外已报道L-门冬酰胺酶脂质体的评价研究〔1〕,但仍无法解决制备中加入的活性药物L-门冬酰胺酶存在不必要的损失问题和与脂质体混悬液有关的诸多问题.为提高脂质体的稳定性,将液态的脂质体制备成固态储存的脂质体,使用前加水水合形成脂质体而被应用.前体脂质体(proliposome)为一种干燥的产品,在加入水或药物水溶液后,分散或溶解形成一个等渗脂质体混悬液,是适用于静脉或其它途径给药的新型工艺制品.本制备技术在以往脂质体的匀化法〔2〕基础上加以改进,制成的空前体脂质体,可在一定程度上避免注射用的脂质体在生产过程经高温灭菌对其双分子结构严重破坏,避免被包封的生物技术产品热不稳定、有活性药物的失活,提高L-门冬酰胺酶的稳定性能、有效地将L-门冬酰胺酶转运到病变细胞.作者以L-门冬酰胺酶为模型药物,研究了空前体脂质体的制备工艺及包封性质.
, 百拇医药
1 实验部分
1.1 仪器与药品
扫描电子显微镜(SX-40型,日本明石公司);透射电子显微镜(H-7000型,日本日立公司);分光光度计(DU640型,美国Beckman公司);库尔特记数仪(Multisizer AccuComp.119型,美国);冷冻干燥机(LYOLAB B11型);722-光栅分光光度计(上海第三分析仪器厂);高速组织匀浆机(DS-1型,上海标本模型厂).
注射用大豆磷脂(soyabean lecithin,批号951001,上海油脂一厂);胆固醇(cholesterol,生化级,Holland进口分装);L-门冬酰胺酶(中国药科大学生化室提供);Sephadex G 200(批号930514,进口分装).
1.2 空前体脂质体的制备
, 百拇医药
脂质体的制备有反相蒸发法、旋转蒸发-薄膜水化法、超声-挤压法、透析、乳化微流体化法等〔3,4〕.作者在此基础上加以改进,采用乳化、挤压、冻干三步法完成空前体脂质体的制备.方法:将大豆磷脂和胆固醇在温热条件下溶于磷酸盐缓冲液,氮气保护下经过高速组织匀浆机匀化,制成溶液.再将上述类脂溶液挤压过微孔滤膜,得空前体脂质体溶液,在氮气保护下灌封,流通蒸气灭菌.灭菌的脂质体溶液,在无菌条件下分装于安瓿中,经冷冻干燥,熔封,即得白色空前体脂质体.
1.3 前体脂质体水合后形成L-门冬酰胺酶脂质体的形态观察
采用透射电子显微镜观察空前体脂质体加入L-门冬酰胺酶溶液水合后形成的L-门冬酰胺酶脂质体经2%磷钨酸染色后的外观形态,见图1、2.结果显示L-门冬酰胺酶脂质体基本显圆球形,并可见外壁为多层型.
, http://www.100md.com
Fig.1 Transmission electron micrograph of L-ASNase liposomes derived from proliposomes (×250 000)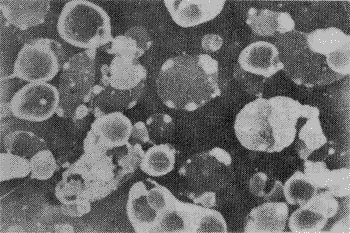
Fig.2 Transmission electron micrograph of L-ASNase liposomes derived from proliposomes (×20 000)
1.4 L-门冬酰胺酶脂质体的粒度范围和贮存期对粒度范围的影响
空前体脂质体加入L-门冬酰胺酶溶液水合形成的L-门冬酰胺酶脂质体,用库尔特记数仪检测粒子大小分布,结果表明脂质体粒径在(0.662±0.0792)μm范围,变异系数为12%(统计粒子数目66 141个,95%可信限:0.661~0.662 μm).L-门冬酰胺酶脂质体混悬液,在4℃储存2个月后,粒径在(0.684±0.1)μm范围,变异系数为14.6%(统计数子数目42 508个,95%可信限:0.683~0.685 μm).L-门冬酰胺酶脂质体经4℃储存3个月后,粒径在(0.745±0.179)μm范围内,(统计粒子数目:55 277个,95%可信限:0.744~0.747 μm),变异系数为24.1%.
, 百拇医药
1.5 L-门冬酰胺酶的测定方法和L-门冬酰胺酶的回收率试验
1.5.1 标准曲线试验
精密配制一系列L-ASNase标准水溶液,浓度分别为0.01、0.02、0.04、0.06、0.08 mg/mL.
精密量取pH 8.5硼酸缓冲液0.5 mL与L-门冬酰胺酶溶液(0.04 mol/L)1.0 mL混匀,于37℃水浴预热,精密加入供试L-门冬酰胺酶标准溶液0.5 mL,37℃水浴15 min,加15%三氯乙酸溶液0.5 mL,混匀,精密量取反应液1.0 mL,加水7 mL与碱性碘化汞钾溶液2 mL,混匀,放置15 min,空白同样处理,但先加15%三氯乙酸溶液,后加L-门冬酰胺酶溶液,在500 nm处测定吸收度.根据工作曲线读出供试品中对应氨量,计算酶活力单位(上述反应条件下,每分钟能催化L-门冬酰胺释放1微摩尔氨的酶量为一个活力单位),结果见表1.分别以活力单位A为纵坐标,浓度C为横坐标做图,得标准曲线方程:A=4.708 5+155.770 5 C,Y=0.999 9.
, 百拇医药
1.5.2 回收率和精密度试验
精密配制一系列L-ASNase水溶液各3份,浓度分别为:4.0、8.0、12.0、16.0、20.0、24.0 μg/μL.按上述条件在6个浓度水平上测定了L-门冬酶胺酶的活力,由标准曲线求得回收率和精密度(RSD),结果见表1.
Tab.1 Recoveries of the spectrophotometry for the
assay of L-asparaginase (n=3) Add/μg.μL-1
Found/μg.μL-1
Recovery/%
, 百拇医药 RSD/%
4.0
4.006±0.121
100.1
0.520
8.0
8.003±0.025
100.0
0.314
12.0
12.003±0.031
100.0
, http://www.100md.com 0.254
16.0
15.987±0.035
99.9
0.220
20.0
19.980±0.035
99.9
0.175
24.0
23.963±0.051
99.8
, http://www.100md.com 0.213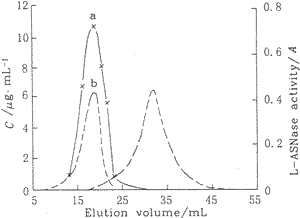
Fig.3 Gel filtration patterns of L-ASNase liposomes
a—Liposome concentration of phosphorus;
b—L-ASNase activity
1.6 L-门冬酰胺酶脂质体的包封率试验
1.6.1 包封率测定法
精密称取空前体脂质体500 mg,用L-门冬酰胺酶液(2 mg/mL)10 mL水合溶解,形成L-门冬酰胺酶脂质体混悬液.精密吸取该混悬液1 mL,置于10 mL容量瓶中,加水定容,再精密吸取0.1 mL上样于Sephadex G 200凝胶柱分离,采用定磷法绘制分离曲线〔5〕,见图3.
, 百拇医药
根据最佳分离条件收集L-ASNase脂质体的初洗脱液25 mL,再用50 mL容量瓶收集游离L-ASNase的续洗脱液至刻度,测定在500 nm处游离L-ASNase的含量(Cf),按下式计算包封率.包封率=(C\-0-C\-f)/C\-0×100%.C0为L-ASNase脂质体的总浓度.
1.6.2 包封率测定的回收率试验
将L-ASNase标准溶液上Sephadex G 200凝胶柱,按“1.6.1”脂质体的包封率测定方法洗脱,收集洗脱液75 mL,测定其中L-ASNase的量.结果平均回收率为99.72%,RSD为0.51%,n=6.
在空前体脂质体中加入L-门冬酰胺酶液1.0 mL,按脂质体的包封率测定方法洗脱,收集续洗脱液50 mL,测定其中L-ASNase的量.结果平均回收率为99.47%,RSD为0.77%,n=6.
, http://www.100md.com
1.6.3 空前体脂质体对L-门冬酰胺酶的包封率测定
空前体脂质体500 mg,分别加入L-门冬酰胺酶液(2 mg/mL)10 mL进行水合包封,形成L-门冬酰胺酶脂质体混悬液,所制备包封的L-门冬酰胺酶的脂质体用以测定包封率,见表2.
制备的前体脂质体对L-门冬酰胺酶的包封率在(48.2±0.99)%~(52.2±1.25)%之间.3个批号的变异系数(RSD%)均小于3%,符合实验要求.
2 讨论
采用药用大豆磷脂制备出不包封药物的空前体脂质体,既区别于由药物和脂类组成的常规前体脂质体,克服其包封药物稳定性问题(药物本身降解或被氧化),又区别于常规脂质体混悬液,克服了其混悬液稳定性问题(与脂类相关的被氧化、脂质体聚集或药物从脂质体中泄漏),适合包封多种药物的前体脂质体.
, 百拇医药
通过空前体脂质体加入L-门冬酰胺酶液进行水合包封,形成L-门冬酰胺酶脂质体混悬液,保持了较高的酶活性并有稳定的包封率.
国外〔3,4〕目前常规制备的前体脂质体均为包含某种药物的脂质体预制品,虽然加水即可形成脂质体,但在制备过程中加入药物,对于制备那些不稳定的活性药物脂质体不利.另外,由于大多数生物技术产品不耐热,常规制备工艺易导致这类产品破坏失效.因此,研制一种不把主药包在里面,临用前现配的空前体脂质体具有重要意义和实用价值.
Tab.2 The entrapment efficiency of L-ASNase
liposomes derived from proliposomes Lot No.
n=6
Entrapment
, 百拇医药
efficiency/%
Mean entrapment
efficiency/%±s
RSD/%
96072701
50.8
49.5
53.2
51.0±1.21
2.37
50.6
50.9
, http://www.100md.com
51.0
96072702
49.2
48.4
47.2
48.2±0.99
2.06
48.2
49.3
46.4
96072903
52.3
53.5
, 百拇医药
53.2
52.2±1.25
2.39
50.2
52.9
51.4
本研究中将空前体脂质体冻干品与L-门冬酰胺酶冻干品分别包装,然后用L-门冬酰胺酶溶解液将前体脂质体水合制成L-门冬酰胺酶脂质体混悬液,在制备上是可行的,运输、贮存方便.临用前调配,稳定性得以提高.
作者简介:王 弘,沈阳药科大学1993级药剂学博士生,现为北京放射医学研究所博士后
参考文献
1 Gurz MEM,Gaspar M M,Lopes F.Liposomal L-asparaginese:in virto evaluation.Int J Pharm,1993,96:67~77
, http://www.100md.com
2 顾学裘主编.中国多相脂质体研究.北京:中国医药科技出版社,1991.1~10
3 Ahn BN,Kim SK,Shim CK.Preparation and evaluation of proliposomes containing propranolol hydrochloride.J Microencapsulation,1995,12(4):363~375
4 Katare OP,Vras SP,VK Dixit VK,et al. Enhanced in vivo performance of liposomal indomethacin derived from effervescent granule based proliposomes.J Microencapsutation,1995,12(5):487~493
5 周之鸿,徐宁宁,陈庆才,等.脂质体中磷脂的含磷量测定.药学通报,1987,22:77~79
收稿日期:1998-12-17, 百拇医药
单位:中国药科大学生物制药学院(吴梧桐);沈阳药科大学药学系(顾学裘)
关键词:前体脂质体;重组L-门冬酰胺酶脂质体;包封率
沈阳药科大学学报990401 摘 要 采用乳化-挤压-冻干三步法完成空前体脂质体的制备.空前体脂质体以L-门冬酰胺酶为实验对象,测定了包封率.制得的前体脂质体水合形成的L-门冬酰胺酶脂质体形态圆整,粒径在(0.662±0.079 2) μm 范围内.3批前体脂质体对L-门冬酰胺酶的包封率分别为(48.2±0.99)%、(51.0±1.21)%、(52.2±1.25)%.3个批号的包封率变异系数(RSD%)均小于3%.结果说明制备的空前体脂质体水合形成的L-门冬酰胺酶脂质体粒度适宜,可用于L-门冬酰胺酶的包封.
分类号 R94
, 百拇医药
Preparation of Proliposomes and the Determination of Encapsulation
of Recombinant-L-asparaginase
Wang Hong,Wu Wutong,Gu Xueqiu
College of Biopharmaceutics,China Pharmaceutical University,Nanjing 210009
Abstract Proliposomes were prepared by the emulsification,extrusion and lyophilization methods.The experiments revealed that the L-asparaginase liposomes were regular in their morphology within diameters of (0.662±0.079 2) μm.The three batches of entrapment efficiency were(48.2±0.99)%,(51.0±1.21)%,(52.2±1625)% respectively.
, 百拇医药
Key words proliposomes;L-asparaginase liposomes;entrapment efficiency
L-门冬酰胺酶(L-asparaginase,L-ASNase)是治疗急性淋巴细胞白血病的有效药物,但静脉注射L-门冬酰胺酶常引起某些副作用,如过敏反应:发烧、皮疹和过敏性休克、血栓出血症等.以往脂质体混悬液以水分散体储存,易水解的药物稳定性受到很大影响.由于磷脂易被氧化、粒子沉降、聚集、融合导致包封药物泄漏等,这些因素使脂质体不能长期存放.虽然国外已报道L-门冬酰胺酶脂质体的评价研究〔1〕,但仍无法解决制备中加入的活性药物L-门冬酰胺酶存在不必要的损失问题和与脂质体混悬液有关的诸多问题.为提高脂质体的稳定性,将液态的脂质体制备成固态储存的脂质体,使用前加水水合形成脂质体而被应用.前体脂质体(proliposome)为一种干燥的产品,在加入水或药物水溶液后,分散或溶解形成一个等渗脂质体混悬液,是适用于静脉或其它途径给药的新型工艺制品.本制备技术在以往脂质体的匀化法〔2〕基础上加以改进,制成的空前体脂质体,可在一定程度上避免注射用的脂质体在生产过程经高温灭菌对其双分子结构严重破坏,避免被包封的生物技术产品热不稳定、有活性药物的失活,提高L-门冬酰胺酶的稳定性能、有效地将L-门冬酰胺酶转运到病变细胞.作者以L-门冬酰胺酶为模型药物,研究了空前体脂质体的制备工艺及包封性质.
, 百拇医药
1 实验部分
1.1 仪器与药品
扫描电子显微镜(SX-40型,日本明石公司);透射电子显微镜(H-7000型,日本日立公司);分光光度计(DU640型,美国Beckman公司);库尔特记数仪(Multisizer AccuComp.119型,美国);冷冻干燥机(LYOLAB B11型);722-光栅分光光度计(上海第三分析仪器厂);高速组织匀浆机(DS-1型,上海标本模型厂).
注射用大豆磷脂(soyabean lecithin,批号951001,上海油脂一厂);胆固醇(cholesterol,生化级,Holland进口分装);L-门冬酰胺酶(中国药科大学生化室提供);Sephadex G 200(批号930514,进口分装).
1.2 空前体脂质体的制备
, 百拇医药
脂质体的制备有反相蒸发法、旋转蒸发-薄膜水化法、超声-挤压法、透析、乳化微流体化法等〔3,4〕.作者在此基础上加以改进,采用乳化、挤压、冻干三步法完成空前体脂质体的制备.方法:将大豆磷脂和胆固醇在温热条件下溶于磷酸盐缓冲液,氮气保护下经过高速组织匀浆机匀化,制成溶液.再将上述类脂溶液挤压过微孔滤膜,得空前体脂质体溶液,在氮气保护下灌封,流通蒸气灭菌.灭菌的脂质体溶液,在无菌条件下分装于安瓿中,经冷冻干燥,熔封,即得白色空前体脂质体.
1.3 前体脂质体水合后形成L-门冬酰胺酶脂质体的形态观察
采用透射电子显微镜观察空前体脂质体加入L-门冬酰胺酶溶液水合后形成的L-门冬酰胺酶脂质体经2%磷钨酸染色后的外观形态,见图1、2.结果显示L-门冬酰胺酶脂质体基本显圆球形,并可见外壁为多层型.

, http://www.100md.com
Fig.1 Transmission electron micrograph of L-ASNase liposomes derived from proliposomes (×250 000)

Fig.2 Transmission electron micrograph of L-ASNase liposomes derived from proliposomes (×20 000)
1.4 L-门冬酰胺酶脂质体的粒度范围和贮存期对粒度范围的影响
空前体脂质体加入L-门冬酰胺酶溶液水合形成的L-门冬酰胺酶脂质体,用库尔特记数仪检测粒子大小分布,结果表明脂质体粒径在(0.662±0.0792)μm范围,变异系数为12%(统计粒子数目66 141个,95%可信限:0.661~0.662 μm).L-门冬酰胺酶脂质体混悬液,在4℃储存2个月后,粒径在(0.684±0.1)μm范围,变异系数为14.6%(统计数子数目42 508个,95%可信限:0.683~0.685 μm).L-门冬酰胺酶脂质体经4℃储存3个月后,粒径在(0.745±0.179)μm范围内,(统计粒子数目:55 277个,95%可信限:0.744~0.747 μm),变异系数为24.1%.
, 百拇医药
1.5 L-门冬酰胺酶的测定方法和L-门冬酰胺酶的回收率试验
1.5.1 标准曲线试验
精密配制一系列L-ASNase标准水溶液,浓度分别为0.01、0.02、0.04、0.06、0.08 mg/mL.
精密量取pH 8.5硼酸缓冲液0.5 mL与L-门冬酰胺酶溶液(0.04 mol/L)1.0 mL混匀,于37℃水浴预热,精密加入供试L-门冬酰胺酶标准溶液0.5 mL,37℃水浴15 min,加15%三氯乙酸溶液0.5 mL,混匀,精密量取反应液1.0 mL,加水7 mL与碱性碘化汞钾溶液2 mL,混匀,放置15 min,空白同样处理,但先加15%三氯乙酸溶液,后加L-门冬酰胺酶溶液,在500 nm处测定吸收度.根据工作曲线读出供试品中对应氨量,计算酶活力单位(上述反应条件下,每分钟能催化L-门冬酰胺释放1微摩尔氨的酶量为一个活力单位),结果见表1.分别以活力单位A为纵坐标,浓度C为横坐标做图,得标准曲线方程:A=4.708 5+155.770 5 C,Y=0.999 9.
, 百拇医药
1.5.2 回收率和精密度试验
精密配制一系列L-ASNase水溶液各3份,浓度分别为:4.0、8.0、12.0、16.0、20.0、24.0 μg/μL.按上述条件在6个浓度水平上测定了L-门冬酶胺酶的活力,由标准曲线求得回收率和精密度(RSD),结果见表1.
Tab.1 Recoveries of the spectrophotometry for the
assay of L-asparaginase (n=3) Add/μg.μL-1
Found/μg.μL-1
Recovery/%
, 百拇医药 RSD/%
4.0
4.006±0.121
100.1
0.520
8.0
8.003±0.025
100.0
0.314
12.0
12.003±0.031
100.0
, http://www.100md.com 0.254
16.0
15.987±0.035
99.9
0.220
20.0
19.980±0.035
99.9
0.175
24.0
23.963±0.051
99.8
, http://www.100md.com 0.213

Fig.3 Gel filtration patterns of L-ASNase liposomes
a—Liposome concentration of phosphorus;
b—L-ASNase activity
1.6 L-门冬酰胺酶脂质体的包封率试验
1.6.1 包封率测定法
精密称取空前体脂质体500 mg,用L-门冬酰胺酶液(2 mg/mL)10 mL水合溶解,形成L-门冬酰胺酶脂质体混悬液.精密吸取该混悬液1 mL,置于10 mL容量瓶中,加水定容,再精密吸取0.1 mL上样于Sephadex G 200凝胶柱分离,采用定磷法绘制分离曲线〔5〕,见图3.
, 百拇医药
根据最佳分离条件收集L-ASNase脂质体的初洗脱液25 mL,再用50 mL容量瓶收集游离L-ASNase的续洗脱液至刻度,测定在500 nm处游离L-ASNase的含量(Cf),按下式计算包封率.包封率=(C\-0-C\-f)/C\-0×100%.C0为L-ASNase脂质体的总浓度.
1.6.2 包封率测定的回收率试验
将L-ASNase标准溶液上Sephadex G 200凝胶柱,按“1.6.1”脂质体的包封率测定方法洗脱,收集洗脱液75 mL,测定其中L-ASNase的量.结果平均回收率为99.72%,RSD为0.51%,n=6.
在空前体脂质体中加入L-门冬酰胺酶液1.0 mL,按脂质体的包封率测定方法洗脱,收集续洗脱液50 mL,测定其中L-ASNase的量.结果平均回收率为99.47%,RSD为0.77%,n=6.
, http://www.100md.com
1.6.3 空前体脂质体对L-门冬酰胺酶的包封率测定
空前体脂质体500 mg,分别加入L-门冬酰胺酶液(2 mg/mL)10 mL进行水合包封,形成L-门冬酰胺酶脂质体混悬液,所制备包封的L-门冬酰胺酶的脂质体用以测定包封率,见表2.
制备的前体脂质体对L-门冬酰胺酶的包封率在(48.2±0.99)%~(52.2±1.25)%之间.3个批号的变异系数(RSD%)均小于3%,符合实验要求.
2 讨论
采用药用大豆磷脂制备出不包封药物的空前体脂质体,既区别于由药物和脂类组成的常规前体脂质体,克服其包封药物稳定性问题(药物本身降解或被氧化),又区别于常规脂质体混悬液,克服了其混悬液稳定性问题(与脂类相关的被氧化、脂质体聚集或药物从脂质体中泄漏),适合包封多种药物的前体脂质体.
, 百拇医药
通过空前体脂质体加入L-门冬酰胺酶液进行水合包封,形成L-门冬酰胺酶脂质体混悬液,保持了较高的酶活性并有稳定的包封率.
国外〔3,4〕目前常规制备的前体脂质体均为包含某种药物的脂质体预制品,虽然加水即可形成脂质体,但在制备过程中加入药物,对于制备那些不稳定的活性药物脂质体不利.另外,由于大多数生物技术产品不耐热,常规制备工艺易导致这类产品破坏失效.因此,研制一种不把主药包在里面,临用前现配的空前体脂质体具有重要意义和实用价值.
Tab.2 The entrapment efficiency of L-ASNase
liposomes derived from proliposomes Lot No.
n=6
Entrapment
, 百拇医药
efficiency/%
Mean entrapment
efficiency/%±s
RSD/%
96072701
50.8
49.5
53.2
51.0±1.21
2.37
50.6
50.9
, http://www.100md.com
51.0
96072702
49.2
48.4
47.2
48.2±0.99
2.06
48.2
49.3
46.4
96072903
52.3
53.5
, 百拇医药
53.2
52.2±1.25
2.39
50.2
52.9
51.4
本研究中将空前体脂质体冻干品与L-门冬酰胺酶冻干品分别包装,然后用L-门冬酰胺酶溶解液将前体脂质体水合制成L-门冬酰胺酶脂质体混悬液,在制备上是可行的,运输、贮存方便.临用前调配,稳定性得以提高.
作者简介:王 弘,沈阳药科大学1993级药剂学博士生,现为北京放射医学研究所博士后
参考文献
1 Gurz MEM,Gaspar M M,Lopes F.Liposomal L-asparaginese:in virto evaluation.Int J Pharm,1993,96:67~77
, http://www.100md.com
2 顾学裘主编.中国多相脂质体研究.北京:中国医药科技出版社,1991.1~10
3 Ahn BN,Kim SK,Shim CK.Preparation and evaluation of proliposomes containing propranolol hydrochloride.J Microencapsulation,1995,12(4):363~375
4 Katare OP,Vras SP,VK Dixit VK,et al. Enhanced in vivo performance of liposomal indomethacin derived from effervescent granule based proliposomes.J Microencapsutation,1995,12(5):487~493
5 周之鸿,徐宁宁,陈庆才,等.脂质体中磷脂的含磷量测定.药学通报,1987,22:77~79
收稿日期:1998-12-17, 百拇医药