人Aγ-珠蛋白基因-173 T→C突变对启动子功能的影响△
作者:黄小东 张俊武 阳学贤 王以弘 赵华路
单位:中国医学科学院 中国协和医科大学 基础医学研究所医学分子生物学国家重点实验室, 北京 100005
关键词:Aγ-珠蛋白基因;启动子;点突变;转录因子GATA-1;基因表达
人Aγ 摘要 目的 研究人Aγ-珠蛋白基因-173 T→C突变对反式作用因子与启动子的结合及对启动子活性的影响。方法 采用电泳迁移改变分析和荧光素酶报告基因瞬时转染分析。 结果 Aγ-珠蛋白基因-173 T→C突变使GATA-1与突变启动子片段(-201~-158)的结合降低了96%(P<0.01),并且使Oct-1与相同的DNA片段的结合降低55%(P<0.05)。在MELGM979细胞中,突变启动子活性是正常启动子的2倍(P<0.05);在K562和Hela细胞中,突变和正常启动子活性基本相同。结论 Aγ-启动子-173 T→C突变导致GATA-1与突变启动子片段结合显著减少,提示在成年期该转录因子可能是Aγ-珠蛋白基因的负调控因子;-173 T→C突变可能仅在成年期红系细胞环境中才能增强Aγ-珠蛋白基因启动子活性。
, http://www.100md.com
中图号 Q512 Q319
Functional Analysis of Human Aγ-globin Gene Promoter
with -173 T→C Mutation
Huang Xiaodong Zhang Junwu# Yang Xuexian Wang Yihong Zhao Hualu
(National Laboratory of Medical Molecular Biology,Institute of Basic of Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective To investigate the effect of the human Aγ-globin gene -173 T→C mutation on the binding of transacting factors to the promoter and the activity of the promoter. Methods Electrophoretic mobility shift assay and transient transfection assay were used in this study. Results The Aγ-globin gene -173 T→C mutation decreased the affinity of GATA-1 to the mutant promoter fragment (-201~-158)96%(P<0.01) and the binding of Oct-1 to the same DNA fragment 55% (P<0.05).The activity of the mutant promoter was 2-fold (P<0.05) as strong as that of the normal one in MELGM979 cells.The mutant and the normal promoters exhibited basically same activities in K562 and Hela cells. Conclusions The -173 T→C mutation decreased dramatically the binding of GATA-1,implicating that GATA-1 may act as a negative regulator of Aγ-globin gene in adults.The -173 T→C mutation may enhance the activity of Aγ-globin gene promoter in the adult erythroid cell environment.
, 百拇医药
Key words Aγ-globin gene; promoter; point mutation; transcription factor GATA-1; gene expression
人γ-珠蛋白基因主要在胎肝红细胞中表达,出生后基本关闭,成人红细胞中胎儿血红蛋白(HbF,α2γ2)不足血红蛋白总量的1%,而遗传性胎儿血红蛋白持续存在综合症(HPFH)患者的红细胞中仍具有相当高的HbF。HPFH产生的原因主要有两种,一是β-珠蛋白基因簇内的DNA片段缺失,二是γ-珠蛋白基因启动子区的突变。对HPFH的研究有助于阐明γ-→β-珠蛋白基因表达开关的机制。本实验探讨-173 T→C突变对人Aγ-珠蛋白基因启动子功能的影响。
1 材料和方法
材料 重组质粒pNγ和pMγ(分别含正常及-173 T→C突变的Aγ-珠蛋白基因启动子)由本室构建。pGL3-Basic载体、pSV-β-gal质粒、限制性内切酶、T4 DNA连接酶、DNA聚合酶Ⅰ Klenow片段、荧光素酶(Luc)和β-半乳糖苷酶(β-Gal)测定试剂盒为Promega公司产品。苯*****、Poly[d(I-C)]和二硫苏糖醇为Boehringer Mannheim公司产品。氯高铁血红素(hemin)和二甲基亚砜(DMSO)为Sigma公司产品。[α-32P]-dGTP为Amersham公司产品。DMEM培养基、RPMI-1640培养基、胎牛血清、丙烯酰胺和N,N′-亚甲双丙烯酰胺为Gibco BRL公司产品。其它试剂为国产分析纯级。K562、MELGM979和Hela细胞均为本室保存。
, 百拇医药
方法
质粒的构建和制备:分别将正常的和-173 T→C突变的Aγ-珠蛋白基因-563~+14启动子片段正向重组到带有Luc报告基因的pGL3-Basic多克隆位点区的KpnⅠ和HindⅢ位点之间,获得表达质粒pNγLuc和pMγLuc(图1)。以碱裂解法提取质粒,然后用氯化铯-溴化乙锭梯度平衡离心法纯化[1]。
图 1 表达质粒pNγLuc和pMγLuc的构建
Fig 1 Construction of plasmid pNγLuc and pMγLuc
The Nγ and Mγ indicate the normal and mutant Aγ promoter from -563 to +14 respectively
, 百拇医药
细胞培养:所有细胞均在37℃、5%CO2和100%湿度的条件下培养。K562和Hela细胞以含10%胎牛血清的DMEM,MELGM979细胞用含10%胎牛血清的RPMI-1640培养基培养。在部分实验中,K562细胞在含有25 μmol/L hemin的培养基中生长4 d,MELGM979细胞在含有2% DMSO的培养基中生长2 d,进行诱导分化。
细胞核提取物的制备:按文献[2]的方法制备K562、MELGM979和Hela细胞核的提取物。按文献[3]的条件对核提取物进行透析。测定核提取物的蛋白浓度[4],分装后存于-80℃。
探针和特异竞争DNA的制备:用ApaⅠ和AvaⅡ酶解pNγ和pMγ质粒获得44 bp启动子片段(-201~-158)。用DNA聚合酶Ⅰ Klenow片段和[α-32P]-dGTP末端补平标记探针。非特异性竞争DNA为Poly[d(I-C)]。合成的单链寡核苷酸经退火成双链后做为特异性竞争DNA。探针和特异性竞争DNA的正义链核苷酸顺序见附表。
, http://www.100md.com
附表 探针及特异性竞争DNA的正义链核苷酸顺序
Table Sequences of the sense strands of the probes and specific competitors
Name
Sequence (5′ to 3′)
Reference
N
CCTTCCCCACACTATCTCAATGCAAATATCTGTCTGAAACGGTC
M
CCTTCCCCACACTATCTCAATGCAAATA CTGTCTGAAACGGTC
CTGTCTGAAACGGTC
, http://www.100md.com
β-globin GATA-1
CGAGGCCAAGAGATATATCTTAGAGGGAGT
[5]
VH Oct-1
TGCTCATGAATATGCAAATCCTGTGTGTCT
[6]
N.normal probe; M.-173 HPFH mutant probe; asterisk: HPFH mutation site;
underlined nucleotides:Oct-1 binding motif; italic and bold nucleotides:GATA-1 binding motif
, http://www.100md.com
电泳迁移改变分析:20 μl的DNA-蛋白质体外结合反应体系中除含有10 μg细胞核提取物和2 μg Poly[d(I-C)]外其它成分与文献[3]报告的相同。反应混合物于30℃孵育5 min,再加入探针(约1 ng)或加入探针及特异竞争DNA的混合物,然后于30℃继续孵育15 min。反应产物按文献[3]的条件进行电泳,于-70℃进行放射自显影。用装有Gelscan XL 2.1软件的Pharmacia LKB UltroScan XL激光密度扫描仪测定滞留带的光密度。该实验重复4次。
瞬时转染分析:按文献[7]的方法转染K562和MELGM979细胞。将10 μg pNγLuc或pMγLuc、2 μg pSV-β-gal和30 μg鲑精DNA导入2×107个细胞中。用磷酸钙-DNA共沉淀法[1]将8 μg pNγLuc或pMγLuc和1.6 μg pSV-β-gal转染到5×105个Hela细胞中。pSV-β-gal作为内对照,用以校正转染效率。转染的细胞培养48 h后,按照试剂盒操作说明进行β-gal及Luc的活性测定。实验重复3次,每次做3个平行转染。以pNγLuc的Luc活性值做为基准1.0,将pMγLuc的Luc活性值与之进行比较,求出相对比值,用以表示突变与正常启动子的活性比。
, http://www.100md.com
统计学处理:实验数据以均值±标准差表示,组间显著性差异比较采用t检验。
2 结果
突变对反式作用因子与启动子结合的影响 电泳迁移改变分析(图2)表明:K562、MELGM979和Hela细胞的核提取物与探针结合后均可形成滞留带A,突变探针的A带比正常探针A带的光密度降低(55±4)%(n=4,P<0.05);K562和MELGM979细胞的核提取物还可以与探针结合形成滞留带B,突变探针的B带比正常探针B带的光密度降低(96±3.5)%(n=4,P<0.01)。特异性竞争结合实验证明,滞留带A是Oct-1与探针结合后形成的,而滞留带B是GATA-1与探针结合后形成的。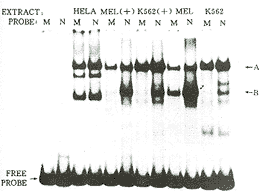
图 2 正常及突变探针与K562、MELGM979及Hela细胞核提取物结合的电泳迁移改变分析
, http://www.100md.com
Fig 2 Electrophoretic mobility shift assay of the normal and mutant probes using nuclear extracts from K562,MELGM979 and Hela cells
N.normal AvaⅡ-ApaⅠ fragment of Aγ-promoter(-201~-158);
M.-173 HPFH mutant counterpart of N; MEL.MELGM979; (+).nuclear extracts from the hemin/DMSO-induced cells; A. band retarded by binding of Oct-1; B.band retarded by binding of GATA-1
突变对启动子活性的影响 Luc活性测定显示,在DMSO诱导的和未诱导的MELGM979细胞中,突变Aγ-基因启动子的活性分别相当于正常启动子活性的(2.01±0.25)倍(n=3,P<0.05)和(1.96±0.04)倍(n=3,P<0.05);在Hela细胞和hemin诱导和未诱导的K562细胞中,突变Aγ-基因启动子的活性分别相当于正常启动子活性的(0.97±0.03)、(0.98±0.03)和(0.99±0.02)倍,与正常启动子活性的差异均无显著性意义(n=3,P>0.05)。
, http://www.100md.com
3 讨论
基因的转录调控主要是通过DNA与蛋白质以及蛋白质与蛋白质之间的相互作用实现的。Aγ-珠蛋白基因启动子的-190~-170区域包括两个GATA-1结合位点和一个位于二者之间的Oct-1结合位点,其中Oct-1结合位点与下游的GATA-1结合位点部分重叠。本研究结果表明与Aγ-基因在成人期活跃表达相关的-173 T→C突变明显降低了GATA-1与此突变所在的启动子区域的结合。Berry等[8]曾报告与HPFH表型相关的Aγ-启动子-117 G→A突变也降低了GATA-1与启动子的结合,并由此假设结合到-117区域的GATA-1可能对成人期的γ-珠蛋白基因起负调控作用。笔者推测结合到-173区域的GATA-1对成人期的γ-珠蛋白基因可能也同样起负调控作用。以往的报告证明在许多情况下GATA-1是转录的活化因子[9],但是此因子的作用可能是复杂的,或许与具体的DNA结合位点及发育阶段有关,而且可能依赖于与其它转录因子的相互作用。
, 百拇医药
Luc活性测定结果显示,在MELGM979中-173 T→C突变启动子活性相当于正常启动子的2倍,而在K562和非红系Hela细胞中突变和正常启动子活性无差别。K562和MELGM979均为红系白血病细胞,前者能提供胚胎期和胎儿期红系细胞环境,而后者提供胚胎期和成年期红系细胞环境。由此表明,-173 T→C突变可能仅在成年期红系细胞环境中才能增强Aγ-珠蛋白基因启动子活性。但值得注意的是,即使在MELGM979细胞中,-173 T→C突变导致Aγ-启动子活性的增加(1倍)也远不及体内(>20倍)的高,因此仅用一个表达质粒进行的瞬时表达还不能反映体内的真实状况。本研究结果为-173 T→C突变影响Aγ-珠蛋白基因发育开关进程的机制提供了一定线索,然而其确切机制尚待进一步研究。
参考文献
1 Sambrook J,Fritsh EF,Maniatis T.Molecular cloning:A laboratory manual.2nd ed.New York:Cold Spring Harbor Laboratory Press,1989
, 百拇医药
2 Dignam JD,Lebovitz RM,Roeder RG.Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei.Nucleic Acid Res,1983,11:1475~1489
3 Gumucio DL,Rood KL,Gray TA,et al.Nuclear proteins that bind the human γ-globin gene promoter:alterations in binding produced by point mutations associated with hereditary persistence of fetal hemoglobin.Mol Cell Biol,1988,8:5310~5322
4 Braford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248~254
, 百拇医药
5 doBore E,Antonion M,Mignotte V,et al.The human β-globin promoter,nuclear protein factors and erythroid specific induction of transcription.EMBO J,1988,7:4203~4212
6 Ballard DW,Bothwell A.Mutational analysis of the immunoglobulin heavy chain promoter region.Proc Natl Acad Sci USA,1986,83:9626~9630
7 张俊武,赵艳君,吴冠芸,等.野生型及启动子区突变的HPFHAγ基因在MEL细胞中的表达.生物化学杂志,1995,11:343~347
8 Berry M,Grosveld F,Dillon N.A single point mutation is the cause of the Greek form of hereditary persistence of fetal haemoglobin.Nature,1992,358:499~502
9 Orkin SH.Regulation of globin gene expression in erythroid cells.Eur J Biochem,1995,231:271~281
(1999-01-24 收稿), 百拇医药
单位:中国医学科学院 中国协和医科大学 基础医学研究所医学分子生物学国家重点实验室, 北京 100005
关键词:Aγ-珠蛋白基因;启动子;点突变;转录因子GATA-1;基因表达
人Aγ 摘要 目的 研究人Aγ-珠蛋白基因-173 T→C突变对反式作用因子与启动子的结合及对启动子活性的影响。方法 采用电泳迁移改变分析和荧光素酶报告基因瞬时转染分析。 结果 Aγ-珠蛋白基因-173 T→C突变使GATA-1与突变启动子片段(-201~-158)的结合降低了96%(P<0.01),并且使Oct-1与相同的DNA片段的结合降低55%(P<0.05)。在MELGM979细胞中,突变启动子活性是正常启动子的2倍(P<0.05);在K562和Hela细胞中,突变和正常启动子活性基本相同。结论 Aγ-启动子-173 T→C突变导致GATA-1与突变启动子片段结合显著减少,提示在成年期该转录因子可能是Aγ-珠蛋白基因的负调控因子;-173 T→C突变可能仅在成年期红系细胞环境中才能增强Aγ-珠蛋白基因启动子活性。
, http://www.100md.com
中图号 Q512 Q319
Functional Analysis of Human Aγ-globin Gene Promoter
with -173 T→C Mutation
Huang Xiaodong Zhang Junwu# Yang Xuexian Wang Yihong Zhao Hualu
(National Laboratory of Medical Molecular Biology,Institute of Basic of Medical Sciences,CAMS and PUMC,Beijing 100005)
Objective To investigate the effect of the human Aγ-globin gene -173 T→C mutation on the binding of transacting factors to the promoter and the activity of the promoter. Methods Electrophoretic mobility shift assay and transient transfection assay were used in this study. Results The Aγ-globin gene -173 T→C mutation decreased the affinity of GATA-1 to the mutant promoter fragment (-201~-158)96%(P<0.01) and the binding of Oct-1 to the same DNA fragment 55% (P<0.05).The activity of the mutant promoter was 2-fold (P<0.05) as strong as that of the normal one in MELGM979 cells.The mutant and the normal promoters exhibited basically same activities in K562 and Hela cells. Conclusions The -173 T→C mutation decreased dramatically the binding of GATA-1,implicating that GATA-1 may act as a negative regulator of Aγ-globin gene in adults.The -173 T→C mutation may enhance the activity of Aγ-globin gene promoter in the adult erythroid cell environment.
, 百拇医药
Key words Aγ-globin gene; promoter; point mutation; transcription factor GATA-1; gene expression
人γ-珠蛋白基因主要在胎肝红细胞中表达,出生后基本关闭,成人红细胞中胎儿血红蛋白(HbF,α2γ2)不足血红蛋白总量的1%,而遗传性胎儿血红蛋白持续存在综合症(HPFH)患者的红细胞中仍具有相当高的HbF。HPFH产生的原因主要有两种,一是β-珠蛋白基因簇内的DNA片段缺失,二是γ-珠蛋白基因启动子区的突变。对HPFH的研究有助于阐明γ-→β-珠蛋白基因表达开关的机制。本实验探讨-173 T→C突变对人Aγ-珠蛋白基因启动子功能的影响。
1 材料和方法
材料 重组质粒pNγ和pMγ(分别含正常及-173 T→C突变的Aγ-珠蛋白基因启动子)由本室构建。pGL3-Basic载体、pSV-β-gal质粒、限制性内切酶、T4 DNA连接酶、DNA聚合酶Ⅰ Klenow片段、荧光素酶(Luc)和β-半乳糖苷酶(β-Gal)测定试剂盒为Promega公司产品。苯*****、Poly[d(I-C)]和二硫苏糖醇为Boehringer Mannheim公司产品。氯高铁血红素(hemin)和二甲基亚砜(DMSO)为Sigma公司产品。[α-32P]-dGTP为Amersham公司产品。DMEM培养基、RPMI-1640培养基、胎牛血清、丙烯酰胺和N,N′-亚甲双丙烯酰胺为Gibco BRL公司产品。其它试剂为国产分析纯级。K562、MELGM979和Hela细胞均为本室保存。
, 百拇医药
方法
质粒的构建和制备:分别将正常的和-173 T→C突变的Aγ-珠蛋白基因-563~+14启动子片段正向重组到带有Luc报告基因的pGL3-Basic多克隆位点区的KpnⅠ和HindⅢ位点之间,获得表达质粒pNγLuc和pMγLuc(图1)。以碱裂解法提取质粒,然后用氯化铯-溴化乙锭梯度平衡离心法纯化[1]。

图 1 表达质粒pNγLuc和pMγLuc的构建
Fig 1 Construction of plasmid pNγLuc and pMγLuc
The Nγ and Mγ indicate the normal and mutant Aγ promoter from -563 to +14 respectively
, 百拇医药
细胞培养:所有细胞均在37℃、5%CO2和100%湿度的条件下培养。K562和Hela细胞以含10%胎牛血清的DMEM,MELGM979细胞用含10%胎牛血清的RPMI-1640培养基培养。在部分实验中,K562细胞在含有25 μmol/L hemin的培养基中生长4 d,MELGM979细胞在含有2% DMSO的培养基中生长2 d,进行诱导分化。
细胞核提取物的制备:按文献[2]的方法制备K562、MELGM979和Hela细胞核的提取物。按文献[3]的条件对核提取物进行透析。测定核提取物的蛋白浓度[4],分装后存于-80℃。
探针和特异竞争DNA的制备:用ApaⅠ和AvaⅡ酶解pNγ和pMγ质粒获得44 bp启动子片段(-201~-158)。用DNA聚合酶Ⅰ Klenow片段和[α-32P]-dGTP末端补平标记探针。非特异性竞争DNA为Poly[d(I-C)]。合成的单链寡核苷酸经退火成双链后做为特异性竞争DNA。探针和特异性竞争DNA的正义链核苷酸顺序见附表。
, http://www.100md.com
附表 探针及特异性竞争DNA的正义链核苷酸顺序
Table Sequences of the sense strands of the probes and specific competitors
Name
Sequence (5′ to 3′)
Reference
N
CCTTCCCCACACTATCTCAATGCAAATATCTGTCTGAAACGGTC
M
CCTTCCCCACACTATCTCAATGCAAATA
, http://www.100md.com
β-globin GATA-1
CGAGGCCAAGAGATATATCTTAGAGGGAGT
[5]
VH Oct-1
TGCTCATGAATATGCAAATCCTGTGTGTCT
[6]
N.normal probe; M.-173 HPFH mutant probe; asterisk: HPFH mutation site;
underlined nucleotides:Oct-1 binding motif; italic and bold nucleotides:GATA-1 binding motif
, http://www.100md.com
电泳迁移改变分析:20 μl的DNA-蛋白质体外结合反应体系中除含有10 μg细胞核提取物和2 μg Poly[d(I-C)]外其它成分与文献[3]报告的相同。反应混合物于30℃孵育5 min,再加入探针(约1 ng)或加入探针及特异竞争DNA的混合物,然后于30℃继续孵育15 min。反应产物按文献[3]的条件进行电泳,于-70℃进行放射自显影。用装有Gelscan XL 2.1软件的Pharmacia LKB UltroScan XL激光密度扫描仪测定滞留带的光密度。该实验重复4次。
瞬时转染分析:按文献[7]的方法转染K562和MELGM979细胞。将10 μg pNγLuc或pMγLuc、2 μg pSV-β-gal和30 μg鲑精DNA导入2×107个细胞中。用磷酸钙-DNA共沉淀法[1]将8 μg pNγLuc或pMγLuc和1.6 μg pSV-β-gal转染到5×105个Hela细胞中。pSV-β-gal作为内对照,用以校正转染效率。转染的细胞培养48 h后,按照试剂盒操作说明进行β-gal及Luc的活性测定。实验重复3次,每次做3个平行转染。以pNγLuc的Luc活性值做为基准1.0,将pMγLuc的Luc活性值与之进行比较,求出相对比值,用以表示突变与正常启动子的活性比。
, http://www.100md.com
统计学处理:实验数据以均值±标准差表示,组间显著性差异比较采用t检验。
2 结果
突变对反式作用因子与启动子结合的影响 电泳迁移改变分析(图2)表明:K562、MELGM979和Hela细胞的核提取物与探针结合后均可形成滞留带A,突变探针的A带比正常探针A带的光密度降低(55±4)%(n=4,P<0.05);K562和MELGM979细胞的核提取物还可以与探针结合形成滞留带B,突变探针的B带比正常探针B带的光密度降低(96±3.5)%(n=4,P<0.01)。特异性竞争结合实验证明,滞留带A是Oct-1与探针结合后形成的,而滞留带B是GATA-1与探针结合后形成的。

图 2 正常及突变探针与K562、MELGM979及Hela细胞核提取物结合的电泳迁移改变分析
, http://www.100md.com
Fig 2 Electrophoretic mobility shift assay of the normal and mutant probes using nuclear extracts from K562,MELGM979 and Hela cells
N.normal AvaⅡ-ApaⅠ fragment of Aγ-promoter(-201~-158);
M.-173 HPFH mutant counterpart of N; MEL.MELGM979; (+).nuclear extracts from the hemin/DMSO-induced cells; A. band retarded by binding of Oct-1; B.band retarded by binding of GATA-1
突变对启动子活性的影响 Luc活性测定显示,在DMSO诱导的和未诱导的MELGM979细胞中,突变Aγ-基因启动子的活性分别相当于正常启动子活性的(2.01±0.25)倍(n=3,P<0.05)和(1.96±0.04)倍(n=3,P<0.05);在Hela细胞和hemin诱导和未诱导的K562细胞中,突变Aγ-基因启动子的活性分别相当于正常启动子活性的(0.97±0.03)、(0.98±0.03)和(0.99±0.02)倍,与正常启动子活性的差异均无显著性意义(n=3,P>0.05)。
, http://www.100md.com
3 讨论
基因的转录调控主要是通过DNA与蛋白质以及蛋白质与蛋白质之间的相互作用实现的。Aγ-珠蛋白基因启动子的-190~-170区域包括两个GATA-1结合位点和一个位于二者之间的Oct-1结合位点,其中Oct-1结合位点与下游的GATA-1结合位点部分重叠。本研究结果表明与Aγ-基因在成人期活跃表达相关的-173 T→C突变明显降低了GATA-1与此突变所在的启动子区域的结合。Berry等[8]曾报告与HPFH表型相关的Aγ-启动子-117 G→A突变也降低了GATA-1与启动子的结合,并由此假设结合到-117区域的GATA-1可能对成人期的γ-珠蛋白基因起负调控作用。笔者推测结合到-173区域的GATA-1对成人期的γ-珠蛋白基因可能也同样起负调控作用。以往的报告证明在许多情况下GATA-1是转录的活化因子[9],但是此因子的作用可能是复杂的,或许与具体的DNA结合位点及发育阶段有关,而且可能依赖于与其它转录因子的相互作用。
, 百拇医药
Luc活性测定结果显示,在MELGM979中-173 T→C突变启动子活性相当于正常启动子的2倍,而在K562和非红系Hela细胞中突变和正常启动子活性无差别。K562和MELGM979均为红系白血病细胞,前者能提供胚胎期和胎儿期红系细胞环境,而后者提供胚胎期和成年期红系细胞环境。由此表明,-173 T→C突变可能仅在成年期红系细胞环境中才能增强Aγ-珠蛋白基因启动子活性。但值得注意的是,即使在MELGM979细胞中,-173 T→C突变导致Aγ-启动子活性的增加(1倍)也远不及体内(>20倍)的高,因此仅用一个表达质粒进行的瞬时表达还不能反映体内的真实状况。本研究结果为-173 T→C突变影响Aγ-珠蛋白基因发育开关进程的机制提供了一定线索,然而其确切机制尚待进一步研究。
参考文献
1 Sambrook J,Fritsh EF,Maniatis T.Molecular cloning:A laboratory manual.2nd ed.New York:Cold Spring Harbor Laboratory Press,1989
, 百拇医药
2 Dignam JD,Lebovitz RM,Roeder RG.Accurate transcription initiation by RNA polymerase Ⅱ in a soluble extract from isolated mammalian nuclei.Nucleic Acid Res,1983,11:1475~1489
3 Gumucio DL,Rood KL,Gray TA,et al.Nuclear proteins that bind the human γ-globin gene promoter:alterations in binding produced by point mutations associated with hereditary persistence of fetal hemoglobin.Mol Cell Biol,1988,8:5310~5322
4 Braford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248~254
, 百拇医药
5 doBore E,Antonion M,Mignotte V,et al.The human β-globin promoter,nuclear protein factors and erythroid specific induction of transcription.EMBO J,1988,7:4203~4212
6 Ballard DW,Bothwell A.Mutational analysis of the immunoglobulin heavy chain promoter region.Proc Natl Acad Sci USA,1986,83:9626~9630
7 张俊武,赵艳君,吴冠芸,等.野生型及启动子区突变的HPFHAγ基因在MEL细胞中的表达.生物化学杂志,1995,11:343~347
8 Berry M,Grosveld F,Dillon N.A single point mutation is the cause of the Greek form of hereditary persistence of fetal haemoglobin.Nature,1992,358:499~502
9 Orkin SH.Regulation of globin gene expression in erythroid cells.Eur J Biochem,1995,231:271~281
(1999-01-24 收稿), 百拇医药