模拟失重对大鼠后肢动脉血管床血管反应性的影响*
作者:马进 张乐宁 张立藩 杨天德
单位:马进 张乐宁 张立藩 第四军医大学航空生理学教研室, 西安710032;杨天德 航天医学工程研究所, 北京 100094
关键词:模拟失重;血管反应性;大鼠;动脉
航天医学与医学工程990405
摘要:目的 观察模拟失重对大鼠后肢血管床血管反应性的影响。方法 采用尾部悬吊大鼠模型模拟失重, 利用离体后肢恒流灌流技术测定模拟失重2 wk后动脉血管床血管反应性的变化。结果 后肢血管床的压力-流量关系在悬吊大鼠与对照大鼠间无明显差别,在对KCl(20~100 mM)与PE(10-8~10-4M) 的收缩反应中,悬吊大鼠后肢血管床的灌流阻力增加幅度明显小于对照大鼠。结论 后肢小动脉的收缩能力在模拟失重状态下明显降低,提示由此所致外周阻力增加的能力受损在飞行后立位耐力不良的发生机制中可能具有一定的作用。
, 百拇医药
中图分类号:R852.22 文献标识码:A 文章编号:1002-0837(1999)04-0254-04
Effects of Simulated Weightlessness on Vasoreactivity of Hindlimb
Arterial Bed in Rats
MA Jin,ZHANG Le-ning, ZHANG Li-fan, YANG Tian-de
Abstract:Objective To investigate the alterations in vasoreactivity of hindlimb arterial bed after simulated weightlessness. Method The tail-suspended rat model was used to simulate weightlessness, and the alterations in vasoreactivity of arterial bed were examined in vitro using isolated, constant flow perfused hindlimb of 2-wk suspended rats and control rats. Result Perfusion flow-pressure relationship of hindlimb arterial bed showed no significant differences between suspended rats and control rats; but vascular responses to KCl(20~100 mM) and PE(10-8~10-4 M) were decreased in hindlimb arterial bed of suspended rats as compared with that of control rats. Conclusion Contractile ability of resistance vessels was diminished in simulated weightlessness rats, and a compromised ability of resistance vessels to increase peripheral resistance may play an important role in occurrence of orthostatic intolerance.
, 百拇医药
Key words:simulated weightlessness;vasoreactivity;rats;arteries
Address reprint requests to:MA Jin.Department of Aerospace Physiology,The Fourth Military Medical University, Xi'an 710032, China
外周循环阻力的大小直接影响动脉血压的水平, 对机体维持良好的立位耐力具有重要作用。近来的工作[1,2]表明,失重/模拟失重后,人体在受到立位应激时,其总外周阻力增加的能力变化可能是飞行后立位耐力不良的主要原因之一。在我们工作[3]中也发现,为期2 wk的尾部悬吊模拟失重即可引起大鼠后身动脉最大收缩反应普遍降低,且这种变化又以远端管径较细动脉表现更为严重,如股动脉收缩反应减弱的程度甚于肠系膜动脉,而后者的变化又甚于腹主动脉。此外,管径不同动脉收缩性能降低及恢复的时程特征也不相同:腹主动脉在模拟失重两周后变化即已稳定下来,恢复也较快;而股动脉约需4 wk方可降至最低水平,4 wk模拟失重引起的变化需5 wk才能完全恢复。这些都提示管径较小的远端动脉受到模拟失重的影响可能更为严重,由此也提示模拟失重大鼠外周循环阻力增加的能力可能受到了损害。我们的前述工作仅涉及大、中动脉血管,这些均属弹性贮器血管与分配血管,而外周循环阻力的产生主要是毛细血管前阻力小动脉的功能,因此,要全面了解模拟失重后外周循环阻力的变化,就有必要探讨阻力血管功能在模拟失重情况下的改变。此外,由于机体内不同部位的血管功能活动均具有各自独特的性质[4],即所谓“血管个性化”(individualization)的缘故,大、中动脉反应性变化不一定与局部小动脉完全一致,且不同管径小动脉的功能也各有侧重。为此,本研究利用悬吊大鼠模型,采用后肢灌流技术观察了模拟失重对大鼠后肢血管床血管反应性的影响。
, 百拇医药
方 法
模拟失重大鼠模型 20只鼠龄为12 wk,体重200 g左右的雄性Sprague-Dawley大鼠由本校实验动物中心提供,动物在专门的动物室内适应饲养1 wk后,按体重配对随机分为对照组与模拟失重组,每组10只。模拟失重大鼠采用陈杰等[5]改进的方法做尾部悬吊,护理与饲养,可自由进食,饮水。动物室室温保持在23±2℃;人工控制室内照明, 每昼夜均保持12 h光照与黑暗交替循环。悬吊时间为2 wk。
灌流液与灌流装置 灌流液采用Krebs液,其溶液组成为(mM): NaCl 118.3, KCl 4.7, NaHCO3 25, MgSO4 1.2, KH2PO4 1.2, CaCl2 2.5, glucose 11.1, EDTA 0.026, pH 7.4。使用前即刻配制,经滤纸过滤后用95%O2-5%CO2混合气充分氧合,并预温至37℃。
, 百拇医药
氧合之灌流液在蠕动泵(Masterflex7534-10, Cole-Parmer Instrument Company, USA)的驱动下,经动脉插管进入血管床,在蠕动泵与插管间串联电磁流量计探头(FR-030T, Nihon Kohden Co, Japan)以监测流量,并联压力传感器(PT14M1, 复旦大学传感器研究室,上海)以观测灌流压的变化。流量信号通过探头经电磁流量计(MFV-1200, Nihon Kohden Co, Japan)后输入四导生理记录仪(RM-6200, Nihon Kohden Co, Japan),经直流放大器(AD-601G, Nihon Kohden Co, Japan)放大后记录;压力信号经载波放大器(AP-601G, Nihon Kohden Co,Japan)放大后由四导生理记录仪记录。灌流过程中,灌流液与被灌流之后肢均保持37℃恒温。
后肢灌流标本制备 后肢灌流标本制备的原则[6]是使灌流液经一条主要动脉,如腹主动脉或股动脉进入后肢,通过后肢本身的血管网灌流后肢的肌肉系统。主要步骤为:在戊巴比妥钠(6 mg/100 g体重)腹腔麻醉下,沿腹股沟剪开皮肤,结扎股动脉的腹壁浅支后,沿腹中线剪开大鼠腹壁,分离腹主动脉与后腔静脉后,在髂腰动、静脉水平与肾、动静脉水平间将结扎线穿过腹主动脉与后腔静脉背面待用;结扎双侧髂腰动、静脉与精索内动、静脉,结扎肠系膜后动脉与荐中动脉,继续向下分离并结扎膀胱动、静脉,髂内动脉与阴部动脉,在足踝部与尾根部结扎粗线以阻断爪部与尾部血流。经后腔静脉注入肝素(100 unit/100 g体重)后, 用预置丝线结扎后腔静脉。动脉夹阻断腹主动脉血流后,剪开腹主动脉,将灌流针头插入腹主动脉,用预置丝线结扎并固定。启动蠕动泵,剪破后腔静脉以供灌流液流出[6,7]。
, http://www.100md.com
灌流实验步骤 灌流开始后,通过提高灌流液流量使灌流压逐步提高至50mmHg,灌流标本在50mmHg灌流压下平衡0.5h后,测定其流量—压力关系,此后实验均在50mmHg对应之灌流流量下进行。灌流标本对氯化钾(KCl)与苯肾上腺素(PE)的反应性通过连续灌流含有不同浓度药物的Krebs溶液测定。灌流另一种药物前,冲洗标本至其灌流压返回静息水平。
数据处理与统计分析 各浓度药物所对应之灌流压经灌流流量作均一化处理后进行统计处理,由所得数据制备累积浓度-效应曲线,并由此得EC50值,即反应达50%最大效应时血管激动剂的浓度。文中数据以均数±标准差(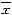 ±s)表示,配对t检验作统计学分析,P<0.05为差异显著的标准。
±s)表示,配对t检验作统计学分析,P<0.05为差异显著的标准。
结 果
一般情况 实验期间动物生长状况良好,除悬吊大鼠在悬吊后前4d内体重无明显增长外,其余时间动物体重持续增长,实验前后,对照组大鼠体重分别为368.6±8.2 g与402.7±14.1g, 模拟失重组体重分别为368.7±7.5g与385.7±11.2g,实验后动物的体重在两组间差异显著(P<0.05)。
, http://www.100md.com
后肢血管床灌流流量—压力关系 如图1所示,悬吊大鼠后肢血管床在灌流压为50mmHg时的灌流流量与对照大鼠无明显差别。后肢血管床的压力-流量关系在悬吊大鼠与对照大鼠间无明显差别。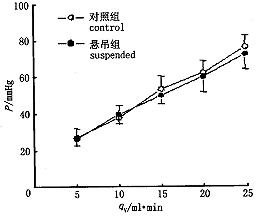
图1 悬吊与对照大鼠后肢血管床流量—压力关系
数值为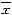 ±s,n=10
±s,n=10
Fig.1 Flow-Pressure relationship of hindlimb arterial beds of suspended and control rats
Values are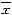 ±s,n=10
±s,n=10
, 百拇医药
后肢血管床对KCl的收缩反应 如图2所示,悬吊大鼠后肢血管床对KCl的收缩反应在KCl浓度为70、80、90和100 mM时均明显低于对照大鼠,其血管床阻力升高的幅度明显小于对照;悬吊大鼠与对照大鼠血管床对KCl反应的EC50值分别为55.5±3.8与56.0±6.0mM, 二者间无显著差异(P>0.05)。
图2 悬吊与对照大鼠后肢血管床对KCl收缩反应的浓度-收缩反应曲线
*P<0.05, **P<0.01,与对照组相比,数值为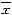 ±s,n=10
±s,n=10
Fig.2 Concentration-contraction response curves showing vasoconstrictor responses of hindlimb arterial beds isolated from suspended and control rats to KCl
, http://www.100md.com
*P<0.05, **P<0.01,as compared with control,Values are ±s,n=10
±s,n=10
后肢血管床对PE的收缩反应 悬吊大鼠后肢血管床对PE的收缩反应在PE浓度为3×10-6,10-5,3×10-5,10-4M时均明显低于对照大鼠,其血管床阻力升高的幅度明显小于对照;悬吊大鼠与对照大鼠血管床对PE反应的EC50值(-logM)分别为5.12±0.35与5.19±0.19,两组间无显著差异(P>0.05)(图3)。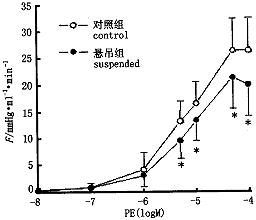
图3 悬吊与对照大鼠后肢膜血管床对PE收缩反应的浓度-收缩反应曲线
, 百拇医药
*P<0.05, **P<0.01,与对照组相比,数值为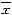 ±s,n=10
±s,n=10
Fig.3 Concentration-contraction response curves showing vasoconstrictor responses of hindlimb arterial beds isolated from suspended and control rats to PE
*P<0.05,**P<0.01,as compared with control,Values are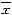 ±s,n=10
±s,n=10
讨 论
本工作对尾部悬吊模拟失重大鼠后肢血管床的血流阻力进行了观察,结果表明:在静息状态下,悬吊大鼠上述两处的血管床血流阻力与对照大鼠相比并无明显不同,但在对KCl与PE 的收缩反应中,悬吊大鼠后肢血管床的血流阻力增加幅度明显小于对照大鼠。此结果与最近我们在肠系膜血管床观察到的结果一致[8]。
, http://www.100md.com
血流阻力是血液在血管内流动时所遇到的阻力。生理情况下,血管床的血流阻力近似与组成血管床的各个血管的长度成正比、与其口径的四次方成反比。此外,血液的粘滞度的变化也可影响血流阻力。因此血管口径变化对血流阻力的影响最大。
血管床血管的长度与血管的口径受到多方面因素的影响,包括许多局部的、神经源性的以及体液的因素。对于模拟失重大鼠,由于血管血流与压力的改变,4 wk尾部悬吊即可导致大鼠动脉系统血管的重建,如血管直径变小,神经支配变化等[9];最近亦有报道[10]提示3 wk后半身背部皮肤悬吊使大鼠后肢血管床的结构改变,静息时血流阻力提高。在本实验中,悬吊大鼠后肢血管床的流量-压力关系与对照大鼠尚无明显不同,提示其血管床本身的结构如血管可能还没有发生明显改变,或其改变的程度尚不足以造成静息状态时血流阻力的改变。此外,不排除本实验灌流流量较小,使灌流压较低而不足以表明其差异的可能。
后肢血管床动脉在受到KCl与PE的刺激时,血管平滑肌收缩,各级动脉的口径缩小,导致血管床血流阻力的增加,在恒定灌流流量的情况下,表现为灌流压明显增加。本实验中,悬吊大鼠后肢血管床在受到血管收缩剂刺激时,其血管阻力升高的幅度明显低于对照大鼠,结合其静息状态下的血流阻力情况,提示血管床动脉对血管收缩剂的收缩反应降低是导致悬吊大鼠血流阻力增加幅度低于对照的原由。而KCl与PE诱发的非受体介导与受体介导的收缩反应均降低,则进一步提示平滑肌收缩结构可能发生变化。这与前述工作中离体动脉实验的结构是一致的,说明小动脉也发生了与中动脉相似的改变。
, http://www.100md.com
最近,Rodionov等[10]报道了与本实验结果一致的工作,他们发现3 wk的悬吊使大鼠对刺激交感神经所致的后肢血管床血管收缩反应减弱,升压反应低于对照大鼠。在外周循环阻力的产生中, 后肢血管床作用是举足轻重的。后肢血管床血流阻力增加幅度的降低,将直接影响立位应激时外周循环阻力的增加,导致立位应激时动脉血压维持功能的改变。
本工作的结果进一步证实动脉功能,尤其是小动脉功能在模拟失重状态下发生了明显变化,且此变化在飞行后立位耐力不良的发生机制中可能具有一定作用。
*基金项目:国家自然科学基金(39380021)
参考文献
[1]Lacolley PJ, Pannier BM, Cuche JL et al. Microgravity and orthostatic intolerance: carotid hemodynamics and peripheral responses[J]. Am J Physiol. 1993, 264:H588~H594
, 百拇医药
[2]Mulvagh SL, Chares JB, Riddle JM et al. Echocardiographic evaluation of the cardiovascular effects of short-duration spaceflight[J]. J Clin Pharmacol. 1991, 31: 1024~1026
[3]马 进,张立藩,杨天德等. 尾部悬吊及恢复过程中大鼠动脉血管收缩反应的变化[J]. 航天医学与医学工程,1999,12(3):169~172
[4]陈孟勤, 曹济民. 血管活动的个性化[J]. 生理科学进展,1996,27:203~209
[5]陈 杰,马 进,丁兆平等. 一种模拟失重影响的大鼠尾部悬吊模型[J]. 空间科学学报,1993, 13:159~162
, http://www.100md.com [6]Bonen A, Clark MG and Henriksen EJ. Experimental approaches in muscle metabolism: hindlimb perfusion and isolated muscle incubations[J]. Am J Physiol,1994, 266:E1~E16
[7]Ruderman NB, Houghton CRS and Hems R. Evaluation of the isolated perfused rat hindquarter for the study of muscle metabolism[J]. Biochem J,1971,124:639~651
[8]张乐宁,马 进, 张立藩. 14 d尾部悬吊大鼠肠系膜血管床反应性的变化[J]. 中华航空航天医学杂志,1998,9(2):81~84
, 百拇医药 [9]Zhang LF, Mao QW, Ma J et al. Effects of simulated weightlessness on arterial vasculature-an experimental study on vascular deconditioning[J]. J Gravitational Physiology,1996,3(2):5~8
[10]Rodionov I, Machkov V, Tarasova O et al. Effect of 3-week suspension on sympathetic vasoconstrictor response in rat[J].J Gravitational Physiology,1997, 4(2),41~42
收稿日期:1998-10-19, 百拇医药
单位:马进 张乐宁 张立藩 第四军医大学航空生理学教研室, 西安710032;杨天德 航天医学工程研究所, 北京 100094
关键词:模拟失重;血管反应性;大鼠;动脉
航天医学与医学工程990405
摘要:目的 观察模拟失重对大鼠后肢血管床血管反应性的影响。方法 采用尾部悬吊大鼠模型模拟失重, 利用离体后肢恒流灌流技术测定模拟失重2 wk后动脉血管床血管反应性的变化。结果 后肢血管床的压力-流量关系在悬吊大鼠与对照大鼠间无明显差别,在对KCl(20~100 mM)与PE(10-8~10-4M) 的收缩反应中,悬吊大鼠后肢血管床的灌流阻力增加幅度明显小于对照大鼠。结论 后肢小动脉的收缩能力在模拟失重状态下明显降低,提示由此所致外周阻力增加的能力受损在飞行后立位耐力不良的发生机制中可能具有一定的作用。
, 百拇医药
中图分类号:R852.22 文献标识码:A 文章编号:1002-0837(1999)04-0254-04
Effects of Simulated Weightlessness on Vasoreactivity of Hindlimb
Arterial Bed in Rats
MA Jin,ZHANG Le-ning, ZHANG Li-fan, YANG Tian-de
Abstract:Objective To investigate the alterations in vasoreactivity of hindlimb arterial bed after simulated weightlessness. Method The tail-suspended rat model was used to simulate weightlessness, and the alterations in vasoreactivity of arterial bed were examined in vitro using isolated, constant flow perfused hindlimb of 2-wk suspended rats and control rats. Result Perfusion flow-pressure relationship of hindlimb arterial bed showed no significant differences between suspended rats and control rats; but vascular responses to KCl(20~100 mM) and PE(10-8~10-4 M) were decreased in hindlimb arterial bed of suspended rats as compared with that of control rats. Conclusion Contractile ability of resistance vessels was diminished in simulated weightlessness rats, and a compromised ability of resistance vessels to increase peripheral resistance may play an important role in occurrence of orthostatic intolerance.
, 百拇医药
Key words:simulated weightlessness;vasoreactivity;rats;arteries
Address reprint requests to:MA Jin.Department of Aerospace Physiology,The Fourth Military Medical University, Xi'an 710032, China
外周循环阻力的大小直接影响动脉血压的水平, 对机体维持良好的立位耐力具有重要作用。近来的工作[1,2]表明,失重/模拟失重后,人体在受到立位应激时,其总外周阻力增加的能力变化可能是飞行后立位耐力不良的主要原因之一。在我们工作[3]中也发现,为期2 wk的尾部悬吊模拟失重即可引起大鼠后身动脉最大收缩反应普遍降低,且这种变化又以远端管径较细动脉表现更为严重,如股动脉收缩反应减弱的程度甚于肠系膜动脉,而后者的变化又甚于腹主动脉。此外,管径不同动脉收缩性能降低及恢复的时程特征也不相同:腹主动脉在模拟失重两周后变化即已稳定下来,恢复也较快;而股动脉约需4 wk方可降至最低水平,4 wk模拟失重引起的变化需5 wk才能完全恢复。这些都提示管径较小的远端动脉受到模拟失重的影响可能更为严重,由此也提示模拟失重大鼠外周循环阻力增加的能力可能受到了损害。我们的前述工作仅涉及大、中动脉血管,这些均属弹性贮器血管与分配血管,而外周循环阻力的产生主要是毛细血管前阻力小动脉的功能,因此,要全面了解模拟失重后外周循环阻力的变化,就有必要探讨阻力血管功能在模拟失重情况下的改变。此外,由于机体内不同部位的血管功能活动均具有各自独特的性质[4],即所谓“血管个性化”(individualization)的缘故,大、中动脉反应性变化不一定与局部小动脉完全一致,且不同管径小动脉的功能也各有侧重。为此,本研究利用悬吊大鼠模型,采用后肢灌流技术观察了模拟失重对大鼠后肢血管床血管反应性的影响。
, 百拇医药
方 法
模拟失重大鼠模型 20只鼠龄为12 wk,体重200 g左右的雄性Sprague-Dawley大鼠由本校实验动物中心提供,动物在专门的动物室内适应饲养1 wk后,按体重配对随机分为对照组与模拟失重组,每组10只。模拟失重大鼠采用陈杰等[5]改进的方法做尾部悬吊,护理与饲养,可自由进食,饮水。动物室室温保持在23±2℃;人工控制室内照明, 每昼夜均保持12 h光照与黑暗交替循环。悬吊时间为2 wk。
灌流液与灌流装置 灌流液采用Krebs液,其溶液组成为(mM): NaCl 118.3, KCl 4.7, NaHCO3 25, MgSO4 1.2, KH2PO4 1.2, CaCl2 2.5, glucose 11.1, EDTA 0.026, pH 7.4。使用前即刻配制,经滤纸过滤后用95%O2-5%CO2混合气充分氧合,并预温至37℃。
, 百拇医药
氧合之灌流液在蠕动泵(Masterflex7534-10, Cole-Parmer Instrument Company, USA)的驱动下,经动脉插管进入血管床,在蠕动泵与插管间串联电磁流量计探头(FR-030T, Nihon Kohden Co, Japan)以监测流量,并联压力传感器(PT14M1, 复旦大学传感器研究室,上海)以观测灌流压的变化。流量信号通过探头经电磁流量计(MFV-1200, Nihon Kohden Co, Japan)后输入四导生理记录仪(RM-6200, Nihon Kohden Co, Japan),经直流放大器(AD-601G, Nihon Kohden Co, Japan)放大后记录;压力信号经载波放大器(AP-601G, Nihon Kohden Co,Japan)放大后由四导生理记录仪记录。灌流过程中,灌流液与被灌流之后肢均保持37℃恒温。
后肢灌流标本制备 后肢灌流标本制备的原则[6]是使灌流液经一条主要动脉,如腹主动脉或股动脉进入后肢,通过后肢本身的血管网灌流后肢的肌肉系统。主要步骤为:在戊巴比妥钠(6 mg/100 g体重)腹腔麻醉下,沿腹股沟剪开皮肤,结扎股动脉的腹壁浅支后,沿腹中线剪开大鼠腹壁,分离腹主动脉与后腔静脉后,在髂腰动、静脉水平与肾、动静脉水平间将结扎线穿过腹主动脉与后腔静脉背面待用;结扎双侧髂腰动、静脉与精索内动、静脉,结扎肠系膜后动脉与荐中动脉,继续向下分离并结扎膀胱动、静脉,髂内动脉与阴部动脉,在足踝部与尾根部结扎粗线以阻断爪部与尾部血流。经后腔静脉注入肝素(100 unit/100 g体重)后, 用预置丝线结扎后腔静脉。动脉夹阻断腹主动脉血流后,剪开腹主动脉,将灌流针头插入腹主动脉,用预置丝线结扎并固定。启动蠕动泵,剪破后腔静脉以供灌流液流出[6,7]。
, http://www.100md.com
灌流实验步骤 灌流开始后,通过提高灌流液流量使灌流压逐步提高至50mmHg,灌流标本在50mmHg灌流压下平衡0.5h后,测定其流量—压力关系,此后实验均在50mmHg对应之灌流流量下进行。灌流标本对氯化钾(KCl)与苯肾上腺素(PE)的反应性通过连续灌流含有不同浓度药物的Krebs溶液测定。灌流另一种药物前,冲洗标本至其灌流压返回静息水平。
数据处理与统计分析 各浓度药物所对应之灌流压经灌流流量作均一化处理后进行统计处理,由所得数据制备累积浓度-效应曲线,并由此得EC50值,即反应达50%最大效应时血管激动剂的浓度。文中数据以均数±标准差(
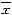 ±s)表示,配对t检验作统计学分析,P<0.05为差异显著的标准。
±s)表示,配对t检验作统计学分析,P<0.05为差异显著的标准。结 果
一般情况 实验期间动物生长状况良好,除悬吊大鼠在悬吊后前4d内体重无明显增长外,其余时间动物体重持续增长,实验前后,对照组大鼠体重分别为368.6±8.2 g与402.7±14.1g, 模拟失重组体重分别为368.7±7.5g与385.7±11.2g,实验后动物的体重在两组间差异显著(P<0.05)。
, http://www.100md.com
后肢血管床灌流流量—压力关系 如图1所示,悬吊大鼠后肢血管床在灌流压为50mmHg时的灌流流量与对照大鼠无明显差别。后肢血管床的压力-流量关系在悬吊大鼠与对照大鼠间无明显差别。

图1 悬吊与对照大鼠后肢血管床流量—压力关系
数值为
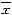 ±s,n=10
±s,n=10Fig.1 Flow-Pressure relationship of hindlimb arterial beds of suspended and control rats
Values are
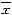 ±s,n=10
±s,n=10, 百拇医药
后肢血管床对KCl的收缩反应 如图2所示,悬吊大鼠后肢血管床对KCl的收缩反应在KCl浓度为70、80、90和100 mM时均明显低于对照大鼠,其血管床阻力升高的幅度明显小于对照;悬吊大鼠与对照大鼠血管床对KCl反应的EC50值分别为55.5±3.8与56.0±6.0mM, 二者间无显著差异(P>0.05)。

图2 悬吊与对照大鼠后肢血管床对KCl收缩反应的浓度-收缩反应曲线
*P<0.05, **P<0.01,与对照组相比,数值为
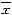 ±s,n=10
±s,n=10Fig.2 Concentration-contraction response curves showing vasoconstrictor responses of hindlimb arterial beds isolated from suspended and control rats to KCl
, http://www.100md.com
*P<0.05, **P<0.01,as compared with control,Values are
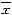 ±s,n=10
±s,n=10后肢血管床对PE的收缩反应 悬吊大鼠后肢血管床对PE的收缩反应在PE浓度为3×10-6,10-5,3×10-5,10-4M时均明显低于对照大鼠,其血管床阻力升高的幅度明显小于对照;悬吊大鼠与对照大鼠血管床对PE反应的EC50值(-logM)分别为5.12±0.35与5.19±0.19,两组间无显著差异(P>0.05)(图3)。

图3 悬吊与对照大鼠后肢膜血管床对PE收缩反应的浓度-收缩反应曲线
, 百拇医药
*P<0.05, **P<0.01,与对照组相比,数值为
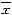 ±s,n=10
±s,n=10Fig.3 Concentration-contraction response curves showing vasoconstrictor responses of hindlimb arterial beds isolated from suspended and control rats to PE
*P<0.05,**P<0.01,as compared with control,Values are
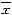 ±s,n=10
±s,n=10讨 论
本工作对尾部悬吊模拟失重大鼠后肢血管床的血流阻力进行了观察,结果表明:在静息状态下,悬吊大鼠上述两处的血管床血流阻力与对照大鼠相比并无明显不同,但在对KCl与PE 的收缩反应中,悬吊大鼠后肢血管床的血流阻力增加幅度明显小于对照大鼠。此结果与最近我们在肠系膜血管床观察到的结果一致[8]。
, http://www.100md.com
血流阻力是血液在血管内流动时所遇到的阻力。生理情况下,血管床的血流阻力近似与组成血管床的各个血管的长度成正比、与其口径的四次方成反比。此外,血液的粘滞度的变化也可影响血流阻力。因此血管口径变化对血流阻力的影响最大。
血管床血管的长度与血管的口径受到多方面因素的影响,包括许多局部的、神经源性的以及体液的因素。对于模拟失重大鼠,由于血管血流与压力的改变,4 wk尾部悬吊即可导致大鼠动脉系统血管的重建,如血管直径变小,神经支配变化等[9];最近亦有报道[10]提示3 wk后半身背部皮肤悬吊使大鼠后肢血管床的结构改变,静息时血流阻力提高。在本实验中,悬吊大鼠后肢血管床的流量-压力关系与对照大鼠尚无明显不同,提示其血管床本身的结构如血管可能还没有发生明显改变,或其改变的程度尚不足以造成静息状态时血流阻力的改变。此外,不排除本实验灌流流量较小,使灌流压较低而不足以表明其差异的可能。
后肢血管床动脉在受到KCl与PE的刺激时,血管平滑肌收缩,各级动脉的口径缩小,导致血管床血流阻力的增加,在恒定灌流流量的情况下,表现为灌流压明显增加。本实验中,悬吊大鼠后肢血管床在受到血管收缩剂刺激时,其血管阻力升高的幅度明显低于对照大鼠,结合其静息状态下的血流阻力情况,提示血管床动脉对血管收缩剂的收缩反应降低是导致悬吊大鼠血流阻力增加幅度低于对照的原由。而KCl与PE诱发的非受体介导与受体介导的收缩反应均降低,则进一步提示平滑肌收缩结构可能发生变化。这与前述工作中离体动脉实验的结构是一致的,说明小动脉也发生了与中动脉相似的改变。
, http://www.100md.com
最近,Rodionov等[10]报道了与本实验结果一致的工作,他们发现3 wk的悬吊使大鼠对刺激交感神经所致的后肢血管床血管收缩反应减弱,升压反应低于对照大鼠。在外周循环阻力的产生中, 后肢血管床作用是举足轻重的。后肢血管床血流阻力增加幅度的降低,将直接影响立位应激时外周循环阻力的增加,导致立位应激时动脉血压维持功能的改变。
本工作的结果进一步证实动脉功能,尤其是小动脉功能在模拟失重状态下发生了明显变化,且此变化在飞行后立位耐力不良的发生机制中可能具有一定作用。
*基金项目:国家自然科学基金(39380021)
参考文献
[1]Lacolley PJ, Pannier BM, Cuche JL et al. Microgravity and orthostatic intolerance: carotid hemodynamics and peripheral responses[J]. Am J Physiol. 1993, 264:H588~H594
, 百拇医药
[2]Mulvagh SL, Chares JB, Riddle JM et al. Echocardiographic evaluation of the cardiovascular effects of short-duration spaceflight[J]. J Clin Pharmacol. 1991, 31: 1024~1026
[3]马 进,张立藩,杨天德等. 尾部悬吊及恢复过程中大鼠动脉血管收缩反应的变化[J]. 航天医学与医学工程,1999,12(3):169~172
[4]陈孟勤, 曹济民. 血管活动的个性化[J]. 生理科学进展,1996,27:203~209
[5]陈 杰,马 进,丁兆平等. 一种模拟失重影响的大鼠尾部悬吊模型[J]. 空间科学学报,1993, 13:159~162
, http://www.100md.com [6]Bonen A, Clark MG and Henriksen EJ. Experimental approaches in muscle metabolism: hindlimb perfusion and isolated muscle incubations[J]. Am J Physiol,1994, 266:E1~E16
[7]Ruderman NB, Houghton CRS and Hems R. Evaluation of the isolated perfused rat hindquarter for the study of muscle metabolism[J]. Biochem J,1971,124:639~651
[8]张乐宁,马 进, 张立藩. 14 d尾部悬吊大鼠肠系膜血管床反应性的变化[J]. 中华航空航天医学杂志,1998,9(2):81~84
, 百拇医药 [9]Zhang LF, Mao QW, Ma J et al. Effects of simulated weightlessness on arterial vasculature-an experimental study on vascular deconditioning[J]. J Gravitational Physiology,1996,3(2):5~8
[10]Rodionov I, Machkov V, Tarasova O et al. Effect of 3-week suspension on sympathetic vasoconstrictor response in rat[J].J Gravitational Physiology,1997, 4(2),41~42
收稿日期:1998-10-19, 百拇医药