一种剪切诱导血小板聚集的检测方法
作者:郑均 吴向东 黄宇烽
单位:南京军区南京总医院全军医学检验中心,南京210002
关键词:血小板;剪切诱导的血小板聚集;剪切力
临床检验杂志990426 摘要 建立一种剪切诱导血小板聚集(SIPA)的检测方法。将0.8 ml含30×109/L血小板的富血小板血浆(PRP)置入锥板粘度仪的锥板中,温度调为37°C,用110达因/cm2的剪切力剪切PRP 1分钟,计数剪切后PRP中游离血小板数目并计算出SIPA值。结果检测正常人SIPA值为(46±5)%。该方法可用于检测PRP中血小板的SIPA值。
血小板的活化和聚集与血栓性疾病如不稳定性心绞痛、心肌梗死等病程有关。剪切诱导的血小板聚集(shear-induced platelet aggregation,SIPA)是指血液循环中因力学变化产生的剪切力引起的血小板聚集,在生理止血中它有很重要的作用[1]。近年来,剪切诱导的血小板聚集被认为是动脉性血栓如心梗和脑血栓等形成过程的一个重要病理因素而引起临床重视[2]。本文利用锥板粘度仪,让富血小板血浆(PRP)在锥板粘度仪中受一定量剪切力的作用,使血小板产生聚集,计数剪切前后PRP中游离的血小板数目,计算出SIPA值,建立了一种体外检测SIPA的方法。临床应用检测了47例健康志愿者的SIPA值,并探讨了该方法的检测条件。
, 百拇医药
1 材料和方法
1.1 仪器 LBY-N5型锥板粘度仪(北京普利生集团产);MEDONIC CA 610血细胞分析仪。
1.2 试剂 0.109 mol/L枸橼酸钠(分析纯,国产Na3C6H5O7.2H2O配制);1%(v/v)戊二醛(分析纯,国产25~28% C4H8O2配制)。
1.3 研究对象 无心、脑、肾疾病健康志愿者,男23例,女24例,平均年龄37岁。志愿者7天内未服用任何影响血小板功能的药物。
1.4 SIPA检测方法4.5 ml,注入含0.5 ml 0.109 mol/L的枸橼酸钠抗凝管。
, 百拇医药
1.4.2 操作步聚 按文献所述[3]的方法制备贫血小板血浆(PPP)和PRP,计数PRP数目,用PPP将PRP中血小板数目调整为30×109/L;取0.8 ml PRP加入粘度仪锥板中,37°C、110达因/cm2剪切力进行剪切。分别在剪切1分钟,3分钟和5分钟时,吸取20 μ
1.4.1 标本采集 空腹抽取静脉血l锥板中的PRP,计数游离血小板数目。血小板计数按CA 610血细胞分析仪说明书介绍的单通道检测血小板数目的方法进行检测。依下列公式计算SIPA值。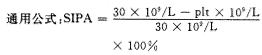
注:plt指剪切后游离的血小板数目。
2 结果
2.1 方法学
, 百拇医药
2.1.1 剪切诱导的血小板聚集 依文献的方法[4]用1%(V/V)的戊二醛固化血小板,分别对30×109/L固化的和非固化的血小板37°C、110达因/cm2剪切力剪切1分钟。结果说明剪切能诱导有生物活性的血小板产生聚集。
2.1.2 方法的重复性 分别对3例样品剪切1分钟时的SIPA值重复测定3次,结果分别为:(45±3)%,(46±2)%和(46±3)%,CV值均小于5%。说明该方法有较好的精密度。
2.2 最适实验条件
2.2.1 不同剪切力对SIPA的影响 测定37°C,血小板数目为30×109/L的PRP在不同剪切力下的SIPA值。结果见表1。
表1 剪切力不同时的SIPA值(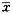 ±s)
±s)
, http://www.100md.com
剪切力(达因/cm2)
30
50
80
110
150
SIPA值(%)
剪切1分钟
6±2
22±4
34±3
46±5
44±3
, 百拇医药
剪切3分钟
6±4
21±3
33±4
45±4
44±4
剪切5分钟
7±2
24±2
34±5
47±4
44±4
2.2.2 不同温度对SIPA的影响 检测不同温度时的SIPA值。结果见表2。表2 温度不同时的SIPA值(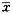 ±s)
±s)
, http://www.100md.com
25°C
37°C
SIPA值(%)
剪切1分钟
38±4
46±5
剪切3分钟
37±5
45±4
剪切5分钟
37±3
47±4
2.2.3 不同剪切时间对SIPA的影响 对37°C、110达因/cm2剪切力,血小板数目为30×109/L的PRP进行剪切,选择不同时间(10、30、60、90、120秒)检测的SIPA值,以及剪切完成后4小时的SIPA值。结果见表3。表3 不同剪切时间的SIPA值(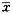 ±s)
±s)
, http://www.100md.com
10 s
30 s
60 s
90 s
120 s
剪切后4 h
SIPA值(%)
0
32±3
46±5
41±3
43±4
7±2
, http://www.100md.com
2.2.4 血小板数目不同对SIPA的影响 37°C,剪切力为110达因/cm2时,PRP中血小板数目不同时的SIPA值。结果见表4。表4 PRP中血小板数目不同时的SIPA值(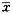 ±s)
±s)
血小板数目(×109/L)
10
20
30
SIPA值(%)
剪切1分钟
14±3
33±6
, 百拇医药
46±5
剪切3分钟
13±4
32±5
45±4
剪切5分钟
14±6
33±5
47±4
2.3 临床检测结果 47例健康志愿者的PRP(含血小板30×109/L)在37°C、110达因/cm2剪切力、剪切1分钟时的SIPA值为(46±5)%。
3 讨论
, http://www.100md.com
人体血管存在粗细、弯曲、分支以及狭窄等几何形态的变化,各种血管的管壁切变率存在较大的差异[5]。血流力学的变化可影响血细胞的功能[6]。本实验结果提示:利用锥板式粘度仪可控制锥板角速度的变化,对锥板中的“非牛顿液体”产生一个可控制大小的、恒定的剪切力,证实了有生理功能的血小板在剪切力作用下,可产生聚集。
本方法利用血细胞全自动分析仪计数剪切前后游离血小板数目,计算SIPA值,有较好的重复性,可以反映血小板受剪切诱导而产生的聚焦。
剪切力对人血小板有较灵敏的致聚性,而且这种致聚性随剪切力的增大而加强(见表2)。结果表明,人血小板在剪切力为30达因/cm2时,就会发生聚集,这有别于Brown等[7]的结果(其认为致聚的最小剪切力为50达因/cm2),与Cattano等[8]的结果(致聚最小剪切力为25达因/cm2)相似。Borgdorff等[9]研究体外循环中的SIPA时认为:诱导人血小板产生最大聚集的剪切力估计为231±17达因/cm2,本文的结果与Ikeda等[10]的研究结果相似(剪切力分别为:110达因/cm2和108达因/cm2)。由于Borgdorff等是在全血状态进行研究的,故推测循环血中血小板在剪切力的诱导下,比其在PRP中更易发生聚集。
, http://www.100md.com
温度对人血小板的SIPA有较大的影响(见表2);PRP中血小板数目对SIPA也有影响,SIPA聚集率随血小板数目的增高而升高(见表4)。在对人血小板SIPA进行的2分钟动态观察中(见表3)看到,PRP被剪切10秒种时,血小板没有发生聚集;剪切30秒后,血小板有较强的聚集;剪切60秒时,血小板聚集达到最高值。剪切后,PRP放置4小时,然后用本方法检测SIPA,血小板聚集率下降,推测SIPA是一种可逆性反应。
综上所述,本方法能检测血小板的SIPA,检测时的最适条件为:PRP中血小板数目为30×109/L,温度为37°C,剪切力大小为110达因/cm2,剪切时间为1分钟。
参考文献
1 Cattaneo M,Lombardi R,Bettega D.Shear-induced platelet aggregation is potentiaed by desmopressin and inhibited by ticlopidine.Arterioscler Thromb,1993,13(3):393
, 百拇医药
2 Konstantopoulos K,Grotta J C,Sills C,et al.Shear-induced platelet aggregation in normal subjects and stroke patients.Thromb Haemost,1995,74(5):1 329
3 包承鑫,李家增,陈炳献.比浊法测定血小板聚集性.中华血液学杂志,1980,1(4):225~228
4 Fukuyama M,Sakai K,Itagaki I,,et al.Continuous measurement of shear-induce platelet aggregation.Thromb Res,1989,54:253~260
5 阮长耿主编.血小板-基础与临床.上海:上海科学技术出版社,1987,75~87
, 百拇医药
6 Konstantopoulos K,Kamat S G,Schafer AI,et al.Shear-induced platelet aggregation is inhibited by in vivo infusion of an anti-glycoprotein Ⅱb/Ⅲa antibody fragment,c7E3 Fab,in patients undergoing coronary angioplasty.Circulaton,1995,91(5):1 427~1 431
7 Brown C H,Levertt L B,Lewis C W,et al.Morphological,biochemical,and functional changes in human platelets subjected to shear stress.J Lab Clin Med,1975,86(3):462~471
8 Cattaneo M,Pareti F I,Zighetti M L,et al.Platelet aggregation at high shear is impaired in patients with congenital defects of platelet secretion and is corrected by DDAVP:correlation with the bleeding time.J Lab Clin Med,1995,125(4):540
, http://www.100md.com
9 Borgdorff P,Kok W E,Vis M A,et al.Vasodilation by shear-induced platelet aggregation in extracorporeal circuit.Am J Physiol,1994,266:H891~897
10 Ikeda Y,Handa M,Kamata T,et al.Transmembrane calcium influx associated with von Willebrand factor binding to GPIb in the initiation of shear-induced platelet aggregation.Thromb Haemost,1993,69:496~502
(1999-02-01收稿), http://www.100md.com
单位:南京军区南京总医院全军医学检验中心,南京210002
关键词:血小板;剪切诱导的血小板聚集;剪切力
临床检验杂志990426 摘要 建立一种剪切诱导血小板聚集(SIPA)的检测方法。将0.8 ml含30×109/L血小板的富血小板血浆(PRP)置入锥板粘度仪的锥板中,温度调为37°C,用110达因/cm2的剪切力剪切PRP 1分钟,计数剪切后PRP中游离血小板数目并计算出SIPA值。结果检测正常人SIPA值为(46±5)%。该方法可用于检测PRP中血小板的SIPA值。
血小板的活化和聚集与血栓性疾病如不稳定性心绞痛、心肌梗死等病程有关。剪切诱导的血小板聚集(shear-induced platelet aggregation,SIPA)是指血液循环中因力学变化产生的剪切力引起的血小板聚集,在生理止血中它有很重要的作用[1]。近年来,剪切诱导的血小板聚集被认为是动脉性血栓如心梗和脑血栓等形成过程的一个重要病理因素而引起临床重视[2]。本文利用锥板粘度仪,让富血小板血浆(PRP)在锥板粘度仪中受一定量剪切力的作用,使血小板产生聚集,计数剪切前后PRP中游离的血小板数目,计算出SIPA值,建立了一种体外检测SIPA的方法。临床应用检测了47例健康志愿者的SIPA值,并探讨了该方法的检测条件。
, 百拇医药
1 材料和方法
1.1 仪器 LBY-N5型锥板粘度仪(北京普利生集团产);MEDONIC CA 610血细胞分析仪。
1.2 试剂 0.109 mol/L枸橼酸钠(分析纯,国产Na3C6H5O7.2H2O配制);1%(v/v)戊二醛(分析纯,国产25~28% C4H8O2配制)。
1.3 研究对象 无心、脑、肾疾病健康志愿者,男23例,女24例,平均年龄37岁。志愿者7天内未服用任何影响血小板功能的药物。
1.4 SIPA检测方法4.5 ml,注入含0.5 ml 0.109 mol/L的枸橼酸钠抗凝管。
, 百拇医药
1.4.2 操作步聚 按文献所述[3]的方法制备贫血小板血浆(PPP)和PRP,计数PRP数目,用PPP将PRP中血小板数目调整为30×109/L;取0.8 ml PRP加入粘度仪锥板中,37°C、110达因/cm2剪切力进行剪切。分别在剪切1分钟,3分钟和5分钟时,吸取20 μ
1.4.1 标本采集 空腹抽取静脉血l锥板中的PRP,计数游离血小板数目。血小板计数按CA 610血细胞分析仪说明书介绍的单通道检测血小板数目的方法进行检测。依下列公式计算SIPA值。
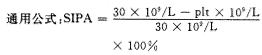
注:plt指剪切后游离的血小板数目。
2 结果
2.1 方法学
, 百拇医药
2.1.1 剪切诱导的血小板聚集 依文献的方法[4]用1%(V/V)的戊二醛固化血小板,分别对30×109/L固化的和非固化的血小板37°C、110达因/cm2剪切力剪切1分钟。结果说明剪切能诱导有生物活性的血小板产生聚集。
2.1.2 方法的重复性 分别对3例样品剪切1分钟时的SIPA值重复测定3次,结果分别为:(45±3)%,(46±2)%和(46±3)%,CV值均小于5%。说明该方法有较好的精密度。
2.2 最适实验条件
2.2.1 不同剪切力对SIPA的影响 测定37°C,血小板数目为30×109/L的PRP在不同剪切力下的SIPA值。结果见表1。
表1 剪切力不同时的SIPA值(
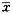 ±s)
±s), http://www.100md.com
剪切力(达因/cm2)
30
50
80
110
150
SIPA值(%)
剪切1分钟
6±2
22±4
34±3
46±5
44±3
, 百拇医药
剪切3分钟
6±4
21±3
33±4
45±4
44±4
剪切5分钟
7±2
24±2
34±5
47±4
44±4
2.2.2 不同温度对SIPA的影响 检测不同温度时的SIPA值。结果见表2。表2 温度不同时的SIPA值(
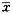 ±s)
±s), http://www.100md.com
25°C
37°C
SIPA值(%)
剪切1分钟
38±4
46±5
剪切3分钟
37±5
45±4
剪切5分钟
37±3
47±4
2.2.3 不同剪切时间对SIPA的影响 对37°C、110达因/cm2剪切力,血小板数目为30×109/L的PRP进行剪切,选择不同时间(10、30、60、90、120秒)检测的SIPA值,以及剪切完成后4小时的SIPA值。结果见表3。表3 不同剪切时间的SIPA值(
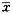 ±s)
±s), http://www.100md.com
10 s
30 s
60 s
90 s
120 s
剪切后4 h
SIPA值(%)
0
32±3
46±5
41±3
43±4
7±2
, http://www.100md.com
2.2.4 血小板数目不同对SIPA的影响 37°C,剪切力为110达因/cm2时,PRP中血小板数目不同时的SIPA值。结果见表4。表4 PRP中血小板数目不同时的SIPA值(
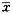 ±s)
±s)血小板数目(×109/L)
10
20
30
SIPA值(%)
剪切1分钟
14±3
33±6
, 百拇医药
46±5
剪切3分钟
13±4
32±5
45±4
剪切5分钟
14±6
33±5
47±4
2.3 临床检测结果 47例健康志愿者的PRP(含血小板30×109/L)在37°C、110达因/cm2剪切力、剪切1分钟时的SIPA值为(46±5)%。
3 讨论
, http://www.100md.com
人体血管存在粗细、弯曲、分支以及狭窄等几何形态的变化,各种血管的管壁切变率存在较大的差异[5]。血流力学的变化可影响血细胞的功能[6]。本实验结果提示:利用锥板式粘度仪可控制锥板角速度的变化,对锥板中的“非牛顿液体”产生一个可控制大小的、恒定的剪切力,证实了有生理功能的血小板在剪切力作用下,可产生聚集。
本方法利用血细胞全自动分析仪计数剪切前后游离血小板数目,计算SIPA值,有较好的重复性,可以反映血小板受剪切诱导而产生的聚焦。
剪切力对人血小板有较灵敏的致聚性,而且这种致聚性随剪切力的增大而加强(见表2)。结果表明,人血小板在剪切力为30达因/cm2时,就会发生聚集,这有别于Brown等[7]的结果(其认为致聚的最小剪切力为50达因/cm2),与Cattano等[8]的结果(致聚最小剪切力为25达因/cm2)相似。Borgdorff等[9]研究体外循环中的SIPA时认为:诱导人血小板产生最大聚集的剪切力估计为231±17达因/cm2,本文的结果与Ikeda等[10]的研究结果相似(剪切力分别为:110达因/cm2和108达因/cm2)。由于Borgdorff等是在全血状态进行研究的,故推测循环血中血小板在剪切力的诱导下,比其在PRP中更易发生聚集。
, http://www.100md.com
温度对人血小板的SIPA有较大的影响(见表2);PRP中血小板数目对SIPA也有影响,SIPA聚集率随血小板数目的增高而升高(见表4)。在对人血小板SIPA进行的2分钟动态观察中(见表3)看到,PRP被剪切10秒种时,血小板没有发生聚集;剪切30秒后,血小板有较强的聚集;剪切60秒时,血小板聚集达到最高值。剪切后,PRP放置4小时,然后用本方法检测SIPA,血小板聚集率下降,推测SIPA是一种可逆性反应。
综上所述,本方法能检测血小板的SIPA,检测时的最适条件为:PRP中血小板数目为30×109/L,温度为37°C,剪切力大小为110达因/cm2,剪切时间为1分钟。
参考文献
1 Cattaneo M,Lombardi R,Bettega D.Shear-induced platelet aggregation is potentiaed by desmopressin and inhibited by ticlopidine.Arterioscler Thromb,1993,13(3):393
, 百拇医药
2 Konstantopoulos K,Grotta J C,Sills C,et al.Shear-induced platelet aggregation in normal subjects and stroke patients.Thromb Haemost,1995,74(5):1 329
3 包承鑫,李家增,陈炳献.比浊法测定血小板聚集性.中华血液学杂志,1980,1(4):225~228
4 Fukuyama M,Sakai K,Itagaki I,,et al.Continuous measurement of shear-induce platelet aggregation.Thromb Res,1989,54:253~260
5 阮长耿主编.血小板-基础与临床.上海:上海科学技术出版社,1987,75~87
, 百拇医药
6 Konstantopoulos K,Kamat S G,Schafer AI,et al.Shear-induced platelet aggregation is inhibited by in vivo infusion of an anti-glycoprotein Ⅱb/Ⅲa antibody fragment,c7E3 Fab,in patients undergoing coronary angioplasty.Circulaton,1995,91(5):1 427~1 431
7 Brown C H,Levertt L B,Lewis C W,et al.Morphological,biochemical,and functional changes in human platelets subjected to shear stress.J Lab Clin Med,1975,86(3):462~471
8 Cattaneo M,Pareti F I,Zighetti M L,et al.Platelet aggregation at high shear is impaired in patients with congenital defects of platelet secretion and is corrected by DDAVP:correlation with the bleeding time.J Lab Clin Med,1995,125(4):540
, http://www.100md.com
9 Borgdorff P,Kok W E,Vis M A,et al.Vasodilation by shear-induced platelet aggregation in extracorporeal circuit.Am J Physiol,1994,266:H891~897
10 Ikeda Y,Handa M,Kamata T,et al.Transmembrane calcium influx associated with von Willebrand factor binding to GPIb in the initiation of shear-induced platelet aggregation.Thromb Haemost,1993,69:496~502
(1999-02-01收稿), http://www.100md.com