机械压力对大鼠下颌髁突软骨细胞增殖活性影响的体外研究
作者:杨红梅 罗颂椒
单位:610041 华西医科大学口腔医学院
关键词:下颌髁突软骨细胞;机械压力;增殖活性;流式细胞术;大鼠
华西口腔学杂志990411 摘要 目的:建立体外培养细胞加力装置,在细胞水平探讨机械力作用下大鼠髁突软骨细胞功能代谢的变化。方法:采用流式细胞术检测不同时段、不同力值的机械压力对体外培养的大鼠髁突软骨细胞增殖活性的影响。结果:在一定时间、0~2.03×10-4 Pa(0~207 g/cm2)力值范围内,随着机械压力的增大,受压的下颌髁突软骨细胞增殖活性增高,以持续压力作用6 h最为明显;当持续压力作用于下颌髁突软骨细胞24 h后,细胞增殖活性则出现下降。结论:在一定时间、一定力值范围内,随着机械压力的增大,受压的下颌髁突软骨细胞增殖活性有逐渐增高的趋势;当持续压力作用超过一定的范围,细胞增殖活性则出现下降趋势。
, 百拇医药
Study on Mechanical Compression Regulating the Proliferation of Rat Mandibular Condylar Chondrocytes in Vitro
Yang Hongmei, Luo Songjiao
College of Stomatology, West China University of Medical Sciences
Abstract
Objective:To study the proliferative changes of cultured rat mandibular condylar chondrocytes effected by mechanical compression.Methods: Using flow cytometry(FCM) to explore the changes of cellular DNA content and cell cycles of passaged condylar chondrocytes.Results: During certain force range (0~207 g/cm2), the proliferation of rat mandibular condylar chondrocytes rose, reaching the maximum after 6-hour application of force. The cellular proliferation went down when the chondrocytes were cultured under continuous pressure for 24 hours.Conclusion: The proliferation of rat mandibular condylar chondrocytes increase under certain force and certain period of time, but decreased if the applied pressure is beyond the magnitude.
, http://www.100md.com
Key words: mandibular condylar chondrocyte rat mechanical compression proliferation flow cytometry
生物力对骨骼的生长发育有重要意义,在颌面矫形治疗中压力和张力常被应用来矫正颌面的骨骼畸形[1]。大量体内研究表明,功能矫形前伸下颌后,使颞下颌关节的生物力学和生物学环境发生改变,使下颌髁突软骨局部的激素和生长因子(雌激素、IGF-Ⅰ等)含量增高,刺激髁突软骨细胞增生活跃,促进髁突及下颌骨的生长[2,3]。但体内研究全身及局部的影响因素太多,无法明确下颌髁突软骨细胞本身在矫形治疗中发生的结构、功能及代谢的变化,因此,本实验在已建立了大鼠下颌髁突软骨细胞体外培养模型基础上[4],使用了一种简单易行的体外培养细胞的加力装置,采用流式细胞术(flow cytometry,FCM)检测不同力值的机械压力对体外培养的大鼠下颌髁突软骨细胞DNA含量及细胞周期的影响,并进一步分析研究机械力对下颌髁突软骨细胞增殖活性的影响,为深入阐明颌面功能矫形治疗的细胞学机制提供可靠的实验依据。
, http://www.100md.com
1 材料和方法
1.1 实验材料
原代培养的大鼠下颌髁突软骨细胞[4];细胞加力装置:该装置由100 ml玻璃注射器制成,注射器针筒内径约为36 mm,底面积约为10.17cm2,活塞重量为105 g,将直径35 mm的细胞培养皿平放入针筒底部,再将活塞放入针筒,并密闭针筒下端,施加外力的砝码置于活塞顶部(图1);碘化丙啶染液:含碘化丙啶10 μg/ml,RNA酶 10μg/ml,Triton X-100 1.0%;流式细胞仪:美国Coulter公司Elite Esp型,光源为氩离子激光发生器,发射波长488 nm,输出率15 mW。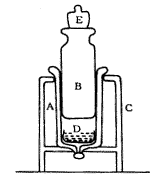
图1 细胞施压力装置示意图
A 针筒, B 活塞, C 支架, D 细胞培养皿, E 砝码
, http://www.100md.com
1.2 方法
将原代培养的大鼠下颌髁突软骨细胞传代,按3×105个/皿的密度接种于直径35 mm的细胞培养皿中,对照组和实验各组均为4个培养皿的细胞,每个培养皿内加入DMEM培养液(含10%小牛血清)2 ml,于CO2孵箱内(37 ℃,含95%空气、5%CO2)培养24 h,细胞贴壁后,用D-Hank’s液洗3次,将实验组培养皿平放入已消毒的100 ml针筒内,在各细胞培养皿内均加入2 ml DMEM培养液(含10%小牛血清),将相应的消毒活塞放入实验组针筒内,各活塞下端对应相同的刻度线,将针筒下端密闭,活塞顶部按实验分组放置100、500、1000,2000 g砝码(表1),实验力值设置参照Yamamoto的实验方法[1],对照组培养皿密闭后,均放入37 ℃孵箱内培养,2、6、16、24 h分别取出相应时段的实验组和对照组细胞作流式细胞术测定。
表1 不同时段不同压力作用的下颌髁突软骨细胞实验分组 压力持
, http://www.100md.com
续作用
时间(h)
对照组压力
实验组压力(Pa)
1
2
3
4
2
0
2.03×10-5
5.83×10-5
, http://www.100md.com 1.07×10-4
2.02×10-4
6
0
2.03×10-5
5.83×10-5
1.07×10-4
2.02×10-4
16
0
2.03×10-5
, 百拇医药
5.83×10-5
1.07×10-4
2.02×10-4
24
0
2.03×10-5
5.83×10-5
1.07×10-4
2.02×10-4
将各培养皿内细胞消化后制成细胞悬液,PBS洗2次,每份样品中加入碘化丙啶染液 1 ml,作用30 min后用于检测。
, 百拇医药
将碘化丙啶染液处理后的各组下颌髁突软骨细胞通过流式细胞仪检测,应用DNA细胞周期分析软件,计算出各样品DNA含量及细胞周期变化。细胞的增殖活性以增殖指数(proliferative index,PI)表示,其计算公式为: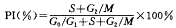
实验结果作分割试验的方差分析。
2 结 果
流式细胞仪分析结果显示,随着培养时间的延长,培养的大鼠下颌髁突软骨细胞增殖活性逐渐下降,各时段间的两两比较结果显示,细胞的增殖活性存在显著性差异(P<0.01)。当细胞被施以持续机械压力后,细胞的增殖活性出现了明显的变化。细胞持续受力2 h后,实验组细胞的增殖指数较对照组增高,差异有显著性(P<0.05);细胞持续受力6 h后,随力值增大,实验组细胞的增殖指数较对照组增高更为明显(P<0.05);细胞持续受力16 h后,随力值增大,实验组细胞的增殖指数仍较对照组增高(P<0.05),但升高幅度减小;细胞持续受力24 h后,除压力为2.03×10-5 Pa组细胞增殖指数轻度增高外,其余各实验组增殖指数均小于对照组,有统计学差异(表2,图2)。
, 百拇医药
表2 各时段机械力作用后细胞增殖活性的变化[PI(%), ±s] 力持续作
±s] 力持续作
用时间(h)
对照组
实验组
1
2
3
4
2
34.5±0.18
35.6±0.18*
, 百拇医药
37.0±0.22*
41.3±0.19*
43.9±0.25*
6
31.8±0.17
47.2±0.17*
50.5±0.08*
51.4±0.16*
53.1±0.26*
16
, 百拇医药
29.9±0.29
34.1±0.17*
34.8±0.08*
35.6±0.16*
35.9±0.16*
24
24.1±0.31
25.2±0.22*
22.5±0.22*
22.2±0.29*
, 百拇医药
22.2±0.37*
*P<0.05,各时段间PI值两两比较P<0.01
图2 各时段不同机械压力作用后细胞增殖活性的变化图
3 讨 论
本文参照Yamamoto等[1]的方法设计了对体外培养细胞施加机械压力的装置,该装置的玻璃注射器可耐受高压蒸气消毒,保证了培养细胞的无菌操作要求,而且体积小,可直接整体放入孵箱内培养,满足了细胞培养所必需的温度条件。体外细胞加力装置的建立,使人们有机会对各种类型细胞在体外受力后发生的结构、功能及代谢的改变进行深入细致的研究。
下颌髁突软骨细胞来源于骨母细胞,在生长激素和口颌系统正常的功能刺激下,骨母细胞转化为前成软骨细胞,并进一步分化成熟形成髁突软骨细胞。功能矫形前伸下颌后,颞下颌关节周围的张力和压力发生改变,使髁突软骨及其周围的理化环境发生改变,刺激了G0期(静止期)细胞进入细胞周期,促进了髁突软骨的增生[1]。
, http://www.100md.com
本研究发现,培养的下颌髁突软骨细胞受到持续压力作用时,在一定时间内表现出随力值增大细胞的增殖活性有逐渐增高的趋势,特别是在压力持续作用6 h组增殖活性增高最为明显,说明适当的压力对下颌髁突软骨细胞起着促进增殖的作用,在髁突生长发育过程中有重要的调节作用。在活体组织中,功能负荷或肌肉牵张力等均为调节骨生长分化的重要因素,缺乏功能刺激则会导致骨生长受限甚至发生退形性变[5]。Yamamoto等[1]研究发现,体外培养的单层下颌髁突软骨细胞受到0~2.03×10-4 Pa的静压力作用1~5 min后,其增殖活性和基质分泌均较未受力的细胞明显增高,本研究结果与之相似。近年来许多学者报道了培养的原发性软骨细胞受到压力、离心力等机械刺激后,细胞DNA含量增加,增殖活性增高[6~8]。但Veldhuijzen等[9]学者发现,体外培养的鸡骺板软骨细胞受力值为96 mmHg的间断压力作用20~24 h后,DNA合成明显下降,说明力作用时间变化对软骨细胞的增殖活性有较大影响。
, http://www.100md.com
本研究发现,培养的大鼠下颌髁突软骨细胞受到24 h持续压力作用后,细胞的增殖活性出现了下降趋势,与Yamamoto等[1]的报道相似。这可能是由于体外培养软骨细胞受持续压力时间过长后,细胞受刺激发生形变,分泌多种细胞因子,包括一些抑制细胞增殖的因子(如白介素、肿瘤坏死因子等)[10],使软骨细胞受力后出现了双相效应,其机理有待进一步深入研究。Bushmann等[11]进行牛股骨头软骨细胞的琼脂凝胶内立体培养时发现,立体培养的原发性软骨细胞受静压力时细胞DNA合成降低,而施以动态压力则促进了细胞的增生。Kim等[12]在进行原发性软骨体外培养加力研究时也有相似发现。软骨细胞的立体培养和软骨组织培养时,软骨细胞受力后增殖活性降低可能是因为软骨基质参与了力的信息传递,而培养的单层细胞基质分泌相对较少,故与细胞立体培养和软骨组织培养受力后细胞的变化存在一定的差异。
本研究为国家自然科学基金资助项目(编号 39470760)
, http://www.100md.com
4 参考文献
1 Yamamoto TT,Nakagawa K,Kawakami M,et al. Compari-son of the effect of hydrostatic compressive force on glycosaminoglycan synthesis and proliferation in rabbit chondrocytes from mandibular condylar cartilage, nasal septum,and spheno-occipital synchondrosis in vitro. Am J Orthod Dentofac Orthop,1991,99(5):448~455
2 白玉兴,罗颂椒.大鼠下颌前伸后大鼠髁突软骨雌激素变化的研究.中华口腔医学杂志,1997,32(3):161~163
3 罗颂椒,周 征.功能矫形前伸大鼠下颌后髁突软骨胰岛素样生长因子Ⅰ表达变化的研究.华西口腔医学杂志, 1998,16(2): 161~163
, 百拇医药
4 杨红梅,罗颂椒,王艳萍,等.大鼠下颌髁突软骨细胞的体外培养研究.华西医科大学学报,1999, 30(1):23~25
5 Palmoski MJ,Perricone E,Brandt KD. Development and reversat of a proteoglycan aggregation defect in normal canine knee cartilage after immobilization. Arthritis Rheum,1997,22(3):509~517
6 Bourret LA,Rodan GA. The role of calcium in the inhibition of cAMP accumulation in epiphyseal cartilage cells exposed to physiological pressure.J Cell Physiol,1976,88(3):353~362
, 百拇医药
7 Shimshoni Z,Binderman I,Fine N,et al. Mechanical and hormonal stimulation of cell cultures derived from young rat mandibular condyle.Arch Oral Biol,1984,29(10):827~831
8 De Witt MT,Handley CJ,Oades BW, et al.In vitro response of chondrocytes to mechanical loading. The effect of short term mechanical tension. Connect Tissue Res,1984,12(1):97~109
9 Veldhuijzen JP,Bourret LA,Rodan GA,et al. In vitro studies of the effect of intermittent compressive force on cartilage cell proliferation. J Cell Physiol,1979,98(2):299~306
, 百拇医药
10 Sandy JR,Farndale RW,Meikle MC. Recent advances in understanding mechanically induced bone remodeling and their relevance to orthodontic theory and practice. Am J Orthod Dentofac Orthop,1993,103(3): 212~222
11 Bushmann MD,Gluzband YA,Grodzinsky AJ,et al. Mechanical compression modulates matrix biosynthesis in chondrocyte/agarose culture. J Cell Sci,1995,108(4):1497~1508
12 Kim YJ,Sah RIY,Grodzinsky AJ, et al. Mechanical regulation of cartilage biosynthetic behavior:physical stimuli. Arch Biochem Biophys,1994,311(1):1~12
(1998-11-24收稿,1999-06-17修回), http://www.100md.com
单位:610041 华西医科大学口腔医学院
关键词:下颌髁突软骨细胞;机械压力;增殖活性;流式细胞术;大鼠
华西口腔学杂志990411 摘要 目的:建立体外培养细胞加力装置,在细胞水平探讨机械力作用下大鼠髁突软骨细胞功能代谢的变化。方法:采用流式细胞术检测不同时段、不同力值的机械压力对体外培养的大鼠髁突软骨细胞增殖活性的影响。结果:在一定时间、0~2.03×10-4 Pa(0~207 g/cm2)力值范围内,随着机械压力的增大,受压的下颌髁突软骨细胞增殖活性增高,以持续压力作用6 h最为明显;当持续压力作用于下颌髁突软骨细胞24 h后,细胞增殖活性则出现下降。结论:在一定时间、一定力值范围内,随着机械压力的增大,受压的下颌髁突软骨细胞增殖活性有逐渐增高的趋势;当持续压力作用超过一定的范围,细胞增殖活性则出现下降趋势。
, 百拇医药
Study on Mechanical Compression Regulating the Proliferation of Rat Mandibular Condylar Chondrocytes in Vitro
Yang Hongmei, Luo Songjiao
College of Stomatology, West China University of Medical Sciences
Abstract
Objective:To study the proliferative changes of cultured rat mandibular condylar chondrocytes effected by mechanical compression.Methods: Using flow cytometry(FCM) to explore the changes of cellular DNA content and cell cycles of passaged condylar chondrocytes.Results: During certain force range (0~207 g/cm2), the proliferation of rat mandibular condylar chondrocytes rose, reaching the maximum after 6-hour application of force. The cellular proliferation went down when the chondrocytes were cultured under continuous pressure for 24 hours.Conclusion: The proliferation of rat mandibular condylar chondrocytes increase under certain force and certain period of time, but decreased if the applied pressure is beyond the magnitude.
, http://www.100md.com
Key words: mandibular condylar chondrocyte rat mechanical compression proliferation flow cytometry
生物力对骨骼的生长发育有重要意义,在颌面矫形治疗中压力和张力常被应用来矫正颌面的骨骼畸形[1]。大量体内研究表明,功能矫形前伸下颌后,使颞下颌关节的生物力学和生物学环境发生改变,使下颌髁突软骨局部的激素和生长因子(雌激素、IGF-Ⅰ等)含量增高,刺激髁突软骨细胞增生活跃,促进髁突及下颌骨的生长[2,3]。但体内研究全身及局部的影响因素太多,无法明确下颌髁突软骨细胞本身在矫形治疗中发生的结构、功能及代谢的变化,因此,本实验在已建立了大鼠下颌髁突软骨细胞体外培养模型基础上[4],使用了一种简单易行的体外培养细胞的加力装置,采用流式细胞术(flow cytometry,FCM)检测不同力值的机械压力对体外培养的大鼠下颌髁突软骨细胞DNA含量及细胞周期的影响,并进一步分析研究机械力对下颌髁突软骨细胞增殖活性的影响,为深入阐明颌面功能矫形治疗的细胞学机制提供可靠的实验依据。
, http://www.100md.com
1 材料和方法
1.1 实验材料
原代培养的大鼠下颌髁突软骨细胞[4];细胞加力装置:该装置由100 ml玻璃注射器制成,注射器针筒内径约为36 mm,底面积约为10.17cm2,活塞重量为105 g,将直径35 mm的细胞培养皿平放入针筒底部,再将活塞放入针筒,并密闭针筒下端,施加外力的砝码置于活塞顶部(图1);碘化丙啶染液:含碘化丙啶10 μg/ml,RNA酶 10μg/ml,Triton X-100 1.0%;流式细胞仪:美国Coulter公司Elite Esp型,光源为氩离子激光发生器,发射波长488 nm,输出率15 mW。

图1 细胞施压力装置示意图
A 针筒, B 活塞, C 支架, D 细胞培养皿, E 砝码
, http://www.100md.com
1.2 方法
将原代培养的大鼠下颌髁突软骨细胞传代,按3×105个/皿的密度接种于直径35 mm的细胞培养皿中,对照组和实验各组均为4个培养皿的细胞,每个培养皿内加入DMEM培养液(含10%小牛血清)2 ml,于CO2孵箱内(37 ℃,含95%空气、5%CO2)培养24 h,细胞贴壁后,用D-Hank’s液洗3次,将实验组培养皿平放入已消毒的100 ml针筒内,在各细胞培养皿内均加入2 ml DMEM培养液(含10%小牛血清),将相应的消毒活塞放入实验组针筒内,各活塞下端对应相同的刻度线,将针筒下端密闭,活塞顶部按实验分组放置100、500、1000,2000 g砝码(表1),实验力值设置参照Yamamoto的实验方法[1],对照组培养皿密闭后,均放入37 ℃孵箱内培养,2、6、16、24 h分别取出相应时段的实验组和对照组细胞作流式细胞术测定。
表1 不同时段不同压力作用的下颌髁突软骨细胞实验分组 压力持
, http://www.100md.com
续作用
时间(h)
对照组压力
实验组压力(Pa)
1
2
3
4
2
0
2.03×10-5
5.83×10-5
, http://www.100md.com 1.07×10-4
2.02×10-4
6
0
2.03×10-5
5.83×10-5
1.07×10-4
2.02×10-4
16
0
2.03×10-5
, 百拇医药
5.83×10-5
1.07×10-4
2.02×10-4
24
0
2.03×10-5
5.83×10-5
1.07×10-4
2.02×10-4
将各培养皿内细胞消化后制成细胞悬液,PBS洗2次,每份样品中加入碘化丙啶染液 1 ml,作用30 min后用于检测。
, 百拇医药
将碘化丙啶染液处理后的各组下颌髁突软骨细胞通过流式细胞仪检测,应用DNA细胞周期分析软件,计算出各样品DNA含量及细胞周期变化。细胞的增殖活性以增殖指数(proliferative index,PI)表示,其计算公式为:
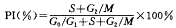
实验结果作分割试验的方差分析。
2 结 果
流式细胞仪分析结果显示,随着培养时间的延长,培养的大鼠下颌髁突软骨细胞增殖活性逐渐下降,各时段间的两两比较结果显示,细胞的增殖活性存在显著性差异(P<0.01)。当细胞被施以持续机械压力后,细胞的增殖活性出现了明显的变化。细胞持续受力2 h后,实验组细胞的增殖指数较对照组增高,差异有显著性(P<0.05);细胞持续受力6 h后,随力值增大,实验组细胞的增殖指数较对照组增高更为明显(P<0.05);细胞持续受力16 h后,随力值增大,实验组细胞的增殖指数仍较对照组增高(P<0.05),但升高幅度减小;细胞持续受力24 h后,除压力为2.03×10-5 Pa组细胞增殖指数轻度增高外,其余各实验组增殖指数均小于对照组,有统计学差异(表2,图2)。
, 百拇医药
表2 各时段机械力作用后细胞增殖活性的变化[PI(%),
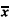 ±s] 力持续作
±s] 力持续作用时间(h)
对照组
实验组
1
2
3
4
2
34.5±0.18
35.6±0.18*
, 百拇医药
37.0±0.22*
41.3±0.19*
43.9±0.25*
6
31.8±0.17
47.2±0.17*
50.5±0.08*
51.4±0.16*
53.1±0.26*
16
, 百拇医药
29.9±0.29
34.1±0.17*
34.8±0.08*
35.6±0.16*
35.9±0.16*
24
24.1±0.31
25.2±0.22*
22.5±0.22*
22.2±0.29*
, 百拇医药
22.2±0.37*
*P<0.05,各时段间PI值两两比较P<0.01

图2 各时段不同机械压力作用后细胞增殖活性的变化图
3 讨 论
本文参照Yamamoto等[1]的方法设计了对体外培养细胞施加机械压力的装置,该装置的玻璃注射器可耐受高压蒸气消毒,保证了培养细胞的无菌操作要求,而且体积小,可直接整体放入孵箱内培养,满足了细胞培养所必需的温度条件。体外细胞加力装置的建立,使人们有机会对各种类型细胞在体外受力后发生的结构、功能及代谢的改变进行深入细致的研究。
下颌髁突软骨细胞来源于骨母细胞,在生长激素和口颌系统正常的功能刺激下,骨母细胞转化为前成软骨细胞,并进一步分化成熟形成髁突软骨细胞。功能矫形前伸下颌后,颞下颌关节周围的张力和压力发生改变,使髁突软骨及其周围的理化环境发生改变,刺激了G0期(静止期)细胞进入细胞周期,促进了髁突软骨的增生[1]。
, http://www.100md.com
本研究发现,培养的下颌髁突软骨细胞受到持续压力作用时,在一定时间内表现出随力值增大细胞的增殖活性有逐渐增高的趋势,特别是在压力持续作用6 h组增殖活性增高最为明显,说明适当的压力对下颌髁突软骨细胞起着促进增殖的作用,在髁突生长发育过程中有重要的调节作用。在活体组织中,功能负荷或肌肉牵张力等均为调节骨生长分化的重要因素,缺乏功能刺激则会导致骨生长受限甚至发生退形性变[5]。Yamamoto等[1]研究发现,体外培养的单层下颌髁突软骨细胞受到0~2.03×10-4 Pa的静压力作用1~5 min后,其增殖活性和基质分泌均较未受力的细胞明显增高,本研究结果与之相似。近年来许多学者报道了培养的原发性软骨细胞受到压力、离心力等机械刺激后,细胞DNA含量增加,增殖活性增高[6~8]。但Veldhuijzen等[9]学者发现,体外培养的鸡骺板软骨细胞受力值为96 mmHg的间断压力作用20~24 h后,DNA合成明显下降,说明力作用时间变化对软骨细胞的增殖活性有较大影响。
, http://www.100md.com
本研究发现,培养的大鼠下颌髁突软骨细胞受到24 h持续压力作用后,细胞的增殖活性出现了下降趋势,与Yamamoto等[1]的报道相似。这可能是由于体外培养软骨细胞受持续压力时间过长后,细胞受刺激发生形变,分泌多种细胞因子,包括一些抑制细胞增殖的因子(如白介素、肿瘤坏死因子等)[10],使软骨细胞受力后出现了双相效应,其机理有待进一步深入研究。Bushmann等[11]进行牛股骨头软骨细胞的琼脂凝胶内立体培养时发现,立体培养的原发性软骨细胞受静压力时细胞DNA合成降低,而施以动态压力则促进了细胞的增生。Kim等[12]在进行原发性软骨体外培养加力研究时也有相似发现。软骨细胞的立体培养和软骨组织培养时,软骨细胞受力后增殖活性降低可能是因为软骨基质参与了力的信息传递,而培养的单层细胞基质分泌相对较少,故与细胞立体培养和软骨组织培养受力后细胞的变化存在一定的差异。
本研究为国家自然科学基金资助项目(编号 39470760)
, http://www.100md.com
4 参考文献
1 Yamamoto TT,Nakagawa K,Kawakami M,et al. Compari-son of the effect of hydrostatic compressive force on glycosaminoglycan synthesis and proliferation in rabbit chondrocytes from mandibular condylar cartilage, nasal septum,and spheno-occipital synchondrosis in vitro. Am J Orthod Dentofac Orthop,1991,99(5):448~455
2 白玉兴,罗颂椒.大鼠下颌前伸后大鼠髁突软骨雌激素变化的研究.中华口腔医学杂志,1997,32(3):161~163
3 罗颂椒,周 征.功能矫形前伸大鼠下颌后髁突软骨胰岛素样生长因子Ⅰ表达变化的研究.华西口腔医学杂志, 1998,16(2): 161~163
, 百拇医药
4 杨红梅,罗颂椒,王艳萍,等.大鼠下颌髁突软骨细胞的体外培养研究.华西医科大学学报,1999, 30(1):23~25
5 Palmoski MJ,Perricone E,Brandt KD. Development and reversat of a proteoglycan aggregation defect in normal canine knee cartilage after immobilization. Arthritis Rheum,1997,22(3):509~517
6 Bourret LA,Rodan GA. The role of calcium in the inhibition of cAMP accumulation in epiphyseal cartilage cells exposed to physiological pressure.J Cell Physiol,1976,88(3):353~362
, 百拇医药
7 Shimshoni Z,Binderman I,Fine N,et al. Mechanical and hormonal stimulation of cell cultures derived from young rat mandibular condyle.Arch Oral Biol,1984,29(10):827~831
8 De Witt MT,Handley CJ,Oades BW, et al.In vitro response of chondrocytes to mechanical loading. The effect of short term mechanical tension. Connect Tissue Res,1984,12(1):97~109
9 Veldhuijzen JP,Bourret LA,Rodan GA,et al. In vitro studies of the effect of intermittent compressive force on cartilage cell proliferation. J Cell Physiol,1979,98(2):299~306
, 百拇医药
10 Sandy JR,Farndale RW,Meikle MC. Recent advances in understanding mechanically induced bone remodeling and their relevance to orthodontic theory and practice. Am J Orthod Dentofac Orthop,1993,103(3): 212~222
11 Bushmann MD,Gluzband YA,Grodzinsky AJ,et al. Mechanical compression modulates matrix biosynthesis in chondrocyte/agarose culture. J Cell Sci,1995,108(4):1497~1508
12 Kim YJ,Sah RIY,Grodzinsky AJ, et al. Mechanical regulation of cartilage biosynthetic behavior:physical stimuli. Arch Biochem Biophys,1994,311(1):1~12
(1998-11-24收稿,1999-06-17修回), http://www.100md.com