高效毛细管电泳法测定苦参碱和氧化苦参碱
作者:罗明 贺平 吴孟超 李琳芳 郭亚军
单位:第二军医大学东方肝胆外科医院肿瘤免疫和基因治疗中心(上海200438)
关键词:高效毛细管电泳;苦参碱;氧化苦参碱;含量检测
990410 摘 要 建立了测定苦参碱和氧化苦参碱含量的高效毛细管电泳法。20 mmoL/L的磷酸盐缓冲液(pH=8.0)为电泳电解质,电压为30 kV(运行电流为100~110 μA),检测波长为214 nm,内标氨茶碱。苦参碱0.126~1.26 mg/mL、氧化苦参碱0.10~1.0 mg/mL其浓度与峰面积之比呈良好的线性关系,r均为0.9998,日内、日间变异系数均小于5.7%,常用22种药物除地塞米松外其余的对其无干扰。用本法测定了2批苦参提取物,其中苦参碱为(45.19±0.058)%,(62.81±0.123)%;氧化苦参碱为(8.71±0.03)%,(6.81±0.086)%。结果表明,该方法简单、灵敏,特异性和重现性良好,具有较强的实用价值。
, http://www.100md.com
Determination of Matrine and Oxymatrine by HPCE
Luo Ming, He Ping, Wu Mengchao, et al.
(Tumor Immunology and Gene Therapy Center, Oriental Hospital,the Second Military Medical University,Shanghai 200438)
Abstract A method has been developed for the determination of matrine and oxymatrine by high performance capillary electrophoresis(HPCE). Aminophylline was used as internal standard. Complete separation was achieved with 20 mmol/L running phosphate buffer (pH=8.0)at a constant voltage of 30 kV(current of 100~110 μA) and detected at a wavelength of 214 nm. Good linearity was shown between the concentration and peak area in the concentration range of 0.126~1.26 mg/mL for matrine and 0.10~1.0 mg/mL for oxymatrine,r=0.9998.The relative standard deviation(RSD)for within-day and between-day was less than 5.7%.22 different drugs in common use except dexamethasone showed no interference. Two samples of extract of Sophora flavescens Ait.gave results of (45.19±0.058)% and (62.81±0.123)% for matrine and (8.71±0.03)% and (6.81±0.086)% for oxymatrine on a trial determination.It seemed that the HPCE method is faster,more convenient and economical as compared with HPLC.
, 百拇医药
Key words high performance capillary electrophoresis(HPCE) matrine oxymatrine
高效毛细管电泳法(HPCE)是近年发展起来的一种新的分离分析方法[1]。苦参碱和氧化苦参碱是常用中草药苦参及广豆根等的主要有效成分,具有镇静、镇痛、解热、降温、抗炎、抗病毒、抗肿瘤和免疫调节作用[2]。已有报道用HPLC方法检测苦参碱和氧化苦参碱的方法[3],但相比HPCE而言又不及后者快速、简便、高效。本实验用HPCE中的毛细管区带电泳法同时测定苦参碱和氧化苦参碱的含量,结果较为满意。
1 实验材料
P/ACE5000型毛细管电泳仪(美国Beckman公司),IBM4460DXZ型电脑,Epso LQ-300型打印机,石英毛细管57 cm×50 μm(美国Beckman公司),有效长度50 cm。对照品苦参碱和氧化苦参碱购于中国药品生物制品检定所,批号分别为0805-9703和0780-9703。试剂均为国产分析纯试剂,水为去离子双蒸水,待测的两份苦参碱样品是分别用乙醇法和酸水法从苦参中自行提取的[4]。
, http://www.100md.com
2 方法与结果
2.1 测定条件:以20 mmoL/L磷酸盐缓冲液(pH=8.0)作为电泳电解溶液。每次开机后用0.1 mmoL/L盐酸、0.1 mmoL/L氢氧化钠、20 mmoL/L磷酸盐缓冲液和水各冲洗4 min。两次进样之间以磷酸盐缓冲液和水各冲洗2 min。真空进样时间为5 s,恒定电压为30 kV,运行电流为100~110 μA,柱温23℃,检测波长214 nm,设定时间10 min,由计算机记录并处理峰面积。
2.2 标准液的配制及样品的处理:精确称取对照品苦参碱和氧化苦参碱一定量,去离子双蒸水溶解,定容,最后用0.2 μm的滤膜过滤,得贮备液。待测的两份苦参碱样品干燥恒重后,分别称取一定量溶解于一定的去离子双蒸水中,分别用0.2 μm滤膜过滤,作为待测样品。
2.3 内标的选择:实验中考察了氢化可的松、甘草酸二胺作为内标的可能性,但二者在 10 min内无吸收峰出现,而氨茶碱在碱性环境中稳定,并且不干扰待测成分出峰,重复性好,故选作检测苦参碱和氧化苦参碱的内标(图1-A)。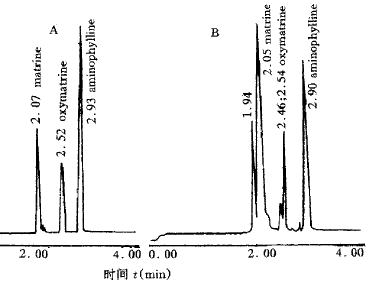
, 百拇医药
A-对照品 B-样品
图1 电泳图
2.4 干扰试验:在本试验条件下,检测临床上常用的22种药物:维生素C、维生素B6、维生素B12、维生素K1、维生素K3、青霉素钠盐、氨苄青霉素、庆大霉素、卡那霉素、链霉素、红霉素、盐酸麻黄碱、氨甲苯酸、甘草酸二胺、三磷酸腺苷二钠、肌苷、肝泰乐、酚磺乙胺、地塞米松、氢化可的松、利多卡因、氟尿嘧啶对测定苦参碱和氧化苦参碱的干扰。结果表明,除地塞米松对氧化苦参碱在出峰时间上有干扰外,其余药对其均无影响。
2.5 标准曲线和线性范围:精密移取标准贮备液不同量,加氨茶碱(25 mg/mL)液作内标,用水定容,得不同浓度的标准系列溶液,按开始设定的工作条件检测,每个样本重复3次,以药物浓度为纵坐标(Y),药物与内标峰面积之比为横坐标(X),进行线性回归。结果见表1。
, http://www.100md.com
表1 苦参碱和氧化苦参碱的线性关系和线性范围 药物
线性关系
线性范围
(mg/mL)
r
苦参碱
Y=3.5 X-0.024
0.126~1.26
0.9998
氧化苦参碱
Y=3.64 X-0.041
0.10~1.0
, http://www.100md.com
0.9998
2.6 回收率及精密度:用苦参碱和氧化苦参碱分别配制成表2所示的高、中、低3 种不同浓度,按相同的方法操作,计算回收率及日内,日间精密度(RSD),结果见表2。表2 回收率和精密度试验(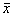 ±s) 药品
±s) 药品
加入量
(mg/mL)
测得量
(mg/mL)
回收率
(%)
日内RSD
, 百拇医药
(%)(n=3)
日间RSD
(%)(n=6)
苦参碱1
0.12
0.1133±0.0065
89.89±5.12
5.7
4.23
苦参碱2
0.63
0.6282±0.0030
, http://www.100md.com
99.91±0.48
0.48
0.81
苦参碱3
1.26
1.233±0.0059
97.88±0.17
0.47
0.87
氧化苦参碱1
0.10
0.1026±0.0018
, 百拇医药
102.63±1.76
1.72
3.41
氧化苦参碱2
0.50
0.512±0.003
102.4±0.59
0.58
1.02
氧化苦参碱2
1.0
1.0068±0.003
, http://www.100md.com
100.68±0.30
0.30
0.77
2.7 重现性:为确定上述分析条件下定量分析的精密度,通过6次重复进样,考察了苦参碱和氧化苦参碱的相对迁移时间和峰面积之比的重现性,结果见表3。表3 苦参碱、氧化苦参碱的相对迁移时间
和峰面积之比(n=6) 药物
相对迁移时间
峰面积比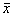 ±s(min)
±s(min)
RSD(%)
x±s
, 百拇医药
RSD(%)
苦参碱
2.068±0.034
1.644
0.3617±0.0032
0.885
氧化苦参碱
2.525±0.017
0.673
0.2860±0.0021
0.734
2.8 最低检测限:当信噪比大于2时,苦参碱和氧化苦参碱的最低检测限分别是1.0 和0.5 μg/mL。
, 百拇医药
2.9 应用:取配制好的两批待测苦参碱样品,分别加入相同的氨茶碱内标。照开始设定工作条件开始检测样品中苦参碱和氧化苦参碱的含量,每个样品重复3次,结果见表4。表4 样品中苦参碱和氧化苦参碱的含量
(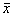 ±s n=3) 样品
±s n=3) 样品
苦参碱(%)
P
氧化苦参碱
P
1
45.19±0.058
8.71±0.03
, 百拇医药
2
62.81±0.123
<0.01
6.81±0.086
<0.01
3 讨论
开始考察了4种不同浓度的缓冲液作为电泳电解质的可能,结果发现30 mmoL/L的磷酸盐缓冲液(pH=6.7)和10 mmoL/L的醋酸缓冲液(pH=3.0)完全不能将苦参碱和氧化苦参碱分离;而10 mmoL/L的磷酸盐缓冲液(pH=6.37)又分离不彻底。相比之下,20 mmoL/L的磷酸缓冲液(pH=8.0)分离效果较好,待测成分及内标均可在2~4min内出峰,而且相互之间分离完全(图1-A)。通过干扰试验发现临床上与苦参碱和氧化苦参碱相关的22种常用药物中除地塞米松对氧化苦参碱的色谱峰干扰外,其余的均无干扰。回收率及日内、日间RSD均在允许范围之内。所试验的两份样品,尽管样品不纯,含杂质较多,但该系统仍然较好地将各个成分分开(图1-B)。同时也说明,乙醇法提取的氧化苦参碱含量较高,而酸水渗漉法提取的苦参碱含量较高。经对同一样本的反复测试,证明方法的重现性、精确性均达到要求,较常规的HPLC法简便、快速、经济,具有较高的实用价值。
, 百拇医药
*Addess:Zheng Xiaowei ,National Institute for the Control of Phrmaceutical and Biolog
罗明 35岁,博士学位,主治医师和讲师。1986年毕业于湖北中医学院中医系,先后在同济医科大学 和第二军医大学获硕士及博士学位。长期从事中西医结合科研、临床及教学工作,已发表论文4篇。
参 考 文 献
1 王 杰,等.中国医药工业杂志,1997,28(7):327
2 李 丹,等.中草药,1996,27(5):308
3 金莉霞,等.药学学报,1993,28(2):136
4 张守芳.中草药通讯,1977,1:38
(1998-06-30收稿), 百拇医药
单位:第二军医大学东方肝胆外科医院肿瘤免疫和基因治疗中心(上海200438)
关键词:高效毛细管电泳;苦参碱;氧化苦参碱;含量检测
990410 摘 要 建立了测定苦参碱和氧化苦参碱含量的高效毛细管电泳法。20 mmoL/L的磷酸盐缓冲液(pH=8.0)为电泳电解质,电压为30 kV(运行电流为100~110 μA),检测波长为214 nm,内标氨茶碱。苦参碱0.126~1.26 mg/mL、氧化苦参碱0.10~1.0 mg/mL其浓度与峰面积之比呈良好的线性关系,r均为0.9998,日内、日间变异系数均小于5.7%,常用22种药物除地塞米松外其余的对其无干扰。用本法测定了2批苦参提取物,其中苦参碱为(45.19±0.058)%,(62.81±0.123)%;氧化苦参碱为(8.71±0.03)%,(6.81±0.086)%。结果表明,该方法简单、灵敏,特异性和重现性良好,具有较强的实用价值。
, http://www.100md.com
Determination of Matrine and Oxymatrine by HPCE
Luo Ming, He Ping, Wu Mengchao, et al.
(Tumor Immunology and Gene Therapy Center, Oriental Hospital,the Second Military Medical University,Shanghai 200438)
Abstract A method has been developed for the determination of matrine and oxymatrine by high performance capillary electrophoresis(HPCE). Aminophylline was used as internal standard. Complete separation was achieved with 20 mmol/L running phosphate buffer (pH=8.0)at a constant voltage of 30 kV(current of 100~110 μA) and detected at a wavelength of 214 nm. Good linearity was shown between the concentration and peak area in the concentration range of 0.126~1.26 mg/mL for matrine and 0.10~1.0 mg/mL for oxymatrine,r=0.9998.The relative standard deviation(RSD)for within-day and between-day was less than 5.7%.22 different drugs in common use except dexamethasone showed no interference. Two samples of extract of Sophora flavescens Ait.gave results of (45.19±0.058)% and (62.81±0.123)% for matrine and (8.71±0.03)% and (6.81±0.086)% for oxymatrine on a trial determination.It seemed that the HPCE method is faster,more convenient and economical as compared with HPLC.
, 百拇医药
Key words high performance capillary electrophoresis(HPCE) matrine oxymatrine
高效毛细管电泳法(HPCE)是近年发展起来的一种新的分离分析方法[1]。苦参碱和氧化苦参碱是常用中草药苦参及广豆根等的主要有效成分,具有镇静、镇痛、解热、降温、抗炎、抗病毒、抗肿瘤和免疫调节作用[2]。已有报道用HPLC方法检测苦参碱和氧化苦参碱的方法[3],但相比HPCE而言又不及后者快速、简便、高效。本实验用HPCE中的毛细管区带电泳法同时测定苦参碱和氧化苦参碱的含量,结果较为满意。
1 实验材料
P/ACE5000型毛细管电泳仪(美国Beckman公司),IBM4460DXZ型电脑,Epso LQ-300型打印机,石英毛细管57 cm×50 μm(美国Beckman公司),有效长度50 cm。对照品苦参碱和氧化苦参碱购于中国药品生物制品检定所,批号分别为0805-9703和0780-9703。试剂均为国产分析纯试剂,水为去离子双蒸水,待测的两份苦参碱样品是分别用乙醇法和酸水法从苦参中自行提取的[4]。
, http://www.100md.com
2 方法与结果
2.1 测定条件:以20 mmoL/L磷酸盐缓冲液(pH=8.0)作为电泳电解溶液。每次开机后用0.1 mmoL/L盐酸、0.1 mmoL/L氢氧化钠、20 mmoL/L磷酸盐缓冲液和水各冲洗4 min。两次进样之间以磷酸盐缓冲液和水各冲洗2 min。真空进样时间为5 s,恒定电压为30 kV,运行电流为100~110 μA,柱温23℃,检测波长214 nm,设定时间10 min,由计算机记录并处理峰面积。
2.2 标准液的配制及样品的处理:精确称取对照品苦参碱和氧化苦参碱一定量,去离子双蒸水溶解,定容,最后用0.2 μm的滤膜过滤,得贮备液。待测的两份苦参碱样品干燥恒重后,分别称取一定量溶解于一定的去离子双蒸水中,分别用0.2 μm滤膜过滤,作为待测样品。
2.3 内标的选择:实验中考察了氢化可的松、甘草酸二胺作为内标的可能性,但二者在 10 min内无吸收峰出现,而氨茶碱在碱性环境中稳定,并且不干扰待测成分出峰,重复性好,故选作检测苦参碱和氧化苦参碱的内标(图1-A)。

, 百拇医药
A-对照品 B-样品
图1 电泳图
2.4 干扰试验:在本试验条件下,检测临床上常用的22种药物:维生素C、维生素B6、维生素B12、维生素K1、维生素K3、青霉素钠盐、氨苄青霉素、庆大霉素、卡那霉素、链霉素、红霉素、盐酸麻黄碱、氨甲苯酸、甘草酸二胺、三磷酸腺苷二钠、肌苷、肝泰乐、酚磺乙胺、地塞米松、氢化可的松、利多卡因、氟尿嘧啶对测定苦参碱和氧化苦参碱的干扰。结果表明,除地塞米松对氧化苦参碱在出峰时间上有干扰外,其余药对其均无影响。
2.5 标准曲线和线性范围:精密移取标准贮备液不同量,加氨茶碱(25 mg/mL)液作内标,用水定容,得不同浓度的标准系列溶液,按开始设定的工作条件检测,每个样本重复3次,以药物浓度为纵坐标(Y),药物与内标峰面积之比为横坐标(X),进行线性回归。结果见表1。
, http://www.100md.com
表1 苦参碱和氧化苦参碱的线性关系和线性范围 药物
线性关系
线性范围
(mg/mL)
r
苦参碱
Y=3.5 X-0.024
0.126~1.26
0.9998
氧化苦参碱
Y=3.64 X-0.041
0.10~1.0
, http://www.100md.com
0.9998
2.6 回收率及精密度:用苦参碱和氧化苦参碱分别配制成表2所示的高、中、低3 种不同浓度,按相同的方法操作,计算回收率及日内,日间精密度(RSD),结果见表2。表2 回收率和精密度试验(
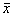 ±s) 药品
±s) 药品加入量
(mg/mL)
测得量
(mg/mL)
回收率
(%)
日内RSD
, 百拇医药
(%)(n=3)
日间RSD
(%)(n=6)
苦参碱1
0.12
0.1133±0.0065
89.89±5.12
5.7
4.23
苦参碱2
0.63
0.6282±0.0030
, http://www.100md.com
99.91±0.48
0.48
0.81
苦参碱3
1.26
1.233±0.0059
97.88±0.17
0.47
0.87
氧化苦参碱1
0.10
0.1026±0.0018
, 百拇医药
102.63±1.76
1.72
3.41
氧化苦参碱2
0.50
0.512±0.003
102.4±0.59
0.58
1.02
氧化苦参碱2
1.0
1.0068±0.003
, http://www.100md.com
100.68±0.30
0.30
0.77
2.7 重现性:为确定上述分析条件下定量分析的精密度,通过6次重复进样,考察了苦参碱和氧化苦参碱的相对迁移时间和峰面积之比的重现性,结果见表3。表3 苦参碱、氧化苦参碱的相对迁移时间
和峰面积之比(n=6) 药物
相对迁移时间
峰面积比
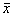 ±s(min)
±s(min)RSD(%)
x±s
, 百拇医药
RSD(%)
苦参碱
2.068±0.034
1.644
0.3617±0.0032
0.885
氧化苦参碱
2.525±0.017
0.673
0.2860±0.0021
0.734
2.8 最低检测限:当信噪比大于2时,苦参碱和氧化苦参碱的最低检测限分别是1.0 和0.5 μg/mL。
, 百拇医药
2.9 应用:取配制好的两批待测苦参碱样品,分别加入相同的氨茶碱内标。照开始设定工作条件开始检测样品中苦参碱和氧化苦参碱的含量,每个样品重复3次,结果见表4。表4 样品中苦参碱和氧化苦参碱的含量
(
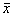 ±s n=3) 样品
±s n=3) 样品苦参碱(%)
P
氧化苦参碱
P
1
45.19±0.058
8.71±0.03
, 百拇医药
2
62.81±0.123
<0.01
6.81±0.086
<0.01
3 讨论
开始考察了4种不同浓度的缓冲液作为电泳电解质的可能,结果发现30 mmoL/L的磷酸盐缓冲液(pH=6.7)和10 mmoL/L的醋酸缓冲液(pH=3.0)完全不能将苦参碱和氧化苦参碱分离;而10 mmoL/L的磷酸盐缓冲液(pH=6.37)又分离不彻底。相比之下,20 mmoL/L的磷酸缓冲液(pH=8.0)分离效果较好,待测成分及内标均可在2~4min内出峰,而且相互之间分离完全(图1-A)。通过干扰试验发现临床上与苦参碱和氧化苦参碱相关的22种常用药物中除地塞米松对氧化苦参碱的色谱峰干扰外,其余的均无干扰。回收率及日内、日间RSD均在允许范围之内。所试验的两份样品,尽管样品不纯,含杂质较多,但该系统仍然较好地将各个成分分开(图1-B)。同时也说明,乙醇法提取的氧化苦参碱含量较高,而酸水渗漉法提取的苦参碱含量较高。经对同一样本的反复测试,证明方法的重现性、精确性均达到要求,较常规的HPLC法简便、快速、经济,具有较高的实用价值。
, 百拇医药
*Addess:Zheng Xiaowei ,National Institute for the Control of Phrmaceutical and Biolog
罗明 35岁,博士学位,主治医师和讲师。1986年毕业于湖北中医学院中医系,先后在同济医科大学 和第二军医大学获硕士及博士学位。长期从事中西医结合科研、临床及教学工作,已发表论文4篇。
参 考 文 献
1 王 杰,等.中国医药工业杂志,1997,28(7):327
2 李 丹,等.中草药,1996,27(5):308
3 金莉霞,等.药学学报,1993,28(2):136
4 张守芳.中草药通讯,1977,1:38
(1998-06-30收稿), 百拇医药