HSV-tk基因转导对涎腺腺样囊性癌细胞生物学特性的影响
作者:孙春晓 何荣根 张志愿 刘兴坤 周晓健 陈诗书
单位:200011 上海第二医科大学附属第九人民医院口腔颌面外科肿瘤生物学实验室(孙春晓现在上海市岳阳路320号中科院上海生命中心35#,何荣根,张志愿,刘兴坤,周晓健),上海第二医科大学人类基因治疗中心(陈诗书)
关键词:涎腺腺样囊性癌细胞;HSV-tk基因转导;生物学特性
华西口腔学杂志990403 摘要 目的:检测单纯疱疹病毒胸苷激酶(HSV-tk)基因的转导对高转移性涎腺腺样囊性癌细胞(ACC-M)生物学行为的影响。方法:对基因转导细胞作生长曲线测定、电镜观察、细胞周期检测、细胞表面组织相容复合物(MHC)Ⅰ类和Ⅱ类分子表达变化的测定。结果:HSV-tk基因转导组和亲本肿瘤细胞组无明显差别。结论:HSV-tk基因的转导对ACC-M细胞的生物学行为无明显影响。
, http://www.100md.com Biological Characters of Adenoid Cystic Carcinoma Cells Transduced with HSV-tk Gene
Sun Chunxiao, He Ronggen, Zhang Zhiyuan, et al
Tumor Biology Laboratory, Department of Oral & Maxillofacial Surgery, the Ninth Hospital, Shanghai Second Medical Universit
Chen Shishu
Human Gene Therapy Research Center, Shanghai Second Medical University
, 百拇医药
Abstract
Objective: To study the effects of herpes simplex virus thymidine kinase(HSV-tk) gene transduction on adenoid cystic carcinoma(ACC) cells. Methods: Gene transduced cells were detected with growth rate, scanning electronic microscope, transmission electronic microscope, cell cycle analysis and the expression of major histocompatibility complex(MHC) class Ⅰ or Ⅱ molecules. Results: The parameters detected in gene transduced cells and parental tumor cells were similar. Conclusion: The HSV-tk gene transduction would not change the biological characters of tumor cells greatly.
, http://www.100md.com
Key words: adenoid cystic carcinoma of salivary gland HSV-tk gene biological character
尽管绝大多数报道认为基因转导(主要是细胞因子基因)对肿瘤细胞的生物学特性无明显影响,但由于对肿瘤细胞转导单纯疱疹病毒胸苷激酶(herpes simplex virus thymidine kinase,HSV-tk)基因后的生物学特性研究极少,本文从各方面对转导HSV-tk基因后的高转移性涎腺腺样囊性癌细胞株(ACC-M)细胞的生物学特性作了研究。
1 材料和方法
1.1 生长曲线的测定
将ACC-M、转导空白载体的ACC-m细胞(AmLN)及转导HSV-tk基因的ACC-M细胞(AmTK)组细胞常规培养,每组取对数生长期细胞1×105接种于96孔板中,每2 d计数1次孔中细胞总数,每组细胞每次计数3个孔。
, 百拇医药
1.2 扫描电镜观察
将细胞培养于直经1.5 cm的玻片上,用PBS将细胞冲洗干净后,2%戊二醛固定48 h,常规制片。
1.3 透射电镜观察
将2×106的培养细胞,用PBS洗2次,2%戊二醛固定48 h。用刷子将细胞刮下离心,常规包埋、切片。
1.4 流式细胞术检测基因转导细胞DNA含量变化
流式细胞术(flow cytometry,FCM)观察基因转导细胞DNA含量的变化[1]。各组取2×106的培养细胞用PBS洗2次,胰酶消化,PBS洗后,加2.5 ml预冷的PBS充分悬浮细胞,再慢慢滴加等量的冷无水乙醇,4℃保存24 h以上,离心(1500 r/min,5 min)去上清,以PBS洗2次,并调细胞密度至1×106~1×107/ml,加70 μl细胞悬液至一FCM专用管,并加1%RNase100 μl,37℃30 min,加70 μl碘化丙啶(propidium iodide,PI)染料(终浓度为25~50 μg/ml),尼龙膜过滤,室温置10 min后上机检测。
, http://www.100md.com
1.5 流式细胞术检测细胞表面主要组织相容复合物分子表达
FCM观察细胞表面主要组织相容复合物(major histocompatibility complex,MHC)Ⅰ、Ⅱ类分子表达的变化[2]。2×106细胞,胰酶消化后PBS洗2次,去上清后加入100 μl鼠抗人MHCⅠ类或Ⅱ类Ⅰ抗(由上海市免疫学研究所提供),冰浴30 min(每5 min摇匀1次),再用大量PBS洗2次,离心(1500 r/min,5 min),去上清加入荧光素异硫氰酸盐(fluoroscein isothiocyanate,FITC)标记的绵羊抗鼠IgGⅡ抗(购自华美生物工程公司)100 μl,冰浴30 min,每5 min摇匀1次,再用大量PBS洗2次,加300 μl PBS后上机。
2 结 果
2.1 生长曲线
, http://www.100md.com
ACC-M、AmLN、AmTK细胞体外培养时,未见明显的生长行为改变,生长曲线测定也证明了这一点(图1)。
图1 ACC-M、AmLN和AmTK细胞体外培养生长曲线
2.2 各细胞周期DNA含量的变化
FCM检测细胞周期DNA变化,结果显示,ACC-M细胞转导入pLXSN空白载体和HSV-tk基因载体pL(TK)SN后,细胞周期也未发生明显变化。
2.3 细胞表面MHC分子表达的检测
通过FCM检测各种细胞表面MHCⅠ、Ⅱ类分子的表达,结果显示细胞转导入pLXSN空白载体,细胞表面的MHCⅠ、Ⅱ类分子的表达无明显变化;而转导HSV-tk基因之后,MHCⅠ类分子表达由原先的4.12%上升到16.23%,而Ⅱ类分子由3.90%上升到8.40%。AmTK细胞加用40 μmol/L无环鸟苷(ganciclovir,GCV)24 h后,细胞表面的MHCⅠ、Ⅱ类表达与未用GCV时无明显差别。但40 μmol/L GCV作用4 d之后,细胞表面的MHCⅠ类分子表达由原先的5.64%上升到31.85%,提高了5.65倍;而MHCⅡ类分子的表达则由10.20%上升到91.33%,提高了8.95倍(图2)。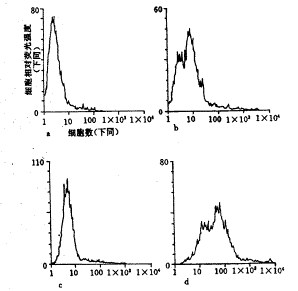
, 百拇医药
图2 AmTK细胞经GCV处理后细胞表面MHCⅠ类及Ⅱ类分子表达变化
a 经GCV处理24 h细胞表面MHCⅠ类分子表达(5.24%)
b 经GCV处理4 d细胞表面MHCⅠ类分子表达(31.85%)
c 经GCV处理24 h细胞表面MHCⅡ类分子表达(8.61%)
d 经GCV处理4 d细胞表面MHCⅡ类分子表达(91.33%)
2.4 扫描电镜
扫描电镜下发现转导基因的细胞与亲本肿瘤细胞无明显差异,细胞核较大,连同细胞膜向外突起,外观如“煎蛋”样。在细胞接触较紧密处,有微绒毛突起与邻近细胞相连,而在细胞较稀疏的地方,微绒毛少或无。
, 百拇医药
2.5 透射电镜
透射电镜下,细胞核大,核浆比例增大,有个别细胞浆内颗粒增多,但AmTK细胞与ACC-M细胞总的来说透射电镜下无明显差异。
3 讨 论
基因治疗作为一种新兴的治疗手段,其治疗方式可分为体内(in vivo)和体外(ex vivo)两种。所谓in vivo就是通过各种方式将目的基因直接注入患者体内,从而达到治疗目的;而ex vivo则是先分离培养靶细胞,并将目的基因转导入靶细胞中,然后再将靶细胞回输入患者体内。in vivo方式简单,易操作,可以在肿瘤部位直接定位,但是目前这种方式最大的缺点是基因转导效率比较低,往往难以达到理想的基因表达水平;而ex vivo方式有可能在体外筛选出基因转导细胞,但靶向性仍是一个问题,且工作量较大,体外培养细胞有可能使细胞的表型发生改变,回输体内时产生过敏反应等副作用。
, 百拇医药 尽管目前的大多数基因治疗项目是以ex vivo的方式进行,但有逐步向in vivo方式发展的趋势。正如美国《Human Gene Therapy》杂志主编Anderson WF所说的那样:只有当载体发展到象药物胰岛素那样可安全有效地注射进病人体内的时候,基因治疗才会对我们群体的健康产生主要影响[3]。
为更好地研究HSV-tk基因的转导对ACC-M细胞生物学特性的影响,本实验采用逆转录病毒为载体,筛选出基因阳性的肿瘤细胞,对这些细胞的生物学特性研究表明,基因的转导并不影响细胞的特性和生物学行为;细胞生长曲线、细胞各周期DNA含量、细胞的超微结构等均未发生改变,而MHCⅠ、Ⅱ类分子表达略有提高。这与文献报道相符。报道[4]认为HSV-tk/GCV作用后死亡的肿瘤细胞比照射灭活的肿瘤细胞更具免疫原性。但本实验中AmTK细胞在GCV40 μmol/L作用24 h后,细胞表面的MHCⅠ、Ⅱ类分子表达均未见明显改变,这可能是由于药物作用时间较短,产生的凋亡小体不明显之故,但是40 μmol/L GCV作用4 d之后,MHCⅠ、Ⅱ类分子表达分别增加5.56倍和8.95倍,说明细胞的免疫原性已有较大提高。
, 百拇医药
有研究报道[5]认为,肿瘤细胞接触实验组上清后瘤细胞表面的共刺激分子B7.1和B7.2的表达明显提高,动物实验也表明以HSV-tk/GCV治疗后,肿瘤细胞的B7.2由原先的5.8%提高到38.3%,而B7.1由原先的阴性表达上升到3.5%;实验组细胞间粘附分子(intercellular adhesion molecule,ICAM)表达由25%上升到50%,而且从实验组肿瘤中分离出来的T细胞比对照组更具增殖杀伤反应。这也充分说明,肿瘤以HSV-tk/GCV治疗后肿瘤细胞的免疫原性得到提高,这有利于机体免疫系统对肿瘤细胞的识别和旁杀伤作用的发挥。
Yamamoto等[6]的研究发现,以GCV治疗后,肿瘤细胞表面的MHCⅠ类分子表达提高,而且可以诱导以CD8+T细胞为主的特异免疫反应,增强机体对肿瘤细胞的杀伤和排斥。这些研究均表明,HSV-tk/GCV系统不仅可以直接杀伤肿瘤细胞,还可以诱导机体的抗肿瘤免疫反应,从而更有效地杀伤肿瘤细胞。
, 百拇医药
本课题为国家自然科学基金资助项目(编号 39800150)
4 参考文献
1 Al-Rubeai M, Emery AN. Flow cytometry application in cell culture. New York: Marcel Dekker Inc, 1996:6~24
2 陈允硕主编.现代实用免疫细胞化学计数.上海:上海科学技术出版社,1996:105~116
3 Anderson WF. Human gene therapy. Science, 1992,256(5058):808~813
4 Vile RG, Nelson JA, Castleden S, et al. Systemic gene therapy of murine melanoma using tissue specific expression of the HSV-tk gene involves an immune component. Cancer Res, 1994,54(23):6228~6234
, 百拇医药
5 Ramesh R, Munshi A, Abbound CN, et al. Expression of co-stimulatory molecules: B7 and ICAM up-regulation after treatment with a suicide gene. Cancer Gene Ther, 1996, 3(6):373~384
6 Yamamoto S, Suzuki S, Hoshino A, et al. Herpes simplex virus thymidine kinase/ganciclovir-mediated killing of tumor cells induces tumor-specific cytotoxic T cells in mice. Cancer Gene Ther, 1997,4(2):91~96
(1998-11-12收稿,1999-07-27修回), http://www.100md.com
单位:200011 上海第二医科大学附属第九人民医院口腔颌面外科肿瘤生物学实验室(孙春晓现在上海市岳阳路320号中科院上海生命中心35#,何荣根,张志愿,刘兴坤,周晓健),上海第二医科大学人类基因治疗中心(陈诗书)
关键词:涎腺腺样囊性癌细胞;HSV-tk基因转导;生物学特性
华西口腔学杂志990403 摘要 目的:检测单纯疱疹病毒胸苷激酶(HSV-tk)基因的转导对高转移性涎腺腺样囊性癌细胞(ACC-M)生物学行为的影响。方法:对基因转导细胞作生长曲线测定、电镜观察、细胞周期检测、细胞表面组织相容复合物(MHC)Ⅰ类和Ⅱ类分子表达变化的测定。结果:HSV-tk基因转导组和亲本肿瘤细胞组无明显差别。结论:HSV-tk基因的转导对ACC-M细胞的生物学行为无明显影响。
, http://www.100md.com Biological Characters of Adenoid Cystic Carcinoma Cells Transduced with HSV-tk Gene
Sun Chunxiao, He Ronggen, Zhang Zhiyuan, et al
Tumor Biology Laboratory, Department of Oral & Maxillofacial Surgery, the Ninth Hospital, Shanghai Second Medical Universit
Chen Shishu
Human Gene Therapy Research Center, Shanghai Second Medical University
, 百拇医药
Abstract
Objective: To study the effects of herpes simplex virus thymidine kinase(HSV-tk) gene transduction on adenoid cystic carcinoma(ACC) cells. Methods: Gene transduced cells were detected with growth rate, scanning electronic microscope, transmission electronic microscope, cell cycle analysis and the expression of major histocompatibility complex(MHC) class Ⅰ or Ⅱ molecules. Results: The parameters detected in gene transduced cells and parental tumor cells were similar. Conclusion: The HSV-tk gene transduction would not change the biological characters of tumor cells greatly.
, http://www.100md.com
Key words: adenoid cystic carcinoma of salivary gland HSV-tk gene biological character
尽管绝大多数报道认为基因转导(主要是细胞因子基因)对肿瘤细胞的生物学特性无明显影响,但由于对肿瘤细胞转导单纯疱疹病毒胸苷激酶(herpes simplex virus thymidine kinase,HSV-tk)基因后的生物学特性研究极少,本文从各方面对转导HSV-tk基因后的高转移性涎腺腺样囊性癌细胞株(ACC-M)细胞的生物学特性作了研究。
1 材料和方法
1.1 生长曲线的测定
将ACC-M、转导空白载体的ACC-m细胞(AmLN)及转导HSV-tk基因的ACC-M细胞(AmTK)组细胞常规培养,每组取对数生长期细胞1×105接种于96孔板中,每2 d计数1次孔中细胞总数,每组细胞每次计数3个孔。
, 百拇医药
1.2 扫描电镜观察
将细胞培养于直经1.5 cm的玻片上,用PBS将细胞冲洗干净后,2%戊二醛固定48 h,常规制片。
1.3 透射电镜观察
将2×106的培养细胞,用PBS洗2次,2%戊二醛固定48 h。用刷子将细胞刮下离心,常规包埋、切片。
1.4 流式细胞术检测基因转导细胞DNA含量变化
流式细胞术(flow cytometry,FCM)观察基因转导细胞DNA含量的变化[1]。各组取2×106的培养细胞用PBS洗2次,胰酶消化,PBS洗后,加2.5 ml预冷的PBS充分悬浮细胞,再慢慢滴加等量的冷无水乙醇,4℃保存24 h以上,离心(1500 r/min,5 min)去上清,以PBS洗2次,并调细胞密度至1×106~1×107/ml,加70 μl细胞悬液至一FCM专用管,并加1%RNase100 μl,37℃30 min,加70 μl碘化丙啶(propidium iodide,PI)染料(终浓度为25~50 μg/ml),尼龙膜过滤,室温置10 min后上机检测。
, http://www.100md.com
1.5 流式细胞术检测细胞表面主要组织相容复合物分子表达
FCM观察细胞表面主要组织相容复合物(major histocompatibility complex,MHC)Ⅰ、Ⅱ类分子表达的变化[2]。2×106细胞,胰酶消化后PBS洗2次,去上清后加入100 μl鼠抗人MHCⅠ类或Ⅱ类Ⅰ抗(由上海市免疫学研究所提供),冰浴30 min(每5 min摇匀1次),再用大量PBS洗2次,离心(1500 r/min,5 min),去上清加入荧光素异硫氰酸盐(fluoroscein isothiocyanate,FITC)标记的绵羊抗鼠IgGⅡ抗(购自华美生物工程公司)100 μl,冰浴30 min,每5 min摇匀1次,再用大量PBS洗2次,加300 μl PBS后上机。
2 结 果
2.1 生长曲线
, http://www.100md.com
ACC-M、AmLN、AmTK细胞体外培养时,未见明显的生长行为改变,生长曲线测定也证明了这一点(图1)。

图1 ACC-M、AmLN和AmTK细胞体外培养生长曲线
2.2 各细胞周期DNA含量的变化
FCM检测细胞周期DNA变化,结果显示,ACC-M细胞转导入pLXSN空白载体和HSV-tk基因载体pL(TK)SN后,细胞周期也未发生明显变化。
2.3 细胞表面MHC分子表达的检测
通过FCM检测各种细胞表面MHCⅠ、Ⅱ类分子的表达,结果显示细胞转导入pLXSN空白载体,细胞表面的MHCⅠ、Ⅱ类分子的表达无明显变化;而转导HSV-tk基因之后,MHCⅠ类分子表达由原先的4.12%上升到16.23%,而Ⅱ类分子由3.90%上升到8.40%。AmTK细胞加用40 μmol/L无环鸟苷(ganciclovir,GCV)24 h后,细胞表面的MHCⅠ、Ⅱ类表达与未用GCV时无明显差别。但40 μmol/L GCV作用4 d之后,细胞表面的MHCⅠ类分子表达由原先的5.64%上升到31.85%,提高了5.65倍;而MHCⅡ类分子的表达则由10.20%上升到91.33%,提高了8.95倍(图2)。

, 百拇医药
图2 AmTK细胞经GCV处理后细胞表面MHCⅠ类及Ⅱ类分子表达变化
a 经GCV处理24 h细胞表面MHCⅠ类分子表达(5.24%)
b 经GCV处理4 d细胞表面MHCⅠ类分子表达(31.85%)
c 经GCV处理24 h细胞表面MHCⅡ类分子表达(8.61%)
d 经GCV处理4 d细胞表面MHCⅡ类分子表达(91.33%)
2.4 扫描电镜
扫描电镜下发现转导基因的细胞与亲本肿瘤细胞无明显差异,细胞核较大,连同细胞膜向外突起,外观如“煎蛋”样。在细胞接触较紧密处,有微绒毛突起与邻近细胞相连,而在细胞较稀疏的地方,微绒毛少或无。
, 百拇医药
2.5 透射电镜
透射电镜下,细胞核大,核浆比例增大,有个别细胞浆内颗粒增多,但AmTK细胞与ACC-M细胞总的来说透射电镜下无明显差异。
3 讨 论
基因治疗作为一种新兴的治疗手段,其治疗方式可分为体内(in vivo)和体外(ex vivo)两种。所谓in vivo就是通过各种方式将目的基因直接注入患者体内,从而达到治疗目的;而ex vivo则是先分离培养靶细胞,并将目的基因转导入靶细胞中,然后再将靶细胞回输入患者体内。in vivo方式简单,易操作,可以在肿瘤部位直接定位,但是目前这种方式最大的缺点是基因转导效率比较低,往往难以达到理想的基因表达水平;而ex vivo方式有可能在体外筛选出基因转导细胞,但靶向性仍是一个问题,且工作量较大,体外培养细胞有可能使细胞的表型发生改变,回输体内时产生过敏反应等副作用。
, 百拇医药 尽管目前的大多数基因治疗项目是以ex vivo的方式进行,但有逐步向in vivo方式发展的趋势。正如美国《Human Gene Therapy》杂志主编Anderson WF所说的那样:只有当载体发展到象药物胰岛素那样可安全有效地注射进病人体内的时候,基因治疗才会对我们群体的健康产生主要影响[3]。
为更好地研究HSV-tk基因的转导对ACC-M细胞生物学特性的影响,本实验采用逆转录病毒为载体,筛选出基因阳性的肿瘤细胞,对这些细胞的生物学特性研究表明,基因的转导并不影响细胞的特性和生物学行为;细胞生长曲线、细胞各周期DNA含量、细胞的超微结构等均未发生改变,而MHCⅠ、Ⅱ类分子表达略有提高。这与文献报道相符。报道[4]认为HSV-tk/GCV作用后死亡的肿瘤细胞比照射灭活的肿瘤细胞更具免疫原性。但本实验中AmTK细胞在GCV40 μmol/L作用24 h后,细胞表面的MHCⅠ、Ⅱ类分子表达均未见明显改变,这可能是由于药物作用时间较短,产生的凋亡小体不明显之故,但是40 μmol/L GCV作用4 d之后,MHCⅠ、Ⅱ类分子表达分别增加5.56倍和8.95倍,说明细胞的免疫原性已有较大提高。
, 百拇医药
有研究报道[5]认为,肿瘤细胞接触实验组上清后瘤细胞表面的共刺激分子B7.1和B7.2的表达明显提高,动物实验也表明以HSV-tk/GCV治疗后,肿瘤细胞的B7.2由原先的5.8%提高到38.3%,而B7.1由原先的阴性表达上升到3.5%;实验组细胞间粘附分子(intercellular adhesion molecule,ICAM)表达由25%上升到50%,而且从实验组肿瘤中分离出来的T细胞比对照组更具增殖杀伤反应。这也充分说明,肿瘤以HSV-tk/GCV治疗后肿瘤细胞的免疫原性得到提高,这有利于机体免疫系统对肿瘤细胞的识别和旁杀伤作用的发挥。
Yamamoto等[6]的研究发现,以GCV治疗后,肿瘤细胞表面的MHCⅠ类分子表达提高,而且可以诱导以CD8+T细胞为主的特异免疫反应,增强机体对肿瘤细胞的杀伤和排斥。这些研究均表明,HSV-tk/GCV系统不仅可以直接杀伤肿瘤细胞,还可以诱导机体的抗肿瘤免疫反应,从而更有效地杀伤肿瘤细胞。
, 百拇医药
本课题为国家自然科学基金资助项目(编号 39800150)
4 参考文献
1 Al-Rubeai M, Emery AN. Flow cytometry application in cell culture. New York: Marcel Dekker Inc, 1996:6~24
2 陈允硕主编.现代实用免疫细胞化学计数.上海:上海科学技术出版社,1996:105~116
3 Anderson WF. Human gene therapy. Science, 1992,256(5058):808~813
4 Vile RG, Nelson JA, Castleden S, et al. Systemic gene therapy of murine melanoma using tissue specific expression of the HSV-tk gene involves an immune component. Cancer Res, 1994,54(23):6228~6234
, 百拇医药
5 Ramesh R, Munshi A, Abbound CN, et al. Expression of co-stimulatory molecules: B7 and ICAM up-regulation after treatment with a suicide gene. Cancer Gene Ther, 1996, 3(6):373~384
6 Yamamoto S, Suzuki S, Hoshino A, et al. Herpes simplex virus thymidine kinase/ganciclovir-mediated killing of tumor cells induces tumor-specific cytotoxic T cells in mice. Cancer Gene Ther, 1997,4(2):91~96
(1998-11-12收稿,1999-07-27修回), http://www.100md.com