复制缺陷型人TPO重组腺病毒的构建与鉴定
作者:刘林罗成基 粟永平
单位:刘林第三军医大学附属新桥医院血液内科 重庆,400037;罗成基 粟永平 第三军医大学预防医学系防原医学教研室、全军复合伤研究所 重庆,400038
关键词:血小板生成素;腺病毒载体;基因转移;基因治疗
第三军医大学学报990502 提 要 目的:构建并鉴定携带人TPO基因的复制缺陷型重组腺病毒。方法:将含全部编码序列的人TPOcDNA克隆于腺病毒载体穿梭质粒pCA3的CMV启动子下游,然后与含有腺病毒基因组的质粒pBHG10共转染293细胞,经同源重组产生人TPO重组腺病毒(AdCMVTPO);体外转染A549细胞并检测其表达活性。结果:扩增后获得的病毒滴度达4.5×109pfu/ml,经体外转染A549细胞检测到TPO的表达。结论:所构建的重组腺病毒能有效介导人TPO基因的转移,可望用于造血功能重建的基因治疗研究。
, 百拇医药
中图法分类号 R394;R349.21;R373.1
Construction and identification of replication-deficient human thrombopoietin recombinant adenoviruses
Liu Lin, Luo Chengji, Su Yongping (Department of Hematology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037)
Abstract Objective: To construct and identify the replication-deficient human thrombopoietin (TPO) recombinant adenoviruses (AdCMVTPO). Methods: The full-length human TPO encoding TPO cDNA was cloned at the down stream of human CMV promoter of adenoviral shuttle plasmid pCA3. Then the resultant pCA3-TPO was cotransfected into 293 cells with the plasmid pBHG10 carrying the adenoviral genome. The AdCMVTPO was successfully generated with homologous recombination. A549 cells were infected with AdCMVTPO and the expression of human TPO was evaluated in vivo. Results: The titer of AdCMVTPO reached 4.5×109 pfu/ml after amplification in 293 cells. A549 cells expressed high level of human TPO after infection. Conclusion: The constructed recombinant adenovirus can mediate the human TPO gene transfer efficiently and can be used in the gene therapy of hemopoietic reconstruction.
, 百拇医药
Key words thrombopoietin; adenovirus; gene transfer; gene therapy
将治疗基因有效导入靶细胞并实现其高效表达是基因治疗的关键环节之一。腺病毒载体具有宿主细胞范围广、高转移效率、高滴度、高表达等优点,是目前体内基因治疗研究中应用最为广泛的载体[1]。血小板生成素(Thrombopoietin,TPO)是近年来克隆的一种造血生长因子[2],具有刺激巨核细胞的增殖和分化,促进血小板的生成和释放的功能[3]。重组TPO可促进放化疗骨髓损伤后血小板的恢复,减少严重出血的发生[4]。因此,构建携带人TPO基因的复制缺陷型重组腺病毒可用于放化疗损伤后造血功能重建的基因治疗研究。
1 材料与方法
1.1 腺病毒载体系统 为E1区和E3区缺失的复制缺陷5型腺病毒载体,包括pCA3和pBHG10(Microbix Inc, Canada)。其中,pCA3为含有人巨细胞病毒启动子(hCMV)并带有E1区缺失的5型腺病毒载体的穿梭质粒,pBHG10为带有E1、E3区及包装信号(ψ)缺失的5型腺病毒基因组质粒。
, http://www.100md.com
1.2 质粒
RC/CMV/TPO质粒(军事医学科学院葛忠良教授馈赠),含有人TP基因的cDNA,全长1.1 kb。
1.3 细菌和细胞株
菌株DH5α(本室保存);人胚肾细胞株293(上海医大陈诗书教授馈赠);人肺癌细胞株A549(第三军医大学呼吸研究所胡懿德博士馈赠)。
1.4 其它试剂
脂质体DOTAP试剂盒(宝灵曼),质粒DNA大量提取试剂盒(Promega),TaqDNA聚合酶、T4DNA连接酶及限制性内切酶等(宝灵曼、华美)。
1.5 人TPO重组腺病毒载体的构建
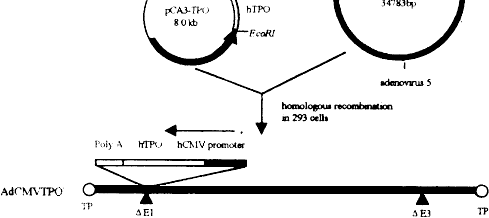
见图1。以EcoRI+XbaI双酶切并经Ⅴ型电泳槽回 收TPOcDNA片段,再以相同酶切并回收pCA3,经定向克隆并转化DH5α细菌后以EcoRI+XbaI酶切筛选出阳性重组子pCA3-TPO,大量制备其DNA。将pCA3-TPO(10μg)与pBHG10(1μg)经DOTAP包装(按试剂盒说明)后共转染293细胞,上层以0.5%琼脂覆盖,移至37℃、5%CO2、饱和湿度培养箱中孵育,8~15d后即可观察到病毒空斑的出现。按相同的方法构建无目的基因插入的空载体(AdCMVNull)。质粒的提取、酶切、连接和转化按《分子克隆》第2版操作。
, http://www.100md.com
图1 人TPO重组腺病毒载体构建流程图
Fig 1 Demonstrative illustration for the construction of human TPO recombinant adenoviral vectors
1.6 空斑鉴定
采用PCR扩增法。挑取空斑再感染293细胞,待细胞出现病变时取少量培养液,经蛋白酶K消化、酚氯仿抽提、乙醇沉淀提取病毒DNA,进行PCR扩增。设计两对引物,P1、P2为人TPO基因引物,P3、P4为腺病毒特异引物,序列如下。
P1:5′-CTCTAGTCCTCACACTGAACG-3′
P2:5′-AAGGAGAATATCCAGGCTGG-3′
, 百拇医药
P3:5′-TCGTTTCTCAGCAGCTGTTG-3′
P4:5′-CATCTGAACTCAAATCGTGG-3′
PCR反应体积为50μl,引物浓度为0.4μmol/L,扩增参数为94℃90s、60℃60s、72℃60s,35个循环,72℃延伸7min。各取10μl反应产物经1.5%琼脂糖凝胶电泳鉴定。
1.7 重组腺病毒的扩增与滴度检测
将重组腺病毒再感染293细胞进行扩增,收集病变细胞,在-70℃反复冻融3次,于4℃,5000r/min离心20min,取上清,用0.22μm的微孔滤器过滤,-70℃保存备用;病毒滴度检测采用空斑法[5]。
1.8 重组腺病毒感染A549细胞及TPO活性的检测
, http://www.100md.com
在对数生长期的A549细胞中加入AdCMVTPO,按20感染强度(Multiplicity of infection,MOI)感染细胞。1.5h后去除病毒液,加入新鲜培养基,48h后收集培养上清,检测TPO活性。取上清液0.5ml经皮下注射至正常Balb/c小鼠体内,每日1次,连续3d,于实验第0、3、6、9、12、15、18、25天经断尾取血检测血小板计数。以相同剂量AdCMVNull感染的A549细胞培养上清液及DMEM注射为对照。每组小鼠数量为6只。
2 结果
2.1 重组质粒酶切鉴定结果
pCA3-TPO质粒经EcoRI和XbaI酶切后获得正确大小的片段,为阳性重组子,见图2。
图2 重组质粒的酶切分析
, http://www.100md.com
Fig 2 Digestive analysis for the recombinant plasmid
Lane 1: PCR marker;Lane 2: EcoRI and XbaI digest of the recombinant plasmid;Lane 3: Plasmid pCA3
2.2 病毒空斑PCR扩增结果 经10~15 d孵育后培养皿共出现5个空斑,分别提取每个空斑的病毒DNA进行双引物PCR扩增,结果均出现2条带,分别在0.32 kb和0.86 kb处,为阳性空斑,即携带人TPO基因的重组腺病毒,见图3。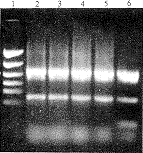
图3 病毒空斑的PCR扩增结果
Fig 3 PCR products of the adenoviral plaques
, http://www.100md.com
Lane 1: PCR marker;Lane 2~6: Positive plaques
2.3 重组腺病毒滴度测定结果
AdCMVTPO和AdCMVNull经繁殖、扩增后空斑法测定滴度分别为4.5×109pfu/ml及5.2×109pfu/ml。
2.4 重组腺病毒介导的TPO体外表达
TPO测定结果表明,感染AdCMVTPO的A549细胞培养上清注射组小鼠血小板计数于第3天开始逐渐升高,持续约两周后降至对照组水平,峰值较对照组增高约2倍,见图4,证明所制备的人TPO重组腺病毒在体外能高效表达TPO。
, 百拇医药 图4 重组腺病毒介导的人TPO体外表达活性检测
Fig 4 In vitro evaluation of the expression of human TPO mediated by the recombinant adenovirus
TPO-CM:Conditioned medium of AdCMVTPO infected cells;Null-CM:Conditioned medium of AdCMVNull infected cells
3 讨论
利用病毒具有与细胞表面受体结合并将其基因组导入宿主细胞的特性,将控制病毒复制的基因及部分病毒复制非必须基因去除后可制备成各种病毒载体。目前已开发的病毒载体主要有逆转录病毒载体、腺病毒载体、腺伴随病毒载体、单纯疱疹病毒载体等,其中,以逆转录病毒载体及腺病毒载体最常用。由于逆转录病毒载体能携带外源基因整合进靶细胞的基因组内,实现目的基因的长期稳定表达,因而主要用于体外的基因治疗研究。但是,由于外源基因的插入有导致基因突变的危险,因此,具有潜在的遗传毒性。此外,逆转录病毒只能感染分裂增殖的细胞,且繁殖滴度低、性质不稳定,不能满足体内基因治疗的需要。
, http://www.100md.com
腺病毒载体具有宿主细胞广泛、可感染静止及分裂期细胞、繁殖滴度高、性质稳定、包装容量大及不整合等优点,因而成为继逆转录病毒之后被广泛应用的病毒载体,主要用于体内基因治疗研究。在本研究中,我们构建的AdCMVTPO是E1、E3区缺失的复制缺陷5型腺病毒。由于E1区基因为腺病毒复制所必需,因此需要由转化了E1区基因的包装细胞即人胚肾293细胞提供反式补偿才能复制和扩增。这种复制缺陷的重组腺病毒仍具有感染靶细胞的能力但不发生复制,因而不会直接造成靶细胞的损害。
由于腺病毒基因组较大(36kb),不便于直接进行分子克隆,因此,在构建腺病毒载体时,通常将腺病毒基因组左端制备成含E1区缺失的穿梭质粒(如本研究采用的pCA3),将目的基因插入其多克隆位点后再与含腺病毒基因组的质粒(本研究采用pBHG10)共转染至293细胞内进行同源重组。由于在pBHG10中包装信号(Ψ)缺失不能被包装成病毒[5],必须与含包装信号的pCA3重组后才能形成感染性病毒,因此,有重组病毒生成后形成的空斑大多为含有目的基因的阳性空斑。本研究中所筛选的5个空斑均为阳性,证实这种重组方法的有效性。
, http://www.100md.com
传统的重组腺病毒载体鉴定方法是通过提取腺病毒感染后产生病变的293细胞的DNA,经限制性内切酶消化鉴定[6],操作较繁琐且灵敏度较低。本研究应用PCR共扩增技术,在同一PCR体系中加入TPO基因特异性引物和腺病毒特异性引物,可迅速、准确地鉴定出阳性噬斑。重组腺病毒载体的成功构建主要取决于以下两个关键环节:①用于共转染293细胞的质粒应具有较高的纯度(超螺旋质粒占80%以上);②采用低传代的293细胞(传代数在40代以内),因为随传代数的增加,293细胞将逐渐丧失其反式补偿功能,不能为E1区缺失的腺病毒载体有效地提供E1区蛋白从而降低同源重组的效率。
血小板减少是肿瘤患者放化疗过程中的常见并发症,目前主要的治疗方法是输注血小板悬液及支持治疗。但是由于血小板寿命短及机体产生抗血小板抗体等问题,因而治疗效果不理想[7]。TPO为近年来克隆的一种造血生长因子,对巨核细胞系的增殖和血小板的生成发挥基础性的调控作用。将重组TPO用于放化疗导致的骨髓损伤可促进巨核系造血的重建。我们所制备的人TPO复制缺陷重组腺病毒体外感染人肺癌细胞株A549细胞后,转染细胞培养上清液可显著的促进正常Balb/c小鼠血小板计数升高,证明AdCMVTPO可有效的介导人TPO表达,为进一步开展放化疗损伤后造血功能重建的基因治疗研究奠定了基础。
, http://www.100md.com
重庆市应用基础研究基金资助项目
作者简介:刘林,男,35岁,主治医师,讲师,博士研究生
参考文献
1 Richard C, Mulligan. The basic science of gene therapy. Science,1993,260(5110):926
2 Bartley T D, Bogenberger J, Hunt P, et al. Identification and cloning of a megakaryocyte growth and development factor that is a ligand for the cytokin receptor Mpl. Cell,1994,77(7):1117
3 Eaton D L, de Sauvage F J. Thrombopoietin:the primary regulator of megakaryocytopoiesis and thrombopoiesis. Exp Hematol,1997,25(1):1
, 百拇医药
4 Hokom M M, Lacey D, Kinstler O B, et al. Pegglated megakaryocyte growth and development factor abrogates the lethal thrombocytopenia associated with carboplatin and irradiaton in mice. Blood,1995,86(11):4486
5 Bett A J, Haddara W, Prevec L, et al. An efficient and flexible system for construction of adenovirus vectors with inserts or deletions in early regions 1 and 3. Proc Natl Acad Sci USA,1994,91(19):8802
6 Graham F L, Prevec L. Methods for construction of adenovirus vectors. Mol Biotechnol,1995,3(3):207
7 Lok S, Foster D C. The structure, biology and potential therapeutic applications of recombinant thrombopoietin. Stem Cells,1994,12(5):586
(收稿:1999-02-03;修回:1999-04-07), http://www.100md.com
单位:刘林第三军医大学附属新桥医院血液内科 重庆,400037;罗成基 粟永平 第三军医大学预防医学系防原医学教研室、全军复合伤研究所 重庆,400038
关键词:血小板生成素;腺病毒载体;基因转移;基因治疗
第三军医大学学报990502 提 要 目的:构建并鉴定携带人TPO基因的复制缺陷型重组腺病毒。方法:将含全部编码序列的人TPOcDNA克隆于腺病毒载体穿梭质粒pCA3的CMV启动子下游,然后与含有腺病毒基因组的质粒pBHG10共转染293细胞,经同源重组产生人TPO重组腺病毒(AdCMVTPO);体外转染A549细胞并检测其表达活性。结果:扩增后获得的病毒滴度达4.5×109pfu/ml,经体外转染A549细胞检测到TPO的表达。结论:所构建的重组腺病毒能有效介导人TPO基因的转移,可望用于造血功能重建的基因治疗研究。
, 百拇医药
中图法分类号 R394;R349.21;R373.1
Construction and identification of replication-deficient human thrombopoietin recombinant adenoviruses
Liu Lin, Luo Chengji, Su Yongping (Department of Hematology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037)
Abstract Objective: To construct and identify the replication-deficient human thrombopoietin (TPO) recombinant adenoviruses (AdCMVTPO). Methods: The full-length human TPO encoding TPO cDNA was cloned at the down stream of human CMV promoter of adenoviral shuttle plasmid pCA3. Then the resultant pCA3-TPO was cotransfected into 293 cells with the plasmid pBHG10 carrying the adenoviral genome. The AdCMVTPO was successfully generated with homologous recombination. A549 cells were infected with AdCMVTPO and the expression of human TPO was evaluated in vivo. Results: The titer of AdCMVTPO reached 4.5×109 pfu/ml after amplification in 293 cells. A549 cells expressed high level of human TPO after infection. Conclusion: The constructed recombinant adenovirus can mediate the human TPO gene transfer efficiently and can be used in the gene therapy of hemopoietic reconstruction.
, 百拇医药
Key words thrombopoietin; adenovirus; gene transfer; gene therapy
将治疗基因有效导入靶细胞并实现其高效表达是基因治疗的关键环节之一。腺病毒载体具有宿主细胞范围广、高转移效率、高滴度、高表达等优点,是目前体内基因治疗研究中应用最为广泛的载体[1]。血小板生成素(Thrombopoietin,TPO)是近年来克隆的一种造血生长因子[2],具有刺激巨核细胞的增殖和分化,促进血小板的生成和释放的功能[3]。重组TPO可促进放化疗骨髓损伤后血小板的恢复,减少严重出血的发生[4]。因此,构建携带人TPO基因的复制缺陷型重组腺病毒可用于放化疗损伤后造血功能重建的基因治疗研究。
1 材料与方法
1.1 腺病毒载体系统 为E1区和E3区缺失的复制缺陷5型腺病毒载体,包括pCA3和pBHG10(Microbix Inc, Canada)。其中,pCA3为含有人巨细胞病毒启动子(hCMV)并带有E1区缺失的5型腺病毒载体的穿梭质粒,pBHG10为带有E1、E3区及包装信号(ψ)缺失的5型腺病毒基因组质粒。
, http://www.100md.com
1.2 质粒
RC/CMV/TPO质粒(军事医学科学院葛忠良教授馈赠),含有人TP基因的cDNA,全长1.1 kb。
1.3 细菌和细胞株
菌株DH5α(本室保存);人胚肾细胞株293(上海医大陈诗书教授馈赠);人肺癌细胞株A549(第三军医大学呼吸研究所胡懿德博士馈赠)。
1.4 其它试剂
脂质体DOTAP试剂盒(宝灵曼),质粒DNA大量提取试剂盒(Promega),TaqDNA聚合酶、T4DNA连接酶及限制性内切酶等(宝灵曼、华美)。
1.5 人TPO重组腺病毒载体的构建
见图1。以EcoRI+XbaI双酶切并经Ⅴ型电泳槽回 收TPOcDNA片段,再以相同酶切并回收pCA3,经定向克隆并转化DH5α细菌后以EcoRI+XbaI酶切筛选出阳性重组子pCA3-TPO,大量制备其DNA。将pCA3-TPO(10μg)与pBHG10(1μg)经DOTAP包装(按试剂盒说明)后共转染293细胞,上层以0.5%琼脂覆盖,移至37℃、5%CO2、饱和湿度培养箱中孵育,8~15d后即可观察到病毒空斑的出现。按相同的方法构建无目的基因插入的空载体(AdCMVNull)。质粒的提取、酶切、连接和转化按《分子克隆》第2版操作。


, http://www.100md.com
图1 人TPO重组腺病毒载体构建流程图
Fig 1 Demonstrative illustration for the construction of human TPO recombinant adenoviral vectors
1.6 空斑鉴定
采用PCR扩增法。挑取空斑再感染293细胞,待细胞出现病变时取少量培养液,经蛋白酶K消化、酚氯仿抽提、乙醇沉淀提取病毒DNA,进行PCR扩增。设计两对引物,P1、P2为人TPO基因引物,P3、P4为腺病毒特异引物,序列如下。
P1:5′-CTCTAGTCCTCACACTGAACG-3′
P2:5′-AAGGAGAATATCCAGGCTGG-3′
, 百拇医药
P3:5′-TCGTTTCTCAGCAGCTGTTG-3′
P4:5′-CATCTGAACTCAAATCGTGG-3′
PCR反应体积为50μl,引物浓度为0.4μmol/L,扩增参数为94℃90s、60℃60s、72℃60s,35个循环,72℃延伸7min。各取10μl反应产物经1.5%琼脂糖凝胶电泳鉴定。
1.7 重组腺病毒的扩增与滴度检测
将重组腺病毒再感染293细胞进行扩增,收集病变细胞,在-70℃反复冻融3次,于4℃,5000r/min离心20min,取上清,用0.22μm的微孔滤器过滤,-70℃保存备用;病毒滴度检测采用空斑法[5]。
1.8 重组腺病毒感染A549细胞及TPO活性的检测
, http://www.100md.com
在对数生长期的A549细胞中加入AdCMVTPO,按20感染强度(Multiplicity of infection,MOI)感染细胞。1.5h后去除病毒液,加入新鲜培养基,48h后收集培养上清,检测TPO活性。取上清液0.5ml经皮下注射至正常Balb/c小鼠体内,每日1次,连续3d,于实验第0、3、6、9、12、15、18、25天经断尾取血检测血小板计数。以相同剂量AdCMVNull感染的A549细胞培养上清液及DMEM注射为对照。每组小鼠数量为6只。
2 结果
2.1 重组质粒酶切鉴定结果
pCA3-TPO质粒经EcoRI和XbaI酶切后获得正确大小的片段,为阳性重组子,见图2。

图2 重组质粒的酶切分析
, http://www.100md.com
Fig 2 Digestive analysis for the recombinant plasmid
Lane 1: PCR marker;Lane 2: EcoRI and XbaI digest of the recombinant plasmid;Lane 3: Plasmid pCA3
2.2 病毒空斑PCR扩增结果 经10~15 d孵育后培养皿共出现5个空斑,分别提取每个空斑的病毒DNA进行双引物PCR扩增,结果均出现2条带,分别在0.32 kb和0.86 kb处,为阳性空斑,即携带人TPO基因的重组腺病毒,见图3。

图3 病毒空斑的PCR扩增结果
Fig 3 PCR products of the adenoviral plaques
, http://www.100md.com
Lane 1: PCR marker;Lane 2~6: Positive plaques
2.3 重组腺病毒滴度测定结果
AdCMVTPO和AdCMVNull经繁殖、扩增后空斑法测定滴度分别为4.5×109pfu/ml及5.2×109pfu/ml。
2.4 重组腺病毒介导的TPO体外表达
TPO测定结果表明,感染AdCMVTPO的A549细胞培养上清注射组小鼠血小板计数于第3天开始逐渐升高,持续约两周后降至对照组水平,峰值较对照组增高约2倍,见图4,证明所制备的人TPO重组腺病毒在体外能高效表达TPO。

, 百拇医药 图4 重组腺病毒介导的人TPO体外表达活性检测
Fig 4 In vitro evaluation of the expression of human TPO mediated by the recombinant adenovirus
TPO-CM:Conditioned medium of AdCMVTPO infected cells;Null-CM:Conditioned medium of AdCMVNull infected cells
3 讨论
利用病毒具有与细胞表面受体结合并将其基因组导入宿主细胞的特性,将控制病毒复制的基因及部分病毒复制非必须基因去除后可制备成各种病毒载体。目前已开发的病毒载体主要有逆转录病毒载体、腺病毒载体、腺伴随病毒载体、单纯疱疹病毒载体等,其中,以逆转录病毒载体及腺病毒载体最常用。由于逆转录病毒载体能携带外源基因整合进靶细胞的基因组内,实现目的基因的长期稳定表达,因而主要用于体外的基因治疗研究。但是,由于外源基因的插入有导致基因突变的危险,因此,具有潜在的遗传毒性。此外,逆转录病毒只能感染分裂增殖的细胞,且繁殖滴度低、性质不稳定,不能满足体内基因治疗的需要。
, http://www.100md.com
腺病毒载体具有宿主细胞广泛、可感染静止及分裂期细胞、繁殖滴度高、性质稳定、包装容量大及不整合等优点,因而成为继逆转录病毒之后被广泛应用的病毒载体,主要用于体内基因治疗研究。在本研究中,我们构建的AdCMVTPO是E1、E3区缺失的复制缺陷5型腺病毒。由于E1区基因为腺病毒复制所必需,因此需要由转化了E1区基因的包装细胞即人胚肾293细胞提供反式补偿才能复制和扩增。这种复制缺陷的重组腺病毒仍具有感染靶细胞的能力但不发生复制,因而不会直接造成靶细胞的损害。
由于腺病毒基因组较大(36kb),不便于直接进行分子克隆,因此,在构建腺病毒载体时,通常将腺病毒基因组左端制备成含E1区缺失的穿梭质粒(如本研究采用的pCA3),将目的基因插入其多克隆位点后再与含腺病毒基因组的质粒(本研究采用pBHG10)共转染至293细胞内进行同源重组。由于在pBHG10中包装信号(Ψ)缺失不能被包装成病毒[5],必须与含包装信号的pCA3重组后才能形成感染性病毒,因此,有重组病毒生成后形成的空斑大多为含有目的基因的阳性空斑。本研究中所筛选的5个空斑均为阳性,证实这种重组方法的有效性。
, http://www.100md.com
传统的重组腺病毒载体鉴定方法是通过提取腺病毒感染后产生病变的293细胞的DNA,经限制性内切酶消化鉴定[6],操作较繁琐且灵敏度较低。本研究应用PCR共扩增技术,在同一PCR体系中加入TPO基因特异性引物和腺病毒特异性引物,可迅速、准确地鉴定出阳性噬斑。重组腺病毒载体的成功构建主要取决于以下两个关键环节:①用于共转染293细胞的质粒应具有较高的纯度(超螺旋质粒占80%以上);②采用低传代的293细胞(传代数在40代以内),因为随传代数的增加,293细胞将逐渐丧失其反式补偿功能,不能为E1区缺失的腺病毒载体有效地提供E1区蛋白从而降低同源重组的效率。
血小板减少是肿瘤患者放化疗过程中的常见并发症,目前主要的治疗方法是输注血小板悬液及支持治疗。但是由于血小板寿命短及机体产生抗血小板抗体等问题,因而治疗效果不理想[7]。TPO为近年来克隆的一种造血生长因子,对巨核细胞系的增殖和血小板的生成发挥基础性的调控作用。将重组TPO用于放化疗导致的骨髓损伤可促进巨核系造血的重建。我们所制备的人TPO复制缺陷重组腺病毒体外感染人肺癌细胞株A549细胞后,转染细胞培养上清液可显著的促进正常Balb/c小鼠血小板计数升高,证明AdCMVTPO可有效的介导人TPO表达,为进一步开展放化疗损伤后造血功能重建的基因治疗研究奠定了基础。
, http://www.100md.com
重庆市应用基础研究基金资助项目
作者简介:刘林,男,35岁,主治医师,讲师,博士研究生
参考文献
1 Richard C, Mulligan. The basic science of gene therapy. Science,1993,260(5110):926
2 Bartley T D, Bogenberger J, Hunt P, et al. Identification and cloning of a megakaryocyte growth and development factor that is a ligand for the cytokin receptor Mpl. Cell,1994,77(7):1117
3 Eaton D L, de Sauvage F J. Thrombopoietin:the primary regulator of megakaryocytopoiesis and thrombopoiesis. Exp Hematol,1997,25(1):1
, 百拇医药
4 Hokom M M, Lacey D, Kinstler O B, et al. Pegglated megakaryocyte growth and development factor abrogates the lethal thrombocytopenia associated with carboplatin and irradiaton in mice. Blood,1995,86(11):4486
5 Bett A J, Haddara W, Prevec L, et al. An efficient and flexible system for construction of adenovirus vectors with inserts or deletions in early regions 1 and 3. Proc Natl Acad Sci USA,1994,91(19):8802
6 Graham F L, Prevec L. Methods for construction of adenovirus vectors. Mol Biotechnol,1995,3(3):207
7 Lok S, Foster D C. The structure, biology and potential therapeutic applications of recombinant thrombopoietin. Stem Cells,1994,12(5):586
(收稿:1999-02-03;修回:1999-04-07), http://www.100md.com