选择素及其和某些病理变化的关系
作者:李保护
单位:李保护(北京邮电总医院健康中心 邮政编码 100032)
关键词:
选择素是近年来发现的细胞粘附分子中的一个家族 选择素是近年来发现的细胞粘附分子中的一个家族,其成员有L-选择素、P-选择素和E-选择素。随着分子生物学的进展,选择素的结构、生化功能逐步为人们所认识,现做简要概括。
一、选择素的发现与命名
1989年以来,选择素的研究者们各自独立研究了淋巴细胞、血小板和内皮细胞上发现的细胞表面糖蛋白,当时把这三种细胞上发现的膜糖蛋白分别称为:鼠淋巴结归巢受体;血小板激活依赖颗粒外膜蛋白;内皮细胞粘附分子-1。这些膜蛋白结构的共同点是N端有类植物凝血素样区,上皮生长因子区和补体蛋白重复(附图)。在命名时强调了凝血素样区的存在,同时强调了这些蛋白分子表达和功能的选择性[1],于是把最先在哪种细胞上得到证明的细胞膜蛋白,分别在选择素前冠以该种细胞的英文字头,如鼠淋巴结归巢受体称为L-选择素(lymphocyte),血小板细胞血小板激活依赖颗粒外膜蛋白称为P-选择素(platelet),内皮细胞吸附因子-1称为E-选择素(endothelium)。
, http://www.100md.com
二、选择素的结构与功能
三种选择素结构上的相似性已如上述,对其进行基因分析,其DNA基因都在人或鼠的第一对染色体的长臂上[2],其氨基酸序列的共同点均为糖基化单链膜蛋白。糖链以N键与蛋白相接,选择素以N键为末端,依次为植物凝血素样区(lectin-like domain),表皮生长因子样区(epidemal growth factor domain),2~9个补体调节蛋白重复区(complement regulating protein repeat domain),疏水跨味区(transmembrane domain)和一个胞浆短尾(short cytoplasmic tail)[3]。选择素在核苷酸和蛋白水平有40%~60%是同源的[4],而在植物凝血素样区和表皮生长因子区60%~70%是同源的。选择素的基因紧密连在第一对染色体上,而其它补体结合蛋白(C4结合蛋白和腐蚀加速因子)和因子V的基因也在人的第一对染色体的这一部位[5],说明选择素家族源于基因复制。其植物凝血素样区和C型植物凝血素(PHA)、甘露糖结合蛋白等同源,该区可能为选择素与配体结合及参与细胞间选择素粘附的部位。
, 百拇医药
L-选择素是Mever首先在小鼠淋巴细胞上发现的,称为归巢受体(homing receptor),后来发现其不仅在淋巴细胞上表达,而且在多数嗜中性粒细胞和单核细胞上都有表达,它是由324个氨基酸残基构成的,在补体调节蛋白区有两个相同蛋白重复,其分子量因在不同种细胞表达而异,这种差异可能为翻译后糖基化造成的[6]。L-选择素介导白细胞向炎症部位移动,与血管内皮细胞粘附,这种粘附作用可被其单克隆抗体所抑制。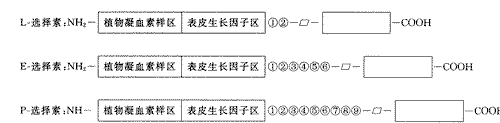
附图 三种选择素的结构
E-选择素最初是在培养的人脐静脉内皮细胞在IL-1刺激后产生,亦称为内皮细胞吸附因子-1,其在补体调节蛋白区有6个补体调节蛋白重复,是由589个氨基酸残基构成的,分子量为115KD,只在内皮细胞上表达。E-选择素的表达受细胞活素、凝血酶、LPS、多肌苷酸、肿瘤坏死因子等炎症介质调节,它可使激活的内皮细胞和中性多形核细胞、单核细胞、淋巴细胞粘附。
, http://www.100md.com
P-选择素最先被证明是在激活的血小板上表达的,后来发现也在内皮细胞上表达,是由789个氨基酸残基构成的,在补体调节蛋白区,有9个补体蛋白重复。P-选择素有两种变异型,一种缺乏第七个蛋白外显子,是膜性的[7],另一种缺乏跨膜区外显子,是可溶性的,这种可溶P-选择素可能是血栓形成有价值的标志物[8]。P-选择素在内皮细胞和血小板合成,分别存于血小板的α-颗粒和内皮细胞的Wiebed-palade小体中,当细胞受凝血酶、组织胺、佛波醇酯等的刺激使内皮激活时,α-颗粒和Wiebed-palade小体迅速与细胞膜融合,从而使P-选择素在细胞膜上表达[9],继而在炎症和血栓形成中发挥作用。综上所述,三种选择素不仅在结构和生化功能上有共同点,同时也有诸多差别,它们不仅在不同种类细胞上表达,而且表达时间的早晚及表达持续的时间不同,但都是和发挥粘附作用相关的。
三、选择素配体
由于选择素含有植物凝血素样区,促使人们不断寻找其配体,后经证实,选择素之所以能发挥作用主要靠其与配体结合,而这种结合是钙依赖性的。大部分配体为细胞表面糖结构,包括:①唾液酸、岩藻糖类单糖如SLex、SLea等及其相关低聚糖,其共同特点为都含有Ⅰ型或Ⅱ型乳糖胺结构[10],这种乳糖胺广泛存在于中性粒细胞、单核细胞和自然杀伤细胞上[11,12]。外周血T和B淋巴细胞上正常情况下不表达SLex,而一旦被激活,也可表达SLex,E-、P-和L-选择素都可识别和结合SLex。应当指出SLea是SLex的异构体,其不被白细胞表达,而被某种肿瘤细胞表达,提示SLea可能和肿瘤转移有关。②磷酸化单糖或多糖如PPME(phosphomannan)和6-磷酸甘露糖等。③硫酸化多糖如岩藻糖(fucoidan)、肝素及脑硫脂(sulfatides)等,虽然糖-凝血素结合对发挥细胞粘附作用是重要的,但某些蛋白也参与它们的粘附作用[13],例如L-选择素本身就是E-选择素的配体,而且蛋白的参与使得凝血素-糖的结合更加牢固,故有人指出按糖为配体分类有失恰当,因为糖结构往往以蛋白形式存在。
, 百拇医药
四、选择素和其它病理变化的关系
1.和炎症或免疫的关系:血流中的白细胞向炎症部位聚集是炎症的基本变化,一般认为血流中的白细胞向炎症部位移动遵循下列规律,首先炎症部位血管内皮细胞激活而表达P-选择素,继而P-选择素与白细胞相应配体结合,从而使随机运动的白细胞在切应力作用下,沿炎症附近血管内皮滚动、爬行,并寻找出口,而后随白细胞激活和整合素的作用,白细胞变平,而后在内皮细胞间隙移向内皮下组织[14]。由此可见,炎症初期选择素发挥着重要作用。
2.与动脉粥样硬化的关系:动脉内膜下白细胞聚集是动脉粥样硬化的基本要素,而参与这一过程的不仅有ICAM-1和VCAM-1,而且还有选择素。有人通过泡沫细胞形成过程中的基因表达来了解动脉粥样硬化的分子基础。他们用PCR技术[15],在乙酰化或氧化LDL存在的情况下,培养由单核细胞衍生的巨噬细胞而诱生泡沫细胞,分离不同表达的基因发现306-6bp DNA与岩藻糖转移酶Ⅳ百分之百同源,此酶分别被载有乙酰化和氧化LDL巨噬细胞20和3因子下调,而此酶充分表达Lewisx和Sial Lewisx(选择素配体),能合成Sial Lewisx的第二种岩藻糖转移酶,通过转录PCR,也被载为乙酰化或氧化LDL的巨噬细胞降低40%和20%。1.3岩藻糖转移酶活性,在载有乙酰化和氧化LDL巨噬细胞的溶解物中也降低,通过血流细胞计数分析表明,在载有乙酰化或氧化LDL的巨噬细胞表面CD15(相当于Lewisx)和CD15S(相当于sial lewisx)抗原表达降低,证明巨噬细胞转变成泡沫细胞,使这些细胞表面结合选择素的配体减少,证实选择素参与了这一过程。
, 百拇医药
目前的研究证实,大多数粥样斑块周围有来自血管外膜滋养层的新生血管,而这些新生血管的存在,为血浆蛋白、白细胞、巨噬细胞向斑块补充提供了有效途径,因此选择素不仅参与了泡沫细胞的形成,而且也参与了斑块的扩大和发展。有人观测到不稳定心绞痛,由于冠脉痉挛产生凝血酶,诱导P-选择素表达,使血小板-白细胞和内皮细胞与白细胞粘附作用增强,促进了血栓的形成。
3.选择素和肿瘤转移的关系:肿瘤转移是一个十分复杂的过程,Stone在研究了癌细胞与激活的血小板和内皮细胞粘附后发现,两种肺癌细胞株和神经母细胞瘤细胞株均可以与激活血小板结合,这种结合也是由P-选择素诱导的,同时也可被P-选择素单抗所抑制,P-选择素的脂质体,也可与多种癌组织相结合。应当指出肿瘤细胞在血液循环中与血小板粘附,可使癌细胞在转移过程中免于被吞噬细胞消灭[16]。
另外肿瘤细胞表面抗原如SLea,在肿瘤转移中也起重要作用。内皮细胞、血小板的选择素通过识别肿瘤细胞上的相应配体而起中介作用。结肠癌在转移癌细胞中Lewis抗原(SLea)明显升高,同时肿瘤细胞可产生IL-1和TNF等细胞因子,后者可使肿瘤患者内皮细胞表达选择素,从而加速肿瘤转移。
, 百拇医药
应当说,选择素的研究取得了很大的进展,但仍然是初步的,虽然它在血栓形成、肿瘤转移和免疫中的作用已初见端倪,但很多问题需要研究。随着选择素研究的深入,将逐步为临床治疗提供新的治疗手段。■
参考文献:
[1]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:379.
[2]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:380.
[3]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:379.
[4]Lacky LA.Selectin: interpreters of cell specified carbohydrate information during inflammation.Science,1992,258:964.
, 百拇医药
[5]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2068.
[6]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2070.
[7]陈金联,吴云林.选择素与肿瘤转移机制.肿瘤,1996,16:54.
[8]Febreqa E,Casagont F,Merino J,et al.Value of plasma P-selectin for vascular complication in liver transplantation.Clintransplatation,1996,10:261.
[9]Stone JP,Wagner DD.P-selectin mediate adhesion of platelet to neuroblastion and cancer cell.J Clin Invest,1993,92:804.
, 百拇医药
[10]Ajit V.Selectin ligand.Proc Nofi Acad Sci,1994,91:7390.
[11]Qhmosi K,Yoneda T,Ishihara,et al.Sialyl SSEA-1 antigen as carbohydrate marker on human nature killer cell and immature lymphoid cell.Blood,1989,74:255.
[12]Pinoala M.Characteration of E-selectin ligand on NK cell.J Immunol,1994,152:3586.
[13]Bevilaepua MP,Nelson RM.Slectin.J Clin Invest,1993,91:379.
, 百拇医药
[14]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2082.
[15]Cullen.Bownregulation of selectin ligand-producing faco-syltransqerase,Fuc-Tiv and Fuc IvⅡ during foam cell formation in monocyte-dericed macrophages.Throm Vasc Biol,1997,17:8.
[16]Aelbelda SM.Biology of disease yole of integrin and other cell adhesion melocules in tumour progression and melastasis.Lab Invest,1993,14:99.
收稿日期:1997-07-07 修回日期:1999-08-06, 百拇医药
单位:李保护(北京邮电总医院健康中心 邮政编码 100032)
关键词:
选择素是近年来发现的细胞粘附分子中的一个家族 选择素是近年来发现的细胞粘附分子中的一个家族,其成员有L-选择素、P-选择素和E-选择素。随着分子生物学的进展,选择素的结构、生化功能逐步为人们所认识,现做简要概括。
一、选择素的发现与命名
1989年以来,选择素的研究者们各自独立研究了淋巴细胞、血小板和内皮细胞上发现的细胞表面糖蛋白,当时把这三种细胞上发现的膜糖蛋白分别称为:鼠淋巴结归巢受体;血小板激活依赖颗粒外膜蛋白;内皮细胞粘附分子-1。这些膜蛋白结构的共同点是N端有类植物凝血素样区,上皮生长因子区和补体蛋白重复(附图)。在命名时强调了凝血素样区的存在,同时强调了这些蛋白分子表达和功能的选择性[1],于是把最先在哪种细胞上得到证明的细胞膜蛋白,分别在选择素前冠以该种细胞的英文字头,如鼠淋巴结归巢受体称为L-选择素(lymphocyte),血小板细胞血小板激活依赖颗粒外膜蛋白称为P-选择素(platelet),内皮细胞吸附因子-1称为E-选择素(endothelium)。
, http://www.100md.com
二、选择素的结构与功能
三种选择素结构上的相似性已如上述,对其进行基因分析,其DNA基因都在人或鼠的第一对染色体的长臂上[2],其氨基酸序列的共同点均为糖基化单链膜蛋白。糖链以N键与蛋白相接,选择素以N键为末端,依次为植物凝血素样区(lectin-like domain),表皮生长因子样区(epidemal growth factor domain),2~9个补体调节蛋白重复区(complement regulating protein repeat domain),疏水跨味区(transmembrane domain)和一个胞浆短尾(short cytoplasmic tail)[3]。选择素在核苷酸和蛋白水平有40%~60%是同源的[4],而在植物凝血素样区和表皮生长因子区60%~70%是同源的。选择素的基因紧密连在第一对染色体上,而其它补体结合蛋白(C4结合蛋白和腐蚀加速因子)和因子V的基因也在人的第一对染色体的这一部位[5],说明选择素家族源于基因复制。其植物凝血素样区和C型植物凝血素(PHA)、甘露糖结合蛋白等同源,该区可能为选择素与配体结合及参与细胞间选择素粘附的部位。
, 百拇医药
L-选择素是Mever首先在小鼠淋巴细胞上发现的,称为归巢受体(homing receptor),后来发现其不仅在淋巴细胞上表达,而且在多数嗜中性粒细胞和单核细胞上都有表达,它是由324个氨基酸残基构成的,在补体调节蛋白区有两个相同蛋白重复,其分子量因在不同种细胞表达而异,这种差异可能为翻译后糖基化造成的[6]。L-选择素介导白细胞向炎症部位移动,与血管内皮细胞粘附,这种粘附作用可被其单克隆抗体所抑制。

附图 三种选择素的结构
E-选择素最初是在培养的人脐静脉内皮细胞在IL-1刺激后产生,亦称为内皮细胞吸附因子-1,其在补体调节蛋白区有6个补体调节蛋白重复,是由589个氨基酸残基构成的,分子量为115KD,只在内皮细胞上表达。E-选择素的表达受细胞活素、凝血酶、LPS、多肌苷酸、肿瘤坏死因子等炎症介质调节,它可使激活的内皮细胞和中性多形核细胞、单核细胞、淋巴细胞粘附。
, http://www.100md.com
P-选择素最先被证明是在激活的血小板上表达的,后来发现也在内皮细胞上表达,是由789个氨基酸残基构成的,在补体调节蛋白区,有9个补体蛋白重复。P-选择素有两种变异型,一种缺乏第七个蛋白外显子,是膜性的[7],另一种缺乏跨膜区外显子,是可溶性的,这种可溶P-选择素可能是血栓形成有价值的标志物[8]。P-选择素在内皮细胞和血小板合成,分别存于血小板的α-颗粒和内皮细胞的Wiebed-palade小体中,当细胞受凝血酶、组织胺、佛波醇酯等的刺激使内皮激活时,α-颗粒和Wiebed-palade小体迅速与细胞膜融合,从而使P-选择素在细胞膜上表达[9],继而在炎症和血栓形成中发挥作用。综上所述,三种选择素不仅在结构和生化功能上有共同点,同时也有诸多差别,它们不仅在不同种类细胞上表达,而且表达时间的早晚及表达持续的时间不同,但都是和发挥粘附作用相关的。
三、选择素配体
由于选择素含有植物凝血素样区,促使人们不断寻找其配体,后经证实,选择素之所以能发挥作用主要靠其与配体结合,而这种结合是钙依赖性的。大部分配体为细胞表面糖结构,包括:①唾液酸、岩藻糖类单糖如SLex、SLea等及其相关低聚糖,其共同特点为都含有Ⅰ型或Ⅱ型乳糖胺结构[10],这种乳糖胺广泛存在于中性粒细胞、单核细胞和自然杀伤细胞上[11,12]。外周血T和B淋巴细胞上正常情况下不表达SLex,而一旦被激活,也可表达SLex,E-、P-和L-选择素都可识别和结合SLex。应当指出SLea是SLex的异构体,其不被白细胞表达,而被某种肿瘤细胞表达,提示SLea可能和肿瘤转移有关。②磷酸化单糖或多糖如PPME(phosphomannan)和6-磷酸甘露糖等。③硫酸化多糖如岩藻糖(fucoidan)、肝素及脑硫脂(sulfatides)等,虽然糖-凝血素结合对发挥细胞粘附作用是重要的,但某些蛋白也参与它们的粘附作用[13],例如L-选择素本身就是E-选择素的配体,而且蛋白的参与使得凝血素-糖的结合更加牢固,故有人指出按糖为配体分类有失恰当,因为糖结构往往以蛋白形式存在。
, 百拇医药
四、选择素和其它病理变化的关系
1.和炎症或免疫的关系:血流中的白细胞向炎症部位聚集是炎症的基本变化,一般认为血流中的白细胞向炎症部位移动遵循下列规律,首先炎症部位血管内皮细胞激活而表达P-选择素,继而P-选择素与白细胞相应配体结合,从而使随机运动的白细胞在切应力作用下,沿炎症附近血管内皮滚动、爬行,并寻找出口,而后随白细胞激活和整合素的作用,白细胞变平,而后在内皮细胞间隙移向内皮下组织[14]。由此可见,炎症初期选择素发挥着重要作用。
2.与动脉粥样硬化的关系:动脉内膜下白细胞聚集是动脉粥样硬化的基本要素,而参与这一过程的不仅有ICAM-1和VCAM-1,而且还有选择素。有人通过泡沫细胞形成过程中的基因表达来了解动脉粥样硬化的分子基础。他们用PCR技术[15],在乙酰化或氧化LDL存在的情况下,培养由单核细胞衍生的巨噬细胞而诱生泡沫细胞,分离不同表达的基因发现306-6bp DNA与岩藻糖转移酶Ⅳ百分之百同源,此酶分别被载有乙酰化和氧化LDL巨噬细胞20和3因子下调,而此酶充分表达Lewisx和Sial Lewisx(选择素配体),能合成Sial Lewisx的第二种岩藻糖转移酶,通过转录PCR,也被载为乙酰化或氧化LDL的巨噬细胞降低40%和20%。1.3岩藻糖转移酶活性,在载有乙酰化和氧化LDL巨噬细胞的溶解物中也降低,通过血流细胞计数分析表明,在载有乙酰化或氧化LDL的巨噬细胞表面CD15(相当于Lewisx)和CD15S(相当于sial lewisx)抗原表达降低,证明巨噬细胞转变成泡沫细胞,使这些细胞表面结合选择素的配体减少,证实选择素参与了这一过程。
, 百拇医药
目前的研究证实,大多数粥样斑块周围有来自血管外膜滋养层的新生血管,而这些新生血管的存在,为血浆蛋白、白细胞、巨噬细胞向斑块补充提供了有效途径,因此选择素不仅参与了泡沫细胞的形成,而且也参与了斑块的扩大和发展。有人观测到不稳定心绞痛,由于冠脉痉挛产生凝血酶,诱导P-选择素表达,使血小板-白细胞和内皮细胞与白细胞粘附作用增强,促进了血栓的形成。
3.选择素和肿瘤转移的关系:肿瘤转移是一个十分复杂的过程,Stone在研究了癌细胞与激活的血小板和内皮细胞粘附后发现,两种肺癌细胞株和神经母细胞瘤细胞株均可以与激活血小板结合,这种结合也是由P-选择素诱导的,同时也可被P-选择素单抗所抑制,P-选择素的脂质体,也可与多种癌组织相结合。应当指出肿瘤细胞在血液循环中与血小板粘附,可使癌细胞在转移过程中免于被吞噬细胞消灭[16]。
另外肿瘤细胞表面抗原如SLea,在肿瘤转移中也起重要作用。内皮细胞、血小板的选择素通过识别肿瘤细胞上的相应配体而起中介作用。结肠癌在转移癌细胞中Lewis抗原(SLea)明显升高,同时肿瘤细胞可产生IL-1和TNF等细胞因子,后者可使肿瘤患者内皮细胞表达选择素,从而加速肿瘤转移。
, 百拇医药
应当说,选择素的研究取得了很大的进展,但仍然是初步的,虽然它在血栓形成、肿瘤转移和免疫中的作用已初见端倪,但很多问题需要研究。随着选择素研究的深入,将逐步为临床治疗提供新的治疗手段。■
参考文献:
[1]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:379.
[2]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:380.
[3]Bevilaequa MP,Nelson RM.Selectin.J Clin Invest,1993,91:379.
[4]Lacky LA.Selectin: interpreters of cell specified carbohydrate information during inflammation.Science,1992,258:964.
, 百拇医药
[5]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2068.
[6]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2070.
[7]陈金联,吴云林.选择素与肿瘤转移机制.肿瘤,1996,16:54.
[8]Febreqa E,Casagont F,Merino J,et al.Value of plasma P-selectin for vascular complication in liver transplantation.Clintransplatation,1996,10:261.
[9]Stone JP,Wagner DD.P-selectin mediate adhesion of platelet to neuroblastion and cancer cell.J Clin Invest,1993,92:804.
, 百拇医药
[10]Ajit V.Selectin ligand.Proc Nofi Acad Sci,1994,91:7390.
[11]Qhmosi K,Yoneda T,Ishihara,et al.Sialyl SSEA-1 antigen as carbohydrate marker on human nature killer cell and immature lymphoid cell.Blood,1989,74:255.
[12]Pinoala M.Characteration of E-selectin ligand on NK cell.J Immunol,1994,152:3586.
[13]Bevilaepua MP,Nelson RM.Slectin.J Clin Invest,1993,91:379.
, 百拇医药
[14]Carlos TM,Harlan JM.Leukocyte-endothelium adhesion molecules.Blood,1994,84:2082.
[15]Cullen.Bownregulation of selectin ligand-producing faco-syltransqerase,Fuc-Tiv and Fuc IvⅡ during foam cell formation in monocyte-dericed macrophages.Throm Vasc Biol,1997,17:8.
[16]Aelbelda SM.Biology of disease yole of integrin and other cell adhesion melocules in tumour progression and melastasis.Lab Invest,1993,14:99.
收稿日期:1997-07-07 修回日期:1999-08-06, 百拇医药