去甲硫氨酸全肠外营养抗癌作用的实验研究
作者:校宏兵,曹伟新,尹浩然,林言箴,叶世会
单位:校宏兵,叶世会 上海铁道大学附属铁路医院外科(上海,200072);曹伟新,尹浩然,林言箴 上海第二医科大学附属瑞金医院外科
关键词:去甲硫氨酸;肠外营养
癌症990632 中图分类:R73-36 文献标识码:A
文章编号:1000-467X(1999)06-0731-02
本文自制去除甲硫氨酸(Met)的复合氨基酸溶液,作为完全胃肠外营养Total parenteral nutrition(TPN)的唯一氮源,对甲基硝基亚硝基胍(MNNG)诱发的胃癌大鼠进行实验研究,观察去甲硫氨酸全肠外营养(-MetTPN)的抗癌作用及其机制。
, 百拇医药 1对象与方法
1.1动物与分组
MNNG自由饮水法诱发胃癌的雄性Wistar大鼠,经剖胃探查,肿瘤直径大于8mm,活检病理证实为胃癌者23只,随机分为实验组[去甲硫氨酸全肠外营养组(n=12),-MetTPN]和对照组[含甲硫氨酸全肠外营养组(n=11),+MetTPN]。每组随机抽取5只,于TPN7天后处死,采取标本作相应指标检测。其余大鼠在TPN7天后改行普通饲喂,分笼饲养直至死亡,观察生存时间。
1.2营养液的组成与输注
全合一营养液由葡萄糖、脂肪乳剂和氨基酸溶液组成。对照组选用含Met氨基酸溶液(氨复命11S注射液),实验组去除其中Met。非蛋白热卡170Kcal.kg-1.d-1,葡萄糖∶脂肪=10∶7。实验组和对照组用氮分别为1.03g-1.kg.d-1和1.30g.kg-1.d-1。营养液经上腔静脉插管24小时连续输注,持续7天。
, 百拇医药
1.3标本的采取和测定
每组随机抽取5只大鼠,于TPN前及处死日分别称量体重、剖胃测肿瘤直径[肿瘤直径=(肿瘤最大径+肿瘤最小径)/2]、活检取肿瘤组织作流式细胞仪(Flow Cytometry,FCM)测定肿瘤细胞DNA含量,作细胞周期分析。于处死前抽血,测血清游离氨基酸谱(HPLC法)。处死后整块切除胃癌组织,同时取心、肺、肝、肾组织各一小块,观察病理组织学变化。
1.4生存期观察
其余大鼠于TPN7天后移入普通鼠笼,分笼给予颗粒饲料喂养,直至死亡,记录生存时间,作尸检。
1.5统计学方法
计量资料选用配对t检验和团体t检验;生存期选用时序检验。以P<0.05(双侧)为显著。
, 百拇医药 2结果
2.1大鼠体重、肿瘤体积和肿瘤细胞DNA含量改变
两组大鼠体重和肿瘤细胞DNA含量在治疗前后均未见明显改变。实验组治疗后肿瘤显著缩小,对照组明显增大(表1)。
表1 TPN前后大鼠体重、肿瘤直径和肿瘤细胞DNA指数改变(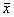 ±s)
±s)
组别
体重(g)
P
肿瘤平均直径(mm)
P
, http://www.100md.com DNA含量(DI)
P
TPN前
TPN后
TPN前
TPN后
TPN前
TPN后
对照组(n=5)
241.8±19.8
243.2±20.4
>0.05
11.2±1.0
, 百拇医药
14.7±0.7
<0.01
1.13±0.24
1.21±0.26
>0.05
实验组(n=5)
248.2±20.0
244.6±17.9
>0.05
11.5±1.2
6.9±0.8
<0.05
, 百拇医药
1.15±0.21
1.12±0.23
>0.05
P
>0.05
>0.05
>0.05
<0.005
>0.05
>0.05
2.2肿瘤细胞周期分析
治疗后两组大鼠肿瘤细胞DNA合成期(S期)比例均增高,实验组更为显著。DNA合成后期及有丝分裂期(G2M期)变化迥异:对照组肿瘤细胞G2M期比例与S期同步增高,实验组肿瘤细胞G2M期比例则显著下降,S期比例明显增高;两组DNA合成前期及静止期(G0/G1期)比例均显著下降(表2)。
, 百拇医药
表2 肿瘤细胞周期改变(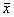 ±s)
±s)
组别
S期(%)
P
G2M期
P
G0G1期(%)
P
TPN前
TPN后
TPN前
, 百拇医药
TPN后
TPN前
TPN后
对照组(n=5)
6.2±1.2
10.3±1.4
<0.005
10.5±1.1
16.6±1.4
<0.05
83.4±1.9
73.1±1.8
, 百拇医药
<0.005
实验组(n=5)
6.4±1.0
28.5±1.0
<0.05
11.2±1.1
8.3±1.5
82.4±0.9
63.2±5.5
<0.05
P
>0.05
, 百拇医药
>0.05
>0.05
<0.005
>0.05
>0.05
2.3血清游离氨基酸(FAA)谱改变
实验组大鼠血清游离Met、胱氨酸(Cys)浓度从79.2±5.5μmol/L、92.3±3.7μmol/L下降至12.3±2.1μmol/L、44.4±2.8μmol/L(P<0.001),天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)等浓度从38.2±6.2μmol/L、25.6±4.1μmol/L、146.3±18.9μmol/L增高至87.3±12.1μmol/L、181.4±23.6μmol/L、228.9±31.5μmol/L,(P<0.05)。
, http://www.100md.com
2.4病理组织学检查结果
对照组大鼠治疗前后肿瘤组织病理学检查未见明显改变。实验组大鼠治疗后肿瘤组织坏死灶增多,肿瘤细胞核仁增大、增粗,肝细胞核亦见核仁增大。两组心肺肾未见病理组织学异常。
2.5生存期观察结果
荷瘤大鼠最终多死于肿瘤转移和全身衰竭,对照组平均生存18.6天(P<0.05),实验组大鼠腹腔和肝脏转移灶明显减少,平均生存期31天。
3讨论
作者自制抽除Met的不平衡氨基酸溶液,以此作为TPN的唯一氮源,经TPN7d后,胃癌大鼠血浆游离Met明显下降,造成肿瘤细胞的“Met饥饿”。其配方成份确定,摄入量亦可精确控制。显然,这将不可避免地引起荷瘤宿主血清氨基酸谱紊乱,体重和血浆蛋白的下降等。但本组大鼠未见明显的体重下降,这可能与大鼠经过长时间的MNNG诱癌,且所选均为肿瘤较大,多数已存在不同程度的营养不良有关;此外,我们选用了葡萄糖和脂肪双能源而非单一葡萄糖能源,亦可能延缓了营养不良的进程。本组肿瘤在-MetTPN治疗后明显缩小;病理组织学检查可见肿瘤组织内坏死灶明显增多,肿瘤细胞核仁增大、增粗;细胞周期分析发现,-MetTPN组肿瘤细胞S期细胞比例显著增高,G0/G1期和G2M期细胞比例显著下降;显示肿瘤细胞从S期到G2M期的过程受阻;RNA转录过程,尤其是rRNA和mRNA进入胞浆的过程受到干扰。这与病理组织学所见肿瘤细胞核仁增大、增粗的结果相吻合。+MetTPN组肿瘤细胞S期和G2M期细胞比例同步升高,G0/G1期细胞比例下降,乃因平衡TPN刺激肿瘤细胞增殖,G0/G1期细胞进入S和G2M期增多所致。
, http://www.100md.com
Hoffman〔3〕等应用图象分析法,对经Met-Hcy+培养的SV-40转化人纤维母细胞进行细胞周期分析,发现该细胞被可逆性地阻滞于S/G2期,进一步研究发现,在缺乏Met的环境中,肿瘤细胞内游离Met极度下降,使原本因为活跃的甲基化反应已经下降的S-腺苷甲硫氨酸(AdoMet)更形减少,AdoMet:AdoHcy(S-腺苷同型半胱氨酸)比值下降,直接对细胞甲基转移酶产生抑制,使细胞分裂过程中至为重要的甲基化反应不能进行,包括DNA合成后期的维持甲基化过程受阻。当细胞重新进入含Met环境时,DNA维持甲基化得以进行,细胞周期又可进行循环。这种细胞周期可逆性的阻滞为周期特异性化疗和序贯化疗指出了应用前景。Usami〔4〕等应用5-溴脱氧脲嘧啶核苷掺入法,经FCM对Met-培养6小时的AH109腹水型肝细胞癌和SLC肺癌细胞、以及MetTPN7d的AH109和SLC荷瘤大鼠肿瘤细胞作细胞周期分析,结果与本文有异,其S期比例下降而G0/G1期比例升高。显然,方法学的差异可以导致结果的不同,但MetTPN对肿瘤细胞动力学和肿瘤生长确具干扰和抑制作用。
, 百拇医药
我们在实验中观察到,经-MetTPN治疗后,荷瘤大鼠生存期显著延长,尸检发现腹腔和肝脏肿瘤转移灶明显减少。即-MetTPN在抑制原发肿瘤生长的同时,对肿瘤细胞的转移能力亦产生明显的抑制作用。Breillout〔5〕等报道,-MetTPN抑制Lewis肺癌的转移和横纹肌肉瘤在动物体内的植入。该作者推测由-MetTPN引起的肿瘤细胞“Met饥饿”,干扰了肿瘤细胞DNA和生物膜磷脂的甲基化,其转移能力受抑。甚至有作者认为,-MetTPN对肿瘤细胞转移能力的抑制作用,比对原发肿瘤增殖的抑制更强,对此尚需作进一步的研究。
基金项目:本课题受国家自然基金(批准号:39370780)资助
〔参考文献〕
〔1〕Chello PL,Bertino JR. Effect of me-thionine deprivation on L5178 murine leukemia cells in culture. Interfe-rence with the antineoplastic effect of methotrexate〔J〕.Biochem Pharmac,1976,25:889~892.
, 百拇医药
〔2〕Breillout F,Antoine E,Poupon MF. Methionine dependency of maligna-nttumors: a possible approach for therapy〔J〕.J Natl Cancer Inst,1990,82:1628~1632.
〔3〕Hoffmann RM,Jacobsen SJ, Erbe RW.Reversion to methionine indepe-ndence by malignant rat SV40-tra-nsformed human fibroblasts〔J〕.Bi-ochem Biophys Res Commun,1978,82:228~234.
〔4〕Usami M,Ohyanagi H,Ishimoto S,et al.Effect of methionine-deprived nutrition on cell growth and cell ki-netics in cell cultures and experi-mental tumors〔J〕. JPEN, 1991,15:540~545.
〔5〕Breillout F,Hadida F,Echinard-Grain P,et al.Decreased rat rhabdo- myosarcoma pulmonary metastasis in response to a low methionine diet〔J〕. Anticancer Reserch, 1987,7:861~868.
收稿日期:1999-06-22;修回日期:1999-07-07, 百拇医药
单位:校宏兵,叶世会 上海铁道大学附属铁路医院外科(上海,200072);曹伟新,尹浩然,林言箴 上海第二医科大学附属瑞金医院外科
关键词:去甲硫氨酸;肠外营养
癌症990632 中图分类:R73-36 文献标识码:A
文章编号:1000-467X(1999)06-0731-02
本文自制去除甲硫氨酸(Met)的复合氨基酸溶液,作为完全胃肠外营养Total parenteral nutrition(TPN)的唯一氮源,对甲基硝基亚硝基胍(MNNG)诱发的胃癌大鼠进行实验研究,观察去甲硫氨酸全肠外营养(-MetTPN)的抗癌作用及其机制。
, 百拇医药 1对象与方法
1.1动物与分组
MNNG自由饮水法诱发胃癌的雄性Wistar大鼠,经剖胃探查,肿瘤直径大于8mm,活检病理证实为胃癌者23只,随机分为实验组[去甲硫氨酸全肠外营养组(n=12),-MetTPN]和对照组[含甲硫氨酸全肠外营养组(n=11),+MetTPN]。每组随机抽取5只,于TPN7天后处死,采取标本作相应指标检测。其余大鼠在TPN7天后改行普通饲喂,分笼饲养直至死亡,观察生存时间。
1.2营养液的组成与输注
全合一营养液由葡萄糖、脂肪乳剂和氨基酸溶液组成。对照组选用含Met氨基酸溶液(氨复命11S注射液),实验组去除其中Met。非蛋白热卡170Kcal.kg-1.d-1,葡萄糖∶脂肪=10∶7。实验组和对照组用氮分别为1.03g-1.kg.d-1和1.30g.kg-1.d-1。营养液经上腔静脉插管24小时连续输注,持续7天。
, 百拇医药
1.3标本的采取和测定
每组随机抽取5只大鼠,于TPN前及处死日分别称量体重、剖胃测肿瘤直径[肿瘤直径=(肿瘤最大径+肿瘤最小径)/2]、活检取肿瘤组织作流式细胞仪(Flow Cytometry,FCM)测定肿瘤细胞DNA含量,作细胞周期分析。于处死前抽血,测血清游离氨基酸谱(HPLC法)。处死后整块切除胃癌组织,同时取心、肺、肝、肾组织各一小块,观察病理组织学变化。
1.4生存期观察
其余大鼠于TPN7天后移入普通鼠笼,分笼给予颗粒饲料喂养,直至死亡,记录生存时间,作尸检。
1.5统计学方法
计量资料选用配对t检验和团体t检验;生存期选用时序检验。以P<0.05(双侧)为显著。
, 百拇医药 2结果
2.1大鼠体重、肿瘤体积和肿瘤细胞DNA含量改变
两组大鼠体重和肿瘤细胞DNA含量在治疗前后均未见明显改变。实验组治疗后肿瘤显著缩小,对照组明显增大(表1)。
表1 TPN前后大鼠体重、肿瘤直径和肿瘤细胞DNA指数改变(
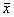 ±s)
±s)组别
体重(g)
P
肿瘤平均直径(mm)
P
, http://www.100md.com DNA含量(DI)
P
TPN前
TPN后
TPN前
TPN后
TPN前
TPN后
对照组(n=5)
241.8±19.8
243.2±20.4
>0.05
11.2±1.0
, 百拇医药
14.7±0.7
<0.01
1.13±0.24
1.21±0.26
>0.05
实验组(n=5)
248.2±20.0
244.6±17.9
>0.05
11.5±1.2
6.9±0.8
<0.05
, 百拇医药
1.15±0.21
1.12±0.23
>0.05
P
>0.05
>0.05
>0.05
<0.005
>0.05
>0.05
2.2肿瘤细胞周期分析
治疗后两组大鼠肿瘤细胞DNA合成期(S期)比例均增高,实验组更为显著。DNA合成后期及有丝分裂期(G2M期)变化迥异:对照组肿瘤细胞G2M期比例与S期同步增高,实验组肿瘤细胞G2M期比例则显著下降,S期比例明显增高;两组DNA合成前期及静止期(G0/G1期)比例均显著下降(表2)。
, 百拇医药
表2 肿瘤细胞周期改变(
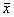 ±s)
±s)组别
S期(%)
P
G2M期
P
G0G1期(%)
P
TPN前
TPN后
TPN前
, 百拇医药
TPN后
TPN前
TPN后
对照组(n=5)
6.2±1.2
10.3±1.4
<0.005
10.5±1.1
16.6±1.4
<0.05
83.4±1.9
73.1±1.8
, 百拇医药
<0.005
实验组(n=5)
6.4±1.0
28.5±1.0
<0.05
11.2±1.1
8.3±1.5
82.4±0.9
63.2±5.5
<0.05
P
>0.05
, 百拇医药
>0.05
>0.05
<0.005
>0.05
>0.05
2.3血清游离氨基酸(FAA)谱改变
实验组大鼠血清游离Met、胱氨酸(Cys)浓度从79.2±5.5μmol/L、92.3±3.7μmol/L下降至12.3±2.1μmol/L、44.4±2.8μmol/L(P<0.001),天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)等浓度从38.2±6.2μmol/L、25.6±4.1μmol/L、146.3±18.9μmol/L增高至87.3±12.1μmol/L、181.4±23.6μmol/L、228.9±31.5μmol/L,(P<0.05)。
, http://www.100md.com
2.4病理组织学检查结果
对照组大鼠治疗前后肿瘤组织病理学检查未见明显改变。实验组大鼠治疗后肿瘤组织坏死灶增多,肿瘤细胞核仁增大、增粗,肝细胞核亦见核仁增大。两组心肺肾未见病理组织学异常。
2.5生存期观察结果
荷瘤大鼠最终多死于肿瘤转移和全身衰竭,对照组平均生存18.6天(P<0.05),实验组大鼠腹腔和肝脏转移灶明显减少,平均生存期31天。
3讨论
作者自制抽除Met的不平衡氨基酸溶液,以此作为TPN的唯一氮源,经TPN7d后,胃癌大鼠血浆游离Met明显下降,造成肿瘤细胞的“Met饥饿”。其配方成份确定,摄入量亦可精确控制。显然,这将不可避免地引起荷瘤宿主血清氨基酸谱紊乱,体重和血浆蛋白的下降等。但本组大鼠未见明显的体重下降,这可能与大鼠经过长时间的MNNG诱癌,且所选均为肿瘤较大,多数已存在不同程度的营养不良有关;此外,我们选用了葡萄糖和脂肪双能源而非单一葡萄糖能源,亦可能延缓了营养不良的进程。本组肿瘤在-MetTPN治疗后明显缩小;病理组织学检查可见肿瘤组织内坏死灶明显增多,肿瘤细胞核仁增大、增粗;细胞周期分析发现,-MetTPN组肿瘤细胞S期细胞比例显著增高,G0/G1期和G2M期细胞比例显著下降;显示肿瘤细胞从S期到G2M期的过程受阻;RNA转录过程,尤其是rRNA和mRNA进入胞浆的过程受到干扰。这与病理组织学所见肿瘤细胞核仁增大、增粗的结果相吻合。+MetTPN组肿瘤细胞S期和G2M期细胞比例同步升高,G0/G1期细胞比例下降,乃因平衡TPN刺激肿瘤细胞增殖,G0/G1期细胞进入S和G2M期增多所致。
, http://www.100md.com
Hoffman〔3〕等应用图象分析法,对经Met-Hcy+培养的SV-40转化人纤维母细胞进行细胞周期分析,发现该细胞被可逆性地阻滞于S/G2期,进一步研究发现,在缺乏Met的环境中,肿瘤细胞内游离Met极度下降,使原本因为活跃的甲基化反应已经下降的S-腺苷甲硫氨酸(AdoMet)更形减少,AdoMet:AdoHcy(S-腺苷同型半胱氨酸)比值下降,直接对细胞甲基转移酶产生抑制,使细胞分裂过程中至为重要的甲基化反应不能进行,包括DNA合成后期的维持甲基化过程受阻。当细胞重新进入含Met环境时,DNA维持甲基化得以进行,细胞周期又可进行循环。这种细胞周期可逆性的阻滞为周期特异性化疗和序贯化疗指出了应用前景。Usami〔4〕等应用5-溴脱氧脲嘧啶核苷掺入法,经FCM对Met-培养6小时的AH109腹水型肝细胞癌和SLC肺癌细胞、以及MetTPN7d的AH109和SLC荷瘤大鼠肿瘤细胞作细胞周期分析,结果与本文有异,其S期比例下降而G0/G1期比例升高。显然,方法学的差异可以导致结果的不同,但MetTPN对肿瘤细胞动力学和肿瘤生长确具干扰和抑制作用。
, 百拇医药
我们在实验中观察到,经-MetTPN治疗后,荷瘤大鼠生存期显著延长,尸检发现腹腔和肝脏肿瘤转移灶明显减少。即-MetTPN在抑制原发肿瘤生长的同时,对肿瘤细胞的转移能力亦产生明显的抑制作用。Breillout〔5〕等报道,-MetTPN抑制Lewis肺癌的转移和横纹肌肉瘤在动物体内的植入。该作者推测由-MetTPN引起的肿瘤细胞“Met饥饿”,干扰了肿瘤细胞DNA和生物膜磷脂的甲基化,其转移能力受抑。甚至有作者认为,-MetTPN对肿瘤细胞转移能力的抑制作用,比对原发肿瘤增殖的抑制更强,对此尚需作进一步的研究。
基金项目:本课题受国家自然基金(批准号:39370780)资助
〔参考文献〕
〔1〕Chello PL,Bertino JR. Effect of me-thionine deprivation on L5178 murine leukemia cells in culture. Interfe-rence with the antineoplastic effect of methotrexate〔J〕.Biochem Pharmac,1976,25:889~892.
, 百拇医药
〔2〕Breillout F,Antoine E,Poupon MF. Methionine dependency of maligna-nttumors: a possible approach for therapy〔J〕.J Natl Cancer Inst,1990,82:1628~1632.
〔3〕Hoffmann RM,Jacobsen SJ, Erbe RW.Reversion to methionine indepe-ndence by malignant rat SV40-tra-nsformed human fibroblasts〔J〕.Bi-ochem Biophys Res Commun,1978,82:228~234.
〔4〕Usami M,Ohyanagi H,Ishimoto S,et al.Effect of methionine-deprived nutrition on cell growth and cell ki-netics in cell cultures and experi-mental tumors〔J〕. JPEN, 1991,15:540~545.
〔5〕Breillout F,Hadida F,Echinard-Grain P,et al.Decreased rat rhabdo- myosarcoma pulmonary metastasis in response to a low methionine diet〔J〕. Anticancer Reserch, 1987,7:861~868.
收稿日期:1999-06-22;修回日期:1999-07-07, 百拇医药