鼠缺血肠癌基因c-jun活化碱性成纤维细胞生长因子受体表达的关系*
作者:蒋礼先 付小兵 孙同柱 杨银辉 顾小曼
单位:解放军304医院创伤研究室 北京市 100037
关键词:癌基因c-jun;肠缺血再灌注;成纤维细胞生长因子
世界华人消化杂志990612
摘 要
目的 探讨在体条件下癌基因c-jun与碱性成纤维细胞生长因子受体(FGFR)的相互关系,以期阐明癌基因c-jun在创伤修复中的作用.
方法 利用免疫组织化学ABC法检测缺血再灌注肠道. 切片顺序与特异性一抗、生物素标记的二抗孵育,冲洗后滴加辣根过氧化物酶标记的链霉卵蛋白,DAB染色,苏木素复染,封片,镜检.
结果 正常肠道c-jun,FGFR均有恒定表达,其中Jun阳性信号主要在核内,少量在胞质,而FGFR阳性信号主要在细胞膜,少量于胞质,两者的分布具有一致性,主要位于肠绒毛固有层,为淋巴细胞、粒细胞;再灌注即刻,肠绒毛脱落、坏死,阳性信号减弱;再灌注6h,两者均达最高峰;而再灌注24h,两者阳性信号减弱,相关分析显示,c-jun与FGFR成直线相关.
, 百拇医药
结论 缺血再灌注后大鼠肠道癌基因c-jun与FGFR的表达两者之间可能存在内在联系.
中国图书馆分类号 R574
Relationship between oncogene c-jun activation and fibroblast growth factor receptor expression of ischemia-reperfusion intestine in rats*
JIANG Li-Xian, FU Xiao-Bing, SUN Tong-Zhu, YANG Yin-Hui and GU Xiao-Man
Research Laboratories of Trauma Center, Chinese PLA 304 Hospital, Beijing 100037, China
, 百拇医药
Subject headings oncogene c-jun; intestine ischemia-reperfusion; fibroblast growth factor receptor
Abstract
AIM To explore the relationship between c-jun and fibroblast growth factor receptor (FGFR) expression on injuried gust tissues.
METHODS ABC immunohischemistry was used to assay the ischemia-reperfusion intestine. Biopsy sections were incubated with special primary antibody and biotin radish peroxidase labeled streptomycin avidin. The immunohistochemical reaction was detected by incubating the tissue sections in DAB solution and counter stained by hematoxylin. Then sections were dehydrated and mounted.
, http://www.100md.com
RESULTS Light microscopy showed that the expressions of c-jun and FGFR proteins could be found in lymphocyte and granulocyte of lamina propria, and most of the positive signals of Jun were found in nuclear, some in cytoplasm, however, the FGFR mostly scattered on the cytomembrane surface, few in cytoplasm. The distribution of Jun protein was consistent with that of FGFR. Furthermore there were stable expressions of c-jun and FGFR in normal intestine, but dropped with mesentery necrosis and exfoliation upon reperfusion. The positive signals peaked at 6h and weekened at 24h after reperfusion. There was a linear relationship between the expression of c-jun and FGFR.
, http://www.100md.com
CONCLUSION There would be an intrinsic mechanism between the expression of proto-oncogene c-jun and FGFR.
0 引言
我们以前的工作表明[1,2],外源性应用碱性成纤维细胞因子(bFGF)能促进缺血再灌注肠道、肝脏的修复,然而其具体机制尚不十分清楚,有人认为这可能是通过增加生长因子受体数量实现的. 然而癌基因与创伤修复以及生长因子受体的关系尚不是十分清楚,并且临床发现创伤修复过度增生会导致癌变,提示癌基因可能参与了创伤修复. 近年来,癌基因的研究越来越深入,认识到其不仅是癌症发生的内因,而且为正常细胞所必需,一些癌基因,如c-jun能诱导多种蛋白的表达,因此研究癌基因c-jun与生长因子FGF受体表达的关系,有助于阐明组织损伤愈合的内在机制.
, http://www.100md.com
1 材料和方法
1.1 动物模型 健康♂ Wistar大鼠20只,体重200g±50g,随机分为两组,一组为假手术组,另一组为缺血再灌注组. 动物以20g/L戊巴比妥钠麻醉,无菌条件下分离颈静脉与肠系膜上动脉(SMA)根部. 缺血再灌注组动物用动脉夹夹闭肠系膜上动脉,缺血45min,随后松开动脉夹,造成再灌注,分别于再灌注即刻、再灌注后6h及24h活杀. 假手术组动物仅暴露动物SMA根部,但不夹闭,45min后关腹, 活杀. 取SMA根部以下1cm肠道于100mL/L福尔马林固定,备用.
1.2 观察指标 ①肠道组织学检查:取100mL/L福尔马林固定后的肠道,脱水,包埋,切片,经HE染色,光镜观察. ②c-jun免疫组织化学检测:组织石蜡切片,厚度为5μm,常规脱蜡至水,然后用3mL/L过氧化氢孵育10min,消除内源性过氧化物酶的活性,随后于pH 6.2柠檬酸缓冲液中95℃加热,抗原修复30min. 以1∶100浓度稀释Jun抗体,滴加于标本上,4℃过夜,经PBS充分洗涤后,滴加生物素标记的二抗,洗涤后滴加辣根过氧化物酶标记的链霉卵白素,PBS冲洗后,用DAB染色,洗去染液,苏木素复染,并经系列酒精脱水后封片,光镜下观察. ③FGFR免疫组织化学检测:将Jun抗体换成FGFR抗体,方法同上.
, 百拇医药
统计学处理 光镜下,取肠绒毛10个视野统计阳性细胞数、细胞总数并计算阳性细胞百分率,累积计算每组标本中FGF受体、Jun蛋白的阳性百分率,以SAS软件包统计每组间的差异,并对FGF受体、Jun进行相关分析.
2 结果
2.1 c-jun表达 实验显示,假手术组,正常肠道中的Jun蛋白有恒定表达,错落分布于靠近肌层的肠绒毛固有层,主要为一些淋巴细胞、粒细胞,而肠绒毛上皮细胞没见阳性着色,阳性信号主要分布于核内,少量位于胞质(图1a);再灌注即刻,肠绒毛脱落严重,肠腔不完整,c-jun表达量下降(图1b);再灌注6h,c-jun表达逐渐恢复,并达到最高(图1c);再灌注24h,阳性颗粒较再灌注6h降低,约与正常持平(图1d).
图1a 假手术肠道c-jun免疫组化照片,示肠绒毛固有层阳性着色细胞,主要为核着色,少量分布于胞质中. (×400)
, 百拇医药
图1b 再灌注即刻肠道c-jun免疫组化照片,肠绒毛脱落,阳性颗粒减弱. (×400)
图1c 再灌注6h肠道c-jun免疫组化照片,肠道较完整,组织逐渐恢复,阳性着色增多. (×400)
图1d 再灌注24h肠道c-jun免疫组化照片,示阳性细胞着色. (×400)
2.2 FGFR的表达 组织学观察显示,FGF受体信号分布与癌基因c-jun表达的位置基本一致,位于肠绒毛固有层,主要为一些淋巴细胞或粒细胞,而绒毛上皮细胞只有少量表达,其余部位无表达;再灌注即刻,肠绒毛坏死、脱落,靠近肌层的肠绒毛固有层有少量细胞着色;再灌注6h,FGFR表达急剧升高,不但在原有部位有表达,而且部分肠腺的基底部、部分肠上皮细胞间也见阳性颗粒;再灌注24h,FGFR信号颗粒有所减弱,分布与假手术组动物相似.
, http://www.100md.com
2.3 c-jun与FGFR细胞阳性染色率 假手术正常肠道,c-jun表达率为0.38±0.11,再灌注即刻为0.25±0.08,两者之间有显著差异(P<0.05);c-jun表达量于再灌注即刻开始上升,6h达到最高,为0.58±0.18,与正常组有显著差异(P<0.05);而再灌注24h,阳性细胞率下降,为0.36±0.09,与缺血即刻组有显著差异(P<0.05),其中再灌注6h与再灌注24h、缺血即刻均有极显著差异(P<0.01). 而FGFR与c-jun阳性染色率变化相似,假手术正常肠道,阳性细胞率为0.56±0.13,再灌注即刻,肠绒毛坏死、脱落,阳性细胞率为0.38±0.17,这两者之间有显著差异(P<0.05);再灌注6h,阳性细胞率为0.88±0.16,再灌注24h,FGFR信号减弱,为0.42±0.09,与假手术组有显著差异(P<0.05),其中,再灌注6h组与其余各组之间均有极显著差异(表1). 利用SAS软件,对Jun,FGFR进行相关分析,结果显示,两者成直线相关,其中a=0.065,b=0.584相关系数r=0.96,P<0.05. 说明癌基因c-jun与FGFR的表达可能存在一定的相关性.
, 百拇医药
表1 c-jun与FGFR细胞阳性染色率 (n=10,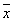 ±s) 分组
±s) 分组
c-jun
FGFR
假手术组
0.38±0.11
0.56±0.13b
再灌注即刻组
0.25±0.08ab
0.38±0.17ab
再灌注6h组
, 百拇医药
0.58±0.18a
0.88±0.16
再灌注24h组
0.36±0.09b
0.42±0.09ab
aP<0.05,vs 假手术组;abP<0.01,vs 再灌注6h组.
3 讨论
近年来研究发现,癌症的发生与癌基因关系密切,然而癌基因与创伤修复的关系尚不十分清楚,临床发现修复过度可导致癌变,提示癌基因与修复两者之间可能存在内在联系. 因此研究癌基因不但有助于阐明组织修复机制,而且能为组织修复过程中癌变的防治提供理论依据. 我们利用肠道缺血再灌注模型,免疫组织化学ABC法观察了癌基因c-jun和FGFR的变化发展趋势. 结果显示,FGF受体位于肠绒毛固有层,主要为一些淋巴细胞、粒细胞,肠绒毛上皮细胞则少见阳性颗粒表达. 因此结果提示FGF促修复作用可能主要通过固有层细胞发生作用. 进一步观察,c-jun表达部位与FGF受体一致,提示两者可能存在一定的关系.
, 百拇医药
以往研究表明,c-jun在外界条件刺激下,表现为一过性升高,故称为即刻早期基因[3]. 而我们的实验显示,c-jun在正常动物肠道以及再灌注后24h就有恒定表达,表达率分别为0.38±0.11与0.36±0.09,两者之间无统计学差异(P>0.05). 这可能是由于手术准备过程中对大鼠的捉拿、麻醉所致. Otori et al文献报道[4],视网膜中央动脉夹闭致视网膜缺血再灌注损伤中,再灌注1h c-jun即达高峰,另有文献报道只需几十分钟,说明c-jun表达非常迅速,并且高温、辐射[5]等多种外界刺激均可诱导c-jun的表达,而手术过程中动物的准备、麻醉一般需几十分钟,故不能排除非缺血再灌注因素的干扰. 再灌注即刻,由于肠缺血缺氧时间较长,细胞正常生理活动所需要的原料及能量供应障碍,致使细胞不仅Jun蛋白、FGF受体合成下降,而且细胞脱落、坏死本身也是c-jun与FGFR表达量减少的原因之一. 随着再灌注时间的延长,肠道血氧供应逐渐趋于正常,c-jun,FGFR表达升高,至6h达到最高. 再灌注24h,创伤逐渐恢复,c-jun,FGFR表达量下降,与假手术组无统计学差异(P>0.05). 相关分析显示,两者之间成直线相关,相关系数γ=0.96,P<0.05,说明两者可能存在一定的联系. 研究表明[6],癌基因蛋白Jun可以与另一癌基因蛋白FOS相互作用形成异二聚体-Jun/Fos,并且Jun相互之间也能形成二聚体,Jun/Jun,其中以二聚体Jun/Fos异源二聚体活性最高,该二聚体进入核内,作用于DNA的AP反应序列[7],刺激下游基因如生长因子FGF,TGF等的表达,间接促进组织修复. 因此,c-jun有可能通过相似的机制促进FGFR的表达而参与修复作用,而c-jun等癌基因的表达失控,则可能造成损伤组织的癌变.
, http://www.100md.com
上述结果显示,缺血再灌注肠道,癌基因c-jun和FGFR主要在肠绒毛固有层表达,两者在空间上存在一致性,而且相关分析表明,两者成直线相关,说明,c-jun与FGFR的表达可能存在内在联系.
作者简介:蒋礼先,男,1971-08-29生,湖南省永州市人,汉族. 1994年湖南师范大学生物系毕业,1997年军事医学科学院生理学专业硕士,助理研究员,主要从事创伤修复的研究与临床,发表论文6篇.
*国家自然科学基金项目,No.39525024
通讯作者 蒋礼先,100037, 北京市海淀区阜成路51号,解放军304医院创伤研究室.
*Supported by the National Science Foundation of China, No.39525024.
, 百拇医药
Correspondence to: Dr. JIANG Li-Xian, Research Laboratories of Trauma Center, Chinese PLA 304 Hospital, 51 Fucheng Road, Beijing 100037, China
Tel. +86.10.66867396, Fax. +86.10.68429998
Email.JLX044@263.net
4 参考文献
1 Fu XB, Jiang LX, Yang YH, Sun TZ, Wang YP, Zhou BT, Sheng ZY. Induction of gut mucosa necrosis and apoptosis after ischemia-reperfusion and the effects of fibroblast growth factor. Zhongguo Weizhongbing Jijiu Yixie, 1998;10:455-458
, http://www.100md.com
2 Fu XB, Wang YP, Ye YX, Sun TZ, Ma LS, Chang GY, Xu MH, Zhou BT, Sheng ZY. The effect of fibroblast growth factor on ischemia injury in intestine and liver. Jiefangjun Yixue Zazhi, 1996;21:121-122
3 Liu HM. Correlation between proto-oncogene, fibroblast growth factor and adaptive response in brain infarct. Prog Brain Res, 1995;105:239-244
4 Otori Y, Shimada S, Morimura H, Ishimoto I, Tohyama M, Tano Y. Expression of c-fos and c-jun mRNA following transient retinal ischemia: an approach using ligation of the retinal central artery in the rat. Sury Ophthalmol, 1997;42(Suppl):S96-104
, 百拇医药
5 Lee YJ, Galoforo SS, Berns CM, Erdos G, Gupta AK, Ways DK, Corry PM. Effect of ionizing radiation on AP-1 binding activity and basic fibroblast growth factor gene expression in drug-sensitive human carcinoma MCF-7 and multidrug-resistant MCF-7/ADR cells. J Biol Chem, 1995;270:28790-28796
6 Chiu R, Boyle WJ, Meek J, Smeal T, Hunter T, Karin M. The c-fos protein interacts with c-jun/AP-1 to stimulate transcription of AP-1 resposive genes. Cell, 1998;54:532-541
7 Hu Y, Cheng L, Hochleitner BW, Xu Q. Activation of mitogen-activated protein kinases (ERK/JNK) and AP-1 transciption factor in rat carotid arteries after balloon injury. Arterioscler Thromb Vasc Biol, 1997;17:2808-2816
收稿日期 1999-01-03 修回日期 1999-03-14, http://www.100md.com
单位:解放军304医院创伤研究室 北京市 100037
关键词:癌基因c-jun;肠缺血再灌注;成纤维细胞生长因子
世界华人消化杂志990612
摘 要
目的 探讨在体条件下癌基因c-jun与碱性成纤维细胞生长因子受体(FGFR)的相互关系,以期阐明癌基因c-jun在创伤修复中的作用.
方法 利用免疫组织化学ABC法检测缺血再灌注肠道. 切片顺序与特异性一抗、生物素标记的二抗孵育,冲洗后滴加辣根过氧化物酶标记的链霉卵蛋白,DAB染色,苏木素复染,封片,镜检.
结果 正常肠道c-jun,FGFR均有恒定表达,其中Jun阳性信号主要在核内,少量在胞质,而FGFR阳性信号主要在细胞膜,少量于胞质,两者的分布具有一致性,主要位于肠绒毛固有层,为淋巴细胞、粒细胞;再灌注即刻,肠绒毛脱落、坏死,阳性信号减弱;再灌注6h,两者均达最高峰;而再灌注24h,两者阳性信号减弱,相关分析显示,c-jun与FGFR成直线相关.
, 百拇医药
结论 缺血再灌注后大鼠肠道癌基因c-jun与FGFR的表达两者之间可能存在内在联系.
中国图书馆分类号 R574
Relationship between oncogene c-jun activation and fibroblast growth factor receptor expression of ischemia-reperfusion intestine in rats*
JIANG Li-Xian, FU Xiao-Bing, SUN Tong-Zhu, YANG Yin-Hui and GU Xiao-Man
Research Laboratories of Trauma Center, Chinese PLA 304 Hospital, Beijing 100037, China
, 百拇医药
Subject headings oncogene c-jun; intestine ischemia-reperfusion; fibroblast growth factor receptor
Abstract
AIM To explore the relationship between c-jun and fibroblast growth factor receptor (FGFR) expression on injuried gust tissues.
METHODS ABC immunohischemistry was used to assay the ischemia-reperfusion intestine. Biopsy sections were incubated with special primary antibody and biotin radish peroxidase labeled streptomycin avidin. The immunohistochemical reaction was detected by incubating the tissue sections in DAB solution and counter stained by hematoxylin. Then sections were dehydrated and mounted.
, http://www.100md.com
RESULTS Light microscopy showed that the expressions of c-jun and FGFR proteins could be found in lymphocyte and granulocyte of lamina propria, and most of the positive signals of Jun were found in nuclear, some in cytoplasm, however, the FGFR mostly scattered on the cytomembrane surface, few in cytoplasm. The distribution of Jun protein was consistent with that of FGFR. Furthermore there were stable expressions of c-jun and FGFR in normal intestine, but dropped with mesentery necrosis and exfoliation upon reperfusion. The positive signals peaked at 6h and weekened at 24h after reperfusion. There was a linear relationship between the expression of c-jun and FGFR.
, http://www.100md.com
CONCLUSION There would be an intrinsic mechanism between the expression of proto-oncogene c-jun and FGFR.
0 引言
我们以前的工作表明[1,2],外源性应用碱性成纤维细胞因子(bFGF)能促进缺血再灌注肠道、肝脏的修复,然而其具体机制尚不十分清楚,有人认为这可能是通过增加生长因子受体数量实现的. 然而癌基因与创伤修复以及生长因子受体的关系尚不是十分清楚,并且临床发现创伤修复过度增生会导致癌变,提示癌基因可能参与了创伤修复. 近年来,癌基因的研究越来越深入,认识到其不仅是癌症发生的内因,而且为正常细胞所必需,一些癌基因,如c-jun能诱导多种蛋白的表达,因此研究癌基因c-jun与生长因子FGF受体表达的关系,有助于阐明组织损伤愈合的内在机制.
, http://www.100md.com
1 材料和方法
1.1 动物模型 健康♂ Wistar大鼠20只,体重200g±50g,随机分为两组,一组为假手术组,另一组为缺血再灌注组. 动物以20g/L戊巴比妥钠麻醉,无菌条件下分离颈静脉与肠系膜上动脉(SMA)根部. 缺血再灌注组动物用动脉夹夹闭肠系膜上动脉,缺血45min,随后松开动脉夹,造成再灌注,分别于再灌注即刻、再灌注后6h及24h活杀. 假手术组动物仅暴露动物SMA根部,但不夹闭,45min后关腹, 活杀. 取SMA根部以下1cm肠道于100mL/L福尔马林固定,备用.
1.2 观察指标 ①肠道组织学检查:取100mL/L福尔马林固定后的肠道,脱水,包埋,切片,经HE染色,光镜观察. ②c-jun免疫组织化学检测:组织石蜡切片,厚度为5μm,常规脱蜡至水,然后用3mL/L过氧化氢孵育10min,消除内源性过氧化物酶的活性,随后于pH 6.2柠檬酸缓冲液中95℃加热,抗原修复30min. 以1∶100浓度稀释Jun抗体,滴加于标本上,4℃过夜,经PBS充分洗涤后,滴加生物素标记的二抗,洗涤后滴加辣根过氧化物酶标记的链霉卵白素,PBS冲洗后,用DAB染色,洗去染液,苏木素复染,并经系列酒精脱水后封片,光镜下观察. ③FGFR免疫组织化学检测:将Jun抗体换成FGFR抗体,方法同上.
, 百拇医药
统计学处理 光镜下,取肠绒毛10个视野统计阳性细胞数、细胞总数并计算阳性细胞百分率,累积计算每组标本中FGF受体、Jun蛋白的阳性百分率,以SAS软件包统计每组间的差异,并对FGF受体、Jun进行相关分析.
2 结果
2.1 c-jun表达 实验显示,假手术组,正常肠道中的Jun蛋白有恒定表达,错落分布于靠近肌层的肠绒毛固有层,主要为一些淋巴细胞、粒细胞,而肠绒毛上皮细胞没见阳性着色,阳性信号主要分布于核内,少量位于胞质(图1a);再灌注即刻,肠绒毛脱落严重,肠腔不完整,c-jun表达量下降(图1b);再灌注6h,c-jun表达逐渐恢复,并达到最高(图1c);再灌注24h,阳性颗粒较再灌注6h降低,约与正常持平(图1d).

图1a 假手术肠道c-jun免疫组化照片,示肠绒毛固有层阳性着色细胞,主要为核着色,少量分布于胞质中. (×400)

, 百拇医药
图1b 再灌注即刻肠道c-jun免疫组化照片,肠绒毛脱落,阳性颗粒减弱. (×400)

图1c 再灌注6h肠道c-jun免疫组化照片,肠道较完整,组织逐渐恢复,阳性着色增多. (×400)

图1d 再灌注24h肠道c-jun免疫组化照片,示阳性细胞着色. (×400)
2.2 FGFR的表达 组织学观察显示,FGF受体信号分布与癌基因c-jun表达的位置基本一致,位于肠绒毛固有层,主要为一些淋巴细胞或粒细胞,而绒毛上皮细胞只有少量表达,其余部位无表达;再灌注即刻,肠绒毛坏死、脱落,靠近肌层的肠绒毛固有层有少量细胞着色;再灌注6h,FGFR表达急剧升高,不但在原有部位有表达,而且部分肠腺的基底部、部分肠上皮细胞间也见阳性颗粒;再灌注24h,FGFR信号颗粒有所减弱,分布与假手术组动物相似.
, http://www.100md.com
2.3 c-jun与FGFR细胞阳性染色率 假手术正常肠道,c-jun表达率为0.38±0.11,再灌注即刻为0.25±0.08,两者之间有显著差异(P<0.05);c-jun表达量于再灌注即刻开始上升,6h达到最高,为0.58±0.18,与正常组有显著差异(P<0.05);而再灌注24h,阳性细胞率下降,为0.36±0.09,与缺血即刻组有显著差异(P<0.05),其中再灌注6h与再灌注24h、缺血即刻均有极显著差异(P<0.01). 而FGFR与c-jun阳性染色率变化相似,假手术正常肠道,阳性细胞率为0.56±0.13,再灌注即刻,肠绒毛坏死、脱落,阳性细胞率为0.38±0.17,这两者之间有显著差异(P<0.05);再灌注6h,阳性细胞率为0.88±0.16,再灌注24h,FGFR信号减弱,为0.42±0.09,与假手术组有显著差异(P<0.05),其中,再灌注6h组与其余各组之间均有极显著差异(表1). 利用SAS软件,对Jun,FGFR进行相关分析,结果显示,两者成直线相关,其中a=0.065,b=0.584相关系数r=0.96,P<0.05. 说明癌基因c-jun与FGFR的表达可能存在一定的相关性.
, 百拇医药
表1 c-jun与FGFR细胞阳性染色率 (n=10,
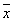 ±s) 分组
±s) 分组c-jun
FGFR
假手术组
0.38±0.11
0.56±0.13b
再灌注即刻组
0.25±0.08ab
0.38±0.17ab
再灌注6h组
, 百拇医药
0.58±0.18a
0.88±0.16
再灌注24h组
0.36±0.09b
0.42±0.09ab
aP<0.05,vs 假手术组;abP<0.01,vs 再灌注6h组.
3 讨论
近年来研究发现,癌症的发生与癌基因关系密切,然而癌基因与创伤修复的关系尚不十分清楚,临床发现修复过度可导致癌变,提示癌基因与修复两者之间可能存在内在联系. 因此研究癌基因不但有助于阐明组织修复机制,而且能为组织修复过程中癌变的防治提供理论依据. 我们利用肠道缺血再灌注模型,免疫组织化学ABC法观察了癌基因c-jun和FGFR的变化发展趋势. 结果显示,FGF受体位于肠绒毛固有层,主要为一些淋巴细胞、粒细胞,肠绒毛上皮细胞则少见阳性颗粒表达. 因此结果提示FGF促修复作用可能主要通过固有层细胞发生作用. 进一步观察,c-jun表达部位与FGF受体一致,提示两者可能存在一定的关系.
, 百拇医药
以往研究表明,c-jun在外界条件刺激下,表现为一过性升高,故称为即刻早期基因[3]. 而我们的实验显示,c-jun在正常动物肠道以及再灌注后24h就有恒定表达,表达率分别为0.38±0.11与0.36±0.09,两者之间无统计学差异(P>0.05). 这可能是由于手术准备过程中对大鼠的捉拿、麻醉所致. Otori et al文献报道[4],视网膜中央动脉夹闭致视网膜缺血再灌注损伤中,再灌注1h c-jun即达高峰,另有文献报道只需几十分钟,说明c-jun表达非常迅速,并且高温、辐射[5]等多种外界刺激均可诱导c-jun的表达,而手术过程中动物的准备、麻醉一般需几十分钟,故不能排除非缺血再灌注因素的干扰. 再灌注即刻,由于肠缺血缺氧时间较长,细胞正常生理活动所需要的原料及能量供应障碍,致使细胞不仅Jun蛋白、FGF受体合成下降,而且细胞脱落、坏死本身也是c-jun与FGFR表达量减少的原因之一. 随着再灌注时间的延长,肠道血氧供应逐渐趋于正常,c-jun,FGFR表达升高,至6h达到最高. 再灌注24h,创伤逐渐恢复,c-jun,FGFR表达量下降,与假手术组无统计学差异(P>0.05). 相关分析显示,两者之间成直线相关,相关系数γ=0.96,P<0.05,说明两者可能存在一定的联系. 研究表明[6],癌基因蛋白Jun可以与另一癌基因蛋白FOS相互作用形成异二聚体-Jun/Fos,并且Jun相互之间也能形成二聚体,Jun/Jun,其中以二聚体Jun/Fos异源二聚体活性最高,该二聚体进入核内,作用于DNA的AP反应序列[7],刺激下游基因如生长因子FGF,TGF等的表达,间接促进组织修复. 因此,c-jun有可能通过相似的机制促进FGFR的表达而参与修复作用,而c-jun等癌基因的表达失控,则可能造成损伤组织的癌变.
, http://www.100md.com
上述结果显示,缺血再灌注肠道,癌基因c-jun和FGFR主要在肠绒毛固有层表达,两者在空间上存在一致性,而且相关分析表明,两者成直线相关,说明,c-jun与FGFR的表达可能存在内在联系.
作者简介:蒋礼先,男,1971-08-29生,湖南省永州市人,汉族. 1994年湖南师范大学生物系毕业,1997年军事医学科学院生理学专业硕士,助理研究员,主要从事创伤修复的研究与临床,发表论文6篇.
*国家自然科学基金项目,No.39525024
通讯作者 蒋礼先,100037, 北京市海淀区阜成路51号,解放军304医院创伤研究室.
*Supported by the National Science Foundation of China, No.39525024.
, 百拇医药
Correspondence to: Dr. JIANG Li-Xian, Research Laboratories of Trauma Center, Chinese PLA 304 Hospital, 51 Fucheng Road, Beijing 100037, China
Tel. +86.10.66867396, Fax. +86.10.68429998
Email.JLX044@263.net
4 参考文献
1 Fu XB, Jiang LX, Yang YH, Sun TZ, Wang YP, Zhou BT, Sheng ZY. Induction of gut mucosa necrosis and apoptosis after ischemia-reperfusion and the effects of fibroblast growth factor. Zhongguo Weizhongbing Jijiu Yixie, 1998;10:455-458
, http://www.100md.com
2 Fu XB, Wang YP, Ye YX, Sun TZ, Ma LS, Chang GY, Xu MH, Zhou BT, Sheng ZY. The effect of fibroblast growth factor on ischemia injury in intestine and liver. Jiefangjun Yixue Zazhi, 1996;21:121-122
3 Liu HM. Correlation between proto-oncogene, fibroblast growth factor and adaptive response in brain infarct. Prog Brain Res, 1995;105:239-244
4 Otori Y, Shimada S, Morimura H, Ishimoto I, Tohyama M, Tano Y. Expression of c-fos and c-jun mRNA following transient retinal ischemia: an approach using ligation of the retinal central artery in the rat. Sury Ophthalmol, 1997;42(Suppl):S96-104
, 百拇医药
5 Lee YJ, Galoforo SS, Berns CM, Erdos G, Gupta AK, Ways DK, Corry PM. Effect of ionizing radiation on AP-1 binding activity and basic fibroblast growth factor gene expression in drug-sensitive human carcinoma MCF-7 and multidrug-resistant MCF-7/ADR cells. J Biol Chem, 1995;270:28790-28796
6 Chiu R, Boyle WJ, Meek J, Smeal T, Hunter T, Karin M. The c-fos protein interacts with c-jun/AP-1 to stimulate transcription of AP-1 resposive genes. Cell, 1998;54:532-541
7 Hu Y, Cheng L, Hochleitner BW, Xu Q. Activation of mitogen-activated protein kinases (ERK/JNK) and AP-1 transciption factor in rat carotid arteries after balloon injury. Arterioscler Thromb Vasc Biol, 1997;17:2808-2816
收稿日期 1999-01-03 修回日期 1999-03-14, http://www.100md.com