人巨细胞病毒对培养人脐静脉内皮细胞增殖和凋亡的影响
作者:黄从新 王德胜 杨 波 尹丽娅 王 晶 江 洪 李庚山
单位:4300060 湖北省武汉市,湖北医科大学附属第一医院 心内科
关键词:人巨细胞病毒;人脐静脉内皮细胞;凋亡;增殖
摘要 目的摘要
目的:探讨人巨细胞病毒(CMV)在动脉粥样硬化发生和发展中的作用。
方法:采用流式细胞计数仪观察了人 CMV对离体培养的人脐静脉内皮细胞(HUVEC)增殖和凋亡的影响。本实验分为5组,分别为正常对照组,肿瘤坏死因子细胞凋亡组,无血清培养细胞凋亡组,CMV感染+肿瘤坏死因子细胞凋亡组,CMV感染+无血清培养细胞凋亡组。
结果:实验发现无血清培养和肿瘤坏死因子诱导的细胞凋亡率较正常对照组升高,而CMV感染的细胞凋亡率明显降低;细胞计数的结果表明CMV感染后3天的HUVEC细胞数是未感染的5倍。流式细胞仪的检测结果表明:CMV感染细胞的增殖指数明显高于正常对照组,CMV可使细胞耐受无血清培养条件,保持细胞增殖。
, 百拇医药
结论:人CMV感染HUVEC后能够改变HUVEC的细胞增殖过程,抑制细胞凋亡,HUVEC的过度增生及HUVEC感染引起的炎性反应可能影响内皮细胞的功能,甚至破坏内皮细胞,导致血栓形成、脂质代谢紊乱,最终形成动脉粥样硬化。
中图分类号:R392.12 文献标识码:A 文章编号:1000-3614(1999)06-0349-02
The Effect of Human Cytomegalovirus on the Proliferation and Apoptosis of Cultured Human Umbilical Vein Endothelial Cell
Huang Congxin,Wang Desheng,Yang Bo,et al.
Department of Cardiology,The Frist Teaching Hospital of Hubei Medical University,Wuhan(430060),Hubei
, 百拇医药
Abstract
Objective:To investigate the role of human cytomegalovirus(CMV)in the initiation and progression of atherosclerosis(AS).
Methods:The effect of human CMV on the proliferation and apoptosis of cultured human umbilical vein endothelial cell(HUVEC)was assayed by flow cytometry.
Results:The proliferation index(PI)of HUVEC group infected by human CMV was higher than that of group uninfected;the HUVEC apoptosis rate induced by tumour necrosis factor (TNE)and cell culture without serum was reduced by human CMV infection.
, 百拇医药
Conclusion:Human CMV infection could accelerate HUVEC proliferation and inhibit its apoptosis,the excessive proliferation and inflammation of HUVEC caused by human CMV infection maybe the initiative factor of AS development.
Key words Human cytomegalovirus;Human umbilical vein endothelial cell;Proliferation;Apoptosis
(Chinese Circulation Journal,1999,14:349.)
动脉粥样硬化是临床上常见的血管病之一,其病因尚未完全明了。现有的证据表明[1,2]:许多微生物与动脉粥样硬化的病理生成有关,感染可引起该疾病的不同阶段的病变,特别是冠状动脉粥样硬化性心脏病,已有许多病原成为研究的焦点。血清流行病学研究发现巨细胞病毒(CMV)与动脉粥样硬化的发生显著相关[3,4],临床和实验研究也提示人CMV感染可加速心脏移植术后病人的动脉粥样硬化[5,6]。为进一步探讨CMV在动脉粥样硬化发生中的作用,我们研究了CMV感染对血管内皮细胞的增殖、凋亡的影响,并初步探讨了其可能的机制。
, 百拇医药
1 材料与方法
材料 人脐静脉内皮细胞(HUVEC)株,由武汉大学典型物种保存中心提供。人CMV AD169株为中国科学院武汉病毒所、湖北医科大学病毒所赠送。达尔伯克氏改良伊格尔F12培养基、胎牛血清及100×的青霉素-链霉素为美国Gibco公司产品。胰蛋白酶为美国Difico公司产品。核糖核酸酶A、碘化吡啶及增殖细胞核抗原抗体为美国Sigma公司产品。链霉素亲和素生物素复合物免疫组化试剂盒、3,3'-二氨基联苯胺盐酸盐显色试剂盒为武汉博士德生物有限公司产品。
方法 HUVEC的培养及人CMV感染HUVEC:HUVEC的培养采用文献[7]报道之方法进行。将人CMV悬液以0.1 pfu/cell的浓度接种到培养的HUVEC中,继续培养HUVEC即可获得人CMV感染的细胞。人CMV对HUVEC生长的影响:采用直接细胞计数和流式细胞仪检测细胞周期的方法。
CMV对内皮细胞凋亡的影响 本实验分为5组,分别为正常对照组,肿瘤坏死因子细胞凋亡组,无血清培养细胞凋亡组,CMV感染+肿瘤坏死因子细胞凋亡组,CMV感染+无血清培养细胞凋亡组,每组样本数均为7。凋亡的实验方法如下:①肿瘤坏死因子诱导细胞凋亡:HUVEC以2×104/cm2的密度接种于培养瓶中,内含玻片,当细胞生长至70%~80%融合时,换去培养基,用D-Hank's洗1次后加含肿瘤坏死因子1 000 μ/ml的培养基,培养8小时后,用上述方法收集细胞,用流式细胞仪检测细胞的凋亡。②无血清培养诱导细胞凋亡:HUVEC以2×104/cm2的密度接种于培养瓶中,内含玻片,当细胞生长至70%~80%融合时,换去培养基,用D-Hank's洗1次后,无血清培养细胞48小时诱导细胞凋亡。③CMV感染的细胞凋亡:HUVEC感染CMV后,分别用两种方法诱导细胞凋亡,然后收集细胞进行流式细胞仪的检测。
, 百拇医药
统计学处理 所有数据均以均数±标准差(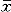 ±s)表示,两两样本均数比较用t检验。P<0.05表示差异有显著性。
±s)表示,两两样本均数比较用t检验。P<0.05表示差异有显著性。
2 结果
2.1 凋亡的人脐静脉内皮细胞形态学特点
正常的HUVEC在倒置相差显微镜上观察,可见生长融合的内皮细胞呈铺路石状镶嵌排列,细胞边界清楚,胞浆丰富,胞核椭圆居中,核仁明显。凋亡的细胞有的变成大细胞。
2.2 流式细胞仪检测细胞的凋亡
在细胞凋亡时,用流式细胞仪检测发现,在脱氧核糖核酸直方图上,在脱氧核糖核酸合成前期(G1)峰左侧细胞可呈现亚二倍体核峰型(亚G1峰,即凋亡峰)。而正常的细胞经流式细胞仪检测,没有亚二倍体细胞群的峰型。在本实验中,无血清培养和肿瘤坏死因子诱导的细胞凋亡率较正常对照组升高,脱氧核糖核酸直方图上可见高大的凋亡峰,而CMV感染的2组细胞凋亡率明显降低。(表1)
, 百拇医药
表1 人巨细胞病毒对人脐静脉内皮细胞的细胞凋亡率的影响(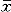 ±s)
±s)
组别
样本数
细胞凋亡率
正常对照组
7
0.58±0.04
肿瘤坏死因子细胞凋亡组
7
7.53±0.64 *
, 百拇医药
无血清培养细胞凋亡组
7
7.39±0.68**
巨细胞病毒感染+肿瘤坏死因子细胞凋亡组
7
3.63±0.32*
巨细胞病毒感染+无血清培养细胞凋亡组
7
3.51±0.29**
注:*两组间比较P<0.01,**两组间比较P<0.01
, 百拇医药 2.3 巨细胞病毒对人脐静脉内皮细胞增殖的影响(表2)
表2 人巨细胞病毒对人脐静脉内皮细胞增殖的影响(%,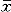 ±s)
±s)
样本数
G0/G1
S
G2/M
细胞增殖指数
正常对照组
7
, http://www.100md.com
75.89±5.69
14.44±1.32
9.67±0.82
14.44±1.32
巨细胞病毒感染的2组△
14
42.01±2.51
43.06±2.91
14.93±1.14
43.06±2.91*
注:与正常对照组相比*P<0.01 G0:静止期 G1:脱氧核糖核酸合成前期 S:脱氧核糖核酸合成期 G2:脱氧核糖核酸合成后期 M:有丝分裂期 △巨细胞病毒感染的2组包括巨细胞病毒感染+肿瘤坏死因子细胞凋亡组和巨细胞病毒感染+无血清培养细胞凋亡组
, http://www.100md.com
细胞计数的结果表明:CMV感染后3天的该组的细胞数是未感染组的5倍。流式细胞仪的检测结果表明:CMV感染2组的细胞增殖指数明显高于正常对照组,CMV可使细胞耐受无血清培养条件,保持细胞增殖。
3 讨论
自从1985年Fabricant等报道用禽类疱疹病毒诱发鸡冠状动脉粥样硬化以来,同属疱疹病毒科的人CMV与人动脉粥样硬化的相关性颇受关注。人体动脉壁上人CMV核酸序列的检出[8],及动脉粥样硬化病人动脉血管壁上人CMV脱氧核糖核酸的检出[3],表明了人CMV与动脉粥样硬化有关,电镜研究发现感染了CMV的小鼠动脉内皮细胞受到损伤[9],这种损伤正是动脉粥样硬化的早期病变过程,提示CMV感染可能是动脉粥样硬化的病因之一。本研究结果显示HUVEC感染人CMV后与正常对照组一起用无血清培养3天,正常对照组细胞的增殖受到明显的抑制,而感染了CMV的HUVEC增殖明显高于正常对照组。这与国外报道基本一致[10]。本研究结果还提示HUVEC感染CMV后可抑制由无血清培养和肿瘤坏死因子诱导的细胞凋亡。由此可见HUVEC感染CMV后能够改变HUVEC的细胞增殖过程,抑制细胞凋亡,使病毒得以在细胞内生存、繁殖。HUVEC的过度增生及HUVEC感染引起的炎性反应可能影响内皮细胞的功能,甚至破坏内皮细胞,导致血栓形成、脂质代谢紊乱,最终形成动脉粥样硬化。
, 百拇医药
综上所述,人CMV感染可能是动脉粥样硬化发生的病因之一,至少人CMV感染在动脉粥样硬化发生和发展中起着重要作用。至于人CMV调控HUVEC凋亡及增殖的途径,目前尚不太清楚,可能与某些癌基因及原癌基因的表达有关。控制人CMV感染可作为动脉粥样硬化预防和治疗的途径之一。
作者简介:黄从新(1951-)男 教授 院长 博士 博士研究生导师 主要从事介入心脏病学研究
4 参考文献
1 Tumilowicz JJ,Gawlik ME,Powell BB.Replication of cytomegalovirus in human arterial smooth muscle cells.J Virol,1985,56:839—845.
2 Etingin OR,Silverstein RL,Hajjar DP.Identification of a monocyte receptor on herpes virus-infected endothelial cells.Proc Natl Acad Sci USA,1991,88:7200—7203.
, http://www.100md.com
3 Melnick JL,Hu C,Burek J,et al.Cytomegalovirus DNA in arterial walls of patients with atherosclerosis.J Med Virol,1994,42:170—174.
4 Visser MR,Vercellatti GM.Herpes simple virus and atherosclerosis.Eur Heart J,1993,14(Suppl):39—42.
5 Lemstrom KB,Bruning JH,Bruggeman CA,et al.Cytomegalovirus infection enhances smooth muscle cell proliferation and intimal thickening of rat aortic allografts.J Clin Invest,1993,92:549—559.
, http://www.100md.com
6 Epstein SE,Speir E,Zhou YF,et al.The role of infection in restenosis and atherosclerosis focus on cytomegalovirus.The Lancet,1996,348:s13—s17.
7 鄂征主编.组织培养和分子生物学技术.第一版.北京:北京出版社,1995.9—26.
8 Hendrix MG,Dormans PH,Kitlar P.The Presence of cytomegalovirus nucleic acids in arterial walls of atherosclerotic and nonatherosclerotic patients.Am J Pathol,1989,134:1151.
9 Span AH,Frederik PM,Grawls G.CMV induced vascular injury:an electron-microscopic study in the rat.Int Virol,1993,7:567—573.
10 Melnick JL,Adam E,Debakey ME.Possible role of cytomegalovirus in atherogenesis.JAMA,1990,263:2204—2207.
收稿:1999-03-18 修回:1999-08-30, http://www.100md.com
单位:4300060 湖北省武汉市,湖北医科大学附属第一医院 心内科
关键词:人巨细胞病毒;人脐静脉内皮细胞;凋亡;增殖
摘要 目的摘要
目的:探讨人巨细胞病毒(CMV)在动脉粥样硬化发生和发展中的作用。
方法:采用流式细胞计数仪观察了人 CMV对离体培养的人脐静脉内皮细胞(HUVEC)增殖和凋亡的影响。本实验分为5组,分别为正常对照组,肿瘤坏死因子细胞凋亡组,无血清培养细胞凋亡组,CMV感染+肿瘤坏死因子细胞凋亡组,CMV感染+无血清培养细胞凋亡组。
结果:实验发现无血清培养和肿瘤坏死因子诱导的细胞凋亡率较正常对照组升高,而CMV感染的细胞凋亡率明显降低;细胞计数的结果表明CMV感染后3天的HUVEC细胞数是未感染的5倍。流式细胞仪的检测结果表明:CMV感染细胞的增殖指数明显高于正常对照组,CMV可使细胞耐受无血清培养条件,保持细胞增殖。
, 百拇医药
结论:人CMV感染HUVEC后能够改变HUVEC的细胞增殖过程,抑制细胞凋亡,HUVEC的过度增生及HUVEC感染引起的炎性反应可能影响内皮细胞的功能,甚至破坏内皮细胞,导致血栓形成、脂质代谢紊乱,最终形成动脉粥样硬化。
中图分类号:R392.12 文献标识码:A 文章编号:1000-3614(1999)06-0349-02
The Effect of Human Cytomegalovirus on the Proliferation and Apoptosis of Cultured Human Umbilical Vein Endothelial Cell
Huang Congxin,Wang Desheng,Yang Bo,et al.
Department of Cardiology,The Frist Teaching Hospital of Hubei Medical University,Wuhan(430060),Hubei
, 百拇医药
Abstract
Objective:To investigate the role of human cytomegalovirus(CMV)in the initiation and progression of atherosclerosis(AS).
Methods:The effect of human CMV on the proliferation and apoptosis of cultured human umbilical vein endothelial cell(HUVEC)was assayed by flow cytometry.
Results:The proliferation index(PI)of HUVEC group infected by human CMV was higher than that of group uninfected;the HUVEC apoptosis rate induced by tumour necrosis factor (TNE)and cell culture without serum was reduced by human CMV infection.
, 百拇医药
Conclusion:Human CMV infection could accelerate HUVEC proliferation and inhibit its apoptosis,the excessive proliferation and inflammation of HUVEC caused by human CMV infection maybe the initiative factor of AS development.
Key words Human cytomegalovirus;Human umbilical vein endothelial cell;Proliferation;Apoptosis
(Chinese Circulation Journal,1999,14:349.)
动脉粥样硬化是临床上常见的血管病之一,其病因尚未完全明了。现有的证据表明[1,2]:许多微生物与动脉粥样硬化的病理生成有关,感染可引起该疾病的不同阶段的病变,特别是冠状动脉粥样硬化性心脏病,已有许多病原成为研究的焦点。血清流行病学研究发现巨细胞病毒(CMV)与动脉粥样硬化的发生显著相关[3,4],临床和实验研究也提示人CMV感染可加速心脏移植术后病人的动脉粥样硬化[5,6]。为进一步探讨CMV在动脉粥样硬化发生中的作用,我们研究了CMV感染对血管内皮细胞的增殖、凋亡的影响,并初步探讨了其可能的机制。
, 百拇医药
1 材料与方法
材料 人脐静脉内皮细胞(HUVEC)株,由武汉大学典型物种保存中心提供。人CMV AD169株为中国科学院武汉病毒所、湖北医科大学病毒所赠送。达尔伯克氏改良伊格尔F12培养基、胎牛血清及100×的青霉素-链霉素为美国Gibco公司产品。胰蛋白酶为美国Difico公司产品。核糖核酸酶A、碘化吡啶及增殖细胞核抗原抗体为美国Sigma公司产品。链霉素亲和素生物素复合物免疫组化试剂盒、3,3'-二氨基联苯胺盐酸盐显色试剂盒为武汉博士德生物有限公司产品。
方法 HUVEC的培养及人CMV感染HUVEC:HUVEC的培养采用文献[7]报道之方法进行。将人CMV悬液以0.1 pfu/cell的浓度接种到培养的HUVEC中,继续培养HUVEC即可获得人CMV感染的细胞。人CMV对HUVEC生长的影响:采用直接细胞计数和流式细胞仪检测细胞周期的方法。
CMV对内皮细胞凋亡的影响 本实验分为5组,分别为正常对照组,肿瘤坏死因子细胞凋亡组,无血清培养细胞凋亡组,CMV感染+肿瘤坏死因子细胞凋亡组,CMV感染+无血清培养细胞凋亡组,每组样本数均为7。凋亡的实验方法如下:①肿瘤坏死因子诱导细胞凋亡:HUVEC以2×104/cm2的密度接种于培养瓶中,内含玻片,当细胞生长至70%~80%融合时,换去培养基,用D-Hank's洗1次后加含肿瘤坏死因子1 000 μ/ml的培养基,培养8小时后,用上述方法收集细胞,用流式细胞仪检测细胞的凋亡。②无血清培养诱导细胞凋亡:HUVEC以2×104/cm2的密度接种于培养瓶中,内含玻片,当细胞生长至70%~80%融合时,换去培养基,用D-Hank's洗1次后,无血清培养细胞48小时诱导细胞凋亡。③CMV感染的细胞凋亡:HUVEC感染CMV后,分别用两种方法诱导细胞凋亡,然后收集细胞进行流式细胞仪的检测。
, 百拇医药
统计学处理 所有数据均以均数±标准差(
2 结果
2.1 凋亡的人脐静脉内皮细胞形态学特点
正常的HUVEC在倒置相差显微镜上观察,可见生长融合的内皮细胞呈铺路石状镶嵌排列,细胞边界清楚,胞浆丰富,胞核椭圆居中,核仁明显。凋亡的细胞有的变成大细胞。
2.2 流式细胞仪检测细胞的凋亡
在细胞凋亡时,用流式细胞仪检测发现,在脱氧核糖核酸直方图上,在脱氧核糖核酸合成前期(G1)峰左侧细胞可呈现亚二倍体核峰型(亚G1峰,即凋亡峰)。而正常的细胞经流式细胞仪检测,没有亚二倍体细胞群的峰型。在本实验中,无血清培养和肿瘤坏死因子诱导的细胞凋亡率较正常对照组升高,脱氧核糖核酸直方图上可见高大的凋亡峰,而CMV感染的2组细胞凋亡率明显降低。(表1)
, 百拇医药
表1 人巨细胞病毒对人脐静脉内皮细胞的细胞凋亡率的影响(
组别
样本数
细胞凋亡率
正常对照组
7
0.58±0.04
肿瘤坏死因子细胞凋亡组
7
7.53±0.64 *
, 百拇医药
无血清培养细胞凋亡组
7
7.39±0.68**
巨细胞病毒感染+肿瘤坏死因子细胞凋亡组
7
3.63±0.32*
巨细胞病毒感染+无血清培养细胞凋亡组
7
3.51±0.29**
注:*两组间比较P<0.01,**两组间比较P<0.01
, 百拇医药 2.3 巨细胞病毒对人脐静脉内皮细胞增殖的影响(表2)
表2 人巨细胞病毒对人脐静脉内皮细胞增殖的影响(%,
样本数
G0/G1
S
G2/M
细胞增殖指数
正常对照组
7
, http://www.100md.com
75.89±5.69
14.44±1.32
9.67±0.82
14.44±1.32
巨细胞病毒感染的2组△
14
42.01±2.51
43.06±2.91
14.93±1.14
43.06±2.91*
注:与正常对照组相比*P<0.01 G0:静止期 G1:脱氧核糖核酸合成前期 S:脱氧核糖核酸合成期 G2:脱氧核糖核酸合成后期 M:有丝分裂期 △巨细胞病毒感染的2组包括巨细胞病毒感染+肿瘤坏死因子细胞凋亡组和巨细胞病毒感染+无血清培养细胞凋亡组
, http://www.100md.com
细胞计数的结果表明:CMV感染后3天的该组的细胞数是未感染组的5倍。流式细胞仪的检测结果表明:CMV感染2组的细胞增殖指数明显高于正常对照组,CMV可使细胞耐受无血清培养条件,保持细胞增殖。
3 讨论
自从1985年Fabricant等报道用禽类疱疹病毒诱发鸡冠状动脉粥样硬化以来,同属疱疹病毒科的人CMV与人动脉粥样硬化的相关性颇受关注。人体动脉壁上人CMV核酸序列的检出[8],及动脉粥样硬化病人动脉血管壁上人CMV脱氧核糖核酸的检出[3],表明了人CMV与动脉粥样硬化有关,电镜研究发现感染了CMV的小鼠动脉内皮细胞受到损伤[9],这种损伤正是动脉粥样硬化的早期病变过程,提示CMV感染可能是动脉粥样硬化的病因之一。本研究结果显示HUVEC感染人CMV后与正常对照组一起用无血清培养3天,正常对照组细胞的增殖受到明显的抑制,而感染了CMV的HUVEC增殖明显高于正常对照组。这与国外报道基本一致[10]。本研究结果还提示HUVEC感染CMV后可抑制由无血清培养和肿瘤坏死因子诱导的细胞凋亡。由此可见HUVEC感染CMV后能够改变HUVEC的细胞增殖过程,抑制细胞凋亡,使病毒得以在细胞内生存、繁殖。HUVEC的过度增生及HUVEC感染引起的炎性反应可能影响内皮细胞的功能,甚至破坏内皮细胞,导致血栓形成、脂质代谢紊乱,最终形成动脉粥样硬化。
, 百拇医药
综上所述,人CMV感染可能是动脉粥样硬化发生的病因之一,至少人CMV感染在动脉粥样硬化发生和发展中起着重要作用。至于人CMV调控HUVEC凋亡及增殖的途径,目前尚不太清楚,可能与某些癌基因及原癌基因的表达有关。控制人CMV感染可作为动脉粥样硬化预防和治疗的途径之一。
作者简介:黄从新(1951-)男 教授 院长 博士 博士研究生导师 主要从事介入心脏病学研究
4 参考文献
1 Tumilowicz JJ,Gawlik ME,Powell BB.Replication of cytomegalovirus in human arterial smooth muscle cells.J Virol,1985,56:839—845.
2 Etingin OR,Silverstein RL,Hajjar DP.Identification of a monocyte receptor on herpes virus-infected endothelial cells.Proc Natl Acad Sci USA,1991,88:7200—7203.
, http://www.100md.com
3 Melnick JL,Hu C,Burek J,et al.Cytomegalovirus DNA in arterial walls of patients with atherosclerosis.J Med Virol,1994,42:170—174.
4 Visser MR,Vercellatti GM.Herpes simple virus and atherosclerosis.Eur Heart J,1993,14(Suppl):39—42.
5 Lemstrom KB,Bruning JH,Bruggeman CA,et al.Cytomegalovirus infection enhances smooth muscle cell proliferation and intimal thickening of rat aortic allografts.J Clin Invest,1993,92:549—559.
, http://www.100md.com
6 Epstein SE,Speir E,Zhou YF,et al.The role of infection in restenosis and atherosclerosis focus on cytomegalovirus.The Lancet,1996,348:s13—s17.
7 鄂征主编.组织培养和分子生物学技术.第一版.北京:北京出版社,1995.9—26.
8 Hendrix MG,Dormans PH,Kitlar P.The Presence of cytomegalovirus nucleic acids in arterial walls of atherosclerotic and nonatherosclerotic patients.Am J Pathol,1989,134:1151.
9 Span AH,Frederik PM,Grawls G.CMV induced vascular injury:an electron-microscopic study in the rat.Int Virol,1993,7:567—573.
10 Melnick JL,Adam E,Debakey ME.Possible role of cytomegalovirus in atherogenesis.JAMA,1990,263:2204—2207.
收稿:1999-03-18 修回:1999-08-30, http://www.100md.com