小鼠牙本质涎磷蛋白成熟蛋白编码区cDNA克隆与部分序列分析
作者:郝建军 汪平 麻孙恺 江卫民 费俭 刘正
单位:郝建军、刘正 200011上海第二医科大学口腔医学院;麻孙恺、费俭 中国科学院上海细胞生物学研究所基因工程组;汪平、江卫民 第四军医大学口腔医学院
关键词:细胞外基质蛋白质类;磷蛋白类;聚合酶链反应;小鼠
中华口腔医学杂志990614 【摘要】 目的 克隆小鼠牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)成熟蛋白编码区基因。方法 用异硫氰酸胍一步法从昆明新生小鼠磨牙牙胚组织中抽提总RNA,用Oligo(dt)作引物逆转录合成牙胚cDNA,然后利用PCR方法,从cDNA中扩增出小鼠DSPP成熟区的基因片段(约3 kbp),将所得基因片段插入pBluescript KS质粒载体,转化到大肠杆菌XL1-Blue后挑选阳性克隆,提取重组质粒DNA,通过限制性酶切和核苷酸序列分析鉴定阳性克隆。结果 重组质粒pBS-DSPP的酶切图谱和部分序列分析结果与国外文献报道一致。结论 克隆到小鼠DSPP成熟编码区基因,正在进行该基因的表达和活性鉴定。
, http://www.100md.com
Cloning and partially sequencing of mouse dentin sialophosphoprotein encoding mature protein
HAO Jianjun* , WANG Ping, MA Sunkai,et al.*
School of Stomatology, Shanghai Second Medical University, Shanghai 200011
【Abstract】 Objective Cloning and partially sequencing of mouse dentin sialophosphoprotein (DSPP) encoding mature protein. Methods Total RNA was extracted from the tooth germs of newborn mouse by acid guanidinium thiocyanata-phenol-chloroform method, the desired DNA product was obtained from the total RNA by RT-PCR with the primers including Oligo(dt) and two gene specific primers. The segment (about 3 Kbp) was inserted into pBluescript vector and the interesting plasmid was transformed into E. Coli host strain XL1- Blue. The double -stranded DNA of the positive clone was analyzed by restriction endonuclease mapping and DNA sequencing. Results The restriction endonuclease map and sequence of mouse DSPP encoding mature protein were consistent with those of the published. Conclusion The mouse DSPP cDNA encoding mature protein was obtained for further study.
, 百拇医药
【Key words】 Extracellular matrix proteins Phosphoproteins Polymerase chain reaction Mice
牙本质磷蛋白(dentin phosphoprotein, DPP)是牙本质非胶原蛋白(dentin non-collagenous proteins, DNCPs)的主要成分[1]。DPP是仅由成牙本质细胞分泌的牙本质特异蛋白,在牙本质的羟基磷灰石矿化晶体形成中有成核作用,在牙本质生物矿化中发挥着极为重要的作用。MacDougall等[2]发现了小鼠牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP),通过对其基因结构的分析,认为DPP和牙本质涎蛋白(dentin sialoprotein, DSP)来自于同一编码基因DSPP,是一个转录本(DSPP mRNA)表达产物的不同切割片段。我们根据报道的小鼠DSPP cDNA基因序列设计PCR引物,采用逆转录PCR方法,从新生昆明小鼠磨牙牙胚组织中克隆到DSPP成熟区基因,并对其进行部分核苷酸序列分析,以促进我国DSPP基因的研究。
, 百拇医药
材料和方法
1. 小鼠磨牙牙胚的来源与获取:本实验所用5~10天龄的新生昆明小鼠(B6D2F1)来源于中国科学院上海细胞生物学研究所。将新生小鼠拉颈处死,断头,暴露磨牙部位,挑开牙龈组织,挖取处于牙本质形成期的小鼠第一、二磨牙[3,4],立即置液氮中冻存,-70℃下长期保存。
2. 总RNA的提取:磨碎冻存小鼠的磨牙牙胚组织,在盛有预冷的变性缓冲液(德国宝灵曼公司)的匀浆器中充分破碎组织细胞,组织与缓冲液的比例为1:10。用异硫氰酸胍一步法从牙胚组织中提取总RNA,并进行电泳鉴定。
3. cDNA的合成和PCR扩增:根据MacDougall[2]等报道的小鼠DSPP的cDNA序列,采用PC Gene 设计PCR扩增的两条引物。为获得完整的小鼠DSPP成熟区基因,将5′和3′端引物向两侧延伸100多bp,5′端引物碱基序列为:5′AAGAATTCTCAGCCTGGAA-AGAGAGATAAGG3′,带有EcoRI酶切位点;3′端的引物序列为5′AAAGGATCCATGGGTTCCACACAGTCTG-C3′,带有BamHI酶切识别序列。用Gibco BRL公司的Super Script TM试剂盒,按其说明进行逆转录(RT),合成cDNA第一链,以其为模板,PCR扩增出小鼠DSPP成熟区基因片段(美国MJ Research公司 PTC-150型PCR仪)。Taq PlusⅡ DNA聚合酶为中科院上海生理研究所生工公司。
, 百拇医药
4. PCR产物的克隆及酶谱分析: PCR产物于1%低熔点琼脂糖凝胶上电泳回收,用大肠杆菌DNA聚合酶I Klenow片段(Promega公司)对PCR产物进行部分补平,对载体质粒pBluescript KS(pBS)用 SmaI酶切消化,平端连接目的基因片段和酶切质粒载体,转化大肠杆菌XL1-Blue,蓝白斑筛选阳性克隆pBS-DSPP。碱裂解法快速提取pBS-DSPP质粒DNA,用EcoRI和BamHI双酶切及PCR鉴定目的基因是否插入载体质粒中(限制性内切酶购自Promega公司)。
5. 核苷酸序列分析:将挑取的pBS-DSPP克隆培养扩增,用碱裂解沉淀法抽提质粒DNA,用T7启动子引物,采用Sanger双脱氧终止法,用α-35S-dATP标记进行部分序列测定。
结果
1. 总RNA:提取的新生小鼠牙胚总RNA电泳(图1),可见28S、18S和5S 3条带,其中28S的带最亮,28S带亮度约为18S带的2倍,表明所抽提的总RNA无明显的降解。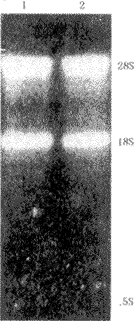
, 百拇医药
1 人牙乳头组织总RNA;2小鼠牙乳头组织总RNA
图1 小鼠牙胚组织总RNA琼脂糖凝胶(1%)电泳
2. RT-PCR:牙胚组织总RNA经RT-PCR扩增后,可见大小约3.0 kbp的特异扩增产物(图2)。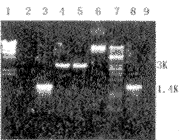
1 λDNA/HindIII;2 阴性对照(未加重组质粒模板);3 以重组质粒为模板的DSP PCR产物;4 pBS-DSPP经EcoR1和BamH1双酶切;5 目的产物DSPP;6 重组质粒pBS-DSPP;7 λDNA/Pst1; 8 DSP;9 阴性产物(未加模板)
图2 PCR扩增产物DSPP和重组质粒pBS-DSPP酶切图谱琼脂糖凝胶(1%)电泳
, 百拇医药
3. pBS-DSPP克隆的酶谱分析(图2):重组质粒pBS-DSPP经EcoR1和BamH1双酶切后为3 kbp的DSPP和2.96kbp的载体pBS(第4道)。3 kbp的DSPP与 PCR的目的产物电泳条带(第5道)平齐。重组质粒pBS-DSPP的酶切图谱与预期的完全一致。以pBS-DSPP为模板,用DSP PCR引物可扩增出1.4 kbp的条带(第3道),且与DSP PCR产物电泳条带(第8道)平齐[5]。
4. pBS-DSPP克隆的序列分析:DSPP成熟蛋白编码区基因克隆质粒pBS-DSPP部分核苷酸的测序结果(图3),可读出的200个碱基序列与MacDougall等[2]报道的结果完全相同,其中第59~116位碱基序列为…C(59)T TTG AAG ACA TTG ATT ACT ACT CAT AAT GAA AAT GAA GAT AAT TAT ATA TAT ATA TGC A(116)…。
, 百拇医药
图3 pBS-DSPP的序列测定结果(第59~116位碱基)
讨论
牙本质中无机物约占其总重量的70%,有机物占18%,水占12%。有机物由胶原和牙本质非胶原蛋白组成,在牙本质非胶原蛋白中DPP占50%,是牙本质中含量仅次于I型胶原蛋白的细胞外基质成分。DPP不仅是成牙本质细胞特异的表面标记,而且在牙本质生物矿化中具有成核作用。当Ca2+存在时,DPP形成β-片层构型,此构型形成带负电荷的表面,在羟基磷灰石晶体形成时,易与Ca2+结合,在胶原间隙的中部矿化沉淀,由于它与钙的高亲和力,DPP可富集钙离子,从而参与早期晶体的形成。同时还可调节矿化晶体的形态和生长速度,是矿化组织稳定的关键调节因子。
由于DPP在牙本质形成中的重要作用,从70年代末各国口腔生物学家就开始对其结构进行研究。通过对分离纯化的小鼠、大鼠和牛DPP蛋白的研究,发现其氨基酸组成也很独特,90%氨基酸是丝氨酸(45%~50%)和天门冬氨酸(35%~38%)[6]。其显著特点是高度磷酸化,为目前已知的酸性最强的蛋白质之一。由于DPP含有许多重复的氨基酸序列和丰富的磷酸丝氨酸,使常规化学测序十分困难。同时由于DPP的免疫原性很弱,研究很难深入,克隆DPP的cDNA基因或许是分析研究DPP的最好途径。
, 百拇医药
George等[7]和Ritchie等[8]在企图用抗体从大鼠成牙本质细胞和牙髓的cDNA文库中筛选DPP基因时分别发现了牙本质基质蛋白1(dentin matrix protein 1, DMP1)和DSP,但DPP基因却一直未能被克隆。最近美国德克萨斯大学圣安东尼奥分校MacDougall博士领导的实验小组发现了小鼠DSPP[2],cDNA序列全长4 420个碱基对,共编码940个氨基酸。通过对其基因结构的分析,认为DPP和DSP来自于同一编码基因,是一个转录本(DSPP mRNA)表达产物的不同切割片段。此外,他们还发现DSPP基因定位于人类第4号染色体上,推测是遗传性牙本质发育不全II型(DGI-II,染色体座位为4q21-23)和 牙本质发育不良II 型(DD-II,为4q)的重要候选基因之一[9]。这不仅解决了长期以来DPP基因克隆的难题,同时也给人们发现DGI和DD的致病基因找到了突破口。
根据小鼠DSPP cDNA序列,本组通过RT-PCR技术扩增出3.0 kbp的特异产物,与质粒载体连接后转化到大肠杆菌中,酶切图谱和部分核苷酸序列分析均与报道的序列完全相同[2]。此外,以pBS-DSPP为模板,用DSP的引物进行PCR,扩增出了DSP特异条带(第3道),也证实DSP来源于DSPP这一大的转录本。前不久MacDougall等[2]又克隆了小鼠DSPP基因组DNA(约9.4kbp),进一步确认了DSP和DPP是由一个连续开放读框的单基因编码[10],为研究DSPP基因的表达调控打下了基础。
, 百拇医药
由于DSPP的特异结构和重要功能,以及作为目前已知的唯一的牙本质特异蛋白及牙本质发育不全候选基因,对DSPP的结构和功能进行研究十分重要。本组首次从中国昆明小鼠中克隆到DSPP成熟区基因,发现其核酸序列与报道的一致,这将为进一步的工作奠定基础。有关小鼠DSPP的蛋白表达和人DSPP基因的克隆工作正在进行,有希望推动和促进我国在牙本质特异性蛋白方面的研究工作。
国家自然科学基金(39800155,39700160)、中国科学院上海细胞生物学研究所开放实验室及上海市博士后科研资助计划项目资助课题
参考文献
1 郝建军.牙本质特异性蛋白的分子生物学研究进展.牙体牙髓牙周病学杂志,1998,8:286.
2 MacDougall M, Simmons D, Luan X, et al. Dentin phosphoprotein and dentin sialoprotein are cleavage products expressed from a single transcript coded by a gene on human chromosome 4.Dentin phosphoprotein DNA sequence determination. J Biol Chem , 1997,272:835-842.
, 百拇医药
3 郝建军, 汪平, 史俊南, 等.碱性成纤维细胞生长因子对体外大鼠牙胚分化的影响.牙体牙髓牙周病学杂志,1997,7:180.
4 郝建军.体外牙胚培养在造牙本质细胞分化研究中的应用.国外医学口腔分册,1996,23:14.
5 郝建军,麻孙恺,费俭, 等.小鼠牙本质涎蛋白成熟编码区cDNA克隆与部分序列分析.牙体牙髓牙周病学杂志,1999,9:40.
6 Butler WT, Ritchie H. The nature and functional significance of dentin extracellular matrix proteins. Int J Dev Biol, 1995,39:169.
7 George A, Sabsay B, Simonian PA, et al. Characterization of a novel dentin matrix acidic phosphoprotein.Implications for induction of biomineralization. J Biol Chem, 1993,268:12624-12630.
, 百拇医药
8 Ritchie HH, Hou H, Veis A, et al. Cloning and sequence determination of rat dentin sialoprotein, a novel dentin protein. J Biol Chem, 1994,269:3698-3702.
9 MacDougall M. Refined mapping of the human dentin sialophosphoprotein(DSPP) gene within the critical dentinogenesis imperfecta type II and dentin dysplasia II loci. Eur J Oral Sci, 1998, 106 Suppl 1:227-233.
10 Feng JQ, Luan X, Wallace J, et al. Genomic organization, chromosomal mapping, and promoter analysis of the mouse dentin sialophosphoprotein (DSPP) gene, which codes for both dentin sialoprotein and dentin phosphoprotein. J Biol Chem, 1998,273:9457-9464.
(收稿:1998-09-11 修回:1999-03-25), 百拇医药
单位:郝建军、刘正 200011上海第二医科大学口腔医学院;麻孙恺、费俭 中国科学院上海细胞生物学研究所基因工程组;汪平、江卫民 第四军医大学口腔医学院
关键词:细胞外基质蛋白质类;磷蛋白类;聚合酶链反应;小鼠
中华口腔医学杂志990614 【摘要】 目的 克隆小鼠牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)成熟蛋白编码区基因。方法 用异硫氰酸胍一步法从昆明新生小鼠磨牙牙胚组织中抽提总RNA,用Oligo(dt)作引物逆转录合成牙胚cDNA,然后利用PCR方法,从cDNA中扩增出小鼠DSPP成熟区的基因片段(约3 kbp),将所得基因片段插入pBluescript KS质粒载体,转化到大肠杆菌XL1-Blue后挑选阳性克隆,提取重组质粒DNA,通过限制性酶切和核苷酸序列分析鉴定阳性克隆。结果 重组质粒pBS-DSPP的酶切图谱和部分序列分析结果与国外文献报道一致。结论 克隆到小鼠DSPP成熟编码区基因,正在进行该基因的表达和活性鉴定。
, http://www.100md.com
Cloning and partially sequencing of mouse dentin sialophosphoprotein encoding mature protein
HAO Jianjun* , WANG Ping, MA Sunkai,et al.*
School of Stomatology, Shanghai Second Medical University, Shanghai 200011
【Abstract】 Objective Cloning and partially sequencing of mouse dentin sialophosphoprotein (DSPP) encoding mature protein. Methods Total RNA was extracted from the tooth germs of newborn mouse by acid guanidinium thiocyanata-phenol-chloroform method, the desired DNA product was obtained from the total RNA by RT-PCR with the primers including Oligo(dt) and two gene specific primers. The segment (about 3 Kbp) was inserted into pBluescript vector and the interesting plasmid was transformed into E. Coli host strain XL1- Blue. The double -stranded DNA of the positive clone was analyzed by restriction endonuclease mapping and DNA sequencing. Results The restriction endonuclease map and sequence of mouse DSPP encoding mature protein were consistent with those of the published. Conclusion The mouse DSPP cDNA encoding mature protein was obtained for further study.
, 百拇医药
【Key words】 Extracellular matrix proteins Phosphoproteins Polymerase chain reaction Mice
牙本质磷蛋白(dentin phosphoprotein, DPP)是牙本质非胶原蛋白(dentin non-collagenous proteins, DNCPs)的主要成分[1]。DPP是仅由成牙本质细胞分泌的牙本质特异蛋白,在牙本质的羟基磷灰石矿化晶体形成中有成核作用,在牙本质生物矿化中发挥着极为重要的作用。MacDougall等[2]发现了小鼠牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP),通过对其基因结构的分析,认为DPP和牙本质涎蛋白(dentin sialoprotein, DSP)来自于同一编码基因DSPP,是一个转录本(DSPP mRNA)表达产物的不同切割片段。我们根据报道的小鼠DSPP cDNA基因序列设计PCR引物,采用逆转录PCR方法,从新生昆明小鼠磨牙牙胚组织中克隆到DSPP成熟区基因,并对其进行部分核苷酸序列分析,以促进我国DSPP基因的研究。
, 百拇医药
材料和方法
1. 小鼠磨牙牙胚的来源与获取:本实验所用5~10天龄的新生昆明小鼠(B6D2F1)来源于中国科学院上海细胞生物学研究所。将新生小鼠拉颈处死,断头,暴露磨牙部位,挑开牙龈组织,挖取处于牙本质形成期的小鼠第一、二磨牙[3,4],立即置液氮中冻存,-70℃下长期保存。
2. 总RNA的提取:磨碎冻存小鼠的磨牙牙胚组织,在盛有预冷的变性缓冲液(德国宝灵曼公司)的匀浆器中充分破碎组织细胞,组织与缓冲液的比例为1:10。用异硫氰酸胍一步法从牙胚组织中提取总RNA,并进行电泳鉴定。
3. cDNA的合成和PCR扩增:根据MacDougall[2]等报道的小鼠DSPP的cDNA序列,采用PC Gene 设计PCR扩增的两条引物。为获得完整的小鼠DSPP成熟区基因,将5′和3′端引物向两侧延伸100多bp,5′端引物碱基序列为:5′AAGAATTCTCAGCCTGGAA-AGAGAGATAAGG3′,带有EcoRI酶切位点;3′端的引物序列为5′AAAGGATCCATGGGTTCCACACAGTCTG-C3′,带有BamHI酶切识别序列。用Gibco BRL公司的Super Script TM试剂盒,按其说明进行逆转录(RT),合成cDNA第一链,以其为模板,PCR扩增出小鼠DSPP成熟区基因片段(美国MJ Research公司 PTC-150型PCR仪)。Taq PlusⅡ DNA聚合酶为中科院上海生理研究所生工公司。
, 百拇医药
4. PCR产物的克隆及酶谱分析: PCR产物于1%低熔点琼脂糖凝胶上电泳回收,用大肠杆菌DNA聚合酶I Klenow片段(Promega公司)对PCR产物进行部分补平,对载体质粒pBluescript KS(pBS)用 SmaI酶切消化,平端连接目的基因片段和酶切质粒载体,转化大肠杆菌XL1-Blue,蓝白斑筛选阳性克隆pBS-DSPP。碱裂解法快速提取pBS-DSPP质粒DNA,用EcoRI和BamHI双酶切及PCR鉴定目的基因是否插入载体质粒中(限制性内切酶购自Promega公司)。
5. 核苷酸序列分析:将挑取的pBS-DSPP克隆培养扩增,用碱裂解沉淀法抽提质粒DNA,用T7启动子引物,采用Sanger双脱氧终止法,用α-35S-dATP标记进行部分序列测定。
结果
1. 总RNA:提取的新生小鼠牙胚总RNA电泳(图1),可见28S、18S和5S 3条带,其中28S的带最亮,28S带亮度约为18S带的2倍,表明所抽提的总RNA无明显的降解。

, 百拇医药
1 人牙乳头组织总RNA;2小鼠牙乳头组织总RNA
图1 小鼠牙胚组织总RNA琼脂糖凝胶(1%)电泳
2. RT-PCR:牙胚组织总RNA经RT-PCR扩增后,可见大小约3.0 kbp的特异扩增产物(图2)。

1 λDNA/HindIII;2 阴性对照(未加重组质粒模板);3 以重组质粒为模板的DSP PCR产物;4 pBS-DSPP经EcoR1和BamH1双酶切;5 目的产物DSPP;6 重组质粒pBS-DSPP;7 λDNA/Pst1; 8 DSP;9 阴性产物(未加模板)
图2 PCR扩增产物DSPP和重组质粒pBS-DSPP酶切图谱琼脂糖凝胶(1%)电泳
, 百拇医药
3. pBS-DSPP克隆的酶谱分析(图2):重组质粒pBS-DSPP经EcoR1和BamH1双酶切后为3 kbp的DSPP和2.96kbp的载体pBS(第4道)。3 kbp的DSPP与 PCR的目的产物电泳条带(第5道)平齐。重组质粒pBS-DSPP的酶切图谱与预期的完全一致。以pBS-DSPP为模板,用DSP PCR引物可扩增出1.4 kbp的条带(第3道),且与DSP PCR产物电泳条带(第8道)平齐[5]。
4. pBS-DSPP克隆的序列分析:DSPP成熟蛋白编码区基因克隆质粒pBS-DSPP部分核苷酸的测序结果(图3),可读出的200个碱基序列与MacDougall等[2]报道的结果完全相同,其中第59~116位碱基序列为…C(59)T TTG AAG ACA TTG ATT ACT ACT CAT AAT GAA AAT GAA GAT AAT TAT ATA TAT ATA TGC A(116)…。

, 百拇医药
图3 pBS-DSPP的序列测定结果(第59~116位碱基)
讨论
牙本质中无机物约占其总重量的70%,有机物占18%,水占12%。有机物由胶原和牙本质非胶原蛋白组成,在牙本质非胶原蛋白中DPP占50%,是牙本质中含量仅次于I型胶原蛋白的细胞外基质成分。DPP不仅是成牙本质细胞特异的表面标记,而且在牙本质生物矿化中具有成核作用。当Ca2+存在时,DPP形成β-片层构型,此构型形成带负电荷的表面,在羟基磷灰石晶体形成时,易与Ca2+结合,在胶原间隙的中部矿化沉淀,由于它与钙的高亲和力,DPP可富集钙离子,从而参与早期晶体的形成。同时还可调节矿化晶体的形态和生长速度,是矿化组织稳定的关键调节因子。
由于DPP在牙本质形成中的重要作用,从70年代末各国口腔生物学家就开始对其结构进行研究。通过对分离纯化的小鼠、大鼠和牛DPP蛋白的研究,发现其氨基酸组成也很独特,90%氨基酸是丝氨酸(45%~50%)和天门冬氨酸(35%~38%)[6]。其显著特点是高度磷酸化,为目前已知的酸性最强的蛋白质之一。由于DPP含有许多重复的氨基酸序列和丰富的磷酸丝氨酸,使常规化学测序十分困难。同时由于DPP的免疫原性很弱,研究很难深入,克隆DPP的cDNA基因或许是分析研究DPP的最好途径。
, 百拇医药
George等[7]和Ritchie等[8]在企图用抗体从大鼠成牙本质细胞和牙髓的cDNA文库中筛选DPP基因时分别发现了牙本质基质蛋白1(dentin matrix protein 1, DMP1)和DSP,但DPP基因却一直未能被克隆。最近美国德克萨斯大学圣安东尼奥分校MacDougall博士领导的实验小组发现了小鼠DSPP[2],cDNA序列全长4 420个碱基对,共编码940个氨基酸。通过对其基因结构的分析,认为DPP和DSP来自于同一编码基因,是一个转录本(DSPP mRNA)表达产物的不同切割片段。此外,他们还发现DSPP基因定位于人类第4号染色体上,推测是遗传性牙本质发育不全II型(DGI-II,染色体座位为4q21-23)和 牙本质发育不良II 型(DD-II,为4q)的重要候选基因之一[9]。这不仅解决了长期以来DPP基因克隆的难题,同时也给人们发现DGI和DD的致病基因找到了突破口。
根据小鼠DSPP cDNA序列,本组通过RT-PCR技术扩增出3.0 kbp的特异产物,与质粒载体连接后转化到大肠杆菌中,酶切图谱和部分核苷酸序列分析均与报道的序列完全相同[2]。此外,以pBS-DSPP为模板,用DSP的引物进行PCR,扩增出了DSP特异条带(第3道),也证实DSP来源于DSPP这一大的转录本。前不久MacDougall等[2]又克隆了小鼠DSPP基因组DNA(约9.4kbp),进一步确认了DSP和DPP是由一个连续开放读框的单基因编码[10],为研究DSPP基因的表达调控打下了基础。
, 百拇医药
由于DSPP的特异结构和重要功能,以及作为目前已知的唯一的牙本质特异蛋白及牙本质发育不全候选基因,对DSPP的结构和功能进行研究十分重要。本组首次从中国昆明小鼠中克隆到DSPP成熟区基因,发现其核酸序列与报道的一致,这将为进一步的工作奠定基础。有关小鼠DSPP的蛋白表达和人DSPP基因的克隆工作正在进行,有希望推动和促进我国在牙本质特异性蛋白方面的研究工作。
国家自然科学基金(39800155,39700160)、中国科学院上海细胞生物学研究所开放实验室及上海市博士后科研资助计划项目资助课题
参考文献
1 郝建军.牙本质特异性蛋白的分子生物学研究进展.牙体牙髓牙周病学杂志,1998,8:286.
2 MacDougall M, Simmons D, Luan X, et al. Dentin phosphoprotein and dentin sialoprotein are cleavage products expressed from a single transcript coded by a gene on human chromosome 4.Dentin phosphoprotein DNA sequence determination. J Biol Chem , 1997,272:835-842.
, 百拇医药
3 郝建军, 汪平, 史俊南, 等.碱性成纤维细胞生长因子对体外大鼠牙胚分化的影响.牙体牙髓牙周病学杂志,1997,7:180.
4 郝建军.体外牙胚培养在造牙本质细胞分化研究中的应用.国外医学口腔分册,1996,23:14.
5 郝建军,麻孙恺,费俭, 等.小鼠牙本质涎蛋白成熟编码区cDNA克隆与部分序列分析.牙体牙髓牙周病学杂志,1999,9:40.
6 Butler WT, Ritchie H. The nature and functional significance of dentin extracellular matrix proteins. Int J Dev Biol, 1995,39:169.
7 George A, Sabsay B, Simonian PA, et al. Characterization of a novel dentin matrix acidic phosphoprotein.Implications for induction of biomineralization. J Biol Chem, 1993,268:12624-12630.
, 百拇医药
8 Ritchie HH, Hou H, Veis A, et al. Cloning and sequence determination of rat dentin sialoprotein, a novel dentin protein. J Biol Chem, 1994,269:3698-3702.
9 MacDougall M. Refined mapping of the human dentin sialophosphoprotein(DSPP) gene within the critical dentinogenesis imperfecta type II and dentin dysplasia II loci. Eur J Oral Sci, 1998, 106 Suppl 1:227-233.
10 Feng JQ, Luan X, Wallace J, et al. Genomic organization, chromosomal mapping, and promoter analysis of the mouse dentin sialophosphoprotein (DSPP) gene, which codes for both dentin sialoprotein and dentin phosphoprotein. J Biol Chem, 1998,273:9457-9464.
(收稿:1998-09-11 修回:1999-03-25), 百拇医药