慢性肾衰继发甲状旁腺功能亢进的发病机制和治疗现状
作者:季大玺 谢红浪
单位:南京军区南京总医院 解放军肾脏病研究所 (南京,210002)
关键词:尿毒症;继发性甲状旁腺功能亢进;高磷血症
肾脏病与透析肾移植杂志990620
慢性肾功能衰竭(chronic renal failure,CRF)早期,就可发生肾性骨病、继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)。一般认为1,25(OH)2D3(calcitriol)缺乏和高磷血症是SHPT的主要原因,事实上GFR 60~80 ml/min的患者口服大剂量含磷制剂将导致低磷血症而不是高磷血症,说明磷的排泄高于正常,而此时甲状旁腺素(parathyroid hormone,PTH)水平已经升高;随着肾功能恶化,GFR接近20 ml/min时才逐渐发生高磷血症。故CRF早期PTH水平升高的主要原因是1,25(OH)2D3水平低下,接近终末期肾衰时,高磷血症将成为加重SHPT的重要因素[1]。本文就慢性肾功能衰竭SHPT的发病机制和治疗现状作一简述。
, 百拇医药
1 SHPT 发病机制的研究进展
1.1 维生素D3受体密度和结合力降低 体外研究发现1,25(OH)2D3能直接抑制甲状旁腺细胞PTH-mRNA转录;1,25(OH)2D3水平低下使PTH-mRNA水平升高,PTH合成增加。1,25(OH)2D3通过胞浆受体复合物发挥作用,人类维生素D受体(VDR)为427个氨基酸组成的多肽,25~112氨基酸残基是DNA结合区,200~400氨基酸残基是配体结合区[2]。
VDR属于核受体超家族,该家族还包括类固醇激素、甲状腺素和维甲酸受体。VDR的DNA结合区具备核受体特征的超级结构,有两个含锌的指状突起部位,介导VDR与维生素D反应性基因(vitamin D responsive genes)DNA 5端的调节促进区(即维生素D反应区,vitamin D responsive element,VDRE)的结合,维生素D-VDR复合体与这个片段结合后,使VDR特异性前体DNA转录为mRNA。尿毒症时VDR的密度和结合力均降低,提高1,25(OH)2D3水平能使VDR上调,反之则使之下调。
, 百拇医药
VDR数量和功能降低使1,25(OH)2D3对甲状旁腺抑制作用减低。服用1,25(OH)2D3后,VDR-mRNA转录增加并使VDR半衰期延长,上调小肠和甲状旁腺细胞上VDR数量[3]。近来有研究资料表明,高钙饮食本身即可上调VDR,低钙饮食和低钙血症则使之下调。此外,维生素D缺乏性大鼠饲以高钙饮食能避免甲状旁腺细胞上VDR减少,从而预防SHPT的发生,提示1,25(OH)2D3上调VDR的作用是通过提高血钙水平而介导[4]。1,25(OH)2D3和血钙水平同步升高使VDR浓度增高的作用更显著,故在应用1,25(OH)2D3同时给予足够钙剂,VDR升高更快,透析患者合理使用1,25(OH)2D3,并使血钙维持在理想水平是治疗成功的关键。
, 百拇医药
1.2 1,25(OH)2D3抵抗 研究发现,血钙、磷和1,25(OH)2D3水平均正常的患者同样有发生SHPT的可能,轻度肾功能不全大鼠尽管VDR正常,仍有SHPT的生化异常和组织学改变,说明此时机体对生理水平1,25(OH)2D3已有抵抗作用,PTH水平业已升高。同样,1,25(OH)2D3水平正常不足以抑制透析患者发生SHPT,还必需间歇性静脉注射1,25(OH)2D3,使之在短时间内达到超生理浓度,与VDR的结合力更强,更有效地抑制PTH分泌。Hsu等发现,尿毒症患者的超滤液有减少小肠VDR与DNA的作用,提示尿毒症时不仅干扰1,25(OH)2D3的合成和清除,还能影响VDR的合成、细胞核对1,25(OH)2D3-VDR复合体的摄取及其与VDRE的结合[5]。
, 百拇医药
此外,SHPT的特点为甲状旁腺细胞增生,而且多表现为结节性增生。结节性增生与弥漫增生相比,VDR密度更低,对1,25(OH)2D3的反应性可能更差。有研究认为基因突变导致了结节性增生,部分尿毒症患者染色体上抑癌基因失活,使单克隆甲状旁腺细胞自主性增生形成结节。HPT严重程度也是影响1,25(OH)2D3疗效的一个原因。有研究认为,对1,25(OH)2D3抵抗者,腺体通常较大,故腺体越大,发生1,25(OH)2D3抵抗的概率也越高。
1.3 钙传感器受体基因突变 最近Brown等[6]从甲状旁腺和肾脏细胞上克隆出钙传感器受体(calcium sensor receptor,CaR)。该受体是一种分布于细胞膜的蛋白质,不仅能结合钙离子,还能与其它二价、三价和多价阳离子结合。钙离子通过CaR发挥作用:在甲状旁腺内与G蛋白偶联的CaR感受到钙离子浓度降低,导致预先合成的PTH分泌释放;细胞外钙离子水平增高则激活CaR,抑制PTH的分泌。CaR不仅介导了钙离子抑制PTH分泌,可能还影响PTH基因表达和甲状旁腺细胞增生[7]。
, 百拇医药
对起源于CaR基因突变遗传性疾病的认识,更加深了对CaR了解。家族性低钙尿高钙血症、新生儿重症甲旁亢和常染色体显性遗传性甲旁亢均与CaR异常有关,在散发性甲状旁腺腺瘤或SHPT患者中也发现了CaR基因突变现象。但研究发现,CaR拮抗剂(calcimimetics)可抑制CRF动物甲状旁腺细胞增生[8]。由于CRF发生SHPT与细胞外钙浓度的感受异常有关,有作者认为CaR变异在SHPT早期就起作用。研究发现,原发性甲状旁腺腺瘤和SHPT的尿毒症患者,CaR在mRNA和蛋白质水平表达均下降,结节性增生的腺体处CaR-mRNA表达,比邻近的非结节性增生处降低更为明显。但各项研究的结果并非完全吻合。CaR拮抗剂的问世可能是SHPT治疗的重要进展。初步研究表明,calcimimetic类制剂能有效降低原发和继发性甲旁亢的PTH水平,但作用是一过性的[9]。
2 SHPT 的临床表现
由于早期采取预防和治疗SHPT的措施,使近30年来SHPT的临床表现发生了显著变化,以往常见的骨痛、肌痛、肌无力、瘙痒、骨骼外钙化、自发性肌键撕裂、钙化防御和骨骼变形等现象已非常罕见,仅见于持续、严重高磷血症和(或)1,25(OH)2D3缺乏者,PTH升高十分显著,并伴有生化异常。高磷血症和钙化防御是临床上亟待解决的两大难题。
, 百拇医药
2.1 高磷血症
高磷血症是透析患者十分常见且严重的并发症,发生率50%以上。Block等[10]根据血磷水平把透析患者分为五组,发现患者血磷越高,死亡率也越高,>2.1 mmol/L组死亡率已明显升高(P=0.03),>2.6 mmol/L组死亡率更高(P<0.0001);而高钙血症却不影响死亡率,显然其临床意义不同于高磷血症(图1,2)。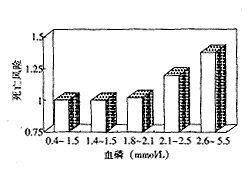
图1 不同血磷水平患者的死亡相对风险(n=6407例)
图2 不同血钙水平患者的死亡相对风险(n=2669)
CRF时实施低磷饮食不影响离子钙和1,25(OH)2D3水平,但能降低PTH水平,改善SHPT,说明低磷能减少PTH分泌。体内和体外研究都证实,高磷可直接刺激PTH分泌和甲状旁腺细胞增生,大鼠饲以低磷饮食,PTH在mRNA转录后的水平降低,高磷和低磷饮食分别增加和降低甲状旁腺细胞的增生。早期CRF大鼠限磷能减少PTH-mRNA的表达,而肾功能正常大鼠饲以高磷饮食,尽管血钙、1,25(OH)2D3和VDR均正常,但甲状旁腺细胞肥大,PTH-mRNA表达增加。在体外培养的甲状旁腺细胞培养基中加入磷使PTH分泌增加,可能发生于转录后水平;而低磷时甲状旁腺细胞基质蛋白与PTH-mRNA 3’端的非转录区结合力减低,使mRNA稳定性下降。高磷血症能加重SHPT,并导致甲状旁腺对1,25(OH)2D3作用发生抵抗,降低1,25(OH)2D3疗效。
, 百拇医药
2.1.1 病因 高磷血症的原因是多方面的(图3)。饮食摄磷过多是最常见的原因,降低血磷必需控制磷摄入量。此外还需要使用磷结合剂,包括大剂量碳酸钙和醋酸钙等,但可能导致高钙血症。透析不充分也是高磷血症的主要原因,研究证实每周夜间血液透析(NHD)与传统血液透析(CHD)相比,磷清除更充分,治疗6个月后,两组血磷分别为1.29 mmol/L和2.10 mmol/L,且NHD组磷摄入增加50%,无一例服用磷结合剂[11]。另外,有极少数严重SHPT患者,破骨细胞骨质吸收增加,骨钙和骨磷向外释放,加重了高磷血症。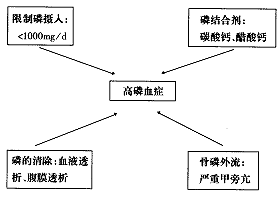
图3 影响血磷水平的因素
2.1.2 临床意义 持续高磷血症可产生严重后果。首先,高磷血症使钙磷乘积升高可导致软组织钙化,同时直接作用于甲状旁腺,刺激PTH合成,促进甲状旁腺细胞增生,从而加重SHPT。严重SHPT的透析患者,血磷越高,PTH水平也越高,PTH-钙的乙状曲线向右移,高磷血症得到控制之后,PTH水平下降,曲线再度左移,血磷越低,PTH水平也越低。此外,高磷血症还可导致1,25(OH)2D3抵抗。血磷超过2.26~2.42 mmol/L时,不管是口服还是静脉注射1,25(OH)2D3,都达不到降低PTH的目的,最终需要手术切除甲状旁腺(PTX)。故1,25(OH)2D3治疗要获得成功,必需先控制高磷血症。
, http://www.100md.com
高磷血症是透析患者SHPT治疗失败的根本原因,Yudd等[12]给42例SHPT患者用1,25(OH)2D3静脉治疗3年,PTH从初始1570 ng/L降至105ng/L,其中12例(30%)伴高磷血症,5例为一过性增高,PTH水平增加了820 ng/L,通过饮食指导而得到控制;其余7例属难治性高磷血症,PTH居高不下,不得不多次中断1,25(OH)2D3治疗,最终5例行PTX。而8例患者发生过16次高钙血症(平均2.93 mmol/L),仅需暂时减少1,25(OH)2D3,调整磷结合剂用量,或改用碳酸镁,最终SHPT得以控制。
2.2 钙化防御(calciphylaxis)
2.2.1 临床表现 钙化防御通常见于维持透析或肾移植术后患者,表现为双侧对称性浅表部位的病灶,病灶远端可触及持续搏动,常见疼痛性斑点状皮疹,酷似网状青斑,在指(趾)尖、踝、膝或臀部表面可见紫色结节,进一步可发展为出血灶;病情进展发生皮肤坏疽后,可出现手指皮肤疼痛,部分患者出现手指坏疽。皮肤结节活检,可见小动脉壁钙沉积伴小叶状脂肪坏死、钙化和中性粒细胞、淋巴细胞及巨噬细胞浸润。早期报道的病灶多位于肢体远端,并伴有SHPT,行PTX后,病变迅速改善也进一步支持两者之间的联系[13]。
, http://www.100md.com
2.2.2 发病机制 Seyle等1962年首次在动物模型发现,钙化防御与二价离子代谢异常有关。Seyle认为,发生全身性异位钙化需要两个条件,首先要具备某些因素(如PTH、维生素D或饮食中钙、磷摄入过多等),组织敏感性提高;其次需要某些触发条件(如皮下注射),2~3天后在皮下注射部位和全身出现微小钙沉着(显微镜下可见)。经数年之后,临床上出现周围组织缺血、坏死和皮肤溃烂表现为主的综合征,与Seyle的动物模型十分相似,被命名为钙化防御。值得一提的是,钙化防御表现为全身浅表部位血管的钙化,与Seyle的动物模型只是相似而已,后者表现为全身转移性钙化,而局部血管没有钙化灶。钙化防御的发病机制目前尚未明确,可能与以下原因有关:
钙磷乘积升高是发生钙化防御最首要因素;其次要求皮肤钙含量增高,降低透析液钙离子浓度可很大程度地逆转钙化防御。再则服用碳酸钙过量导致高钙血症也会触发钙化防御,停药之后可以逆转。由于绝大多数透析患者都服用含钙的磷结合剂,由此摄入过多元素钙,有作者认为这也是导致钙化防御的一个重要原因。
, 百拇医药
PTH水平升高是钙化防御另一个好发因素。早年Gipstein等描述了一组钙化防御的患者行PTX后,指端溃疡愈合;同样值得重视的是,这些患者出现钙化防御之前较长时间内都伴有明显的高磷血症,降低PTH水平、限制磷的摄入之后,钙化防御可以逆转[14]。但近10年来,有作者报道部分低PTH患者也伴有钙化防御,随着1,25(OH)2D3时代到来以及二价离子代谢异常的控制,严重肥胖,特别是白人妇女,也成为重要的好发因素。
钙化防御患者预后很差,多死于败血症或缺血性疾病。由于发病机制认识不充分,故其治疗方案也不明确。首先要降低钙磷乘积,并控制SHPT;其次要加强对病变部位的护理以及全身使用抗生素。PTH极高者才能行PTX,对低PTH则绝对不能施行。有报道47例钙化防御患者中,31例行PTX,其中50%在术后9周内死亡[15]。透析液钙离子浓度尽可能不超过1.25 mmol/L,慎用含钙的磷结合剂,或选用碳酸镁等制剂。
, 百拇医药
3 SHPT 的治疗策略
1,25(OH)2D3的问世成为治疗SHPT的重要进展。1,25(OH)2D3在体内有多种靶细胞,VDR分布于小肠、甲状旁腺、肾脏、骨骼、白细胞、表皮细胞等处,1,25(OH)2D3的效应也取决于所作用组织:在肠道促进钙和磷吸收,在骨骼促进骨形成和骨吸收,在甲状旁腺则抑制PTH的合成。
高磷和高钙血症是使用1,25(OH)2D3最大障碍,口服治疗时高磷和高钙血症的发生率分别达70%和75%,静脉用药时发生率相对较低。导致高钙和高磷的重要原因是剂量过小,初始剂量应根据HPT浓度而定,PTH越高,1,25(OH)2D3剂量也越大:1,25(OH)2D3剂量不足,不但不能抑制PTH分泌,反而促进胃肠道的钙、磷吸收。其次,研究发现治疗高磷血症多发生于PTH水平接近正常时,治疗初期发生率很低,因为PTH和碱性磷酸酶(AKP)接近正常时,骨质再矿化率降低,缓冲钙、磷代谢能力下降,如此时饮食中钙、磷摄入过多,或磷结合剂使用不当,或钙摄入过多,均可导致高磷血症或高钙血症。
, 百拇医药
对于CRF伴SHPT者,最理想的维生素D制剂应该只抑制PTH分泌而不影响肠道和骨骼,避免高钙和高磷血症,paricalcitol[19-nor-1α,25(OH)2D2]可能就是这样一个制剂。
小结 总之,SHPT是透析患者最常见并发症,对其发病机制已有较深入了解。1,25(OH)2D3治疗时应先纠正高磷血症,合理使用磷结合剂;HPT程度越重,1,25(OH)2D3剂量也越大,剂量要足,并建议静脉用药。此外,临床上正在寻找没有高钙和高磷副作用的维生素D制剂。
参考文献
1 Slatopolsky E,Delmez JA.Pathogenesis of secondary hyperparathyroidism.Am J Kidney Dis,1994,23:229
, 百拇医药
2 Demay ME,Kiernan MW,Deluca HF.Sequences in the human parathyroid hormone gene that binds the 1,25-dihydroxyvitamin D3 receptor and mediates transcriptional repression in response to 1,25-dihydroxyvitamin D3.Proc Natl Acad Sci USA,1992,89:8097
3 Deda M,Finch J,Borwn AJ et al.1,25-dihydroxyvitamin D3 and 22-oxacalcitriol prevent the decrease in vitamin D receptor content in the parathyroid glands of uremic rats.Kidney Int,1996,50:34
, http://www.100md.com
4 Brown AJ,Zhong M,Finch J et al.The roles of calcium and 1,25-dihydroxyvitamin D3 in the regulation of vitamin D receptor expression by rat parathyroid glands.Endocrinology,1995,136:1419
5 Hsu CH,Patel SR,Young EW.Mechanism of decreased calcitriol degradation in renal failure.Am J Physiol,1992,262:F192
6 Brown Em,Gamba G,Riccardi D et al.Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid.Nature,1993,368:575
, http://www.100md.com
7 Brown EM,Pollack M,Hebert SC.The extracellular calcium-sensing receptor:Its role in health and disease.Annu Rev Med,1998,49:15
8 Wada M,Furuya Y,Sakiyama J et al.The calcimimetic compound NPS R-568 suppresses parathyroid cell proliferation in rats with renal insufficiency-control of parathyroid cell growth via a calcium receptor.J Clin Invest,1997,100:2977
9 Antonsen Je,Sherrard DJ,Andress DL.A calcimimetic agent acutely suppresses parathyroid hormone levels in patients with chronic renal failure.Kidney Int,1998,53:223
, 百拇医药
10 Block GA,Hulbert-Shearon E,Levin NW et al.Associations of serum phosphorus and calcium×phosphate product with mortality risk in chronic hemodialysis patients:A national study.Am J Kidney Dis,1998,31:607
11 Lowrie EG,Lew NL.Death risk in hemodialysis patients:the predictive value of commonly measured variables and an evaluation of death rate differences between facilities.Am J Kidney Dis,1990,15:458
12 Yudd M,Goldblat MV,Llach F.Hyperphosphatemia and not hypercalcemia is the major factor in the therapeutic failure of dialysis patients with hyperparathyroid bone disease.To be presented at the 31st Annual American Society of Nephrology.Philadelphia:PA,October 1998.24-28
, 百拇医药
13 Viedermann K,Brunner U,Helfenstein U et al.Uremic small artery disease with medical calcification and intimal hypertrophy(so called calciphylaxis):A complication of chronic renal failure and benefits from parathyroidectomy.J Am Acad Dermatol,1995,33:954
14 McAuley K,Devereux F,Walker R.Calciphylaxis in two noncompliant patients with end-stage renal failure.Nephrol Dial Transplant,1997,12:1061
15 Budisavijecvic MN,Cheek D,Ploth DW.Calciphylaxis in chronic renal failure.J Am Soc Nephrol,1996,7:978
(1999-07-15收稿), http://www.100md.com
单位:南京军区南京总医院 解放军肾脏病研究所 (南京,210002)
关键词:尿毒症;继发性甲状旁腺功能亢进;高磷血症
肾脏病与透析肾移植杂志990620
慢性肾功能衰竭(chronic renal failure,CRF)早期,就可发生肾性骨病、继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)。一般认为1,25(OH)2D3(calcitriol)缺乏和高磷血症是SHPT的主要原因,事实上GFR 60~80 ml/min的患者口服大剂量含磷制剂将导致低磷血症而不是高磷血症,说明磷的排泄高于正常,而此时甲状旁腺素(parathyroid hormone,PTH)水平已经升高;随着肾功能恶化,GFR接近20 ml/min时才逐渐发生高磷血症。故CRF早期PTH水平升高的主要原因是1,25(OH)2D3水平低下,接近终末期肾衰时,高磷血症将成为加重SHPT的重要因素[1]。本文就慢性肾功能衰竭SHPT的发病机制和治疗现状作一简述。
, 百拇医药
1 SHPT 发病机制的研究进展
1.1 维生素D3受体密度和结合力降低 体外研究发现1,25(OH)2D3能直接抑制甲状旁腺细胞PTH-mRNA转录;1,25(OH)2D3水平低下使PTH-mRNA水平升高,PTH合成增加。1,25(OH)2D3通过胞浆受体复合物发挥作用,人类维生素D受体(VDR)为427个氨基酸组成的多肽,25~112氨基酸残基是DNA结合区,200~400氨基酸残基是配体结合区[2]。
VDR属于核受体超家族,该家族还包括类固醇激素、甲状腺素和维甲酸受体。VDR的DNA结合区具备核受体特征的超级结构,有两个含锌的指状突起部位,介导VDR与维生素D反应性基因(vitamin D responsive genes)DNA 5端的调节促进区(即维生素D反应区,vitamin D responsive element,VDRE)的结合,维生素D-VDR复合体与这个片段结合后,使VDR特异性前体DNA转录为mRNA。尿毒症时VDR的密度和结合力均降低,提高1,25(OH)2D3水平能使VDR上调,反之则使之下调。
, 百拇医药
VDR数量和功能降低使1,25(OH)2D3对甲状旁腺抑制作用减低。服用1,25(OH)2D3后,VDR-mRNA转录增加并使VDR半衰期延长,上调小肠和甲状旁腺细胞上VDR数量[3]。近来有研究资料表明,高钙饮食本身即可上调VDR,低钙饮食和低钙血症则使之下调。此外,维生素D缺乏性大鼠饲以高钙饮食能避免甲状旁腺细胞上VDR减少,从而预防SHPT的发生,提示1,25(OH)2D3上调VDR的作用是通过提高血钙水平而介导[4]。1,25(OH)2D3和血钙水平同步升高使VDR浓度增高的作用更显著,故在应用1,25(OH)2D3同时给予足够钙剂,VDR升高更快,透析患者合理使用1,25(OH)2D3,并使血钙维持在理想水平是治疗成功的关键。
, 百拇医药
1.2 1,25(OH)2D3抵抗 研究发现,血钙、磷和1,25(OH)2D3水平均正常的患者同样有发生SHPT的可能,轻度肾功能不全大鼠尽管VDR正常,仍有SHPT的生化异常和组织学改变,说明此时机体对生理水平1,25(OH)2D3已有抵抗作用,PTH水平业已升高。同样,1,25(OH)2D3水平正常不足以抑制透析患者发生SHPT,还必需间歇性静脉注射1,25(OH)2D3,使之在短时间内达到超生理浓度,与VDR的结合力更强,更有效地抑制PTH分泌。Hsu等发现,尿毒症患者的超滤液有减少小肠VDR与DNA的作用,提示尿毒症时不仅干扰1,25(OH)2D3的合成和清除,还能影响VDR的合成、细胞核对1,25(OH)2D3-VDR复合体的摄取及其与VDRE的结合[5]。
, 百拇医药
此外,SHPT的特点为甲状旁腺细胞增生,而且多表现为结节性增生。结节性增生与弥漫增生相比,VDR密度更低,对1,25(OH)2D3的反应性可能更差。有研究认为基因突变导致了结节性增生,部分尿毒症患者染色体上抑癌基因失活,使单克隆甲状旁腺细胞自主性增生形成结节。HPT严重程度也是影响1,25(OH)2D3疗效的一个原因。有研究认为,对1,25(OH)2D3抵抗者,腺体通常较大,故腺体越大,发生1,25(OH)2D3抵抗的概率也越高。
1.3 钙传感器受体基因突变 最近Brown等[6]从甲状旁腺和肾脏细胞上克隆出钙传感器受体(calcium sensor receptor,CaR)。该受体是一种分布于细胞膜的蛋白质,不仅能结合钙离子,还能与其它二价、三价和多价阳离子结合。钙离子通过CaR发挥作用:在甲状旁腺内与G蛋白偶联的CaR感受到钙离子浓度降低,导致预先合成的PTH分泌释放;细胞外钙离子水平增高则激活CaR,抑制PTH的分泌。CaR不仅介导了钙离子抑制PTH分泌,可能还影响PTH基因表达和甲状旁腺细胞增生[7]。
, 百拇医药
对起源于CaR基因突变遗传性疾病的认识,更加深了对CaR了解。家族性低钙尿高钙血症、新生儿重症甲旁亢和常染色体显性遗传性甲旁亢均与CaR异常有关,在散发性甲状旁腺腺瘤或SHPT患者中也发现了CaR基因突变现象。但研究发现,CaR拮抗剂(calcimimetics)可抑制CRF动物甲状旁腺细胞增生[8]。由于CRF发生SHPT与细胞外钙浓度的感受异常有关,有作者认为CaR变异在SHPT早期就起作用。研究发现,原发性甲状旁腺腺瘤和SHPT的尿毒症患者,CaR在mRNA和蛋白质水平表达均下降,结节性增生的腺体处CaR-mRNA表达,比邻近的非结节性增生处降低更为明显。但各项研究的结果并非完全吻合。CaR拮抗剂的问世可能是SHPT治疗的重要进展。初步研究表明,calcimimetic类制剂能有效降低原发和继发性甲旁亢的PTH水平,但作用是一过性的[9]。
2 SHPT 的临床表现
由于早期采取预防和治疗SHPT的措施,使近30年来SHPT的临床表现发生了显著变化,以往常见的骨痛、肌痛、肌无力、瘙痒、骨骼外钙化、自发性肌键撕裂、钙化防御和骨骼变形等现象已非常罕见,仅见于持续、严重高磷血症和(或)1,25(OH)2D3缺乏者,PTH升高十分显著,并伴有生化异常。高磷血症和钙化防御是临床上亟待解决的两大难题。
, 百拇医药
2.1 高磷血症
高磷血症是透析患者十分常见且严重的并发症,发生率50%以上。Block等[10]根据血磷水平把透析患者分为五组,发现患者血磷越高,死亡率也越高,>2.1 mmol/L组死亡率已明显升高(P=0.03),>2.6 mmol/L组死亡率更高(P<0.0001);而高钙血症却不影响死亡率,显然其临床意义不同于高磷血症(图1,2)。

图1 不同血磷水平患者的死亡相对风险(n=6407例)

图2 不同血钙水平患者的死亡相对风险(n=2669)
CRF时实施低磷饮食不影响离子钙和1,25(OH)2D3水平,但能降低PTH水平,改善SHPT,说明低磷能减少PTH分泌。体内和体外研究都证实,高磷可直接刺激PTH分泌和甲状旁腺细胞增生,大鼠饲以低磷饮食,PTH在mRNA转录后的水平降低,高磷和低磷饮食分别增加和降低甲状旁腺细胞的增生。早期CRF大鼠限磷能减少PTH-mRNA的表达,而肾功能正常大鼠饲以高磷饮食,尽管血钙、1,25(OH)2D3和VDR均正常,但甲状旁腺细胞肥大,PTH-mRNA表达增加。在体外培养的甲状旁腺细胞培养基中加入磷使PTH分泌增加,可能发生于转录后水平;而低磷时甲状旁腺细胞基质蛋白与PTH-mRNA 3’端的非转录区结合力减低,使mRNA稳定性下降。高磷血症能加重SHPT,并导致甲状旁腺对1,25(OH)2D3作用发生抵抗,降低1,25(OH)2D3疗效。
, 百拇医药
2.1.1 病因 高磷血症的原因是多方面的(图3)。饮食摄磷过多是最常见的原因,降低血磷必需控制磷摄入量。此外还需要使用磷结合剂,包括大剂量碳酸钙和醋酸钙等,但可能导致高钙血症。透析不充分也是高磷血症的主要原因,研究证实每周夜间血液透析(NHD)与传统血液透析(CHD)相比,磷清除更充分,治疗6个月后,两组血磷分别为1.29 mmol/L和2.10 mmol/L,且NHD组磷摄入增加50%,无一例服用磷结合剂[11]。另外,有极少数严重SHPT患者,破骨细胞骨质吸收增加,骨钙和骨磷向外释放,加重了高磷血症。

图3 影响血磷水平的因素
2.1.2 临床意义 持续高磷血症可产生严重后果。首先,高磷血症使钙磷乘积升高可导致软组织钙化,同时直接作用于甲状旁腺,刺激PTH合成,促进甲状旁腺细胞增生,从而加重SHPT。严重SHPT的透析患者,血磷越高,PTH水平也越高,PTH-钙的乙状曲线向右移,高磷血症得到控制之后,PTH水平下降,曲线再度左移,血磷越低,PTH水平也越低。此外,高磷血症还可导致1,25(OH)2D3抵抗。血磷超过2.26~2.42 mmol/L时,不管是口服还是静脉注射1,25(OH)2D3,都达不到降低PTH的目的,最终需要手术切除甲状旁腺(PTX)。故1,25(OH)2D3治疗要获得成功,必需先控制高磷血症。
, http://www.100md.com
高磷血症是透析患者SHPT治疗失败的根本原因,Yudd等[12]给42例SHPT患者用1,25(OH)2D3静脉治疗3年,PTH从初始1570 ng/L降至105ng/L,其中12例(30%)伴高磷血症,5例为一过性增高,PTH水平增加了820 ng/L,通过饮食指导而得到控制;其余7例属难治性高磷血症,PTH居高不下,不得不多次中断1,25(OH)2D3治疗,最终5例行PTX。而8例患者发生过16次高钙血症(平均2.93 mmol/L),仅需暂时减少1,25(OH)2D3,调整磷结合剂用量,或改用碳酸镁,最终SHPT得以控制。
2.2 钙化防御(calciphylaxis)
2.2.1 临床表现 钙化防御通常见于维持透析或肾移植术后患者,表现为双侧对称性浅表部位的病灶,病灶远端可触及持续搏动,常见疼痛性斑点状皮疹,酷似网状青斑,在指(趾)尖、踝、膝或臀部表面可见紫色结节,进一步可发展为出血灶;病情进展发生皮肤坏疽后,可出现手指皮肤疼痛,部分患者出现手指坏疽。皮肤结节活检,可见小动脉壁钙沉积伴小叶状脂肪坏死、钙化和中性粒细胞、淋巴细胞及巨噬细胞浸润。早期报道的病灶多位于肢体远端,并伴有SHPT,行PTX后,病变迅速改善也进一步支持两者之间的联系[13]。
, http://www.100md.com
2.2.2 发病机制 Seyle等1962年首次在动物模型发现,钙化防御与二价离子代谢异常有关。Seyle认为,发生全身性异位钙化需要两个条件,首先要具备某些因素(如PTH、维生素D或饮食中钙、磷摄入过多等),组织敏感性提高;其次需要某些触发条件(如皮下注射),2~3天后在皮下注射部位和全身出现微小钙沉着(显微镜下可见)。经数年之后,临床上出现周围组织缺血、坏死和皮肤溃烂表现为主的综合征,与Seyle的动物模型十分相似,被命名为钙化防御。值得一提的是,钙化防御表现为全身浅表部位血管的钙化,与Seyle的动物模型只是相似而已,后者表现为全身转移性钙化,而局部血管没有钙化灶。钙化防御的发病机制目前尚未明确,可能与以下原因有关:
钙磷乘积升高是发生钙化防御最首要因素;其次要求皮肤钙含量增高,降低透析液钙离子浓度可很大程度地逆转钙化防御。再则服用碳酸钙过量导致高钙血症也会触发钙化防御,停药之后可以逆转。由于绝大多数透析患者都服用含钙的磷结合剂,由此摄入过多元素钙,有作者认为这也是导致钙化防御的一个重要原因。
, 百拇医药
PTH水平升高是钙化防御另一个好发因素。早年Gipstein等描述了一组钙化防御的患者行PTX后,指端溃疡愈合;同样值得重视的是,这些患者出现钙化防御之前较长时间内都伴有明显的高磷血症,降低PTH水平、限制磷的摄入之后,钙化防御可以逆转[14]。但近10年来,有作者报道部分低PTH患者也伴有钙化防御,随着1,25(OH)2D3时代到来以及二价离子代谢异常的控制,严重肥胖,特别是白人妇女,也成为重要的好发因素。
钙化防御患者预后很差,多死于败血症或缺血性疾病。由于发病机制认识不充分,故其治疗方案也不明确。首先要降低钙磷乘积,并控制SHPT;其次要加强对病变部位的护理以及全身使用抗生素。PTH极高者才能行PTX,对低PTH则绝对不能施行。有报道47例钙化防御患者中,31例行PTX,其中50%在术后9周内死亡[15]。透析液钙离子浓度尽可能不超过1.25 mmol/L,慎用含钙的磷结合剂,或选用碳酸镁等制剂。
, 百拇医药
3 SHPT 的治疗策略
1,25(OH)2D3的问世成为治疗SHPT的重要进展。1,25(OH)2D3在体内有多种靶细胞,VDR分布于小肠、甲状旁腺、肾脏、骨骼、白细胞、表皮细胞等处,1,25(OH)2D3的效应也取决于所作用组织:在肠道促进钙和磷吸收,在骨骼促进骨形成和骨吸收,在甲状旁腺则抑制PTH的合成。
高磷和高钙血症是使用1,25(OH)2D3最大障碍,口服治疗时高磷和高钙血症的发生率分别达70%和75%,静脉用药时发生率相对较低。导致高钙和高磷的重要原因是剂量过小,初始剂量应根据HPT浓度而定,PTH越高,1,25(OH)2D3剂量也越大:1,25(OH)2D3剂量不足,不但不能抑制PTH分泌,反而促进胃肠道的钙、磷吸收。其次,研究发现治疗高磷血症多发生于PTH水平接近正常时,治疗初期发生率很低,因为PTH和碱性磷酸酶(AKP)接近正常时,骨质再矿化率降低,缓冲钙、磷代谢能力下降,如此时饮食中钙、磷摄入过多,或磷结合剂使用不当,或钙摄入过多,均可导致高磷血症或高钙血症。
, 百拇医药
对于CRF伴SHPT者,最理想的维生素D制剂应该只抑制PTH分泌而不影响肠道和骨骼,避免高钙和高磷血症,paricalcitol[19-nor-1α,25(OH)2D2]可能就是这样一个制剂。
小结 总之,SHPT是透析患者最常见并发症,对其发病机制已有较深入了解。1,25(OH)2D3治疗时应先纠正高磷血症,合理使用磷结合剂;HPT程度越重,1,25(OH)2D3剂量也越大,剂量要足,并建议静脉用药。此外,临床上正在寻找没有高钙和高磷副作用的维生素D制剂。
参考文献
1 Slatopolsky E,Delmez JA.Pathogenesis of secondary hyperparathyroidism.Am J Kidney Dis,1994,23:229
, 百拇医药
2 Demay ME,Kiernan MW,Deluca HF.Sequences in the human parathyroid hormone gene that binds the 1,25-dihydroxyvitamin D3 receptor and mediates transcriptional repression in response to 1,25-dihydroxyvitamin D3.Proc Natl Acad Sci USA,1992,89:8097
3 Deda M,Finch J,Borwn AJ et al.1,25-dihydroxyvitamin D3 and 22-oxacalcitriol prevent the decrease in vitamin D receptor content in the parathyroid glands of uremic rats.Kidney Int,1996,50:34
, http://www.100md.com
4 Brown AJ,Zhong M,Finch J et al.The roles of calcium and 1,25-dihydroxyvitamin D3 in the regulation of vitamin D receptor expression by rat parathyroid glands.Endocrinology,1995,136:1419
5 Hsu CH,Patel SR,Young EW.Mechanism of decreased calcitriol degradation in renal failure.Am J Physiol,1992,262:F192
6 Brown Em,Gamba G,Riccardi D et al.Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid.Nature,1993,368:575
, http://www.100md.com
7 Brown EM,Pollack M,Hebert SC.The extracellular calcium-sensing receptor:Its role in health and disease.Annu Rev Med,1998,49:15
8 Wada M,Furuya Y,Sakiyama J et al.The calcimimetic compound NPS R-568 suppresses parathyroid cell proliferation in rats with renal insufficiency-control of parathyroid cell growth via a calcium receptor.J Clin Invest,1997,100:2977
9 Antonsen Je,Sherrard DJ,Andress DL.A calcimimetic agent acutely suppresses parathyroid hormone levels in patients with chronic renal failure.Kidney Int,1998,53:223
, 百拇医药
10 Block GA,Hulbert-Shearon E,Levin NW et al.Associations of serum phosphorus and calcium×phosphate product with mortality risk in chronic hemodialysis patients:A national study.Am J Kidney Dis,1998,31:607
11 Lowrie EG,Lew NL.Death risk in hemodialysis patients:the predictive value of commonly measured variables and an evaluation of death rate differences between facilities.Am J Kidney Dis,1990,15:458
12 Yudd M,Goldblat MV,Llach F.Hyperphosphatemia and not hypercalcemia is the major factor in the therapeutic failure of dialysis patients with hyperparathyroid bone disease.To be presented at the 31st Annual American Society of Nephrology.Philadelphia:PA,October 1998.24-28
, 百拇医药
13 Viedermann K,Brunner U,Helfenstein U et al.Uremic small artery disease with medical calcification and intimal hypertrophy(so called calciphylaxis):A complication of chronic renal failure and benefits from parathyroidectomy.J Am Acad Dermatol,1995,33:954
14 McAuley K,Devereux F,Walker R.Calciphylaxis in two noncompliant patients with end-stage renal failure.Nephrol Dial Transplant,1997,12:1061
15 Budisavijecvic MN,Cheek D,Ploth DW.Calciphylaxis in chronic renal failure.J Am Soc Nephrol,1996,7:978
(1999-07-15收稿), http://www.100md.com