锤头状核酶对不同长度mdrl mRNA的体外切割*
作者:何 斌杨唐俊 金欢胜 王祥卫 刘素英 曾 毅 金锡御 宋 波
单位:何 斌 杨唐俊 金欢胜 王祥卫 刘素英 曾 毅 第三军医大学附属新桥医院泌尿外科 重庆,400037;金锡御 宋 波 第三军医大学附属西南医院泌尿外科 重庆,400038
关键词:多药耐药性;核酶;转基因
第三军医大学学报990701 提 要 目的:探讨膀胱癌多药耐药性逆转的新方法。方法:应用计算机对mdrl mRNA二级结构进行模拟,设计针对mdrl mRNA 1959位GUC的“锤头状”(Hammerhead)核酶(Ribozyme 1,RZ1)基因,定点克隆于质粒pGEMEX-1的BamHⅠ和EcoRⅠ位点上;将mdrl cDNA 864 bp的片段亚克隆于pGEMEX-1的HindⅢ和EcoRⅠ位点上,mdrl cDNA 1 383 bp片段亚克隆于pGEMEX-1的EcoRⅠ位点上,在T3启动子作用下体外转录成RZ1、864 nt和1 430 nt的mdrl mRNA。结果:RZ1在体外分别将864 nt和1 430 nt的mdrl mRNA切割成两个片段,切割温度在42°C和52°C两个条件下切割效率差异不明显。结论:核酶对底物的体外切割活性取决于核酶切割位点的选择,与底物长度无关。
, http://www.100md.com
中图法分类号 R342.2;R737.14
Hammerhead ribozyme-mediated cleavage of mdrl mRNA with different length*
He Bin, Jin Xiyu, Yang Tangjun, Jin Huanshen, Wang Xiangwei, Liu Suying, Zeng Yi, Song Bo
(Department of Urology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037)
Abstract Objective: To explore the new methods to reverse the multidrug resistance of bladder cancer. Methods: A hammerhead ribozyme was designed to cleave the GUC sequence at codon 1959 of mdrl mRNA after the analysis of the secondary structure of mdrl mRNA by computer. The hammerhead ribozyme 1 gene was synthesized and cloned into the BamHⅠ/EcoRⅠ sites of pGEMEX-1 called pEX-RZ1. The 864 bp fragment of mdr1 cDNA was subcloned into the HindⅢ/EcoRⅠ sites of pGEMEX-1 called pMDR-864. The 1383 bp fragment of mdr1 cDNA was subcloned into the EcoR I site of pGEMEX-1 called pMDR-1383 (+5). The pEX-RZ1 and pMDR-864 were lineralized with HindⅢ while the pMDR-1383(+5) was lineralized with BamHⅠ and these lineralized plasmids were transcribed with T3 promotor in vitro. Results: The ribozyme 1 showed strong cleavage activity after being mixed with the transcribed RZ1 and its substrates for 2 hours at 42℃ and 52℃. Conclusion: The designed ribozyme can be used as a tool to reverse the multidrug resistance of bladder cancer. the cleavage activity of the ribozyme is not associated with the length of its substrate but depended on the location of the cutting site.
, 百拇医药
Key words multidrug-resistance gene; ribozyme; gene transfer; bladder cancer
基因治疗是目前医学领域中的重要课题,特别是以RNA为研究对象的基因治疗已取得重要的进展[1]。这种针对RNA的基因治疗较常规的药物治疗的潜在优势在于其长期性和无毒副作用。多药耐药基因(mdrl)及其产物P-糖蛋白(PGP)的异常表达是引起肿瘤细胞出现多药耐药性的重要原因。尽管某些药物可逆转肿瘤细胞的这种多药耐药性,但都存在有极大的局限性和不完全性。本研究应用计算机对mdrl mRNA二级结构进行模拟,选择mdrl mRNA 1 959位的GUC为切割位点,按Haseloff和Gerlach[2]的锤头状核酸结构设计并合成了针对该位点的核酶基因,构建于体外表达载体上,在体外对864 nt的mdrl mRNA和1 430 nt的mdrl mRNA(其中含47 nt的载体部分)分子进行切割,并比较其切割效率的差异。
, 百拇医药
1 材料和方法
1.1 材料来源
pGEMEX-1,Ribomax T3 RNA转录试剂盒购自Promega公司,α-32P-UTP购自北京亚辉生物工程公司,克隆所需的酶和Rapid DNA Ligation Kit均购自Boehringer Mannheim公司。质粒pHDR5A由美国Gottesman M博士惠赠。
1.2 核酶基因的合成及分子克隆
根据mRNA二级结构的模拟,选择mdrl mRNA 1959位GUC为切割位点,该位点位于mdrl mRNA的环状部位。
核酶DNA合成序列为:
, 百拇医药
下划波浪线部分为核酶特异性结合序列,下划单线部分为
核酶切割核心,两端分别为BamHⅠ和EcoRⅠ的粘性末端。DNA由上海细胞生物研究所合成,经PAGE纯化。上述两条核苷酸链各40 μg,分别加入退火缓冲液(10 mmol/L Tris HCl,pH7.5,100 mmol/L NaCl)混匀,置95°C水浴5 min,缓慢冷却至室温即为核酶1(RZ1)基因片段。pGEMEX-1经BamHⅠ和EcoRⅠ双酶切后纯化载体片段,1∶3比例混合总量为100 ng的载体和RZ1基因片段,按Rapid DNA Ligation Kit损伤说明书,加入T4 DNA连接酶,室温5 min,CaCl2方法转染入JM109细菌中。该质粒称之为pEX-RZ1。
1.3 质粒pMDR-864的构建及克隆
pHDR5A,pGEMEX-1均经EcoRⅠ和HindⅢ双酶切,0.8%琼脂糖回收864 bp的mdrl cDNA片段和3944 bp的pGEMEX-1载体片段,1∶3比例混合总量为100 ng的载体和864 bp的mdrl cDNA,加入T4 DNA连接酶,定向将864 bp mdrl cDNA基因片段克隆于pGEMEX-1上,称之为pMDR-864。
, 百拇医药
1.4 质粒pMDR-1 383(+5)的构建及克隆
pHDR5A经EcoRⅠ酶切,0.8%琼脂糖回收1383 bp的mdrl cDNA片段,pGEMEX-1经EcoRⅠ酶切,酚∶氯仿纯化,CIAP脱磷酸化后,按1∶3比例 混合总量为100 ng的pGEMEX-1载体和1383 bp的mdrl cDNA,加入T4 DNA连接酶,常规CaCl2方法导入JM109细菌中,小量提质粒,经HindⅢ酶切鉴定插入方向,筛选出正向插入的克隆,称之为pMDR-1 383(+5)。
1.5 RZ1及其864 nt、1 430 nt 的 切 割 底 物 的 体 外 转 录
pEX-RZ1、pMDR-864用HindⅢ线性化,pMDR-1383(+5)用BamHⅠ线性化,经酚、氯仿抽提纯化后作为转录模板。按Ribomax转录试剂盒操作,在T3 RNA聚合酶作用下,37°C反应4h,然后加RQ1 RNase-free DNase去除模板DNA。转录底物时加入0.37 mbq的α-32P-UTP。总反应体积为20 μl。
, 百拇医药
1.6 RZ1对864 nt和1 430 nt底物的体外切割反应
取底物转录物3.5μl,加入10×buffer (0.5mol/L Tris HCl,10 mmol/L EDTA,pH8.0)1μl0.2 mol/L MgCl21μl,95°C水浴2 min后迅速置于冰浴中10 min,然后加入RZ1转录物及RNAsin 0.5μl(20U),DEPC水补足至10μl,42°C(或者52°C)×2 h,反应完成后加入10μl甲酰胺,55°C×5 min,8%PAGE 8 mol/L尿素电泳,(切割1 430 nt底物时用4%PAGE 8 mol/L尿素电泳)300 V×1.5 h,凝胶用保鲜膜包裹后进行放射自显影,常温下曝光4h,X光片为国产乐凯胶片。
2 结果
2.1 重组pEX-RZ1克隆的酶切鉴定,见图1
, 百拇医药
连接混合物常规CaCl2方法导入大肠杆菌JM109,得到4个转化子,取其中之一大量扩增,提取质粒。经BamHⅠ和EcoRⅠ各酶切6 h,然后加入等体积的甲酰胺,55°C×5 min,8%PAGE 8 mol/L尿素,电泳结果见图1。双酶切后的片段长为48 bp。
图 1 重组质粒pEX-RZ1的酶切分析
Fig 1 Restrictive digestion analysis of pEX-RZ1
1:pEX-RZ1+BamHⅠ+EcoRⅠ
2:pGEM-7Zf(+)/HaeⅢ marker
2.2 重组pMDR-864克隆的酶切鉴定
, 百拇医药
经Amp筛选的转化子,大量扩增,提取质粒。限制性片段分析结果见图2。重组子经HindⅢ和EcoRⅠ双酶切的片段为864 bp。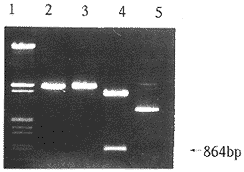
图 2 重组质粒pMDR-864的酶切分析
Fig 2 Restrictive digestion analysis of pMDR-86
1:λDNA/HindⅢ+EcoRⅠ marker;2:pMDR-864+EcoRⅠ;3:pMDR-864+HindⅢ;4:pMDR-864+HindⅢ+EcoRⅠ;5:pMDR-864
2.3 重组pMDR-1 383(+5)克隆的筛选及酶切鉴定
挑选经Amp筛选的7个转化子,小量扩增,提取质粒。用HindⅢ酶切鉴定插入方向,结果见图3。转化子5、7经HindⅢ酶切片段长为570 bp(519 bp+51 bp载体)和4808 bp,为正向插入,转化子1、2、6为反向插入,转化子3、4为双载体大环。pMDR-1383(+5)经大量扩增,限制性酶切分析结果见图4。
, http://www.100md.com
图 3 pMDR-1 383(+5)克隆的筛选
Fig 3 Clone screening of pMDR-1 383(+5)
0:λDNA/HindⅢ+EcoRⅠ marker
1、2、6:clone 1、2、6
3、4:clone 3、4
5、7:clone 5、7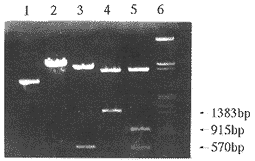
图 4 pMDR-1 383(+5)的限制性酶切分析
Fig 4 Restrictive digestion analysis of pMDR-1 383(+5)
, 百拇医药
1:pMDR-1 383(+5)
2:pMDR-1 383(+5)+BamHⅠ
3:pMDR-1 383(+5)+HindⅢ
4:pMDR-1 383(+5)+EcoRⅠ
5:pMDR-1 383(+5)+EcoRⅠ+HindⅢ
6:λDNA/HindⅢ+EcoRⅠ marker
2.4 RZ1对864 nt底物的体外切割反应
见图5,5为864 nt的底物,未加入RZ1,1、2、3、4为不同比例的RZ1和不同反应温度条件下RZ1对底物的切割结果,可以看出RZ1明显的将底物切割成83 nt和781 nt的两条带。用密度扫描仪对切割条带进行扫描,切割效率达94%。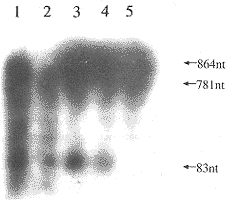
, 百拇医药
图 5 RZ1对864 nt底物的体外切割图
Fig 5 Autoradiograph of cleaving 864 nt substrate with ribozymes
1:Substrate+RZ1(substate∶ribozyme=7∶1),52°C
2:Substrate+RZ1(substate∶ribozyme=14∶1),52°C
3:Substrate+RZ1(substate∶ribozyme=7∶1),42°C
4:Substrate+RZ1(substate∶ribozyme=14∶1),42°C
5:Substrate only
, http://www.100md.com
2.5 RZ1对1 430 nt底物的体外切割反应
见图6。1为1430 nt的底物,未加入RZ1,2、3为不同比例的RZ1对底物的切割结果,可以看出RZ1明显的将底物切割成631 nt和799 nt的两条带。用密度扫描仪对切割条带进行扫描,切割效率达98%。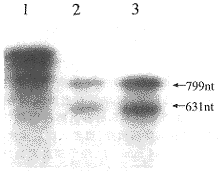
图 6 RZ1对1 430 nt底物的体外切割图
Fig 6 Autoradiograph of cleaving 1 430 nt substrate with ribozymes
1:Substrate only;2:Substrate+RZ1,52°C;3:Substrate+RZ1,42°C
, 百拇医药
3 讨论
核酶对靶mRNA的体外切割常被作为判定该核酶是否能起到治疗目的的预测[3]。Bertrand等[4]报道950 bp长度的底物较60 bp慢3~15倍,RZ对不同长度底物切割活性出现明显差异是由于长底物在体外极易形成二级结构,使RZ不易与底物结合,因而RZ对长底物的切割活性明显下降,所以一般做体外切割反应时应使用短长度的底物。我们首先用RZ1对864 nt的底物进行切割,切割效率达90%以上,由于RZ1的切割位点位于864 nt底物的下游83 nt处,切割位点较易暴露,为进一步验证RZ1对mdrl mRNA的体外切割是否受长度的影响,我们将1 383 bp mdrl cDNA片段亚克隆于体外表达载体上,RZ1切割位点位于1 430 nt的中间部位,理论上极易被二级结构遮盖,但结果RZ1也完全将1 430 nt的底物切割成两个片段,切割效率并不低于其对864 nt的底物的切割效率。我们曾构建另外一个核酶,同样条件下对上述两个底物进行切割,结果该核酶对两底物切割效率均极低。我们认为作核酶体外切割反应时只要对底物进行彻底的变性,完全可以避免二级结构的影响,底物长度不是影响核酶体外切割活性的主要因素,而位点的选择是决定核酶活性的重要因素之一[5,6]。
, 百拇医药
参考文献
1 Rossi J J. Therapeutic antisense and ribozyemes. Br Med Bull,1995,51(1):217
2Haseloff J, Gerlach W L. Simple RNA enzyme with new and highly specific endoribonuclease activities. Nature,1988,334(618):585
3 Hiroyuki K, Thambi D, Holland J F, et al. Reversal of drug sensitivity in multidrug-resistant tumor cells by a mdrl (PGY1) ribozyme. Cancer Res,1994,54(5):1271
, http://www.100md.com
4 Bertrand E, Pictet R, Grange T, et al. Can hammerhead ribozyme by efficient tools to inactivate gene function? Nucleic Acids Res,1994,22(3):293
5 Holm P S, Dietel M, Krupp G. Similar cleavage effciencies of an oligoribonucleotide substrate and a mdrl mRNA segment by a hammerhead ribozyme. Gene,1995,167(2):221
6 何 斌,金锡御,杨唐俊,等.位点选择对核酶体外切割活性的影响.免疫学杂志,1998,14(3);149
*国家自然科学基金资助项目,No.39670824
**何 斌,男,35岁,主治医师,博士
收稿:1998-12-25;修回:1999-03-31, 百拇医药
单位:何 斌 杨唐俊 金欢胜 王祥卫 刘素英 曾 毅 第三军医大学附属新桥医院泌尿外科 重庆,400037;金锡御 宋 波 第三军医大学附属西南医院泌尿外科 重庆,400038
关键词:多药耐药性;核酶;转基因
第三军医大学学报990701 提 要 目的:探讨膀胱癌多药耐药性逆转的新方法。方法:应用计算机对mdrl mRNA二级结构进行模拟,设计针对mdrl mRNA 1959位GUC的“锤头状”(Hammerhead)核酶(Ribozyme 1,RZ1)基因,定点克隆于质粒pGEMEX-1的BamHⅠ和EcoRⅠ位点上;将mdrl cDNA 864 bp的片段亚克隆于pGEMEX-1的HindⅢ和EcoRⅠ位点上,mdrl cDNA 1 383 bp片段亚克隆于pGEMEX-1的EcoRⅠ位点上,在T3启动子作用下体外转录成RZ1、864 nt和1 430 nt的mdrl mRNA。结果:RZ1在体外分别将864 nt和1 430 nt的mdrl mRNA切割成两个片段,切割温度在42°C和52°C两个条件下切割效率差异不明显。结论:核酶对底物的体外切割活性取决于核酶切割位点的选择,与底物长度无关。
, http://www.100md.com
中图法分类号 R342.2;R737.14
Hammerhead ribozyme-mediated cleavage of mdrl mRNA with different length*
He Bin, Jin Xiyu, Yang Tangjun, Jin Huanshen, Wang Xiangwei, Liu Suying, Zeng Yi, Song Bo
(Department of Urology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037)
Abstract Objective: To explore the new methods to reverse the multidrug resistance of bladder cancer. Methods: A hammerhead ribozyme was designed to cleave the GUC sequence at codon 1959 of mdrl mRNA after the analysis of the secondary structure of mdrl mRNA by computer. The hammerhead ribozyme 1 gene was synthesized and cloned into the BamHⅠ/EcoRⅠ sites of pGEMEX-1 called pEX-RZ1. The 864 bp fragment of mdr1 cDNA was subcloned into the HindⅢ/EcoRⅠ sites of pGEMEX-1 called pMDR-864. The 1383 bp fragment of mdr1 cDNA was subcloned into the EcoR I site of pGEMEX-1 called pMDR-1383 (+5). The pEX-RZ1 and pMDR-864 were lineralized with HindⅢ while the pMDR-1383(+5) was lineralized with BamHⅠ and these lineralized plasmids were transcribed with T3 promotor in vitro. Results: The ribozyme 1 showed strong cleavage activity after being mixed with the transcribed RZ1 and its substrates for 2 hours at 42℃ and 52℃. Conclusion: The designed ribozyme can be used as a tool to reverse the multidrug resistance of bladder cancer. the cleavage activity of the ribozyme is not associated with the length of its substrate but depended on the location of the cutting site.
, 百拇医药
Key words multidrug-resistance gene; ribozyme; gene transfer; bladder cancer
基因治疗是目前医学领域中的重要课题,特别是以RNA为研究对象的基因治疗已取得重要的进展[1]。这种针对RNA的基因治疗较常规的药物治疗的潜在优势在于其长期性和无毒副作用。多药耐药基因(mdrl)及其产物P-糖蛋白(PGP)的异常表达是引起肿瘤细胞出现多药耐药性的重要原因。尽管某些药物可逆转肿瘤细胞的这种多药耐药性,但都存在有极大的局限性和不完全性。本研究应用计算机对mdrl mRNA二级结构进行模拟,选择mdrl mRNA 1 959位的GUC为切割位点,按Haseloff和Gerlach[2]的锤头状核酸结构设计并合成了针对该位点的核酶基因,构建于体外表达载体上,在体外对864 nt的mdrl mRNA和1 430 nt的mdrl mRNA(其中含47 nt的载体部分)分子进行切割,并比较其切割效率的差异。
, 百拇医药
1 材料和方法
1.1 材料来源
pGEMEX-1,Ribomax T3 RNA转录试剂盒购自Promega公司,α-32P-UTP购自北京亚辉生物工程公司,克隆所需的酶和Rapid DNA Ligation Kit均购自Boehringer Mannheim公司。质粒pHDR5A由美国Gottesman M博士惠赠。
1.2 核酶基因的合成及分子克隆
根据mRNA二级结构的模拟,选择mdrl mRNA 1959位GUC为切割位点,该位点位于mdrl mRNA的环状部位。
核酶DNA合成序列为:

, 百拇医药
下划波浪线部分为核酶特异性结合序列,下划单线部分为
核酶切割核心,两端分别为BamHⅠ和EcoRⅠ的粘性末端。DNA由上海细胞生物研究所合成,经PAGE纯化。上述两条核苷酸链各40 μg,分别加入退火缓冲液(10 mmol/L Tris HCl,pH7.5,100 mmol/L NaCl)混匀,置95°C水浴5 min,缓慢冷却至室温即为核酶1(RZ1)基因片段。pGEMEX-1经BamHⅠ和EcoRⅠ双酶切后纯化载体片段,1∶3比例混合总量为100 ng的载体和RZ1基因片段,按Rapid DNA Ligation Kit损伤说明书,加入T4 DNA连接酶,室温5 min,CaCl2方法转染入JM109细菌中。该质粒称之为pEX-RZ1。
1.3 质粒pMDR-864的构建及克隆
pHDR5A,pGEMEX-1均经EcoRⅠ和HindⅢ双酶切,0.8%琼脂糖回收864 bp的mdrl cDNA片段和3944 bp的pGEMEX-1载体片段,1∶3比例混合总量为100 ng的载体和864 bp的mdrl cDNA,加入T4 DNA连接酶,定向将864 bp mdrl cDNA基因片段克隆于pGEMEX-1上,称之为pMDR-864。
, 百拇医药
1.4 质粒pMDR-1 383(+5)的构建及克隆
pHDR5A经EcoRⅠ酶切,0.8%琼脂糖回收1383 bp的mdrl cDNA片段,pGEMEX-1经EcoRⅠ酶切,酚∶氯仿纯化,CIAP脱磷酸化后,按1∶3比例 混合总量为100 ng的pGEMEX-1载体和1383 bp的mdrl cDNA,加入T4 DNA连接酶,常规CaCl2方法导入JM109细菌中,小量提质粒,经HindⅢ酶切鉴定插入方向,筛选出正向插入的克隆,称之为pMDR-1 383(+5)。
1.5 RZ1及其864 nt、1 430 nt 的 切 割 底 物 的 体 外 转 录
pEX-RZ1、pMDR-864用HindⅢ线性化,pMDR-1383(+5)用BamHⅠ线性化,经酚、氯仿抽提纯化后作为转录模板。按Ribomax转录试剂盒操作,在T3 RNA聚合酶作用下,37°C反应4h,然后加RQ1 RNase-free DNase去除模板DNA。转录底物时加入0.37 mbq的α-32P-UTP。总反应体积为20 μl。
, 百拇医药
1.6 RZ1对864 nt和1 430 nt底物的体外切割反应
取底物转录物3.5μl,加入10×buffer (0.5mol/L Tris HCl,10 mmol/L EDTA,pH8.0)1μl0.2 mol/L MgCl21μl,95°C水浴2 min后迅速置于冰浴中10 min,然后加入RZ1转录物及RNAsin 0.5μl(20U),DEPC水补足至10μl,42°C(或者52°C)×2 h,反应完成后加入10μl甲酰胺,55°C×5 min,8%PAGE 8 mol/L尿素电泳,(切割1 430 nt底物时用4%PAGE 8 mol/L尿素电泳)300 V×1.5 h,凝胶用保鲜膜包裹后进行放射自显影,常温下曝光4h,X光片为国产乐凯胶片。
2 结果
2.1 重组pEX-RZ1克隆的酶切鉴定,见图1
, 百拇医药
连接混合物常规CaCl2方法导入大肠杆菌JM109,得到4个转化子,取其中之一大量扩增,提取质粒。经BamHⅠ和EcoRⅠ各酶切6 h,然后加入等体积的甲酰胺,55°C×5 min,8%PAGE 8 mol/L尿素,电泳结果见图1。双酶切后的片段长为48 bp。

图 1 重组质粒pEX-RZ1的酶切分析
Fig 1 Restrictive digestion analysis of pEX-RZ1
1:pEX-RZ1+BamHⅠ+EcoRⅠ
2:pGEM-7Zf(+)/HaeⅢ marker
2.2 重组pMDR-864克隆的酶切鉴定
, 百拇医药
经Amp筛选的转化子,大量扩增,提取质粒。限制性片段分析结果见图2。重组子经HindⅢ和EcoRⅠ双酶切的片段为864 bp。

图 2 重组质粒pMDR-864的酶切分析
Fig 2 Restrictive digestion analysis of pMDR-86
1:λDNA/HindⅢ+EcoRⅠ marker;2:pMDR-864+EcoRⅠ;3:pMDR-864+HindⅢ;4:pMDR-864+HindⅢ+EcoRⅠ;5:pMDR-864
2.3 重组pMDR-1 383(+5)克隆的筛选及酶切鉴定
挑选经Amp筛选的7个转化子,小量扩增,提取质粒。用HindⅢ酶切鉴定插入方向,结果见图3。转化子5、7经HindⅢ酶切片段长为570 bp(519 bp+51 bp载体)和4808 bp,为正向插入,转化子1、2、6为反向插入,转化子3、4为双载体大环。pMDR-1383(+5)经大量扩增,限制性酶切分析结果见图4。

, http://www.100md.com
图 3 pMDR-1 383(+5)克隆的筛选
Fig 3 Clone screening of pMDR-1 383(+5)
0:λDNA/HindⅢ+EcoRⅠ marker
1、2、6:clone 1、2、6
3、4:clone 3、4
5、7:clone 5、7

图 4 pMDR-1 383(+5)的限制性酶切分析
Fig 4 Restrictive digestion analysis of pMDR-1 383(+5)
, 百拇医药
1:pMDR-1 383(+5)
2:pMDR-1 383(+5)+BamHⅠ
3:pMDR-1 383(+5)+HindⅢ
4:pMDR-1 383(+5)+EcoRⅠ
5:pMDR-1 383(+5)+EcoRⅠ+HindⅢ
6:λDNA/HindⅢ+EcoRⅠ marker
2.4 RZ1对864 nt底物的体外切割反应
见图5,5为864 nt的底物,未加入RZ1,1、2、3、4为不同比例的RZ1和不同反应温度条件下RZ1对底物的切割结果,可以看出RZ1明显的将底物切割成83 nt和781 nt的两条带。用密度扫描仪对切割条带进行扫描,切割效率达94%。

, 百拇医药
图 5 RZ1对864 nt底物的体外切割图
Fig 5 Autoradiograph of cleaving 864 nt substrate with ribozymes
1:Substrate+RZ1(substate∶ribozyme=7∶1),52°C
2:Substrate+RZ1(substate∶ribozyme=14∶1),52°C
3:Substrate+RZ1(substate∶ribozyme=7∶1),42°C
4:Substrate+RZ1(substate∶ribozyme=14∶1),42°C
5:Substrate only
, http://www.100md.com
2.5 RZ1对1 430 nt底物的体外切割反应
见图6。1为1430 nt的底物,未加入RZ1,2、3为不同比例的RZ1对底物的切割结果,可以看出RZ1明显的将底物切割成631 nt和799 nt的两条带。用密度扫描仪对切割条带进行扫描,切割效率达98%。

图 6 RZ1对1 430 nt底物的体外切割图
Fig 6 Autoradiograph of cleaving 1 430 nt substrate with ribozymes
1:Substrate only;2:Substrate+RZ1,52°C;3:Substrate+RZ1,42°C
, 百拇医药
3 讨论
核酶对靶mRNA的体外切割常被作为判定该核酶是否能起到治疗目的的预测[3]。Bertrand等[4]报道950 bp长度的底物较60 bp慢3~15倍,RZ对不同长度底物切割活性出现明显差异是由于长底物在体外极易形成二级结构,使RZ不易与底物结合,因而RZ对长底物的切割活性明显下降,所以一般做体外切割反应时应使用短长度的底物。我们首先用RZ1对864 nt的底物进行切割,切割效率达90%以上,由于RZ1的切割位点位于864 nt底物的下游83 nt处,切割位点较易暴露,为进一步验证RZ1对mdrl mRNA的体外切割是否受长度的影响,我们将1 383 bp mdrl cDNA片段亚克隆于体外表达载体上,RZ1切割位点位于1 430 nt的中间部位,理论上极易被二级结构遮盖,但结果RZ1也完全将1 430 nt的底物切割成两个片段,切割效率并不低于其对864 nt的底物的切割效率。我们曾构建另外一个核酶,同样条件下对上述两个底物进行切割,结果该核酶对两底物切割效率均极低。我们认为作核酶体外切割反应时只要对底物进行彻底的变性,完全可以避免二级结构的影响,底物长度不是影响核酶体外切割活性的主要因素,而位点的选择是决定核酶活性的重要因素之一[5,6]。
, 百拇医药
参考文献
1 Rossi J J. Therapeutic antisense and ribozyemes. Br Med Bull,1995,51(1):217
2Haseloff J, Gerlach W L. Simple RNA enzyme with new and highly specific endoribonuclease activities. Nature,1988,334(618):585
3 Hiroyuki K, Thambi D, Holland J F, et al. Reversal of drug sensitivity in multidrug-resistant tumor cells by a mdrl (PGY1) ribozyme. Cancer Res,1994,54(5):1271
, http://www.100md.com
4 Bertrand E, Pictet R, Grange T, et al. Can hammerhead ribozyme by efficient tools to inactivate gene function? Nucleic Acids Res,1994,22(3):293
5 Holm P S, Dietel M, Krupp G. Similar cleavage effciencies of an oligoribonucleotide substrate and a mdrl mRNA segment by a hammerhead ribozyme. Gene,1995,167(2):221
6 何 斌,金锡御,杨唐俊,等.位点选择对核酶体外切割活性的影响.免疫学杂志,1998,14(3);149
*国家自然科学基金资助项目,No.39670824
**何 斌,男,35岁,主治医师,博士
收稿:1998-12-25;修回:1999-03-31, 百拇医药