Cyclin D1在视黄酸诱导胸腺细胞分化中的作用研究
作者:杨志祥糜漫天 张乾勇 郎海滨 韦 娜
单位:杨志祥糜漫天 张乾勇 郎海滨 韦 娜 第三军医大学预防医学系营养与食品卫生学教研室 重庆,400038
关键词:视黄酸;cyclinD1;CDK4;Rb蛋白;胸腺细胞
第三军医大学学报990716
提 要 目的:探讨视黄醇类化合物促胸腺细胞分化的分子机制。方法:选择幼年小鼠胸腺细胞为研究对象,采用免疫组化染色、Western blot、流式细胞分析等实验方法,观察全反式视黄酸(ATRA)或视黄醇(Retinol)灌胃给药后对胸腺细胞分化成熟的影响,同时检测周期调控蛋白cyclinD1及相应基因表达变化情况。结果:ATRA和Retinol均可抑制胸腺细胞增殖活性,使胸腺组织中成熟功能T细胞比例增大;胸腺细胞cyclinD1、CDK4和RB基因表达呈时间剂量依赖性下调,而P16、P21蛋白表达上调,且ATRA作用优于Retinol。结论:RA可能经PRb、P16等多因素反馈调节cyclinD1和CDK4表达,抑或直接同其发生作用,进而影响胸腺细胞增殖分化的变化。
, http://www.100md.com
中图法分类号 R322.53;R392.11
Role of cyclin D1 in differentiation of thymocytes induced by rentinoids in mice
Yang Zhixiang, Mi Mantian, Zhang Qianyong, Lang Haibin, Wei Na
(Department of Nutrition and Food Hygiene , Faculty of Preventive Medicine, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To explore the molecular mechanism of the role of cyclin D1 in the differentiation of thymocytes induced by all-trans retinoic acid and retinol. Methods: The expression of cyclin D1, CDK4, CKIs and PRb was determined with immunohistochemistry or immunoblotting and the subgroups of murine thymocytes were analyzed with FCM 1 to 4 weeks after the young mice were treated with ATRA or retinol. Results: With the increase of ATRA content in vivo, functional T lymphocytes became a greater portion of thymocytes. Both ATRA and retinol decreased the expression of cyclin D1, CDK4 and pRb but increased the expression of P16 and P21. Conclusion: ATRA and retinol can stimulate the maturation of functional T lymphocytes in murine thymus. The changes in expression of cyclin D1, CDK4 and related genes might be the molecular mechanism of RA-induced differentiation of thymocytes.
, 百拇医药
Key words retinoic acid; cyclin D1; CDK4, retinoblastoma protein; thymocyte; mouse
视黄醇类化合物是一类作用广泛的重要营养素,能增强机体免疫功能,但其作用机制尚不清楚[1]。近年来视黄酸(Retinoic acid,RA)诱导血液系统肿瘤细胞分化已成为研究热点,尤以其诱导早幼粒白血病细胞分化成熟更为引人注目。免疫系统的早期幼稚细胞同肿瘤细胞一样具有低分化特征。目前细胞周期调控研究已取得了突破性进展[2,3],其中细胞周期素(cyclin)/细胞周期素依赖性激酶(CDK)被认为是作用的核心因子。低分化细胞的生长抑制多表现G1期阻滞的特征,cyclin D1/CDK4复合物是G1期调控的关键因子,探讨该复合物的变化对揭示RA诱导分化机制有重要意义。本研究以小鼠胸腺细胞为研究对象,观察RA或视黄醇(Retinol)灌胃给药后对其分化的影响,探讨视黄酸诱导分化作用同周期调控蛋白cyclinD1及相应基因表达变化的相关性,由细胞周期调控途径入手,深入研究RA诱导分化作用的分子机制,为视黄酸的合理应用提供理论依据。
, http://www.100md.com
1 材料与方法
1.1 实验对象与分组
本实验采用昆明株小白鼠,体重(10±2)g,雌雄不拘,自由进食和饮水,随机分为3组,每组动物32只。①全反式视黄酸(All-trans retinoic acid,ATRA,Sigma)组:小鼠隔天给予ATRA液灌胃(按5 mg/kg体重);②视黄醇(Retinol,Sigma)组:隔天给予Retinol液灌胃(按5 mg/kg体重)。③正常对照组:以与给药组体积相同的芝麻油(Sesame oil)灌胃。检测时相点分别定为灌胃后1、2、3、4周。
1.2 血浆ATRA浓度
参照Rigas等[4]的HPLC测定方法,各组不同时相点动物经眼球取血,肝素抗凝分离血浆,加入8倍体积乙醚∶丙酮(9∶1)液充分混匀,离心去除沉淀,吸取上清以纯氮气吹干,少量甲醇溶解残余物,10 μl样品上色谱仪分析。HPLC测定条件:甲醇∶冰乙酸(1 000∶2)流动相;流速1.5 ml/min;C18反相柱;UV484紫外分光光度计;波长345 nm。
, 百拇医药
1.3 胸腺细胞制备及生长曲线的测定
动物经颈椎脱臼处死,无菌取胸腺,经200目尼龙网揉搓过滤细胞后,Tris-NH4Cl液溶红细胞,以1640培养液悬浮所得细胞。取不同组别4个时相点动物胸腺细胞悬液,台盼蓝染色计数活细胞比例后,每组行3次计数,绘制生长曲线。
1.4 胸腺CD4、CD8阳性细胞间接免疫荧光分析
每组取1×105个细胞,0.01 mol/L PBS(pH7.4)漂洗2次,4%多聚甲醛固定30 min,PBS漂洗后,分别加入1∶100稀释CD4、CD8单克隆抗体(鼠抗L3T4、鼠抗Lyt2,北京医科大学免疫教研室),4°C孵育45 min,PBS漂洗2次,各孔加入100 μl 1∶20稀释二抗(羊抗IgG,FITC标记,华美公司),4°C孵育45 min,PBS漂洗后以4%多聚甲醛PBS液悬浮细胞,上流式细胞仪分析各组CD4和/或CD8阳性细胞比例。
, http://www.100md.com
1.5 蛋白检测
1.5.1 免疫细胞化学 参照SP试剂盒操作方法:细胞滴片,4%多聚甲醛固定30 min,0.3% H2O2-甲醇溶液封闭30 min,含0.1%Triton X-100、10%山羊血清的PBS缓冲液(pH7.2)室温孵育1 h,加入1∶1 000稀释一抗,37°C孵育1 h,再与生物素标记二抗及链菌素亲生物蛋白-过氧化物酶复合物反应,用含0.05%DAB、0.03%H2O2的0.01 mol/L Tris-Cl(pH7.5)缓冲液显色。
1.5.2 免疫印迹 1×107个细胞,加100 μl预冷至0°C的1%NP-40裂解液(含50 mmol/L Tris、150 mmol/L NaCl、1%NP-40、25 mmol/L NaF、5 mmol/L Na4P2O7、5 mmol/L Na3PO4、0.1% SDS、1 mmol/L PMSF、10 μg/ml Leupeptin、10 μg/ml Aprotinain),冰上放置30 min,4°C12 000×g离心2 min,将上清液转移到另一微量离心管中,分装后保存于-20°C备用。每20 μl蛋白质提取液中加入20 μl 2×SDS凝胶加样缓冲液,100°C煮沸5 min,以聚丙烯酰胺电泳后,电转移转膜22 h,1% BSA封闭37°C 1 h或4°C过夜,加一抗37°C孵育1 h,按SP试剂盒操作反应后用化学发光检测试剂盒检测。
, http://www.100md.com
1.6 统计学处理
采用t检验。
2 结果
2.1 血浆视黄酸浓度
通过反相高效液相色谱检测动物ATRA或Retinol灌胃后不同时相点血浆ATRA浓度。发现随灌胃时间延长,血浆ATRA含量逐渐增多,见图1。且ATRA、Retinol和对照组之间差异均显著,表明药物灌胃成功,可推测Retinol仅有部分在体内代谢为ATRA。
图1 ATRA或Retinol处理后外周血浆中ATRA含量的变化
Fig 1 Changes of the concentration of ATRA in peripheral blood plasma after treatment with ATRA or Retinol
, 百拇医药
2.2 生长曲线 动物随ATRA和Retinol体内蓄积量增多,ATRA和Retinol与对照组之间,胸腺细胞数差异不显著(P>0.05),见表1。说明视黄醇类化合物对成熟小鼠胸腺细胞总数影响较小。
表1 ATRA或Retinol处理后胸腺细胞总数变化
Tab 1 Changes of the number of thymocytes after treatment
with ATRA or retinol(×107)(x±s,n=8) Group
1 week
2 weeks
3 weeks
, 百拇医药
4 weeks
Control
4.98±0.28
5.12±0.36
6.10±0.55
5.42±0.29
Retinol
5.02±0.60
5.62±0.25
6.14±0.28
5.96±0.58
ATRA
, 百拇医药
5.56±0.49
5.48±0.30
6.06±0.42
5.62±0.35
2.3 ATRA和Retinol对胸腺细胞分化能力的影响
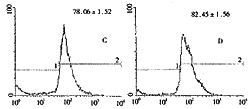
胸腺的发育过程表现为CD4-CD8-双阴性低分化细胞、CD4+CD8+双阳性幼稚细胞、CD4+或CD8+成熟功能细胞的逐渐演变。通过间接免疫荧光技术标记细胞表面抗原,经流式细胞分析各细胞亚型在胸腺中比例:结果显示CD4+、CD8+、及CD4+CD8+阳性细胞随药物摄入增多而比例上升,提示胸腺中CD4-CD8-细胞减少,成熟的CD4+CD8-、CD4-CD8+细胞增多(P<0.05),见图2。

, 百拇医药
图2 经流式细胞仪分析ATRA或Retinol处理后胸腺亚群细胞比例变化
A:CD4+胸腺细胞(对照);B:CD4+胸腺细胞(ATRA处理4周);C:CD8+胸腺细胞(对照);
D:CD8+胸腺细胞(ATRA处理4周);E:CD4+CD8+胸腺细胞(对照);
F:CD4+CD8+胸腺细胞(ATRA处理4周)
Fig 2 Thymocyte subgroups analysis by FACS
A:CD4+ thymocytes (control); B:CD4+ thymocytes (treated with ATRA for 4 weeks);
, 百拇医药
C:CD8+ thymocytes (control); D:CD8+ thymocytes (treated with ATRA for 4 weeks);
E: CD4+CD8+ thymocytes (control); F:CD4+CD8+ thymocytes (treated with ATRA for 4 weeks)
2.4 ATRA和Retinol对胸腺细胞cyclin D1、CDK4蛋白表达的影响
免疫组化染色结果表明,ATRA灌胃后动物胸腺细胞cyclin D1蛋白表达量显著下降,CDK4蛋白表达亦呈下降趋势,但不及cyclinD1明显;Retinol灌胃后cyclin D1和CDK4蛋白变化趋势同ATRA,但下降程度稍差。Cyclin D1、CDK4蛋白表达均以细胞核着色为主,胞质亦有部分阳性反应,见图3。
, 百拇医药
2.5 ATRA和Retinol诱导CKls及pRb蛋白表达变化
免疫印迹分析发现,ATRA或Retinol处理动物后,细胞周期依赖性激酶抑制物P16INK4A、P21WAP-1蛋白在胸腺细胞表达增多,并呈时间剂量依赖性,而PRb蛋白随ATRA或Retinol摄入增多表达逐渐下降,见图4。


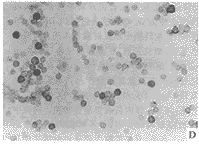
图3 ATRA作用后小鼠胸腺细胞cyclin D1和CDK4蛋白免疫组化染色结果
, http://www.100md.com
A:对照组cyclin D1蛋白呈强阳性; B:ATRA处理四周cyclinD1呈弱阳性; C:对照组CDK4蛋白呈强阳性; D:ATRA处理四周CDK4呈阳性
Fig 3 Expressions of cyclin D1 and CDK4 protein as indicated by ICC-stained
in thymocytes treated with ATRA for 4 weeks
A: Intensive positive of cyclin D1 protein in control; B: Weak positive of cyclin D1 protein in ATRA treated group; C: Intensive positive of CDK4 protein in control; D: Positive of CDK4 protein in ATRA treated group
, 百拇医药
图4 视黄醇类化合物对胸腺细胞P16、P21及PRb的表达影响
Fig 4 Immunoblot analysis of the effects of ATRA and retinol on the
expression of PRb、P21 and P16 protein in thymocytes
3 讨论
既往研究显示生理剂量下RA能增强体液免疫反应及T淋巴细胞杀瘤作用[1]。RA摄入机体后,经其受体调控某些相关基因表达,影响细胞增殖和分化[5]。通过对T细胞淋巴瘤诱导分化的研究发现,RA可调节胞内嘌呤核苷磷酸化酶(PNP)、脱氧核苷酸转移酶(TdT)及腺苷脱氨酶(ADA)的表达和活性变化,而PNP、ADA和TdT正是胸腺细胞分化的标志酶[6]。由此推测,RA可能与决定机体免疫功能状态的胸腺幼稚祖细胞分化成熟密切相关。本实验采用隔天5 mg/kg ATRA或Retinol经灌胃给药处理昆明株小鼠1~4周,观察胸腺细胞生长状况,发现胸腺细胞数与对照组相比变化不明显,提示RA对胸腺细胞总数影响较小,推测可能与成熟小鼠胸腺发育状态和/或对RA敏感程度不同有关。流式细胞分析结果表明,ATRA或Retinol动物灌胃后胸腺组织中CD4-CD8-双阴性胸腺细胞比例下降,而成熟的功能性T淋巴细胞增多,且与对照组间差异显著。因胸腺细胞总数变化并不显著,分析RA可能主要对胸腺中比例较小的低分化细胞起作用,抑制其增殖,促其向成熟细胞分化。RA是否通过刺激淋巴系祖细胞的分化,提高功能T细胞数量来增强机体免疫力,尚无定论,但本实验RA给药后胸腺细胞分化状态的改变多少为该途径的深入研究提供了思路。
, http://www.100md.com
细胞周期进程受细胞因子、周期调控蛋白、癌基因及抑癌基因表达产物等多因素调控,各因素之间相互协调,构成一网络调控机制。通过RA对血液肿瘤细胞抑制增殖和诱导分化的研究发现,G1期关卡(Checkpoint)是决定细胞能否正常增殖分化的关键位点。CyclinD1作为G1期调控蛋白,与CDK4形成的复合物在G1/S期转换中起关键调节作用。胸腺细胞属于淋巴系统,研究发现,在多种恶性淋巴瘤细胞中可见cyclinD1超表达[7],推测cyclinD1在淋巴系统增殖分化过程中亦起重要调控作用。本实验免疫组化结果发现CyclinD1和CDK4在1~4周时相点表达逐渐下降,与RA体内摄入量呈负相关。胸腺中反应阳性细胞呈不均匀分布,分析可能与组织细胞的不同分化状态有关。RA经胞内核受体激活某些早期即刻反应基因转录,介导其生理功能[8],但RA信号是否直接同cyclinD1基因作用目前尚未确定。RA在诱导多种肿瘤细胞分化过程中,均可见不同类型cyclin和/或CDK表达下调,其中cyclinD1等G1期周期蛋白变化更为常见[9],结合本实验结果,推测G1期周期蛋白cyclinD1及其相应激酶CDK4表达下调可能为RA诱导胸腺细胞分化分子机制中的重要事件。
, 百拇医药
本实验中免疫印迹结果显示随RA蓄积量增多,胸腺细胞内P16、P21蛋白表达均呈上调趋势,PRb表达逐渐下调。既往研究表明RA诱导白血病细胞分化时,既可上调P16、P21发挥负调节作用,又可降低PRb表达量,且CKI与PRb间可通过磷酸化状态的改变相互作用[10]。RB+/+的SKUT1B细胞中含CDK4蛋白,而RB-/-SKUT1A细胞则缺乏CDK4-P16INK4A复合物,分析P16、CDKs和PRb间为一负反馈调节环路。P21可通过拮抗cyclinD1/CDK4、cyclinE/CDK2功能,调控G1时相进程。Segaert等[11]发现ATRA和9-cis RA诱导机体上皮细胞分化时P21、P27及TGF-β1出现高表达,其中P21变化与本实验结果相符,推测P21作用可能与P16类似。目前研究认为cyclinD1-CDK4-P16-PRb环路为调控细胞G1期最重要途径。结合本实验结果,分析RA诱导分化信号可能经不同水平、不同途径调控靶基因表达,使周期调控蛋白与转录因子、生长因子、细胞信使间形成一相互作用的网络。
, http://www.100md.com
*杨志祥,男,26岁,助教,硕士
参考文献
1 孙关林.维甲酸的临床研究与应用.实用内科杂志,1990,10(5):270
2 Imaizumi M, Breitman T R. Retinoic acid-induced differentiation of the human promyelocytic leukemia cell line, HL-60,and fresh human leukemia cells in primary culture:a model for differentiation inducing therapy of leukemia. Eur J Haematol,1987,38(7):289
3 Brooks S C, Sturgill R, Choi J, et al. An RXR-seletive analog attenuates the RARa-seletive analog-induce differentiation and non-G1-restricted growth arrest of NB4 cell. Exp Cell Res,1997,234(2):259
, 百拇医药
4 Rigas J R, Miller V A, Zhang Z F, et al. Metabolic phenotypes of retinoic acid and the risk of lung cancer. Cancer Res,1996,56(8):2692
5 Leid M, Kastner P, Chambon P. Multiplicity generates diversity in the retinoic acid signalling pathways. Trends Biochem Sci,1992,17(3):427
6 Madrid-Marina V, Martinez-Valdez H, Cohen A,et al. Phorbol esters induce changes in adenosine deaminase,purine nucleoside phosphorylase,and terminal deoxynucleotidyl transferase messenger RNA levels in human leukemic cell lines. Cancer Res,1990,50(9):2891
, 百拇医药
7 Quelle D E, Ashmum R A, Hannon G J, et al. Cloning and characterization of murine p16INK4A and p15INK4B genes. Oncogene,1995,11(5):635
8 Bennett G D, Lau F, Calvin J A, et al. Phenytoin-induced terutogenesis:a molecular basis for the observed developmental delay during neurulation. Epilepsia,1997,38(2):415
9 Spanjaard R A, Lee P J, Sarlar S, et al. Clone 10d/BM28(CDCL1),an early S-phage protein, is an important growth regulator of melanoma. Cancer Res,1997,57(22):5122
, 百拇医药
10 Sellers W R, Kaelin W G. Role of the retinoblastoma protein in the pathogenesis of human cancer. J Clin Oncol,1997,15(11):3301
11 Segaert S, Garmyn M, Degreef H, et al. Retinoic acid modulates the anti-proliferative effect of 1,25-dihydroxy vitamin D3 in culture human epidermal keratinocytes. J Invest Dermatol,1997,109(1):46
收稿:1998-09-29;修回:1999-04-01, http://www.100md.com
单位:杨志祥糜漫天 张乾勇 郎海滨 韦 娜 第三军医大学预防医学系营养与食品卫生学教研室 重庆,400038
关键词:视黄酸;cyclinD1;CDK4;Rb蛋白;胸腺细胞
第三军医大学学报990716
提 要 目的:探讨视黄醇类化合物促胸腺细胞分化的分子机制。方法:选择幼年小鼠胸腺细胞为研究对象,采用免疫组化染色、Western blot、流式细胞分析等实验方法,观察全反式视黄酸(ATRA)或视黄醇(Retinol)灌胃给药后对胸腺细胞分化成熟的影响,同时检测周期调控蛋白cyclinD1及相应基因表达变化情况。结果:ATRA和Retinol均可抑制胸腺细胞增殖活性,使胸腺组织中成熟功能T细胞比例增大;胸腺细胞cyclinD1、CDK4和RB基因表达呈时间剂量依赖性下调,而P16、P21蛋白表达上调,且ATRA作用优于Retinol。结论:RA可能经PRb、P16等多因素反馈调节cyclinD1和CDK4表达,抑或直接同其发生作用,进而影响胸腺细胞增殖分化的变化。
, http://www.100md.com
中图法分类号 R322.53;R392.11
Role of cyclin D1 in differentiation of thymocytes induced by rentinoids in mice
Yang Zhixiang, Mi Mantian, Zhang Qianyong, Lang Haibin, Wei Na
(Department of Nutrition and Food Hygiene , Faculty of Preventive Medicine, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To explore the molecular mechanism of the role of cyclin D1 in the differentiation of thymocytes induced by all-trans retinoic acid and retinol. Methods: The expression of cyclin D1, CDK4, CKIs and PRb was determined with immunohistochemistry or immunoblotting and the subgroups of murine thymocytes were analyzed with FCM 1 to 4 weeks after the young mice were treated with ATRA or retinol. Results: With the increase of ATRA content in vivo, functional T lymphocytes became a greater portion of thymocytes. Both ATRA and retinol decreased the expression of cyclin D1, CDK4 and pRb but increased the expression of P16 and P21. Conclusion: ATRA and retinol can stimulate the maturation of functional T lymphocytes in murine thymus. The changes in expression of cyclin D1, CDK4 and related genes might be the molecular mechanism of RA-induced differentiation of thymocytes.
, 百拇医药
Key words retinoic acid; cyclin D1; CDK4, retinoblastoma protein; thymocyte; mouse
视黄醇类化合物是一类作用广泛的重要营养素,能增强机体免疫功能,但其作用机制尚不清楚[1]。近年来视黄酸(Retinoic acid,RA)诱导血液系统肿瘤细胞分化已成为研究热点,尤以其诱导早幼粒白血病细胞分化成熟更为引人注目。免疫系统的早期幼稚细胞同肿瘤细胞一样具有低分化特征。目前细胞周期调控研究已取得了突破性进展[2,3],其中细胞周期素(cyclin)/细胞周期素依赖性激酶(CDK)被认为是作用的核心因子。低分化细胞的生长抑制多表现G1期阻滞的特征,cyclin D1/CDK4复合物是G1期调控的关键因子,探讨该复合物的变化对揭示RA诱导分化机制有重要意义。本研究以小鼠胸腺细胞为研究对象,观察RA或视黄醇(Retinol)灌胃给药后对其分化的影响,探讨视黄酸诱导分化作用同周期调控蛋白cyclinD1及相应基因表达变化的相关性,由细胞周期调控途径入手,深入研究RA诱导分化作用的分子机制,为视黄酸的合理应用提供理论依据。
, http://www.100md.com
1 材料与方法
1.1 实验对象与分组
本实验采用昆明株小白鼠,体重(10±2)g,雌雄不拘,自由进食和饮水,随机分为3组,每组动物32只。①全反式视黄酸(All-trans retinoic acid,ATRA,Sigma)组:小鼠隔天给予ATRA液灌胃(按5 mg/kg体重);②视黄醇(Retinol,Sigma)组:隔天给予Retinol液灌胃(按5 mg/kg体重)。③正常对照组:以与给药组体积相同的芝麻油(Sesame oil)灌胃。检测时相点分别定为灌胃后1、2、3、4周。
1.2 血浆ATRA浓度
参照Rigas等[4]的HPLC测定方法,各组不同时相点动物经眼球取血,肝素抗凝分离血浆,加入8倍体积乙醚∶丙酮(9∶1)液充分混匀,离心去除沉淀,吸取上清以纯氮气吹干,少量甲醇溶解残余物,10 μl样品上色谱仪分析。HPLC测定条件:甲醇∶冰乙酸(1 000∶2)流动相;流速1.5 ml/min;C18反相柱;UV484紫外分光光度计;波长345 nm。
, 百拇医药
1.3 胸腺细胞制备及生长曲线的测定
动物经颈椎脱臼处死,无菌取胸腺,经200目尼龙网揉搓过滤细胞后,Tris-NH4Cl液溶红细胞,以1640培养液悬浮所得细胞。取不同组别4个时相点动物胸腺细胞悬液,台盼蓝染色计数活细胞比例后,每组行3次计数,绘制生长曲线。
1.4 胸腺CD4、CD8阳性细胞间接免疫荧光分析
每组取1×105个细胞,0.01 mol/L PBS(pH7.4)漂洗2次,4%多聚甲醛固定30 min,PBS漂洗后,分别加入1∶100稀释CD4、CD8单克隆抗体(鼠抗L3T4、鼠抗Lyt2,北京医科大学免疫教研室),4°C孵育45 min,PBS漂洗2次,各孔加入100 μl 1∶20稀释二抗(羊抗IgG,FITC标记,华美公司),4°C孵育45 min,PBS漂洗后以4%多聚甲醛PBS液悬浮细胞,上流式细胞仪分析各组CD4和/或CD8阳性细胞比例。
, http://www.100md.com
1.5 蛋白检测
1.5.1 免疫细胞化学 参照SP试剂盒操作方法:细胞滴片,4%多聚甲醛固定30 min,0.3% H2O2-甲醇溶液封闭30 min,含0.1%Triton X-100、10%山羊血清的PBS缓冲液(pH7.2)室温孵育1 h,加入1∶1 000稀释一抗,37°C孵育1 h,再与生物素标记二抗及链菌素亲生物蛋白-过氧化物酶复合物反应,用含0.05%DAB、0.03%H2O2的0.01 mol/L Tris-Cl(pH7.5)缓冲液显色。
1.5.2 免疫印迹 1×107个细胞,加100 μl预冷至0°C的1%NP-40裂解液(含50 mmol/L Tris、150 mmol/L NaCl、1%NP-40、25 mmol/L NaF、5 mmol/L Na4P2O7、5 mmol/L Na3PO4、0.1% SDS、1 mmol/L PMSF、10 μg/ml Leupeptin、10 μg/ml Aprotinain),冰上放置30 min,4°C12 000×g离心2 min,将上清液转移到另一微量离心管中,分装后保存于-20°C备用。每20 μl蛋白质提取液中加入20 μl 2×SDS凝胶加样缓冲液,100°C煮沸5 min,以聚丙烯酰胺电泳后,电转移转膜22 h,1% BSA封闭37°C 1 h或4°C过夜,加一抗37°C孵育1 h,按SP试剂盒操作反应后用化学发光检测试剂盒检测。
, http://www.100md.com
1.6 统计学处理
采用t检验。
2 结果
2.1 血浆视黄酸浓度
通过反相高效液相色谱检测动物ATRA或Retinol灌胃后不同时相点血浆ATRA浓度。发现随灌胃时间延长,血浆ATRA含量逐渐增多,见图1。且ATRA、Retinol和对照组之间差异均显著,表明药物灌胃成功,可推测Retinol仅有部分在体内代谢为ATRA。

图1 ATRA或Retinol处理后外周血浆中ATRA含量的变化
Fig 1 Changes of the concentration of ATRA in peripheral blood plasma after treatment with ATRA or Retinol
, 百拇医药
2.2 生长曲线 动物随ATRA和Retinol体内蓄积量增多,ATRA和Retinol与对照组之间,胸腺细胞数差异不显著(P>0.05),见表1。说明视黄醇类化合物对成熟小鼠胸腺细胞总数影响较小。
表1 ATRA或Retinol处理后胸腺细胞总数变化
Tab 1 Changes of the number of thymocytes after treatment
with ATRA or retinol(×107)(x±s,n=8) Group
1 week
2 weeks
3 weeks
, 百拇医药
4 weeks
Control
4.98±0.28
5.12±0.36
6.10±0.55
5.42±0.29
Retinol
5.02±0.60
5.62±0.25
6.14±0.28
5.96±0.58
ATRA
, 百拇医药
5.56±0.49
5.48±0.30
6.06±0.42
5.62±0.35
2.3 ATRA和Retinol对胸腺细胞分化能力的影响
胸腺的发育过程表现为CD4-CD8-双阴性低分化细胞、CD4+CD8+双阳性幼稚细胞、CD4+或CD8+成熟功能细胞的逐渐演变。通过间接免疫荧光技术标记细胞表面抗原,经流式细胞分析各细胞亚型在胸腺中比例:结果显示CD4+、CD8+、及CD4+CD8+阳性细胞随药物摄入增多而比例上升,提示胸腺中CD4-CD8-细胞减少,成熟的CD4+CD8-、CD4-CD8+细胞增多(P<0.05),见图2。



, 百拇医药
图2 经流式细胞仪分析ATRA或Retinol处理后胸腺亚群细胞比例变化
A:CD4+胸腺细胞(对照);B:CD4+胸腺细胞(ATRA处理4周);C:CD8+胸腺细胞(对照);
D:CD8+胸腺细胞(ATRA处理4周);E:CD4+CD8+胸腺细胞(对照);
F:CD4+CD8+胸腺细胞(ATRA处理4周)
Fig 2 Thymocyte subgroups analysis by FACS
A:CD4+ thymocytes (control); B:CD4+ thymocytes (treated with ATRA for 4 weeks);
, 百拇医药
C:CD8+ thymocytes (control); D:CD8+ thymocytes (treated with ATRA for 4 weeks);
E: CD4+CD8+ thymocytes (control); F:CD4+CD8+ thymocytes (treated with ATRA for 4 weeks)
2.4 ATRA和Retinol对胸腺细胞cyclin D1、CDK4蛋白表达的影响
免疫组化染色结果表明,ATRA灌胃后动物胸腺细胞cyclin D1蛋白表达量显著下降,CDK4蛋白表达亦呈下降趋势,但不及cyclinD1明显;Retinol灌胃后cyclin D1和CDK4蛋白变化趋势同ATRA,但下降程度稍差。Cyclin D1、CDK4蛋白表达均以细胞核着色为主,胞质亦有部分阳性反应,见图3。
, 百拇医药
2.5 ATRA和Retinol诱导CKls及pRb蛋白表达变化
免疫印迹分析发现,ATRA或Retinol处理动物后,细胞周期依赖性激酶抑制物P16INK4A、P21WAP-1蛋白在胸腺细胞表达增多,并呈时间剂量依赖性,而PRb蛋白随ATRA或Retinol摄入增多表达逐渐下降,见图4。




图3 ATRA作用后小鼠胸腺细胞cyclin D1和CDK4蛋白免疫组化染色结果
, http://www.100md.com
A:对照组cyclin D1蛋白呈强阳性; B:ATRA处理四周cyclinD1呈弱阳性; C:对照组CDK4蛋白呈强阳性; D:ATRA处理四周CDK4呈阳性
Fig 3 Expressions of cyclin D1 and CDK4 protein as indicated by ICC-stained
in thymocytes treated with ATRA for 4 weeks
A: Intensive positive of cyclin D1 protein in control; B: Weak positive of cyclin D1 protein in ATRA treated group; C: Intensive positive of CDK4 protein in control; D: Positive of CDK4 protein in ATRA treated group

, 百拇医药
图4 视黄醇类化合物对胸腺细胞P16、P21及PRb的表达影响
Fig 4 Immunoblot analysis of the effects of ATRA and retinol on the
expression of PRb、P21 and P16 protein in thymocytes
3 讨论
既往研究显示生理剂量下RA能增强体液免疫反应及T淋巴细胞杀瘤作用[1]。RA摄入机体后,经其受体调控某些相关基因表达,影响细胞增殖和分化[5]。通过对T细胞淋巴瘤诱导分化的研究发现,RA可调节胞内嘌呤核苷磷酸化酶(PNP)、脱氧核苷酸转移酶(TdT)及腺苷脱氨酶(ADA)的表达和活性变化,而PNP、ADA和TdT正是胸腺细胞分化的标志酶[6]。由此推测,RA可能与决定机体免疫功能状态的胸腺幼稚祖细胞分化成熟密切相关。本实验采用隔天5 mg/kg ATRA或Retinol经灌胃给药处理昆明株小鼠1~4周,观察胸腺细胞生长状况,发现胸腺细胞数与对照组相比变化不明显,提示RA对胸腺细胞总数影响较小,推测可能与成熟小鼠胸腺发育状态和/或对RA敏感程度不同有关。流式细胞分析结果表明,ATRA或Retinol动物灌胃后胸腺组织中CD4-CD8-双阴性胸腺细胞比例下降,而成熟的功能性T淋巴细胞增多,且与对照组间差异显著。因胸腺细胞总数变化并不显著,分析RA可能主要对胸腺中比例较小的低分化细胞起作用,抑制其增殖,促其向成熟细胞分化。RA是否通过刺激淋巴系祖细胞的分化,提高功能T细胞数量来增强机体免疫力,尚无定论,但本实验RA给药后胸腺细胞分化状态的改变多少为该途径的深入研究提供了思路。
, http://www.100md.com
细胞周期进程受细胞因子、周期调控蛋白、癌基因及抑癌基因表达产物等多因素调控,各因素之间相互协调,构成一网络调控机制。通过RA对血液肿瘤细胞抑制增殖和诱导分化的研究发现,G1期关卡(Checkpoint)是决定细胞能否正常增殖分化的关键位点。CyclinD1作为G1期调控蛋白,与CDK4形成的复合物在G1/S期转换中起关键调节作用。胸腺细胞属于淋巴系统,研究发现,在多种恶性淋巴瘤细胞中可见cyclinD1超表达[7],推测cyclinD1在淋巴系统增殖分化过程中亦起重要调控作用。本实验免疫组化结果发现CyclinD1和CDK4在1~4周时相点表达逐渐下降,与RA体内摄入量呈负相关。胸腺中反应阳性细胞呈不均匀分布,分析可能与组织细胞的不同分化状态有关。RA经胞内核受体激活某些早期即刻反应基因转录,介导其生理功能[8],但RA信号是否直接同cyclinD1基因作用目前尚未确定。RA在诱导多种肿瘤细胞分化过程中,均可见不同类型cyclin和/或CDK表达下调,其中cyclinD1等G1期周期蛋白变化更为常见[9],结合本实验结果,推测G1期周期蛋白cyclinD1及其相应激酶CDK4表达下调可能为RA诱导胸腺细胞分化分子机制中的重要事件。
, 百拇医药
本实验中免疫印迹结果显示随RA蓄积量增多,胸腺细胞内P16、P21蛋白表达均呈上调趋势,PRb表达逐渐下调。既往研究表明RA诱导白血病细胞分化时,既可上调P16、P21发挥负调节作用,又可降低PRb表达量,且CKI与PRb间可通过磷酸化状态的改变相互作用[10]。RB+/+的SKUT1B细胞中含CDK4蛋白,而RB-/-SKUT1A细胞则缺乏CDK4-P16INK4A复合物,分析P16、CDKs和PRb间为一负反馈调节环路。P21可通过拮抗cyclinD1/CDK4、cyclinE/CDK2功能,调控G1时相进程。Segaert等[11]发现ATRA和9-cis RA诱导机体上皮细胞分化时P21、P27及TGF-β1出现高表达,其中P21变化与本实验结果相符,推测P21作用可能与P16类似。目前研究认为cyclinD1-CDK4-P16-PRb环路为调控细胞G1期最重要途径。结合本实验结果,分析RA诱导分化信号可能经不同水平、不同途径调控靶基因表达,使周期调控蛋白与转录因子、生长因子、细胞信使间形成一相互作用的网络。
, http://www.100md.com
*杨志祥,男,26岁,助教,硕士
参考文献
1 孙关林.维甲酸的临床研究与应用.实用内科杂志,1990,10(5):270
2 Imaizumi M, Breitman T R. Retinoic acid-induced differentiation of the human promyelocytic leukemia cell line, HL-60,and fresh human leukemia cells in primary culture:a model for differentiation inducing therapy of leukemia. Eur J Haematol,1987,38(7):289
3 Brooks S C, Sturgill R, Choi J, et al. An RXR-seletive analog attenuates the RARa-seletive analog-induce differentiation and non-G1-restricted growth arrest of NB4 cell. Exp Cell Res,1997,234(2):259
, 百拇医药
4 Rigas J R, Miller V A, Zhang Z F, et al. Metabolic phenotypes of retinoic acid and the risk of lung cancer. Cancer Res,1996,56(8):2692
5 Leid M, Kastner P, Chambon P. Multiplicity generates diversity in the retinoic acid signalling pathways. Trends Biochem Sci,1992,17(3):427
6 Madrid-Marina V, Martinez-Valdez H, Cohen A,et al. Phorbol esters induce changes in adenosine deaminase,purine nucleoside phosphorylase,and terminal deoxynucleotidyl transferase messenger RNA levels in human leukemic cell lines. Cancer Res,1990,50(9):2891
, 百拇医药
7 Quelle D E, Ashmum R A, Hannon G J, et al. Cloning and characterization of murine p16INK4A and p15INK4B genes. Oncogene,1995,11(5):635
8 Bennett G D, Lau F, Calvin J A, et al. Phenytoin-induced terutogenesis:a molecular basis for the observed developmental delay during neurulation. Epilepsia,1997,38(2):415
9 Spanjaard R A, Lee P J, Sarlar S, et al. Clone 10d/BM28(CDCL1),an early S-phage protein, is an important growth regulator of melanoma. Cancer Res,1997,57(22):5122
, 百拇医药
10 Sellers W R, Kaelin W G. Role of the retinoblastoma protein in the pathogenesis of human cancer. J Clin Oncol,1997,15(11):3301
11 Segaert S, Garmyn M, Degreef H, et al. Retinoic acid modulates the anti-proliferative effect of 1,25-dihydroxy vitamin D3 in culture human epidermal keratinocytes. J Invest Dermatol,1997,109(1):46
收稿:1998-09-29;修回:1999-04-01, http://www.100md.com