大内皮素-1的生物转化对兔肺动脉收缩反应的影响
作者:贾建锋 杜军保 齐建光
单位:100034 北京医科大学第一医院儿科
关键词:
中华医学杂志990825 内皮素1(endothelin-1,ET-1)是目前发现的血管内皮细胞产生的缩血管作用最强的多肽[1]。大内皮素1(big endothelin-1,BET-1)的生物活性仅为ET-1的1/200,只有在内皮素转换酶(ECE)作用下转化生成ET-1之后,才能充分发挥其生物学作用[2,3]。我们旨在研究BET-1在肺动脉的生物转化及其对肺动脉收缩反应的影响,同时对幼年和成年兔肺动脉转化BET-1生成ET-1的活性进行比较研究。
一、材料与方法
1.肺动脉血管环制备及给药方法:新西兰大白兔(北京医科大学第一医院动物室提供),成年兔(体重2.5~3.0 kg)和幼年兔(体重100~200 g,平均兔龄7天)各8只,雌雄不拘。实验分为4组:成年兔BET-1组,成年兔BET-1+内皮素转换酶抑制剂(PR)组,幼年兔BET-1组 和幼年兔BET-1+PR组,每组观察8条肺动脉血管环。将成年兔钝击枕部,放血处死,迅速开胸取肺动脉,置于0℃的Krebs营养液(单位均为mmol/L,包括:NaCl 118、KCl 4.8、NaHCO3 25.0、CaCl2 2.5、MgSO4 1.2、KH2PO4 1.2及葡萄糖11.0)中,仔细分离肺动脉周围脂肪及结缔组织,避免血管内皮细胞的损伤,并将其切成5 mm宽的血管环。随后将肺动脉血管环悬挂于生理浴槽中2个L型不锈钢血管环支架之间,上端与肌张力传感器相连。生理浴槽中加入5 ml的Krebs营养液,并保持38℃恒定,同时持续通入混合气(体积分数为95%的O2及50%CO2)。预先拉伸肺动脉血管环使静息张力为1~2 g,用Krebs营养液平衡60~100分钟,每15分钟更换营养液1次,待张力平衡之后加入1 mol/L的氯化钾(终浓度50 mmol/L),收缩曲线稳定之后用Krebs营养液冲洗数次,血管环张力恢复至静息张力后,在成年兔BET-1组加入BET-1(终浓度3×10-8 mmol/L),而成年兔BET-1+PR组在加入BET-1之前20分钟加入PR(终浓度10-4 mmol/L),同时描记张力变化曲线。加BET-1后观察记录60分钟,张力曲线达稳定后停止,并留取所用营养液-20℃保存,测定其中ET-1的含量。预置幼年兔BET-1组和幼年兔BET-1+PR组肺动脉血管环静息张力为0.5~1.5 g,其余处理同前。
, 百拇医药
2.试剂与仪器:BET-1及PR均购自美国Sigma公司,ET放射免疫测定试剂盒购自北京东亚免疫技术研究所。主要实验仪器包括四导生理记录仪(日本光电公司),JH-2型肌张力传感器(北京航天医学工程开发公司),SN-682型放射免疫计数器(上海核福光电仪器有限公司)。
3.内皮素测定:采用ET放射免疫测定试剂盒,用非平衡法测定各实验组营养液中ET-1的含量。
4.数据处理及统计学分析:以50 mmol/L氯化钾所致肺动脉血管环的张力变化,作为所用肺动脉血管环的大小的量化指标,计算单位血管环使营养液ET-1改变的量。用加入BET-1前后肺动脉血管环张力分析BET-1缩血管作用。以50 mmol/L氯化钾所致肺动脉血管环的张力变化,作为肺动脉血管环大小的量化指标,计算BET-1所致单位血管环张力变化的量。结果用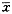 ±s
±s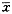 表示,组间分析采用t检验。
表示,组间分析采用t检验。
, 百拇医药
二、结果
1.营养液中ET-1含量的变化:加入BET-1前营养液中不含ET-1,单独加入BET-1后成年兔BET-1组营养液中ET-1含量与幼年兔BET-1组比较,后者明显高于前者,差异有显著意义(t=7.22,P<0.01)。加PR后再加入BET-1时,成年兔BET-1+PR组和幼年兔BET-1+PR组营养液中ET-1的含量较未用PR时明显降低(t=4.59,t=8.61,P均<0.01),两组肺动脉血管环BET-1转化生成ET-1的作用受到明显抑制,见表1。
表1 4组兔ET-1含量(pg.ml-1.血管环-1,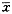 ±s
±s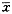 ) 组别
) 组别
, 百拇医药
兔数
ET-1
成年兔BET-1
8
0.0109±0.0017*△
成年兔BET-1+PR
8
0.0027±0.0044
幼年兔BET-1
8
0.0451±0.0004△
幼年兔BET-1+PR
, 百拇医药
8
0.0061±0.0010
注:与幼年兔BET-1组比较,*t=7.22,P<0.01;与成年兔(幼年兔)BET-1+PR组比较,△t=4.59,t=8.61,P均<0.01
2.肺动脉血管环的收缩反应:加入BET-1后,成年兔BET-1组和幼年兔BET-1组肺动脉血管环张力均明显增高(t=6.42,t=8.57,P均<0.01),成年兔BET-1+PR组和与幼年兔BET-1+PR组肺动脉血管环张力亦明显增高(t=4.96,t=5.79,P均<0.01),但增高幅度明显低于成年兔BET-1组和幼年兔BET-1组(t=4.59,t=8.61,P均<0.01),见表2。BET-1所致成年兔BET-1组肺动脉血管环的张力变化为50 mmol/L氯化钾所致张力变化的(62±9)%,而幼年兔BET-1组为(91±4)% ,后者明显高于前者(t=2.87,P<0.05)。
, http://www.100md.com
表2 肺动脉血管环的张力变化(mg,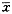 ±s
±s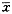 ) 组别
) 组别
兔数
用药前
用药后
变化量
成年兔BET-1
8
1553±130
2812±236*△
, 百拇医药 1259±196
成年兔BET-1+PR
8
1705±92
2187±172*
482±97
幼年兔BET-1
8
663±52
1221±62*△
559±65
幼年兔BET-1+PR
, 百拇医药
8
769±54
997±76*
228±39
注:与用药前比较,*t=6.42,t=4.96,t=8.57,t=5.79,P均<0.01;与成年兔(幼年兔)BET-1+PR组比较,△t=4.59,t=8.61,P均<0.01
三、讨论
目前关于BET-1在肺循环发生生物转化过程中肺动脉组织的作用尚不清楚。以往有研究发现,BET-1可以使离体灌流肺血管产生剂量依赖性的收缩反应,肺循环阻力升高[4],在静脉中应用BET-1可引起豚鼠肺动脉压力和平均压力缓慢而持久的升高,而PR则可以抑制BET-1的上述作用[5],证明BET-1可以在肺循环中转化生成ET,并且在ECE作用下BET-1的生物转化是发挥其缩血管作用的关键环节。上述研究是应用离体灌流肺模型或在整体条件下进行的,由于发现多核白细胞[6]、肺实质[7]和呼吸道上皮细胞[8]同样可以转化BET-1生成ET-1,因而不能除外上述因素可能造成的影响。而在本实验中我们应用离体肺动脉血管环,排除了血液以及血管周围组织对BET-1生物转化过程的影响,证明肺动脉在BET-1生物转化过程中发挥着重要作用。
, 百拇医药
我们发现,加入BET-1后,原本不含ET-1的营养液中出现ET-1并使肺动脉血管环的张力增高,ECE的抑制剂PR使加入BET-1后营养液中ET-1浓度的增高和肺动脉血管环张力增高的程度受到明显抑制,证明肺动脉组织可以使BET-1发生生物转化而生成ET-1,产生缩血管作用,表明肺动脉组织是BET-1在肺脏中发生生物转化生成ET-1的重要部位之一。同时由于PR可以抑制上述作用,表明在ECE作用下BET-1转化生成ET-1的过程在BET-1收缩肺动脉的作用中发挥着关键作用。然而PR并不能使加入BET-1后肺动脉血管环张力增高的现象完全消失,表明在未发生生物转化以前BET-1也有一定的缩血管作用,可以收缩肺动脉血管环,这与以往研究结果一致。
由于内源性的血管活性物质对肺循环结构与功能的发育发挥着重要作用[9],探索不同发育阶段的肺动脉ECE对BET-1转化活性的规律性对于揭示ET系统对发育中肺循环的调节作用有重要意义,目前尚少有关于幼年与成年之间ECE活性比较的报道。本研究中我们发现在营养液中加入BET-1后,幼年兔BET-1组肺动脉血管环使营养液中ET-1升高的程度明显高于成年兔BET-1组,同时BET-1所致幼年兔肺动脉血管环张力升高的程度也高于成年兔组,提示幼年兔肺动脉组织ECE转化BET-1生成ET-1的活性高于成年兔肺动脉;幼年时期肺动脉ECE活性高于成年时期肺动脉。
, http://www.100md.com
参考文献
1 Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells.Nature,1988,332: 411-415.
2 Kashiwabara T,Inagaki Y,Ohata H,et al.Putative precursors of endothelin have less vasoconstrictor activity in vitro but a potent pressor effect in vivo.FEBS Lett,1989,247:73-76.
3 Kimura S,Kaysuya Y,Sawamura T,et al.Conversion of big endothelin-1 to 21 residue endothelin-1 is essential for expression of full vasoconstrictor activity: sturcture-activity relationships of big endothelin-1.J cardiovasu,1989,13:S5-S7.
, 百拇医药
4 Liben S,Stewart DJ,De Mater J,et al.Ontogeny of big endothelin-1 effects in newborn piglet pulmonary vasculature.Am J Physiol,1993,265: H139-H145.
5 Pons F,Touvay C,Lagente V, et al.Involvement of phosphoramidon-sensitive endopeptidase in the processing of big endothelin-1 in the guinea-pig.Eur J Pharmacol,1992,217: 65-70.
6 Sessa WC,Kaw S,Hecker M,et al.The biosynthesis of endothelin-1 by human polymorphonuclear leukocytes.Biochem Biophys Res Commun,1990,174: 613-618.
, 百拇医药
7 Lebel N, D′Orleans Juste P,Fournier A,et al.Role of the neutral endopeptidase 24.11 in the conversion of big endothelins in guinea pig lung parenchyma.Br J Pharmacol,1996,117: 184-188.
8 Shima H,Yamanouchi M,Omori K,et al.Endothelin-1 production and endothelin converting enzyme expression by guinea pig airway epithelial cells.Biochem Mol Biol Int,1995,37: 1001-1010.
9 Perreault T,De Marte J.Maturational changes in endothelium-derived relaxation in newbron pig let pulmonary circulation.Am J Physiol,1993,264:H302-309.
(收稿:1998-11-05 修回:1999-03-10), 百拇医药
单位:100034 北京医科大学第一医院儿科
关键词:
中华医学杂志990825 内皮素1(endothelin-1,ET-1)是目前发现的血管内皮细胞产生的缩血管作用最强的多肽[1]。大内皮素1(big endothelin-1,BET-1)的生物活性仅为ET-1的1/200,只有在内皮素转换酶(ECE)作用下转化生成ET-1之后,才能充分发挥其生物学作用[2,3]。我们旨在研究BET-1在肺动脉的生物转化及其对肺动脉收缩反应的影响,同时对幼年和成年兔肺动脉转化BET-1生成ET-1的活性进行比较研究。
一、材料与方法
1.肺动脉血管环制备及给药方法:新西兰大白兔(北京医科大学第一医院动物室提供),成年兔(体重2.5~3.0 kg)和幼年兔(体重100~200 g,平均兔龄7天)各8只,雌雄不拘。实验分为4组:成年兔BET-1组,成年兔BET-1+内皮素转换酶抑制剂(PR)组,幼年兔BET-1组 和幼年兔BET-1+PR组,每组观察8条肺动脉血管环。将成年兔钝击枕部,放血处死,迅速开胸取肺动脉,置于0℃的Krebs营养液(单位均为mmol/L,包括:NaCl 118、KCl 4.8、NaHCO3 25.0、CaCl2 2.5、MgSO4 1.2、KH2PO4 1.2及葡萄糖11.0)中,仔细分离肺动脉周围脂肪及结缔组织,避免血管内皮细胞的损伤,并将其切成5 mm宽的血管环。随后将肺动脉血管环悬挂于生理浴槽中2个L型不锈钢血管环支架之间,上端与肌张力传感器相连。生理浴槽中加入5 ml的Krebs营养液,并保持38℃恒定,同时持续通入混合气(体积分数为95%的O2及50%CO2)。预先拉伸肺动脉血管环使静息张力为1~2 g,用Krebs营养液平衡60~100分钟,每15分钟更换营养液1次,待张力平衡之后加入1 mol/L的氯化钾(终浓度50 mmol/L),收缩曲线稳定之后用Krebs营养液冲洗数次,血管环张力恢复至静息张力后,在成年兔BET-1组加入BET-1(终浓度3×10-8 mmol/L),而成年兔BET-1+PR组在加入BET-1之前20分钟加入PR(终浓度10-4 mmol/L),同时描记张力变化曲线。加BET-1后观察记录60分钟,张力曲线达稳定后停止,并留取所用营养液-20℃保存,测定其中ET-1的含量。预置幼年兔BET-1组和幼年兔BET-1+PR组肺动脉血管环静息张力为0.5~1.5 g,其余处理同前。
, 百拇医药
2.试剂与仪器:BET-1及PR均购自美国Sigma公司,ET放射免疫测定试剂盒购自北京东亚免疫技术研究所。主要实验仪器包括四导生理记录仪(日本光电公司),JH-2型肌张力传感器(北京航天医学工程开发公司),SN-682型放射免疫计数器(上海核福光电仪器有限公司)。
3.内皮素测定:采用ET放射免疫测定试剂盒,用非平衡法测定各实验组营养液中ET-1的含量。
4.数据处理及统计学分析:以50 mmol/L氯化钾所致肺动脉血管环的张力变化,作为所用肺动脉血管环的大小的量化指标,计算单位血管环使营养液ET-1改变的量。用加入BET-1前后肺动脉血管环张力分析BET-1缩血管作用。以50 mmol/L氯化钾所致肺动脉血管环的张力变化,作为肺动脉血管环大小的量化指标,计算BET-1所致单位血管环张力变化的量。结果用
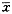 ±s
±s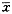 表示,组间分析采用t检验。
表示,组间分析采用t检验。, 百拇医药
二、结果
1.营养液中ET-1含量的变化:加入BET-1前营养液中不含ET-1,单独加入BET-1后成年兔BET-1组营养液中ET-1含量与幼年兔BET-1组比较,后者明显高于前者,差异有显著意义(t=7.22,P<0.01)。加PR后再加入BET-1时,成年兔BET-1+PR组和幼年兔BET-1+PR组营养液中ET-1的含量较未用PR时明显降低(t=4.59,t=8.61,P均<0.01),两组肺动脉血管环BET-1转化生成ET-1的作用受到明显抑制,见表1。
表1 4组兔ET-1含量(pg.ml-1.血管环-1,
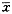 ±s
±s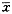 ) 组别
) 组别, 百拇医药
兔数
ET-1
成年兔BET-1
8
0.0109±0.0017*△
成年兔BET-1+PR
8
0.0027±0.0044
幼年兔BET-1
8
0.0451±0.0004△
幼年兔BET-1+PR
, 百拇医药
8
0.0061±0.0010
注:与幼年兔BET-1组比较,*t=7.22,P<0.01;与成年兔(幼年兔)BET-1+PR组比较,△t=4.59,t=8.61,P均<0.01
2.肺动脉血管环的收缩反应:加入BET-1后,成年兔BET-1组和幼年兔BET-1组肺动脉血管环张力均明显增高(t=6.42,t=8.57,P均<0.01),成年兔BET-1+PR组和与幼年兔BET-1+PR组肺动脉血管环张力亦明显增高(t=4.96,t=5.79,P均<0.01),但增高幅度明显低于成年兔BET-1组和幼年兔BET-1组(t=4.59,t=8.61,P均<0.01),见表2。BET-1所致成年兔BET-1组肺动脉血管环的张力变化为50 mmol/L氯化钾所致张力变化的(62±9)%,而幼年兔BET-1组为(91±4)% ,后者明显高于前者(t=2.87,P<0.05)。
, http://www.100md.com
表2 肺动脉血管环的张力变化(mg,
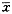 ±s
±s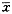 ) 组别
) 组别兔数
用药前
用药后
变化量
成年兔BET-1
8
1553±130
2812±236*△
, 百拇医药 1259±196
成年兔BET-1+PR
8
1705±92
2187±172*
482±97
幼年兔BET-1
8
663±52
1221±62*△
559±65
幼年兔BET-1+PR
, 百拇医药
8
769±54
997±76*
228±39
注:与用药前比较,*t=6.42,t=4.96,t=8.57,t=5.79,P均<0.01;与成年兔(幼年兔)BET-1+PR组比较,△t=4.59,t=8.61,P均<0.01
三、讨论
目前关于BET-1在肺循环发生生物转化过程中肺动脉组织的作用尚不清楚。以往有研究发现,BET-1可以使离体灌流肺血管产生剂量依赖性的收缩反应,肺循环阻力升高[4],在静脉中应用BET-1可引起豚鼠肺动脉压力和平均压力缓慢而持久的升高,而PR则可以抑制BET-1的上述作用[5],证明BET-1可以在肺循环中转化生成ET,并且在ECE作用下BET-1的生物转化是发挥其缩血管作用的关键环节。上述研究是应用离体灌流肺模型或在整体条件下进行的,由于发现多核白细胞[6]、肺实质[7]和呼吸道上皮细胞[8]同样可以转化BET-1生成ET-1,因而不能除外上述因素可能造成的影响。而在本实验中我们应用离体肺动脉血管环,排除了血液以及血管周围组织对BET-1生物转化过程的影响,证明肺动脉在BET-1生物转化过程中发挥着重要作用。
, 百拇医药
我们发现,加入BET-1后,原本不含ET-1的营养液中出现ET-1并使肺动脉血管环的张力增高,ECE的抑制剂PR使加入BET-1后营养液中ET-1浓度的增高和肺动脉血管环张力增高的程度受到明显抑制,证明肺动脉组织可以使BET-1发生生物转化而生成ET-1,产生缩血管作用,表明肺动脉组织是BET-1在肺脏中发生生物转化生成ET-1的重要部位之一。同时由于PR可以抑制上述作用,表明在ECE作用下BET-1转化生成ET-1的过程在BET-1收缩肺动脉的作用中发挥着关键作用。然而PR并不能使加入BET-1后肺动脉血管环张力增高的现象完全消失,表明在未发生生物转化以前BET-1也有一定的缩血管作用,可以收缩肺动脉血管环,这与以往研究结果一致。
由于内源性的血管活性物质对肺循环结构与功能的发育发挥着重要作用[9],探索不同发育阶段的肺动脉ECE对BET-1转化活性的规律性对于揭示ET系统对发育中肺循环的调节作用有重要意义,目前尚少有关于幼年与成年之间ECE活性比较的报道。本研究中我们发现在营养液中加入BET-1后,幼年兔BET-1组肺动脉血管环使营养液中ET-1升高的程度明显高于成年兔BET-1组,同时BET-1所致幼年兔肺动脉血管环张力升高的程度也高于成年兔组,提示幼年兔肺动脉组织ECE转化BET-1生成ET-1的活性高于成年兔肺动脉;幼年时期肺动脉ECE活性高于成年时期肺动脉。
, http://www.100md.com
参考文献
1 Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells.Nature,1988,332: 411-415.
2 Kashiwabara T,Inagaki Y,Ohata H,et al.Putative precursors of endothelin have less vasoconstrictor activity in vitro but a potent pressor effect in vivo.FEBS Lett,1989,247:73-76.
3 Kimura S,Kaysuya Y,Sawamura T,et al.Conversion of big endothelin-1 to 21 residue endothelin-1 is essential for expression of full vasoconstrictor activity: sturcture-activity relationships of big endothelin-1.J cardiovasu,1989,13:S5-S7.
, 百拇医药
4 Liben S,Stewart DJ,De Mater J,et al.Ontogeny of big endothelin-1 effects in newborn piglet pulmonary vasculature.Am J Physiol,1993,265: H139-H145.
5 Pons F,Touvay C,Lagente V, et al.Involvement of phosphoramidon-sensitive endopeptidase in the processing of big endothelin-1 in the guinea-pig.Eur J Pharmacol,1992,217: 65-70.
6 Sessa WC,Kaw S,Hecker M,et al.The biosynthesis of endothelin-1 by human polymorphonuclear leukocytes.Biochem Biophys Res Commun,1990,174: 613-618.
, 百拇医药
7 Lebel N, D′Orleans Juste P,Fournier A,et al.Role of the neutral endopeptidase 24.11 in the conversion of big endothelins in guinea pig lung parenchyma.Br J Pharmacol,1996,117: 184-188.
8 Shima H,Yamanouchi M,Omori K,et al.Endothelin-1 production and endothelin converting enzyme expression by guinea pig airway epithelial cells.Biochem Mol Biol Int,1995,37: 1001-1010.
9 Perreault T,De Marte J.Maturational changes in endothelium-derived relaxation in newbron pig let pulmonary circulation.Am J Physiol,1993,264:H302-309.
(收稿:1998-11-05 修回:1999-03-10), 百拇医药