高浓度二氧化碳致大鼠全身性水肿的机理研究
作者:汪建新 王辰 庞宝森 翁心植 牛淑洁 黄秀霞 张海燕
单位:100020 首都医科大学附属北京红十字朝阳医院呼吸科
关键词:肺疾病,阻塞性;水肿;脂质过氧化
中华医学杂志990823 【摘要】 目的 探讨高碳酸血症时大鼠全身性水肿发生的机理。方法 给大鼠呼吸高浓度二氧化碳气体(8% CO2、21% O2,71% N2),每天7小时,连续4周。观察高碳酸血症大鼠各项指标的变化,并设对照组。结果 对照组平均肺动脉压(mPAP)为(1.94±0.28)kPa,PaCO2为(4.6±0.9)kPa。大鼠循环血中125I-牛血清白蛋白半排出时间(T1/2)为(238±30)min;血浆过氧化脂质(LPO)为(3.0±0.6)nmol/ml,红细胞超氧化物歧化酶(SOD)活性为(1 042±135)U/g Hb。肺组织中水含量为(76.2±1.0)%,肌组织为(74.1±2.8)%。高碳酸血症组mPAP为(2.0±0.4)kPa、PaCO2为(7.4±0.4)kPa、T1/2为(150±23)min、LPO为(8.8±2.0)nmol/ml、SOD为(682±341)U/g Hb、肺组织中水含量为(78.8±1.8)%、肌组织为(76.0±1.0)%。两组比较mPAP差异无显著意义(P>0.05);PaCO2、T1/2、LPO、SOD,肺组织及肌组织中水含量差异有显著性意义(P<0.01),结论 脂质过氧化导致微血管内皮细胞受损、通透性增加是引起水肿的直接原因。肺脏本身因素可以引起全身性水肿。
, http://www.100md.com
Anasarcous mechanism induced by hypercapnia in rats
WANG Jianxin WANG Chen PANG Baosen et al.
(Department of Respiratory Disease,Beijing Red Cross Chaoyang Hospital,Beijing 100020)
【Abstract】 Objective To study anasarcous pathogenesis during hypercapnia.Methods The mixed gases of highly concentrated carbon dioxide(8%CO2,21%O2,71%N2) were given to Wistar rats 7 hours a day for four weeks.The various indexes were comparatively observed between control group and hypercapnia group.Results Pulmonary arterial pressure (mPAP) in control group was(1.94±0.28)kPa and PaCO2(4.6±0.9)kPa.T1/2 of 125 I-BSA in the blood was (238±30) min,plasma lipid peroxide (LPO) level (3.08±0.69) nmol/ml,erythrocytic superoxide dismutase (SOD) activity (1 042±135) CU/g Hb.Water content was (76.2±1.0)% in lung and (74.1±2.8)% in muscular tissues.mPAP in hypercapnia group was (2.0±0.4) kPa,PaCO2 (7.4±0.4) kPa,T1/2(150±23) min,LPO (8.8±2.0) nmol/ml,SOD (682±341) U/g Hb1 and water content was (78.8±1.8)% in lung and (76.04±1.07)% in muscular tissues.No significant differences were found in mPAP (P>0.05).There were significant differences in PaCO2 (P<0.01),T1/2(P<0.01),LPO (P<0.001),SOD (P<0.01),water content in lung (P<0.01),and water content in muscular tissues (P<0.05).Conclusions Rat hypercapnic model can be reproduced with 8% CO2 mixed gases.Systemic water and natrium retention (edema) might occur in the model.Microvascular endothelial cell damage and its highly increased permeability induced by lipid peroxidation is the direct cause of edema.The pulmonary cause per se can produce anasarca.
, 百拇医药
【Key words】 Pulmonary disease,obstructive Edema Lipid peroxidation
慢性阻塞性肺疾病(COPD)、慢性肺原性心脏病急性发作期患者常出现全身性水肿,这一临床现象早为人们熟知,但形成水肿的机理迄今尚未明了[1,2]。晚近,我们的临床研究结果表明,右心衰竭并不是这类水肿形成的必备条件,水肿形成与低氧、高碳酸血症等综合因素有关[3],而高碳酸血症在水肿发生中可能起更为重要的作用[4]。本项研究中我们以8%的CO2混合气体复制大鼠常压、常氧、高碳酸血症动物模型,着重探讨高碳酸血症在全身性水肿发生中的可能机制。
材料和方法
一、材料
雄性Wistar大鼠51只,4~5月龄,体重(307±34)g,购自首都医科大学动物中心;8%高二氧化碳混合气体(8%CO2,21%O2,71%N2)购自北京特种气体研究所;125I-牛血清白蛋白(125I-BSA)由中国原子能科学研究院提供;采用ABL 500型血气分析仪(丹麦);GY-682D型8导生理记录仪(开封华南仪器厂)。
, 百拇医药
二、方法
将大鼠随机分为正常对照(11只)组和高碳酸血症(12只)组。
1.大鼠高碳酸血症模型的复制:将大鼠置特制密闭舱中,通入8%的CO2混合气体,每天7小时,连续4周。舱中水蒸气用氯化钙吸收,舱壁留有排气小孔,使舱内气体保持流动,压力与大气压保持平衡。动物在完成4周高二氧化碳致伤后次日用20%乌拉坦(0.7 ml/100 g体重)腹腔麻醉,按孙波等[5]方法测定右心房平均压(MRAP)和肺动脉平均压(MPAP)。
2.血气分析:经左侧颈总动脉采集血样标本送检血气(在高二氧化碳舱中取血)、血浆过氧化脂质(LPO)和红细胞超氧化物歧化酶(SOD);血清醛固酮(ALD)、渗透压、白蛋白、丙氨酸转氨酶(ALT)、尿素氮(BUN)以及钠、钾、氯离子浓度。
3.全身毛细血管通透性测定[6]:将动物(每组10只大鼠)麻醉后仰卧位固定于手术台,分离右侧颈外静脉和左侧颈总动脉。经右颈外静脉准确注入125I-BSA(555.6 Bq/g体重)。分别于注射后30、60、90及120分钟经左颈总动脉取血0.5 ml,肝素抗凝,常温离心(3500 r/min,10 min),分离并取0.1 ml血浆置试管内,r计数器测定各管放射性强度(Bq)。按以下公式计算出125I-BSA从循环血中的半排出时间,T1/2=0.693/K(K=2.3×logI1-logI2/t1-t2)(logI1-logI2是在时间t1-t2时血样品的放射性对数,K为排出系数)。
, 百拇医药
4.组织水含量测定:分别取右侧肺、肝、肾组织及右侧后腿股外侧肌肉组织,称湿重0.5~0.9 g,置真空烤箱内(80℃)烘烤24小时后称干重。按以下公式计算各组织中水含量。组织水含量=[湿组织重(g)-干组织重(g)]/湿组织重(g)×100
5.红细胞SOD测定:采用邻苯三酚法;血浆LPO测定采用硫代巴比妥酸法。
6.统计学处理:两组间数据比较采用t检验,结果以均数±标准差表示。
结果
两组间部分观测指标见表1。不同组织中水含量见表2,结果显示对照组肺及肌肉组织中水含量显著增高。大鼠循环血中125I-BSA半排出时间(T1/2)计算结果:实验组T1/2为(238±30) min;对照组T1/2为(150±23) min,结果显示对照组T1/2明显快于实验组(P<0.001)。
, 百拇医药
表1 两组大鼠部分观察指标的比较(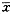 ±s) 组别
±s) 组别
鼠数
(只)
MRAP
(kPa)
MPAP
(kPa)
pH值*
PaCO2*
(kPa)
, 百拇医药 PaO2*
(kPa)
LPO
(nmol/ml)
SOD*
(U/g Hb)
对照组
11
0.26±0.18
1.94±0.28
7.38±0.10
4.6±0.9
, 百拇医药
12.6±1.2
3.0±0.6
1042±135
实验组
12
0.25±0.25
2.05±0.37
7.20±0.04
7.4±0.4
12.7±0.8
8.8±2.0
682±±341
, 百拇医药
P值
>0.05
>0.05
<0.01
<0.01
>0.05
<0.001
<0.01
组别
鼠数
(只)
ALD
(pg/ml)
, http://www.100md.com
白蛋白
(g/L)
渗透压
(mmol/L)
ALT
(IU/L)
BUN
(mmol/L)
Na+
(mmol/L)
K+
(mmol/L)
, http://www.100md.com
Cl-
(mmol/L)
对照组
11
2301±803
13.0±1.7
296±18
42±8
10.6±1.4
134±8
6.0±0.4
101±8
, 百拇医药
实验组
12
2371±1286
13.0±1.4
308±6
39±8
10.1±2.6
140±3
5.6±0.6
105±3
P值
>0.05
>0.05
, 百拇医药
>0.05
>0.05
>0.05
>0.05
>0.05
>0.05
注:*实验组为8只鼠;1 kPa=7.5 mm Hg
表2 两组大鼠不同组织中水含量比较(%,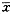 ±s) 组别
±s) 组别
鼠数
(只)
, 百拇医药
组织水含量
肺组织
肝组织
肾组织
肌组织
对照组
11
76.2±1.0
70.3±0.9
75.9±0.6
74.1±2.8
实验组
12
, http://www.100md.com
78.8±1.8
70.4±1.5
76.4±0.6
76.0±1.0
P值
<0.01
>0.05
>0.05
<0.05
讨论
经高浓度二氧化碳气体致伤后,大鼠PaCO2显著增高,动脉血pH值明显降低,动脉血气分析结果呈失代偿性呼吸性酸中毒改变。证实本实验方法可以复制常压、常氧、高碳酸血症动物模型。
, 百拇医药
对比分析两组结果显示,高碳酸血症大鼠肺和肌肉组织中水含量显著增多。证实有全身性水钠潴留现象存在。实验结果表明,高碳酸血症引起全身性水钠潴留(水肿),主要与其所致的全身性毛细血管通透性增高有关,因为高碳酸血症组大鼠并未出现右心功能不全、低蛋白血症、低血浆渗透压和肝肾功能不全等引起水肿的原因。上述变化与晚近我们临床研究所得的结果是相一致的[3],同时也进一步使我们联想到“肺性水肿”的概念[3]。由高碳酸血症引起的“肺性水肿”可通过改善通气功能达到治疗目的,而不需要使用传统的强心剂、利尿剂等方法,这一新的认识对COPD和肺心病急性发作期水肿的治疗具有一定的指导意义。
高碳酸血症大鼠全身性水肿的发生主要与全身性毛细血管通透性增高有关,这是本实验观察到的一个重要的病理生理改变。高二氧化碳致伤后刺激动物体内产生过多的氧自由基,引发血管内皮细胞的脂质过氧化,从而使毛细血管内皮细胞的功能和膜的正常结构遭到破坏、通透性增加。除上述机理外,高二氧化碳对微血管内皮细胞可能具有直接损伤作用。
, 百拇医药
曾有报道,二氧化碳增加可刺激肾素-血管紧张素-醛固酮系统[7],引起水钠潴留。但另有研究表明,二氧化碳增高时对醛固酮影响很小[8,9]。我们的结果亦显示,在高碳酸血症所致的全身性水钠潴留(水肿)的发生过程中,醛固酮并未介入作用。本课题为北京市科技新星计划(854871100)和卫生部科学研究基金资助项目(98-2-244)
参考文献
1 Swarsk K,Morrsion D,Sime P,et al.Effect of hypoxia on hormonal balance in chronic obstructive lung disease (COLD).Thorax,1993,48:446.
2 Weitzenblum E,Apprill M,Oswald M,et al.Pulmonary hemodynamics in patients with chronic obstructive pulmonary disease before and during an episode of peripheral edema.Chest,1994,105:1377-1382.
, 百拇医药
3 王辰,张洪玉,方保民,等.慢性肺原性心脏病患者急性发作期水肿与右心功能的关系.中华医学杂志,1996,76:531-533.
4 Campbell EJM,Short DS.The cause of edema in cor pulmonale.Lancet,1960,1:1 184-1 186.
5 孙波,刘文利.右心导管测定大鼠肺动脉压的实验方法.中国医学科学院学报,1984,6:465-467.
6 施新猷,主编.医学动物实验方法.第1版.北京:人民卫生出版社,1986,334-340.
7 Anand IS,Chandrashekhar Y,Ferrari R,et al.Pathogenesis of congestive state in chronic obstructive pulmonary disease.Circulation,1992,86:12-21.
, 百拇医药
8 Chabot F,Mertes PM,Delorme N,et al.Effect of acute hypercapnia on alpha atrial natriuretic peptide,renin,angiotensin II,aldosterone,and vasopressin plasma levels in patients with COPD.CheSt,1995,107:780-786.
9 Raff H,Jankowski B.Effect of CO2/pH on the aldosterone response to hypoxia in bovine adrenal cells in vitro.Am J Physiol,1993,265:R820-R825.
(收稿:1998-06-24 修回:1999-05-20), 百拇医药
单位:100020 首都医科大学附属北京红十字朝阳医院呼吸科
关键词:肺疾病,阻塞性;水肿;脂质过氧化
中华医学杂志990823 【摘要】 目的 探讨高碳酸血症时大鼠全身性水肿发生的机理。方法 给大鼠呼吸高浓度二氧化碳气体(8% CO2、21% O2,71% N2),每天7小时,连续4周。观察高碳酸血症大鼠各项指标的变化,并设对照组。结果 对照组平均肺动脉压(mPAP)为(1.94±0.28)kPa,PaCO2为(4.6±0.9)kPa。大鼠循环血中125I-牛血清白蛋白半排出时间(T1/2)为(238±30)min;血浆过氧化脂质(LPO)为(3.0±0.6)nmol/ml,红细胞超氧化物歧化酶(SOD)活性为(1 042±135)U/g Hb。肺组织中水含量为(76.2±1.0)%,肌组织为(74.1±2.8)%。高碳酸血症组mPAP为(2.0±0.4)kPa、PaCO2为(7.4±0.4)kPa、T1/2为(150±23)min、LPO为(8.8±2.0)nmol/ml、SOD为(682±341)U/g Hb、肺组织中水含量为(78.8±1.8)%、肌组织为(76.0±1.0)%。两组比较mPAP差异无显著意义(P>0.05);PaCO2、T1/2、LPO、SOD,肺组织及肌组织中水含量差异有显著性意义(P<0.01),结论 脂质过氧化导致微血管内皮细胞受损、通透性增加是引起水肿的直接原因。肺脏本身因素可以引起全身性水肿。
, http://www.100md.com
Anasarcous mechanism induced by hypercapnia in rats
WANG Jianxin WANG Chen PANG Baosen et al.
(Department of Respiratory Disease,Beijing Red Cross Chaoyang Hospital,Beijing 100020)
【Abstract】 Objective To study anasarcous pathogenesis during hypercapnia.Methods The mixed gases of highly concentrated carbon dioxide(8%CO2,21%O2,71%N2) were given to Wistar rats 7 hours a day for four weeks.The various indexes were comparatively observed between control group and hypercapnia group.Results Pulmonary arterial pressure (mPAP) in control group was(1.94±0.28)kPa and PaCO2(4.6±0.9)kPa.T1/2 of 125 I-BSA in the blood was (238±30) min,plasma lipid peroxide (LPO) level (3.08±0.69) nmol/ml,erythrocytic superoxide dismutase (SOD) activity (1 042±135) CU/g Hb.Water content was (76.2±1.0)% in lung and (74.1±2.8)% in muscular tissues.mPAP in hypercapnia group was (2.0±0.4) kPa,PaCO2 (7.4±0.4) kPa,T1/2(150±23) min,LPO (8.8±2.0) nmol/ml,SOD (682±341) U/g Hb1 and water content was (78.8±1.8)% in lung and (76.04±1.07)% in muscular tissues.No significant differences were found in mPAP (P>0.05).There were significant differences in PaCO2 (P<0.01),T1/2(P<0.01),LPO (P<0.001),SOD (P<0.01),water content in lung (P<0.01),and water content in muscular tissues (P<0.05).Conclusions Rat hypercapnic model can be reproduced with 8% CO2 mixed gases.Systemic water and natrium retention (edema) might occur in the model.Microvascular endothelial cell damage and its highly increased permeability induced by lipid peroxidation is the direct cause of edema.The pulmonary cause per se can produce anasarca.
, 百拇医药
【Key words】 Pulmonary disease,obstructive Edema Lipid peroxidation
慢性阻塞性肺疾病(COPD)、慢性肺原性心脏病急性发作期患者常出现全身性水肿,这一临床现象早为人们熟知,但形成水肿的机理迄今尚未明了[1,2]。晚近,我们的临床研究结果表明,右心衰竭并不是这类水肿形成的必备条件,水肿形成与低氧、高碳酸血症等综合因素有关[3],而高碳酸血症在水肿发生中可能起更为重要的作用[4]。本项研究中我们以8%的CO2混合气体复制大鼠常压、常氧、高碳酸血症动物模型,着重探讨高碳酸血症在全身性水肿发生中的可能机制。
材料和方法
一、材料
雄性Wistar大鼠51只,4~5月龄,体重(307±34)g,购自首都医科大学动物中心;8%高二氧化碳混合气体(8%CO2,21%O2,71%N2)购自北京特种气体研究所;125I-牛血清白蛋白(125I-BSA)由中国原子能科学研究院提供;采用ABL 500型血气分析仪(丹麦);GY-682D型8导生理记录仪(开封华南仪器厂)。
, 百拇医药
二、方法
将大鼠随机分为正常对照(11只)组和高碳酸血症(12只)组。
1.大鼠高碳酸血症模型的复制:将大鼠置特制密闭舱中,通入8%的CO2混合气体,每天7小时,连续4周。舱中水蒸气用氯化钙吸收,舱壁留有排气小孔,使舱内气体保持流动,压力与大气压保持平衡。动物在完成4周高二氧化碳致伤后次日用20%乌拉坦(0.7 ml/100 g体重)腹腔麻醉,按孙波等[5]方法测定右心房平均压(MRAP)和肺动脉平均压(MPAP)。
2.血气分析:经左侧颈总动脉采集血样标本送检血气(在高二氧化碳舱中取血)、血浆过氧化脂质(LPO)和红细胞超氧化物歧化酶(SOD);血清醛固酮(ALD)、渗透压、白蛋白、丙氨酸转氨酶(ALT)、尿素氮(BUN)以及钠、钾、氯离子浓度。
3.全身毛细血管通透性测定[6]:将动物(每组10只大鼠)麻醉后仰卧位固定于手术台,分离右侧颈外静脉和左侧颈总动脉。经右颈外静脉准确注入125I-BSA(555.6 Bq/g体重)。分别于注射后30、60、90及120分钟经左颈总动脉取血0.5 ml,肝素抗凝,常温离心(3500 r/min,10 min),分离并取0.1 ml血浆置试管内,r计数器测定各管放射性强度(Bq)。按以下公式计算出125I-BSA从循环血中的半排出时间,T1/2=0.693/K(K=2.3×logI1-logI2/t1-t2)(logI1-logI2是在时间t1-t2时血样品的放射性对数,K为排出系数)。
, 百拇医药
4.组织水含量测定:分别取右侧肺、肝、肾组织及右侧后腿股外侧肌肉组织,称湿重0.5~0.9 g,置真空烤箱内(80℃)烘烤24小时后称干重。按以下公式计算各组织中水含量。组织水含量=[湿组织重(g)-干组织重(g)]/湿组织重(g)×100
5.红细胞SOD测定:采用邻苯三酚法;血浆LPO测定采用硫代巴比妥酸法。
6.统计学处理:两组间数据比较采用t检验,结果以均数±标准差表示。
结果
两组间部分观测指标见表1。不同组织中水含量见表2,结果显示对照组肺及肌肉组织中水含量显著增高。大鼠循环血中125I-BSA半排出时间(T1/2)计算结果:实验组T1/2为(238±30) min;对照组T1/2为(150±23) min,结果显示对照组T1/2明显快于实验组(P<0.001)。
, 百拇医药
表1 两组大鼠部分观察指标的比较(
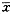 ±s) 组别
±s) 组别鼠数
(只)
MRAP
(kPa)
MPAP
(kPa)
pH值*
PaCO2*
(kPa)
, 百拇医药 PaO2*
(kPa)
LPO
(nmol/ml)
SOD*
(U/g Hb)
对照组
11
0.26±0.18
1.94±0.28
7.38±0.10
4.6±0.9
, 百拇医药
12.6±1.2
3.0±0.6
1042±135
实验组
12
0.25±0.25
2.05±0.37
7.20±0.04
7.4±0.4
12.7±0.8
8.8±2.0
682±±341
, 百拇医药
P值
>0.05
>0.05
<0.01
<0.01
>0.05
<0.001
<0.01
组别
鼠数
(只)
ALD
(pg/ml)
, http://www.100md.com
白蛋白
(g/L)
渗透压
(mmol/L)
ALT
(IU/L)
BUN
(mmol/L)
Na+
(mmol/L)
K+
(mmol/L)
, http://www.100md.com
Cl-
(mmol/L)
对照组
11
2301±803
13.0±1.7
296±18
42±8
10.6±1.4
134±8
6.0±0.4
101±8
, 百拇医药
实验组
12
2371±1286
13.0±1.4
308±6
39±8
10.1±2.6
140±3
5.6±0.6
105±3
P值
>0.05
>0.05
, 百拇医药
>0.05
>0.05
>0.05
>0.05
>0.05
>0.05
注:*实验组为8只鼠;1 kPa=7.5 mm Hg
表2 两组大鼠不同组织中水含量比较(%,
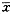 ±s) 组别
±s) 组别鼠数
(只)
, 百拇医药
组织水含量
肺组织
肝组织
肾组织
肌组织
对照组
11
76.2±1.0
70.3±0.9
75.9±0.6
74.1±2.8
实验组
12
, http://www.100md.com
78.8±1.8
70.4±1.5
76.4±0.6
76.0±1.0
P值
<0.01
>0.05
>0.05
<0.05
讨论
经高浓度二氧化碳气体致伤后,大鼠PaCO2显著增高,动脉血pH值明显降低,动脉血气分析结果呈失代偿性呼吸性酸中毒改变。证实本实验方法可以复制常压、常氧、高碳酸血症动物模型。
, 百拇医药
对比分析两组结果显示,高碳酸血症大鼠肺和肌肉组织中水含量显著增多。证实有全身性水钠潴留现象存在。实验结果表明,高碳酸血症引起全身性水钠潴留(水肿),主要与其所致的全身性毛细血管通透性增高有关,因为高碳酸血症组大鼠并未出现右心功能不全、低蛋白血症、低血浆渗透压和肝肾功能不全等引起水肿的原因。上述变化与晚近我们临床研究所得的结果是相一致的[3],同时也进一步使我们联想到“肺性水肿”的概念[3]。由高碳酸血症引起的“肺性水肿”可通过改善通气功能达到治疗目的,而不需要使用传统的强心剂、利尿剂等方法,这一新的认识对COPD和肺心病急性发作期水肿的治疗具有一定的指导意义。
高碳酸血症大鼠全身性水肿的发生主要与全身性毛细血管通透性增高有关,这是本实验观察到的一个重要的病理生理改变。高二氧化碳致伤后刺激动物体内产生过多的氧自由基,引发血管内皮细胞的脂质过氧化,从而使毛细血管内皮细胞的功能和膜的正常结构遭到破坏、通透性增加。除上述机理外,高二氧化碳对微血管内皮细胞可能具有直接损伤作用。
, 百拇医药
曾有报道,二氧化碳增加可刺激肾素-血管紧张素-醛固酮系统[7],引起水钠潴留。但另有研究表明,二氧化碳增高时对醛固酮影响很小[8,9]。我们的结果亦显示,在高碳酸血症所致的全身性水钠潴留(水肿)的发生过程中,醛固酮并未介入作用。本课题为北京市科技新星计划(854871100)和卫生部科学研究基金资助项目(98-2-244)
参考文献
1 Swarsk K,Morrsion D,Sime P,et al.Effect of hypoxia on hormonal balance in chronic obstructive lung disease (COLD).Thorax,1993,48:446.
2 Weitzenblum E,Apprill M,Oswald M,et al.Pulmonary hemodynamics in patients with chronic obstructive pulmonary disease before and during an episode of peripheral edema.Chest,1994,105:1377-1382.
, 百拇医药
3 王辰,张洪玉,方保民,等.慢性肺原性心脏病患者急性发作期水肿与右心功能的关系.中华医学杂志,1996,76:531-533.
4 Campbell EJM,Short DS.The cause of edema in cor pulmonale.Lancet,1960,1:1 184-1 186.
5 孙波,刘文利.右心导管测定大鼠肺动脉压的实验方法.中国医学科学院学报,1984,6:465-467.
6 施新猷,主编.医学动物实验方法.第1版.北京:人民卫生出版社,1986,334-340.
7 Anand IS,Chandrashekhar Y,Ferrari R,et al.Pathogenesis of congestive state in chronic obstructive pulmonary disease.Circulation,1992,86:12-21.
, 百拇医药
8 Chabot F,Mertes PM,Delorme N,et al.Effect of acute hypercapnia on alpha atrial natriuretic peptide,renin,angiotensin II,aldosterone,and vasopressin plasma levels in patients with COPD.CheSt,1995,107:780-786.
9 Raff H,Jankowski B.Effect of CO2/pH on the aldosterone response to hypoxia in bovine adrenal cells in vitro.Am J Physiol,1993,265:R820-R825.
(收稿:1998-06-24 修回:1999-05-20), 百拇医药