中药阿魏酸钠对人EBL-7404肝癌细胞生存性及凋亡的影响
作者:朱秀琴 王国申 张学军 赵 倩
单位:朱秀琴 王国申 上海市传染病医院中医科 上海市 200083; 张学军 赵 倩 中科院上海细胞生物学研究所 中-法合作血液血管细胞生物学研究室 上海市 200031
关键词:阿魏酸钠;肝肿瘤;癌,肝细胞;细胞凋亡
世界华人消化杂志990836 中国图书馆分类号 R735.7
Subject headings sodium ferculate; liver neoplasms; carcinoma, hepatocellular; apoptosis
很多的实验已经证明,中医药对肝癌的发展具有一定的抑制作用. 阿魏酸钠(sodium ferulate, SF)是从当归或川芎中提取的水溶性有效成分,为探讨SF抑制肝癌发展的作用机制,我们观察了SF对人EBL-7404肝癌细胞生存性和凋亡的影响.
, 百拇医药
1 材料和方法
1.1 材料 SF(批号:980601):成都亨达制药厂提供. 人EBL-7404肝癌细胞株:中科院上海细胞生物学研究所提供. 1640培养基(RPMI Medium),Gibco公司产品. 润湿剂P-40(nonidet P-40,NP-40),Fluka公司产品. 核糖核酸酶A(RNase A),华美生物公司产品. 蛋白酶K(proteinase K),Fraco公司产品. 琼脂糖(agurose),上海东海制药厂产品. 噻唑蓝(thiazolyl blue, MTT),Bib公司产品. 二甲亚砜(dimethylsulfoxide DMSO). Sigma公司产品. CO2培养箱,Hersesus公司产品. 光学显微镜,Nikon公司产品. 酶标检测仪(EL311),Bio-tek公司产品. 核酸电泳槽(H-6微型电泳槽),上海精益有机玻璃制品仪器厂产品.
1.2 方法 培养在含100mL/L小牛血清1640培养液中的细胞株,置于37℃,50mL/L CO2的培养箱中,长满单层后,用2.5g/L胰蛋白酶消化,消化液以1000r/min离心,细胞团块用含100mL/L小牛血清1640培养液悬浮,以1×108/L浓度接种于细胞培养瓶中.
, 百拇医药
1.2.1 MTT比色法 传代后的细胞以1×108/L浓度接种于96孔培养板中,接近单层时,分为SF组和对照组. SF组分别加入含SF终浓度为1,0.1,0.01和0.001g/L 4种浓度的50mL/L小牛血清1640培养液,对照组加入等量的无SF的50mL/L小牛血清1640培养液,每组设5个复孔,继续培养48h后,加入含终浓度为1g/L的MTT培养液,继续培养4h后,吸弃培养液,每孔加入100μL DMSO,摇匀后,用酶标仪检测450,645两处的吸光度.
1.2.2 DNA的抽提和琼脂糖凝胶电泳 传代后的细胞以1×108/L浓度接种于15mL的细胞培养瓶中,接近单层时分为SF组和对照组,SF组加入含SF终浓度为1g/L的50mL/L小牛血清1640培养液,对照组加入等量的无SF的50mL/L小牛血清1640培养液,继续培养48h后,分别收集贴壁和悬浮细胞,以1000r/min离心,细胞团块用PBS离心洗涤,沉淀用40μL的0.2mol/L磷酸二氢钠/0.1mol/L柠檬酸(192∶8)重悬,室温放置60min后,4800r/min离心30min,上清转入1.5mL Eppendof管中加入3μL 2.5g/L NP-40和3μL RNase A(10g/L),37℃温育60min,再加入3μL蛋白酶K(10g/L),50℃温育30min. 反应完毕加入5μL加样缓冲液,进行10g/L琼脂糖凝胶电泳.
, 百拇医药
统计学处理 采用双侧t检验.
2 结果
阿魏酸钠对人EBL-7404肝癌细胞生存性影响的实验重复3次,结果表明SF各组吸光度值均低于对照组,并随着SF浓度的升高而减少(表1). 阿魏酸钠对人EBL-7404肝癌细胞凋亡的影响可见SF组DNA片段呈梯形表现(图1).
图1 DNA琼脂糖凝胶电泳结果.
表1 阿魏酸钠对人EBL-7404肝癌细胞生存性影响的结果 (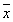 ±s,A,n=5) 阿魏酸钠(g/L)
±s,A,n=5) 阿魏酸钠(g/L)
吸光度A
, 百拇医药
0,对照组
0.38±0.05
0.001
0.33±0.02
0.01
0.27±0.02b
0.1
0.20±0.03b
1
0.12±0.03b
bP<0.01,vs对照组.
, http://www.100md.com
3 讨论
凋亡是在生理或病理条件下,被受体介导过程诱导而且在生长调节信号的控制下发生的单个细胞的死亡[1]. 细胞内核酸内切酶被激活,将双链DNA裂解为核小体间长度的片段是凋亡时细胞内发生的特异性生物化学的改变[2-4]. 凋亡是一种主动清除无用或有害的细胞的过程,是组织在癌症发展的不同阶段通过抑制每个癌细胞的生存性和控制他们的生长数量抗癌的一种先天性机制[5].
我们用4种浓度的SF培养液作用于细胞,在24h后,光镜下所见,1g/L组有少量细胞收缩,并与连接细胞脱离,少量细胞悬浮于培养液表面. 48h后,收缩和悬浮的细胞明显增多,而0.1,0.01和0.001g/L浓度组与对照组比较,细胞形态无明显变化. 但四种浓度组吸光度值均低于对照组(表1). 其中,1,0.1和0.01g/L组分别与对照组比较有明显差异,提示SF抑制了人EBL-7404肝癌细胞的生存性.
, 百拇医药
在琼脂糖凝胶电泳中DNA片段呈梯形表现,是DNA链被降解成核小体间长度片段的特异性表现[6]. 我们以含SF终浓度为1g/L的培养液温育细胞48h后,观察细胞内生物化学的改变,结果表明(图1),SF组的琼脂糖凝胶电泳呈梯形表达,提示SF诱导了人EBL-7404肝癌细胞的凋亡. 因此,我们推测,SF对肝癌发展的抑制作用可能与抑制肝癌细胞的生存性和诱导肝癌细胞的凋亡有关,其作用机制尚待进一步研究.
致谢:本实验经费由中科院上海细胞生物学研究所中-法合作血液血管细胞生物学研究室提供.
通讯作者 朱秀琴
4 参考文献
1 Yamamoto M, Okawa K, Morita M, Fukuda K, Komatsu Y. The herbal medicine inchin-ko-to inhibits liver cell apoptosis induced by transforming growth factor β1. Hepatology, 1996;23:552-559
, 百拇医药
2 Alison MR, Sarraf CE. Liver cell death: patterns and mechanisms. GUT, 1994;35:577-581
3 Jaffrezou JP, Levade T, Bettaieb A, Andrieu N, Bezombes C, Maestre N, Vermeersch S, Rousse A, Laurent G. Daunorubicin-induced apoptosis: triggering of ceramide generation through sphingomyelin hydrolysis. EMBO J, 1996;15:2417-2424
4 Bulera SJ, Sattler CA, Pitot HC. The translational inhibitor cycloheximide represses growth factor depletion-induced apoptosis in an alb-sv40T transgenic rat liver cell line. Hepatology, 1996;23:1591-1601
, 百拇医药
5 Goldsworthy TL, Conolly RB, Fransson-Steen R. Apoptosis and cancer risk assessment. Mutat Res, 1996;365:71-90
6 Gao W, Bentley RC, Madden JF, Clavien PA. Apoptosis of sinusoidal endothelial cells is a critical mechanism of preservation injury in rat liver transplantation. Hepatology, 1998;27:1652-1659
收稿日期 1999-04-08 修回日期 1999-06-03, http://www.100md.com
单位:朱秀琴 王国申 上海市传染病医院中医科 上海市 200083; 张学军 赵 倩 中科院上海细胞生物学研究所 中-法合作血液血管细胞生物学研究室 上海市 200031
关键词:阿魏酸钠;肝肿瘤;癌,肝细胞;细胞凋亡
世界华人消化杂志990836 中国图书馆分类号 R735.7
Subject headings sodium ferculate; liver neoplasms; carcinoma, hepatocellular; apoptosis
很多的实验已经证明,中医药对肝癌的发展具有一定的抑制作用. 阿魏酸钠(sodium ferulate, SF)是从当归或川芎中提取的水溶性有效成分,为探讨SF抑制肝癌发展的作用机制,我们观察了SF对人EBL-7404肝癌细胞生存性和凋亡的影响.
, 百拇医药
1 材料和方法
1.1 材料 SF(批号:980601):成都亨达制药厂提供. 人EBL-7404肝癌细胞株:中科院上海细胞生物学研究所提供. 1640培养基(RPMI Medium),Gibco公司产品. 润湿剂P-40(nonidet P-40,NP-40),Fluka公司产品. 核糖核酸酶A(RNase A),华美生物公司产品. 蛋白酶K(proteinase K),Fraco公司产品. 琼脂糖(agurose),上海东海制药厂产品. 噻唑蓝(thiazolyl blue, MTT),Bib公司产品. 二甲亚砜(dimethylsulfoxide DMSO). Sigma公司产品. CO2培养箱,Hersesus公司产品. 光学显微镜,Nikon公司产品. 酶标检测仪(EL311),Bio-tek公司产品. 核酸电泳槽(H-6微型电泳槽),上海精益有机玻璃制品仪器厂产品.
1.2 方法 培养在含100mL/L小牛血清1640培养液中的细胞株,置于37℃,50mL/L CO2的培养箱中,长满单层后,用2.5g/L胰蛋白酶消化,消化液以1000r/min离心,细胞团块用含100mL/L小牛血清1640培养液悬浮,以1×108/L浓度接种于细胞培养瓶中.
, 百拇医药
1.2.1 MTT比色法 传代后的细胞以1×108/L浓度接种于96孔培养板中,接近单层时,分为SF组和对照组. SF组分别加入含SF终浓度为1,0.1,0.01和0.001g/L 4种浓度的50mL/L小牛血清1640培养液,对照组加入等量的无SF的50mL/L小牛血清1640培养液,每组设5个复孔,继续培养48h后,加入含终浓度为1g/L的MTT培养液,继续培养4h后,吸弃培养液,每孔加入100μL DMSO,摇匀后,用酶标仪检测450,645两处的吸光度.
1.2.2 DNA的抽提和琼脂糖凝胶电泳 传代后的细胞以1×108/L浓度接种于15mL的细胞培养瓶中,接近单层时分为SF组和对照组,SF组加入含SF终浓度为1g/L的50mL/L小牛血清1640培养液,对照组加入等量的无SF的50mL/L小牛血清1640培养液,继续培养48h后,分别收集贴壁和悬浮细胞,以1000r/min离心,细胞团块用PBS离心洗涤,沉淀用40μL的0.2mol/L磷酸二氢钠/0.1mol/L柠檬酸(192∶8)重悬,室温放置60min后,4800r/min离心30min,上清转入1.5mL Eppendof管中加入3μL 2.5g/L NP-40和3μL RNase A(10g/L),37℃温育60min,再加入3μL蛋白酶K(10g/L),50℃温育30min. 反应完毕加入5μL加样缓冲液,进行10g/L琼脂糖凝胶电泳.
, 百拇医药
统计学处理 采用双侧t检验.
2 结果
阿魏酸钠对人EBL-7404肝癌细胞生存性影响的实验重复3次,结果表明SF各组吸光度值均低于对照组,并随着SF浓度的升高而减少(表1). 阿魏酸钠对人EBL-7404肝癌细胞凋亡的影响可见SF组DNA片段呈梯形表现(图1).

图1 DNA琼脂糖凝胶电泳结果.
表1 阿魏酸钠对人EBL-7404肝癌细胞生存性影响的结果 (
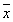 ±s,A,n=5) 阿魏酸钠(g/L)
±s,A,n=5) 阿魏酸钠(g/L)吸光度A
, 百拇医药
0,对照组
0.38±0.05
0.001
0.33±0.02
0.01
0.27±0.02b
0.1
0.20±0.03b
1
0.12±0.03b
bP<0.01,vs对照组.
, http://www.100md.com
3 讨论
凋亡是在生理或病理条件下,被受体介导过程诱导而且在生长调节信号的控制下发生的单个细胞的死亡[1]. 细胞内核酸内切酶被激活,将双链DNA裂解为核小体间长度的片段是凋亡时细胞内发生的特异性生物化学的改变[2-4]. 凋亡是一种主动清除无用或有害的细胞的过程,是组织在癌症发展的不同阶段通过抑制每个癌细胞的生存性和控制他们的生长数量抗癌的一种先天性机制[5].
我们用4种浓度的SF培养液作用于细胞,在24h后,光镜下所见,1g/L组有少量细胞收缩,并与连接细胞脱离,少量细胞悬浮于培养液表面. 48h后,收缩和悬浮的细胞明显增多,而0.1,0.01和0.001g/L浓度组与对照组比较,细胞形态无明显变化. 但四种浓度组吸光度值均低于对照组(表1). 其中,1,0.1和0.01g/L组分别与对照组比较有明显差异,提示SF抑制了人EBL-7404肝癌细胞的生存性.
, 百拇医药
在琼脂糖凝胶电泳中DNA片段呈梯形表现,是DNA链被降解成核小体间长度片段的特异性表现[6]. 我们以含SF终浓度为1g/L的培养液温育细胞48h后,观察细胞内生物化学的改变,结果表明(图1),SF组的琼脂糖凝胶电泳呈梯形表达,提示SF诱导了人EBL-7404肝癌细胞的凋亡. 因此,我们推测,SF对肝癌发展的抑制作用可能与抑制肝癌细胞的生存性和诱导肝癌细胞的凋亡有关,其作用机制尚待进一步研究.
致谢:本实验经费由中科院上海细胞生物学研究所中-法合作血液血管细胞生物学研究室提供.
通讯作者 朱秀琴
4 参考文献
1 Yamamoto M, Okawa K, Morita M, Fukuda K, Komatsu Y. The herbal medicine inchin-ko-to inhibits liver cell apoptosis induced by transforming growth factor β1. Hepatology, 1996;23:552-559
, 百拇医药
2 Alison MR, Sarraf CE. Liver cell death: patterns and mechanisms. GUT, 1994;35:577-581
3 Jaffrezou JP, Levade T, Bettaieb A, Andrieu N, Bezombes C, Maestre N, Vermeersch S, Rousse A, Laurent G. Daunorubicin-induced apoptosis: triggering of ceramide generation through sphingomyelin hydrolysis. EMBO J, 1996;15:2417-2424
4 Bulera SJ, Sattler CA, Pitot HC. The translational inhibitor cycloheximide represses growth factor depletion-induced apoptosis in an alb-sv40T transgenic rat liver cell line. Hepatology, 1996;23:1591-1601
, 百拇医药
5 Goldsworthy TL, Conolly RB, Fransson-Steen R. Apoptosis and cancer risk assessment. Mutat Res, 1996;365:71-90
6 Gao W, Bentley RC, Madden JF, Clavien PA. Apoptosis of sinusoidal endothelial cells is a critical mechanism of preservation injury in rat liver transplantation. Hepatology, 1998;27:1652-1659
收稿日期 1999-04-08 修回日期 1999-06-03, http://www.100md.com