血小板活化因子对体外培养肝细胞的作用
作者:何云 王宇明 何燕 袁凤仪 丁健
单位:何云 袁凤仪 中国人民解放军44医院内四科 贵州省贵阳市 550009; 丁健 王宇明 中国人民解放军第三军医大学西南医院; 何燕 老年病研究所
关键词:血小板活化因子;肝细胞;Kupffer细胞;细胞,培养的
世界华人消化杂志991022 中国科学院分类号 R575.7
Subject headings platelet activating factor; hepatocytes; Kupffer cell; cell, cultured
血小板活化因子(platelet activating factor, PAF)是一具有广泛生物活性的脂质递质,与内毒素有着密切的关系,后者对肝脏的损害较为明确[1]. 新近我们研究发现PAF在各型病毒性肝炎中特别是重症肝炎患者显著增高,与肝细胞坏死程度及血中内毒素水平呈正相关,提示PAF参与了内毒素介导的肝脏损害[2]. 但PAF对体外肝脏细胞是否有损害作用目前尚未见报道.
, 百拇医药
1 材料和方法
1.1 材料 胶原酶、链酶蛋白酶、PAF标准品、内毒素(LPS,O111:B4)为Sigma公司产品,RPMI1640培养液、肿瘤坏死因子(rhTNF)为Gibco公司产品,PAF受体拮抗剂WEB2170为德国Zimmer博士惠赠.
1.2 方法 PAF检查按Jouvin_Marche法[3],根据PAF标准品引起洗涤后兔血小板聚集程度的标准曲线,计算出上清液及冻融法破坏过的细胞内PAF的含量. 丙二醛(MDA)检查按TBA法. 结果以μmol/m表示. TNF检查用双抗夹心法. 肝细胞分离培养[4]: 取Wistar大鼠(第三军医大学动物所提供)体质量180g~200g,用体外灌流法分离肝细胞,经苔盼蓝染色,存活率在95%以上用于实验,用RPMI1640液调整肝细胞浓度为2×108/L,加入终浓度为100mL/L的灭活无菌小牛血清,接种于Ⅰ型胶原. 被覆的12孔培养板(1mL/孔),置培养箱中37℃ 50mL/L CO2孵育4h后更换培养液,继续培养至所需时间. Kupffer细胞的分离培养[5]从体外灌流法分离所得的肝细胞悬液,离心后再经1g/L链霉蛋白酶,使肝细胞分解破碎,然后500g离心10min,重复3次,得到非肝脏细胞,以RPMI1640和小牛血清培养稀释成2×109细胞/L,接种于12孔培养板在37℃ 50mL/L CO2孵育20h后,洗去非贴壁细胞,再继续培养至所需时间. 将PAF加入培养的肝细胞,观察其作用后4h上清液中LDH水平及20h后肝细胞存活率和WEB 2170的防护作用. 将PAF加入培养的Kupffer细胞作用后4h上清液中TNF及MDA水平和WEB 2170的阻断作用. 将LPS和TNF分别加入培养的Kupffer细胞作用4h后,测定上清液及细胞内PAF的量.
, 百拇医药
统计学处理 定量资料两组数据比较采用t检验.
2 结果
2.1 PAF对肝细胞的损伤作用 PAF可引起肝细胞培养上清液中LDH升高,肝细胞存活率下降,与剂量无明显的依赖性,可被WEB 2170显著抑制(表1).
表1 PAF对培养肝细胞上清液LDH和存活率的影响
(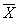 ±s,n=10)
±s,n=10)
LDH(IU/L)
t值
存活率%
t值
, 百拇医药
空白对照
138.5±29.4
98.5±3.6
PAF(10ng)
452.9±123.4b
7.84
73.1±10.2d
7.43
PAF(100ng)
498.1±103.9b
10.53
, 百拇医药
70.9±14.8d
5.73
PAF(10ng)/WEB 2170
169.2±30.3b
7.06
86.3±9.2d
3.04
PAF(100ng)/WEB 2170
208.7±72.5b
7.22
84.5±10.5
, 百拇医药
2.37
bP<0.01, vs 空白对照组;dP<0.01, vs 未加WEB 2170组. WEB 2170(10ug/L).
2.2 PAF对Kupffer细胞产生TNF,MDA的影响 空白对照组培养的肝Kupffer细胞上清液中测不到TNF,MDA含量也很低. PAF能显著促进Kupffer合成并释放TNF,MDA,呈剂量依赖性,可被WEB 2170显著抑制(表2).
表2 PAF对Kupffer细胞产生TNF,MDA的影响
(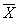 ±s,n=10) 分组
±s,n=10) 分组
TNF(μg/g)
, 百拇医药
t值
MDA(μmol/g)
t值
空白对照
—
0.13±0.02
PAF(10ng)
1.52±0.39b
12.36
0.61±0.13d
11.43
PAF(100ng)
, 百拇医药
2.34±0.55b
13.45
0.82±0.25d
8.73
PAF(10ng)/WEB2170
0.98±0.26b
3.65
0.24±0.07d
7.87
PAF(100ng)/WEB2170
1.31±0.29b
, 百拇医药
5.23
0.37±0.18d
4.6
bP<0.01, vs 空白对照组;dP<0.01, vs 未加WEB 2170组. WEB 2170(10μg/L).
2.3 LPS,TNF对Kupffer细胞产生PAF的影响 LPS,TNF可显著促进培养Kupffer细胞上清及细胞内PAF产生(表3).
表3 LPS,TNF对Kupffer细胞产生PAF的影响
(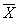 ±s,n=10)
±s,n=10)
, http://www.100md.com
上清PAF
t值
细胞内PAF
t值
空白对照
3.29±0.85
6.44±2.01
LPS(30mg/L)
17.39±5.12b
8.59
15.56±3.49d
7.18
, 百拇医药
TNF(1×106μ/L)
14.17±3.37b
10.10
13.82±4.79d
4.50
bP<0.01, vs 空白对照组.
3 讨论
Kupffer细胞被认为是肠源性内毒素的“生物滤过器”,具有吞噬、清除内毒素起保护性作用,另一方面Kupffer细胞被内毒素激活化后可释放多种炎症递质如花生四烯酸,TNF,白介素,PAF等,这与Kupffer细胞所处的状态有关,正常情况下Kupffer细胞主要起保护作用,而在损害时以致伤为主[5]. 最近,我们发现内毒素血症发生率较高慢性重症肝炎患者血中PAF水平也较高;用PAF受体拮抗剂WEB 2170可减轻D_氨基半乳糖对大鼠肝脏的损害,提示PAF参与了内毒素介导的肝脏损害,与肝细胞的坏死程度呈正相关[2]. 我们采用体外PAF与肝细胞共孵,其上清中LDH水平明显增加及肝细胞的存活率明显下降. 进一步证实PAF对肝细胞的损伤作用,可能通过氧自由基介导的脂质过氧化损伤肝细胞膜性结构,并可引起肝细胞蛋白质和染色体核酸的破坏[6],我们也发现PAF可引起肝脏细胞MDA水平升高;另一方面,如本实验用PAF作用于Kupffer细胞4h后上清中TNF水平明显升高并可被WEB2170显著抑制. PAF刺激Kupffer细胞释放其他炎性递质或细胞因子进一步说明PAF可放大内毒素参与的肝损害作用. 也有报道极低浓度PAF(10-6ng~10-11ng)就可以刺激中性粒细胞释放大量的TNF,IL_1等[7];同时,我们也发现TNF,LPS等反过来也可刺激Kupffer细胞生成释放PAF,这些细胞因子相互间存在着复杂的网络联系,它们的产生和释放过程既可以相互激发、协同作用,诱发肝细胞损害. 总之,在以内毒素参与的肝损害中,多种细胞因子或炎性递质特别是PAF,TNF在其中有重要的作用.
, 百拇医药
贵州省科委社会攻关基金课题,No.871157
通讯作者:何云
参考文献
1 Fukuoka T, Nakjima Y, Nakano H. The platelet activating factor as a pivotal mediator of shock liver ischemia. Surg Today, 1995;25:351-356
2 何云,顾长海,王宇明,郝飞. 病毒性肝炎血小板活化因子水平及其与发病机制的关系. 中华传染病杂志,1999;17:92-94
3 Nakamura T, Morita Y, Kuiyama M. Platelet activating factor in late asthmatic response. Clin Immunol, 1987;82:57-59
, 百拇医药
4 韩伟,成会忠,顾云娣. 大鼠肝枯否细胞分离培养与免疫活性的研究. 解剖学杂志,1998;11:71-72
5 王宇明,丁健,顾长海. 内毒素/肿瘤坏死因子所致肝细胞损伤机制的体外研究. 中华传染病杂志,1996:14-15
6 张帆,王家珑,过晋源. 血小板活化因子拮抗剂对急性肝脏损害保护作用的实验研究. 中华医学杂志,1990;70:375-378
7 Poooubelle P. PAF enchances the concomitant production of TNF and IL_1 of human monocytes. Immunology, 1991;72:181-183
收稿日期 1999-05-09 修回日期 1999-08-14, 百拇医药
单位:何云 袁凤仪 中国人民解放军44医院内四科 贵州省贵阳市 550009; 丁健 王宇明 中国人民解放军第三军医大学西南医院; 何燕 老年病研究所
关键词:血小板活化因子;肝细胞;Kupffer细胞;细胞,培养的
世界华人消化杂志991022 中国科学院分类号 R575.7
Subject headings platelet activating factor; hepatocytes; Kupffer cell; cell, cultured
血小板活化因子(platelet activating factor, PAF)是一具有广泛生物活性的脂质递质,与内毒素有着密切的关系,后者对肝脏的损害较为明确[1]. 新近我们研究发现PAF在各型病毒性肝炎中特别是重症肝炎患者显著增高,与肝细胞坏死程度及血中内毒素水平呈正相关,提示PAF参与了内毒素介导的肝脏损害[2]. 但PAF对体外肝脏细胞是否有损害作用目前尚未见报道.
, 百拇医药
1 材料和方法
1.1 材料 胶原酶、链酶蛋白酶、PAF标准品、内毒素(LPS,O111:B4)为Sigma公司产品,RPMI1640培养液、肿瘤坏死因子(rhTNF)为Gibco公司产品,PAF受体拮抗剂WEB2170为德国Zimmer博士惠赠.
1.2 方法 PAF检查按Jouvin_Marche法[3],根据PAF标准品引起洗涤后兔血小板聚集程度的标准曲线,计算出上清液及冻融法破坏过的细胞内PAF的含量. 丙二醛(MDA)检查按TBA法. 结果以μmol/m表示. TNF检查用双抗夹心法. 肝细胞分离培养[4]: 取Wistar大鼠(第三军医大学动物所提供)体质量180g~200g,用体外灌流法分离肝细胞,经苔盼蓝染色,存活率在95%以上用于实验,用RPMI1640液调整肝细胞浓度为2×108/L,加入终浓度为100mL/L的灭活无菌小牛血清,接种于Ⅰ型胶原. 被覆的12孔培养板(1mL/孔),置培养箱中37℃ 50mL/L CO2孵育4h后更换培养液,继续培养至所需时间. Kupffer细胞的分离培养[5]从体外灌流法分离所得的肝细胞悬液,离心后再经1g/L链霉蛋白酶,使肝细胞分解破碎,然后500g离心10min,重复3次,得到非肝脏细胞,以RPMI1640和小牛血清培养稀释成2×109细胞/L,接种于12孔培养板在37℃ 50mL/L CO2孵育20h后,洗去非贴壁细胞,再继续培养至所需时间. 将PAF加入培养的肝细胞,观察其作用后4h上清液中LDH水平及20h后肝细胞存活率和WEB 2170的防护作用. 将PAF加入培养的Kupffer细胞作用后4h上清液中TNF及MDA水平和WEB 2170的阻断作用. 将LPS和TNF分别加入培养的Kupffer细胞作用4h后,测定上清液及细胞内PAF的量.
, 百拇医药
统计学处理 定量资料两组数据比较采用t检验.
2 结果
2.1 PAF对肝细胞的损伤作用 PAF可引起肝细胞培养上清液中LDH升高,肝细胞存活率下降,与剂量无明显的依赖性,可被WEB 2170显著抑制(表1).
表1 PAF对培养肝细胞上清液LDH和存活率的影响
(
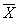 ±s,n=10)
±s,n=10)LDH(IU/L)
t值
存活率%
t值
, 百拇医药
空白对照
138.5±29.4
98.5±3.6
PAF(10ng)
452.9±123.4b
7.84
73.1±10.2d
7.43
PAF(100ng)
498.1±103.9b
10.53
, 百拇医药
70.9±14.8d
5.73
PAF(10ng)/WEB 2170
169.2±30.3b
7.06
86.3±9.2d
3.04
PAF(100ng)/WEB 2170
208.7±72.5b
7.22
84.5±10.5
, 百拇医药
2.37
bP<0.01, vs 空白对照组;dP<0.01, vs 未加WEB 2170组. WEB 2170(10ug/L).
2.2 PAF对Kupffer细胞产生TNF,MDA的影响 空白对照组培养的肝Kupffer细胞上清液中测不到TNF,MDA含量也很低. PAF能显著促进Kupffer合成并释放TNF,MDA,呈剂量依赖性,可被WEB 2170显著抑制(表2).
表2 PAF对Kupffer细胞产生TNF,MDA的影响
(
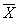 ±s,n=10) 分组
±s,n=10) 分组TNF(μg/g)
, 百拇医药
t值
MDA(μmol/g)
t值
空白对照
—
0.13±0.02
PAF(10ng)
1.52±0.39b
12.36
0.61±0.13d
11.43
PAF(100ng)
, 百拇医药
2.34±0.55b
13.45
0.82±0.25d
8.73
PAF(10ng)/WEB2170
0.98±0.26b
3.65
0.24±0.07d
7.87
PAF(100ng)/WEB2170
1.31±0.29b
, 百拇医药
5.23
0.37±0.18d
4.6
bP<0.01, vs 空白对照组;dP<0.01, vs 未加WEB 2170组. WEB 2170(10μg/L).
2.3 LPS,TNF对Kupffer细胞产生PAF的影响 LPS,TNF可显著促进培养Kupffer细胞上清及细胞内PAF产生(表3).
表3 LPS,TNF对Kupffer细胞产生PAF的影响
(
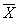 ±s,n=10)
±s,n=10), http://www.100md.com
上清PAF
t值
细胞内PAF
t值
空白对照
3.29±0.85
6.44±2.01
LPS(30mg/L)
17.39±5.12b
8.59
15.56±3.49d
7.18
, 百拇医药
TNF(1×106μ/L)
14.17±3.37b
10.10
13.82±4.79d
4.50
bP<0.01, vs 空白对照组.
3 讨论
Kupffer细胞被认为是肠源性内毒素的“生物滤过器”,具有吞噬、清除内毒素起保护性作用,另一方面Kupffer细胞被内毒素激活化后可释放多种炎症递质如花生四烯酸,TNF,白介素,PAF等,这与Kupffer细胞所处的状态有关,正常情况下Kupffer细胞主要起保护作用,而在损害时以致伤为主[5]. 最近,我们发现内毒素血症发生率较高慢性重症肝炎患者血中PAF水平也较高;用PAF受体拮抗剂WEB 2170可减轻D_氨基半乳糖对大鼠肝脏的损害,提示PAF参与了内毒素介导的肝脏损害,与肝细胞的坏死程度呈正相关[2]. 我们采用体外PAF与肝细胞共孵,其上清中LDH水平明显增加及肝细胞的存活率明显下降. 进一步证实PAF对肝细胞的损伤作用,可能通过氧自由基介导的脂质过氧化损伤肝细胞膜性结构,并可引起肝细胞蛋白质和染色体核酸的破坏[6],我们也发现PAF可引起肝脏细胞MDA水平升高;另一方面,如本实验用PAF作用于Kupffer细胞4h后上清中TNF水平明显升高并可被WEB2170显著抑制. PAF刺激Kupffer细胞释放其他炎性递质或细胞因子进一步说明PAF可放大内毒素参与的肝损害作用. 也有报道极低浓度PAF(10-6ng~10-11ng)就可以刺激中性粒细胞释放大量的TNF,IL_1等[7];同时,我们也发现TNF,LPS等反过来也可刺激Kupffer细胞生成释放PAF,这些细胞因子相互间存在着复杂的网络联系,它们的产生和释放过程既可以相互激发、协同作用,诱发肝细胞损害. 总之,在以内毒素参与的肝损害中,多种细胞因子或炎性递质特别是PAF,TNF在其中有重要的作用.
, 百拇医药
贵州省科委社会攻关基金课题,No.871157
通讯作者:何云
参考文献
1 Fukuoka T, Nakjima Y, Nakano H. The platelet activating factor as a pivotal mediator of shock liver ischemia. Surg Today, 1995;25:351-356
2 何云,顾长海,王宇明,郝飞. 病毒性肝炎血小板活化因子水平及其与发病机制的关系. 中华传染病杂志,1999;17:92-94
3 Nakamura T, Morita Y, Kuiyama M. Platelet activating factor in late asthmatic response. Clin Immunol, 1987;82:57-59
, 百拇医药
4 韩伟,成会忠,顾云娣. 大鼠肝枯否细胞分离培养与免疫活性的研究. 解剖学杂志,1998;11:71-72
5 王宇明,丁健,顾长海. 内毒素/肿瘤坏死因子所致肝细胞损伤机制的体外研究. 中华传染病杂志,1996:14-15
6 张帆,王家珑,过晋源. 血小板活化因子拮抗剂对急性肝脏损害保护作用的实验研究. 中华医学杂志,1990;70:375-378
7 Poooubelle P. PAF enchances the concomitant production of TNF and IL_1 of human monocytes. Immunology, 1991;72:181-183
收稿日期 1999-05-09 修回日期 1999-08-14, 百拇医药