脑挫裂伤后c-fos基因的表达
作者:罗毅男 刁文卓 尚庆义 赵万 韩影 付双林 陆俊平 刘庆波
单位:罗毅男 刁文卓 赵万 付双林 白求恩医科大学第一临床医学院神经外科,长春 130021;尚庆义 陆俊平 刘庆波 长春市第二医院神经外科,长春 130021;韩影 吉林市中心医院病理科,吉林 132011
关键词:
中国急救医学991012 脑挫裂伤是临床外伤中的常见疾病,它的病情演变,预后的判定一直是我们研究的焦点。一般认为继发性损害的发生,尤其是脑水肿的出现是导致脑挫裂伤预后不良的重要因素。近年来的一些研究表明,c-fos基因的表达在脑挫裂伤的病情演变中起重要的作用。本文通过对脑挫裂伤患者局部c-fos基因表达变化的研究对此进行了探讨。
1 资料与方法
1.1 病人资料
, http://www.100md.com
重症脑挫裂伤患者32例,男27例,女5例,年龄21~57岁,平均34±12.3岁。其中车祸致伤18例,坠落伤7例,钝器击伤5例,摔伤2例。合并其他系统损伤的3例,腹腔脏器损伤2例,股骨干骨折1例。32例患者均因高颅压需行内减压,采集标本到伤后时间从1小时到36小时。按病人伤后到取标本的时间分为大于12小时组和小于12小时组,患者术前的GCS评分为3~14分,分为GCS≥8组和GCS<8组。预后按病人两周内转归情况分为死亡组及存活组,两组患者平均年龄无统计学差异。另外选取无脑损伤死亡患者尸检标本9例做为对照组,男8例,女1例,年龄18~61岁,平均37.8±15.4岁,两组年龄无统计学差异。
1.2 脑挫裂伤标本的制做
行内减压术时取脑挫裂伤区脑组织一块大小约为0.5 cm×0.5 cm。室温下立即投入10%甲醛溶液中固定。固定24小时内常规石腊包埋,做成切片供免疫组织化学染色。对照组采用同样方法做成切片。
, 百拇医药
1.3 免疫组织化学染色方法
采用福州迈新公司提供的免疫组织化学方法。石蜡切片经脱蜡和水化后,PBS溶液冲洗,过氧化物酶阻断溶液阻断内源性过氧化物酶活性,再用非免疫性动物血清减少非特异性背景后,滴加由北京中山生物技术公司提供的兔抗第一抗体,室温下孵育1小时,然后滴加辣根过氧化物酶标记的二抗,室温下孵育半小时,最后加现配的DAB显色溶剂显微镜下观察3~10分钟。
1.4 图像分析和数据处理
计数c-fos表达阳性细胞:在脑挫裂伤与正常脑组织交界处随机选取100个神经细胞,读取其中c-fos表达阳性的细胞数,将其除以100,既为该片中c-fos蛋白表达阳性细胞的百分率。
灰度值及细胞直径的测定。从上述选择的脑区内随机选取40个胞体,输入彩色病理图像分析仪,对其灰度值(从0度到255度,最黑者为0度,最亮者为255度)和直径(该分析仪给定的标准值d)进行测量。然后求出该片中的平均灰度值及平均直径。
, http://www.100md.com
1.5 统计学处理 采用非配对数值t检验,数值用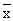 ±s表示。
±s表示。
附表 脑挫裂伤患者c-fos基因的表达
脑挫裂伤组(32)
对照组(9)
大于12小时组(16)
小于12小时组(16)
GCS≥8组(8)
GCS<8组(24)
死亡组(20)
存活组(12)
, 百拇医药
细胞阳性率(%)
58.72±13.28
7.00±1.11**
60.02±10.21
48.55±11.31**
50.48±12.56
63.73±11.23**
69.83±14.91
49.38±12.82**
灰度值(度)
, 百拇医药
118.73±8.53
158.24±7.40**
115.83±5.60
131.3±5.23**
125.36±6.32
108.12±5.41**
110.88±7.50
120.94±5.80**
细胞直径(d)
18.30±1.60
, http://www.100md.com
17.95±1.69**
18.313±1.48
16.92±1.59*
17.07±1.49
18.32±1.50*
18.51±1.89
17.79±1.34*
**P<0.01 *P<0.05
2 结果
各组细胞的比较见附表,脑挫裂伤组的细胞阳性率及细胞直径大于正常组,灰度值小于正常组,两组间的差异有显著性(P<0.01)。大于12小时组细胞阳性率高于小于12小时组(P<0.01),灰度值小(P<0.01),细胞直径大(P<0.05)。从预后来看GCS<8组细胞阳性率(P<0.01)及细胞直径(P<0.05)大于GCS≥8组,灰度值小于GCS≥8组(P<0.01)。死亡组与存活组比较,死亡组的细胞阳性率(P<0.01),细胞直径(P<0.05)大于存活组,灰度值(P<0.01)小于存活组。
, http://www.100md.com
3 讨论
c-fos基因是即刻早期基因的一种。它是FBR和FBJ小鼠特发性骨肉瘤病毒中v-fos的细胞同源物[1]。它的表达产物c-fos蛋白与jun蛋白形成二聚体,增强了jun蛋白与DNA结合的能力[2]。正常情况下,c-fos基因表达的浓度是极低的,它与细胞的生长、分化、增殖密切相关。多种刺激可诱发它的表达,但诱发因素消失后,它也很快消失。外伤的刺激是多种诱发因素之一[3]。病理情况下,最早人们认为它的出现与神经细胞的自我修复有关,和神经生长因子的作用相似[4]。但近年来人们认为它与颅脑损伤继发损害的关系十分密切,但是其确切机制不是十分清楚。
本组实验采用免疫组织化学方法,研究人脑外伤后c-fos基因表达变化,及其与预后之间的关系。从脑挫裂伤组与正常组对比来看,脑挫裂伤组的阳性细胞率、细胞直径明显大于正常组,灰度值小于正常组,统计学分析两组间差异有显著性。伤后时间≥12小时组的阳性细胞率、细胞直径大于伤后时间<12小时组,灰度值<12小时组,差异有显著性。从以上结果我们可以推测,脑挫裂伤后c-fos基因被激活,而且随着时间的推移表达有逐渐增多的趋势,并有一定的时程效应。并且我们看到c-fos基因的表达只限于受损脑区的周围,表明其是由于受伤区域扩散的因子诱导的。现在多数观点认为谷氨酸-NMDA受体系统的激活诱导了c-fos基因的表达[5]。
, http://www.100md.com
从另外两组来看,GCS<8组阳性细胞率、细胞直径大于GCS≥8组,灰度值小于GCS<8组,两组间差异有显著性。死亡组的阳性细胞率、细胞直径大于存活组,灰度值小于存活组,两组有显著性差异。通过上述的结果,我们可以推测出c-fos基因的活化在脑挫裂伤的病情发展中起着十分重要的作用。它可能是各种继发损害的启动基因[6],活化了一些相关基因,与脑挫裂伤的病情发展基本平行,随病情加重而表达增多。c-fos蛋白的增加常常提示神经细胞核酸代谢及调控机制紊乱,细胞钙超载,钙的增多常常伴随着脑水肿的出现,所以c-fos表达的增多提示预后不良。以上的结果提示在以后的临床工作中我们可以通过检测c-fos基因表达变化,从而判断脑挫裂伤的预后。
本实研研究了人脑损伤后c-fos基因表达的变化,探讨了其表达变化的一般规律,及其与脑损伤继发损害的关系,初步证明了脑挫裂伤后c-fos基因被激活,它可能是各种继发损害的启动基因。在实际工作中,我们可以通过对脑损伤患者的c-fos基因表达进行检测,在一定程度上可以作为判定预后的依据。
, http://www.100md.com
基金项目:本文系长春市科委资助项目(No.97031)
参考文献
[1]宁可.神经元钙通道与c-fos原癌基因表达的关系及其在颅脑创伤中的意义.《国外医学》创伤与外科基本问题分册,1995,16(3):149-154.
[2]Daniel G.Activation of c-fos in the brain.Progress in Neurobiology,1996,50:83-107.
[3]王占祥.颅脑穿入伤c-fos基因表达特征及意义.中华创伤杂志,1997,13(6):369-371.
[4]Sharp.Induction of the c-fos gene product in rat forebrain following cortical lesions and NGF injections.Neurosci Lett,1989,100:117-122.
[5]Sharp.The NMDA receptor mediates cortical induction of fos and fos-related antigens following cortical in jury.Expl Neurol,1990,109:323-332.
[6]王占祥.实验性脑损伤c-fos基因表达时相特性及其意义.陕西医学杂志,1997,26(9):573-576.
收稿:1999-05-20
修回:1999-08-10, http://www.100md.com
单位:罗毅男 刁文卓 赵万 付双林 白求恩医科大学第一临床医学院神经外科,长春 130021;尚庆义 陆俊平 刘庆波 长春市第二医院神经外科,长春 130021;韩影 吉林市中心医院病理科,吉林 132011
关键词:
中国急救医学991012 脑挫裂伤是临床外伤中的常见疾病,它的病情演变,预后的判定一直是我们研究的焦点。一般认为继发性损害的发生,尤其是脑水肿的出现是导致脑挫裂伤预后不良的重要因素。近年来的一些研究表明,c-fos基因的表达在脑挫裂伤的病情演变中起重要的作用。本文通过对脑挫裂伤患者局部c-fos基因表达变化的研究对此进行了探讨。
1 资料与方法
1.1 病人资料
, http://www.100md.com
重症脑挫裂伤患者32例,男27例,女5例,年龄21~57岁,平均34±12.3岁。其中车祸致伤18例,坠落伤7例,钝器击伤5例,摔伤2例。合并其他系统损伤的3例,腹腔脏器损伤2例,股骨干骨折1例。32例患者均因高颅压需行内减压,采集标本到伤后时间从1小时到36小时。按病人伤后到取标本的时间分为大于12小时组和小于12小时组,患者术前的GCS评分为3~14分,分为GCS≥8组和GCS<8组。预后按病人两周内转归情况分为死亡组及存活组,两组患者平均年龄无统计学差异。另外选取无脑损伤死亡患者尸检标本9例做为对照组,男8例,女1例,年龄18~61岁,平均37.8±15.4岁,两组年龄无统计学差异。
1.2 脑挫裂伤标本的制做
行内减压术时取脑挫裂伤区脑组织一块大小约为0.5 cm×0.5 cm。室温下立即投入10%甲醛溶液中固定。固定24小时内常规石腊包埋,做成切片供免疫组织化学染色。对照组采用同样方法做成切片。
, 百拇医药
1.3 免疫组织化学染色方法
采用福州迈新公司提供的免疫组织化学方法。石蜡切片经脱蜡和水化后,PBS溶液冲洗,过氧化物酶阻断溶液阻断内源性过氧化物酶活性,再用非免疫性动物血清减少非特异性背景后,滴加由北京中山生物技术公司提供的兔抗第一抗体,室温下孵育1小时,然后滴加辣根过氧化物酶标记的二抗,室温下孵育半小时,最后加现配的DAB显色溶剂显微镜下观察3~10分钟。
1.4 图像分析和数据处理
计数c-fos表达阳性细胞:在脑挫裂伤与正常脑组织交界处随机选取100个神经细胞,读取其中c-fos表达阳性的细胞数,将其除以100,既为该片中c-fos蛋白表达阳性细胞的百分率。
灰度值及细胞直径的测定。从上述选择的脑区内随机选取40个胞体,输入彩色病理图像分析仪,对其灰度值(从0度到255度,最黑者为0度,最亮者为255度)和直径(该分析仪给定的标准值d)进行测量。然后求出该片中的平均灰度值及平均直径。
, http://www.100md.com
1.5 统计学处理 采用非配对数值t检验,数值用
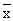 ±s表示。
±s表示。附表 脑挫裂伤患者c-fos基因的表达
脑挫裂伤组(32)
对照组(9)
大于12小时组(16)
小于12小时组(16)
GCS≥8组(8)
GCS<8组(24)
死亡组(20)
存活组(12)
, 百拇医药
细胞阳性率(%)
58.72±13.28
7.00±1.11**
60.02±10.21
48.55±11.31**
50.48±12.56
63.73±11.23**
69.83±14.91
49.38±12.82**
灰度值(度)
, 百拇医药
118.73±8.53
158.24±7.40**
115.83±5.60
131.3±5.23**
125.36±6.32
108.12±5.41**
110.88±7.50
120.94±5.80**
细胞直径(d)
18.30±1.60
, http://www.100md.com
17.95±1.69**
18.313±1.48
16.92±1.59*
17.07±1.49
18.32±1.50*
18.51±1.89
17.79±1.34*
**P<0.01 *P<0.05
2 结果
各组细胞的比较见附表,脑挫裂伤组的细胞阳性率及细胞直径大于正常组,灰度值小于正常组,两组间的差异有显著性(P<0.01)。大于12小时组细胞阳性率高于小于12小时组(P<0.01),灰度值小(P<0.01),细胞直径大(P<0.05)。从预后来看GCS<8组细胞阳性率(P<0.01)及细胞直径(P<0.05)大于GCS≥8组,灰度值小于GCS≥8组(P<0.01)。死亡组与存活组比较,死亡组的细胞阳性率(P<0.01),细胞直径(P<0.05)大于存活组,灰度值(P<0.01)小于存活组。
, http://www.100md.com
3 讨论
c-fos基因是即刻早期基因的一种。它是FBR和FBJ小鼠特发性骨肉瘤病毒中v-fos的细胞同源物[1]。它的表达产物c-fos蛋白与jun蛋白形成二聚体,增强了jun蛋白与DNA结合的能力[2]。正常情况下,c-fos基因表达的浓度是极低的,它与细胞的生长、分化、增殖密切相关。多种刺激可诱发它的表达,但诱发因素消失后,它也很快消失。外伤的刺激是多种诱发因素之一[3]。病理情况下,最早人们认为它的出现与神经细胞的自我修复有关,和神经生长因子的作用相似[4]。但近年来人们认为它与颅脑损伤继发损害的关系十分密切,但是其确切机制不是十分清楚。
本组实验采用免疫组织化学方法,研究人脑外伤后c-fos基因表达变化,及其与预后之间的关系。从脑挫裂伤组与正常组对比来看,脑挫裂伤组的阳性细胞率、细胞直径明显大于正常组,灰度值小于正常组,统计学分析两组间差异有显著性。伤后时间≥12小时组的阳性细胞率、细胞直径大于伤后时间<12小时组,灰度值<12小时组,差异有显著性。从以上结果我们可以推测,脑挫裂伤后c-fos基因被激活,而且随着时间的推移表达有逐渐增多的趋势,并有一定的时程效应。并且我们看到c-fos基因的表达只限于受损脑区的周围,表明其是由于受伤区域扩散的因子诱导的。现在多数观点认为谷氨酸-NMDA受体系统的激活诱导了c-fos基因的表达[5]。
, http://www.100md.com
从另外两组来看,GCS<8组阳性细胞率、细胞直径大于GCS≥8组,灰度值小于GCS<8组,两组间差异有显著性。死亡组的阳性细胞率、细胞直径大于存活组,灰度值小于存活组,两组有显著性差异。通过上述的结果,我们可以推测出c-fos基因的活化在脑挫裂伤的病情发展中起着十分重要的作用。它可能是各种继发损害的启动基因[6],活化了一些相关基因,与脑挫裂伤的病情发展基本平行,随病情加重而表达增多。c-fos蛋白的增加常常提示神经细胞核酸代谢及调控机制紊乱,细胞钙超载,钙的增多常常伴随着脑水肿的出现,所以c-fos表达的增多提示预后不良。以上的结果提示在以后的临床工作中我们可以通过检测c-fos基因表达变化,从而判断脑挫裂伤的预后。
本实研研究了人脑损伤后c-fos基因表达的变化,探讨了其表达变化的一般规律,及其与脑损伤继发损害的关系,初步证明了脑挫裂伤后c-fos基因被激活,它可能是各种继发损害的启动基因。在实际工作中,我们可以通过对脑损伤患者的c-fos基因表达进行检测,在一定程度上可以作为判定预后的依据。
, http://www.100md.com
基金项目:本文系长春市科委资助项目(No.97031)
参考文献
[1]宁可.神经元钙通道与c-fos原癌基因表达的关系及其在颅脑创伤中的意义.《国外医学》创伤与外科基本问题分册,1995,16(3):149-154.
[2]Daniel G.Activation of c-fos in the brain.Progress in Neurobiology,1996,50:83-107.
[3]王占祥.颅脑穿入伤c-fos基因表达特征及意义.中华创伤杂志,1997,13(6):369-371.
[4]Sharp.Induction of the c-fos gene product in rat forebrain following cortical lesions and NGF injections.Neurosci Lett,1989,100:117-122.
[5]Sharp.The NMDA receptor mediates cortical induction of fos and fos-related antigens following cortical in jury.Expl Neurol,1990,109:323-332.
[6]王占祥.实验性脑损伤c-fos基因表达时相特性及其意义.陕西医学杂志,1997,26(9):573-576.
收稿:1999-05-20
修回:1999-08-10, http://www.100md.com