可溶性Ⅰ型补体受体活性区基因的突变修正*
作者:黄盛东 赵仙先 张宝仁 朱家麟 李白翎
单位:第二军医大学长海医院胸心外科,上海,200433
关键词:受体;补体;诱变;定点;点杂交
第二军医大学学报991207 摘要 目的:修正可溶性Ⅰ型补体受体(sCR1)PCR过程中造成的碱基突变,保证基因序列氨基酸编码的准确性,为蛋白表达和基因转染打下基础。 方法:采用掺尿苷寡聚核苷酸介导的定点突变法,对sCR1活性区基因中错配的碱基加以修正,用点杂交方法筛选突变子阳性克隆,测序鉴定。结果: 40℃洗膜,放射自显影示除阴性对照和1个样品外,阳性对照和其余19个克隆均显阳性黑斑;56℃洗膜,放射自显影示5个样品为阳性。阳性克隆测序结果正确。结论:掺尿苷寡聚核苷酸介导的定点突变法是一种快速而可靠的DNA突变修正方法,但仍存在较高的假阳性,点杂交有助于阳性克隆的筛选。
, 百拇医药
中图分类号 R 654.2;Q 754 文章编号:0258-879X(1999)12-0956-03 文献标识码:A
Correction of the mismatch in cloned sCR1 segment by oligonucleotide-directed mutagenesis
Huang Shengdong,Zhao Xianxian,Zhang Baoren,Zhu Jialin,Li Bailing
(Department of Cardiothoracic Surgery, Changhai Hospital,Second Military Medical University,Shanghai,200433)
ABSTRACT Objective: To correct the soluble complement recptor Ⅰ (SCR1) DNA mismatch before protein expression and gene therapy. Methods: Oligonucleotide-directed mutagenesis was used to correct the DNA mismatch. Results: Autoradiography with the membrane washed at 56℃ showed 5 mutants were positive after dot blotting hybridization. DNA sequencing showed the mismatch has been corrected. Conclusion: Oligonucleotide -directed mutagenesis using of the uracil-contain template is a rapid and reliable method for correcting the mismatch in a cloned DNA segment. But pseudo-positive rate is still high. Dot blotting hybridization is much helpful in the determination of the mutant.
, 百拇医药
KEY WORDS receptors,complement; mutagenesis, site-directed;dot blotting hybridization
[Acad J Sec Mil Med Univ, 1999, 20(12): 956~958]
PCR是常用的获取目的基因的方法,操作简便且经济易行,但不足之处是偶有碱基错配的发生。可溶性Ⅰ型补体受体(sCR1)是一种能有效地抑制补体活性的功能蛋白[1],在对抑制异种心脏移植后排斥反应和多种肾炎的治疗研究中都取得了满意的效果[2,3]。我们通过反转录PCR的方法获取了sCR1活性区的基因序列,经测序发现,其中第2 954位碱基由C突变为T,所编码的氨基酸由苏氨酸(ACA)变为异亮氨酸(ATA)。为保证氨基酸编码的正确性,本实验采用掺尿苷寡聚核苷酸介导的定点突变法将错配碱基加以修正[4],现报道如下。
, 百拇医药
1 材料和方法
1.1 材料 含待修正基因片段的M13mp18重组噬菌体,由本实验室先期制备,TG1、 CJ236菌株由复旦大学遗传研究所提供。主要酶类: T4 DNA聚合酶、 T4 DNA连接酶 (华美生物工程公司);T4多核苷酸激酶 (Biolabs)。突变引物: 5′AGTCGATGTGGCACCGGGG 3′(上海生工生物工程有限公司)。γ-32PdATP (Amersham),尿苷(Boehringer)。ABI373型DNA自动序列分析仪(美国ABI公司)。
1.2 方法
1.2.1 掺尿苷单链DNA模板的制备 取CJ236过夜菌100 μl,25 mg/ml氯霉素2.7 μl,1.25 mg/ml尿苷4 μl,共同加入1 ml 2YT培养液中, 37℃培养45 min。加入106 pfu M13mp18重组噬菌体120 μl,37℃剧烈振荡培养6 h。取培养液上清的1 000倍稀释液10 μl, CJ236过夜菌200 μl,另取培养液上清的10 000倍稀释液10 μl, TG1过夜菌200 μl, 分别置于LB半固体培养基中,37℃培养过夜。在满足感染CJ236的效价>1011pfu/ml,感染TG1的效价<105 pfu/ml,两者比不小于104条件的前提下,在20 ml LB培养液中继续掺尿苷扩增, PEG8000沉淀噬菌体,酚-氯仿抽提后待用。
, 百拇医药
1.2.2 突变重组子制备 用5 U T4多核苷酸激酶作用于100 pmol突变引物37℃ 1.5 h,然后100℃ 1 min,存于-20℃待用。取10 pmol突变引物和0.2 pmol 掺尿苷单链DNA置80℃水浴5 min,自然冷却至室温。反应液用3 U T4 DNA 连接酶和1 U T4 DNA聚合酶于37℃水浴90 min,68℃ 10 min灭活。转化感受态TG1, 37℃培养过夜。选取20个克隆扩增后抽取噬菌体单链待用。
1.2.3 斑点杂交[5] 每个样品各取1 μg噬菌体单链,依次点于硝酸纤维膜上,另设未突变子为阳性对照,无菌水为阴性对照。室温晾干,75℃烘烤2 h。将20 pmol突变引物用 2 U多核苷酸激酶,296 kBq的γ-32P-dATP于37℃共同作用2 h,68℃ 10 min灭活,制成标记探针。点样膜置于塑料袋中,加入10 ml Denhardt预杂液,封口后68℃水浴2 h。加入标记探针,封口后42℃水浴过夜。依次用2×SSC,0.1% SDS,0.1×SSC,0.1%SDS,0.1×SSC,40℃各洗15 min。室温晾干后压片12 h,X线自显影。根据经验公式计算,探针与突变子杂交后膜洗脱温度为60℃,而探针与突变前的单链模板杂交后膜洗脱温度为52℃,故选择56℃为二次洗膜温度。
, 百拇医药
1.2.4 测序鉴定 选取1株56℃洗膜阳性的菌株扩增后抽单链,用ABI373型DNA自动序列分析仪测序鉴定。
2 结果
2.1 40℃洗膜后放射自显影 除1个样品外,所有样品及阳性对照均有杂交斑点。阴性对照未见杂交斑点(图1A)。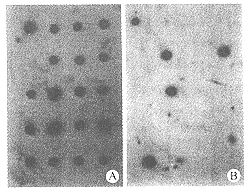
图1 点杂交膜放射自显影结果
Fig 1 Autoradiography of the dot blot
A:Membrane washed at 40 ℃;B:Membrane washed at 56 ℃
2.2 56℃洗膜后放射自显影 除5个样品外,阳性对照及其他样品的杂交斑均被洗脱,提示上述5个样品为突变子(图1B)。
, 百拇医药
2.3 测序结果 第2 954位碱基的突变被纠正,测序结果见图2。
图2 DNA测序部分结果
Fig 2 Partial results of DNA sequencing
A: Before correction; B: After correction
3 讨论
任何影响氨基酸编码的碱基错配都会影响蛋白质表达。对于碱基错配的纠正,目前常用的方法是掺尿苷寡聚核苷酸介导定点突变法。尽管从理论上讲,用掺尿苷法所得到的突变子阳性率几乎为100%。但实际操作中发现,突变子的阳性率远未达此要求。本实验突变子阳性率仅为25%。造成突变子阳性率不高的原因尚不清楚。因此,我们在掺尿苷后再用点杂交方法[5]进行梯度洗膜筛选,以确保突变子的正确性。
, 百拇医药
采用梯度洗膜筛选方法成功与否的关键,在于掌握好探针与突变前、后模板杂交后膜洗脱温度相差的程度,相差越大,突变子的筛选就越简单易行。为此,我们在实际操作中预先将拟修正的编码苏氨酸的ACA改成ACC。这样,在不影响氨基酸编码的基础上,探针的膜洗脱温度差就从原先的4℃提高为8℃,因而在选用56℃洗膜时,确保了在突变子不被洗脱的同时将未突变子彻底洗脱。
*国家自然科学基金资助项目,批准号39870756
作者简介:黄盛东,男,1965年1月生,博士,助理研究员
参考文献
1 Himmelfarb J, McMonagle E, Holbrook D, et al. Soluble complement receptor 1 inhibits both complement and granulocyte activation during ex vivo hemodialysis[J]. J Lab Clin Med,1995,126(4):392
, http://www.100md.com
2 Pratt JR, Hibbs MJ, Laver AJ, et al. Allograft immune response with sCR1 intervention[J].Transpl Immunol, 1996,4(1):72
3 Sadallah S, Gudat F, Laissue JA,et al. Glomerulonephritis in a patient with complement factor 1 deficiency[J]. Am J Kidney Dis,1999,33(6):1153
4 Kunkel TA. Mutagenesis of cloned DNA. In: Ausubel F ed. Current protocols in molecular biology[M]. New York: John Wiley & Sons Inc, 1995. 8.1.1~8.1.6
5 Tijssen P. Hybridization to colony or plaque nucleic acids. In: Tijssen P ed. Hybridization with nucleic acid probes. Part Ⅱ[M]. Amsterdam: Elsevier Science Publishers, 1993. 488~492
(1999-05-11收稿,1999-11-02修回), 百拇医药
单位:第二军医大学长海医院胸心外科,上海,200433
关键词:受体;补体;诱变;定点;点杂交
第二军医大学学报991207 摘要 目的:修正可溶性Ⅰ型补体受体(sCR1)PCR过程中造成的碱基突变,保证基因序列氨基酸编码的准确性,为蛋白表达和基因转染打下基础。 方法:采用掺尿苷寡聚核苷酸介导的定点突变法,对sCR1活性区基因中错配的碱基加以修正,用点杂交方法筛选突变子阳性克隆,测序鉴定。结果: 40℃洗膜,放射自显影示除阴性对照和1个样品外,阳性对照和其余19个克隆均显阳性黑斑;56℃洗膜,放射自显影示5个样品为阳性。阳性克隆测序结果正确。结论:掺尿苷寡聚核苷酸介导的定点突变法是一种快速而可靠的DNA突变修正方法,但仍存在较高的假阳性,点杂交有助于阳性克隆的筛选。
, 百拇医药
中图分类号 R 654.2;Q 754 文章编号:0258-879X(1999)12-0956-03 文献标识码:A
Correction of the mismatch in cloned sCR1 segment by oligonucleotide-directed mutagenesis
Huang Shengdong,Zhao Xianxian,Zhang Baoren,Zhu Jialin,Li Bailing
(Department of Cardiothoracic Surgery, Changhai Hospital,Second Military Medical University,Shanghai,200433)
ABSTRACT Objective: To correct the soluble complement recptor Ⅰ (SCR1) DNA mismatch before protein expression and gene therapy. Methods: Oligonucleotide-directed mutagenesis was used to correct the DNA mismatch. Results: Autoradiography with the membrane washed at 56℃ showed 5 mutants were positive after dot blotting hybridization. DNA sequencing showed the mismatch has been corrected. Conclusion: Oligonucleotide -directed mutagenesis using of the uracil-contain template is a rapid and reliable method for correcting the mismatch in a cloned DNA segment. But pseudo-positive rate is still high. Dot blotting hybridization is much helpful in the determination of the mutant.
, 百拇医药
KEY WORDS receptors,complement; mutagenesis, site-directed;dot blotting hybridization
[Acad J Sec Mil Med Univ, 1999, 20(12): 956~958]
PCR是常用的获取目的基因的方法,操作简便且经济易行,但不足之处是偶有碱基错配的发生。可溶性Ⅰ型补体受体(sCR1)是一种能有效地抑制补体活性的功能蛋白[1],在对抑制异种心脏移植后排斥反应和多种肾炎的治疗研究中都取得了满意的效果[2,3]。我们通过反转录PCR的方法获取了sCR1活性区的基因序列,经测序发现,其中第2 954位碱基由C突变为T,所编码的氨基酸由苏氨酸(ACA)变为异亮氨酸(ATA)。为保证氨基酸编码的正确性,本实验采用掺尿苷寡聚核苷酸介导的定点突变法将错配碱基加以修正[4],现报道如下。
, 百拇医药
1 材料和方法
1.1 材料 含待修正基因片段的M13mp18重组噬菌体,由本实验室先期制备,TG1、 CJ236菌株由复旦大学遗传研究所提供。主要酶类: T4 DNA聚合酶、 T4 DNA连接酶 (华美生物工程公司);T4多核苷酸激酶 (Biolabs)。突变引物: 5′AGTCGATGTGGCACCGGGG 3′(上海生工生物工程有限公司)。γ-32PdATP (Amersham),尿苷(Boehringer)。ABI373型DNA自动序列分析仪(美国ABI公司)。
1.2 方法
1.2.1 掺尿苷单链DNA模板的制备 取CJ236过夜菌100 μl,25 mg/ml氯霉素2.7 μl,1.25 mg/ml尿苷4 μl,共同加入1 ml 2YT培养液中, 37℃培养45 min。加入106 pfu M13mp18重组噬菌体120 μl,37℃剧烈振荡培养6 h。取培养液上清的1 000倍稀释液10 μl, CJ236过夜菌200 μl,另取培养液上清的10 000倍稀释液10 μl, TG1过夜菌200 μl, 分别置于LB半固体培养基中,37℃培养过夜。在满足感染CJ236的效价>1011pfu/ml,感染TG1的效价<105 pfu/ml,两者比不小于104条件的前提下,在20 ml LB培养液中继续掺尿苷扩增, PEG8000沉淀噬菌体,酚-氯仿抽提后待用。
, 百拇医药
1.2.2 突变重组子制备 用5 U T4多核苷酸激酶作用于100 pmol突变引物37℃ 1.5 h,然后100℃ 1 min,存于-20℃待用。取10 pmol突变引物和0.2 pmol 掺尿苷单链DNA置80℃水浴5 min,自然冷却至室温。反应液用3 U T4 DNA 连接酶和1 U T4 DNA聚合酶于37℃水浴90 min,68℃ 10 min灭活。转化感受态TG1, 37℃培养过夜。选取20个克隆扩增后抽取噬菌体单链待用。
1.2.3 斑点杂交[5] 每个样品各取1 μg噬菌体单链,依次点于硝酸纤维膜上,另设未突变子为阳性对照,无菌水为阴性对照。室温晾干,75℃烘烤2 h。将20 pmol突变引物用 2 U多核苷酸激酶,296 kBq的γ-32P-dATP于37℃共同作用2 h,68℃ 10 min灭活,制成标记探针。点样膜置于塑料袋中,加入10 ml Denhardt预杂液,封口后68℃水浴2 h。加入标记探针,封口后42℃水浴过夜。依次用2×SSC,0.1% SDS,0.1×SSC,0.1%SDS,0.1×SSC,40℃各洗15 min。室温晾干后压片12 h,X线自显影。根据经验公式计算,探针与突变子杂交后膜洗脱温度为60℃,而探针与突变前的单链模板杂交后膜洗脱温度为52℃,故选择56℃为二次洗膜温度。
, 百拇医药
1.2.4 测序鉴定 选取1株56℃洗膜阳性的菌株扩增后抽单链,用ABI373型DNA自动序列分析仪测序鉴定。
2 结果
2.1 40℃洗膜后放射自显影 除1个样品外,所有样品及阳性对照均有杂交斑点。阴性对照未见杂交斑点(图1A)。

图1 点杂交膜放射自显影结果
Fig 1 Autoradiography of the dot blot
A:Membrane washed at 40 ℃;B:Membrane washed at 56 ℃
2.2 56℃洗膜后放射自显影 除5个样品外,阳性对照及其他样品的杂交斑均被洗脱,提示上述5个样品为突变子(图1B)。
, 百拇医药
2.3 测序结果 第2 954位碱基的突变被纠正,测序结果见图2。

图2 DNA测序部分结果
Fig 2 Partial results of DNA sequencing
A: Before correction; B: After correction
3 讨论
任何影响氨基酸编码的碱基错配都会影响蛋白质表达。对于碱基错配的纠正,目前常用的方法是掺尿苷寡聚核苷酸介导定点突变法。尽管从理论上讲,用掺尿苷法所得到的突变子阳性率几乎为100%。但实际操作中发现,突变子的阳性率远未达此要求。本实验突变子阳性率仅为25%。造成突变子阳性率不高的原因尚不清楚。因此,我们在掺尿苷后再用点杂交方法[5]进行梯度洗膜筛选,以确保突变子的正确性。
, 百拇医药
采用梯度洗膜筛选方法成功与否的关键,在于掌握好探针与突变前、后模板杂交后膜洗脱温度相差的程度,相差越大,突变子的筛选就越简单易行。为此,我们在实际操作中预先将拟修正的编码苏氨酸的ACA改成ACC。这样,在不影响氨基酸编码的基础上,探针的膜洗脱温度差就从原先的4℃提高为8℃,因而在选用56℃洗膜时,确保了在突变子不被洗脱的同时将未突变子彻底洗脱。
*国家自然科学基金资助项目,批准号39870756
作者简介:黄盛东,男,1965年1月生,博士,助理研究员
参考文献
1 Himmelfarb J, McMonagle E, Holbrook D, et al. Soluble complement receptor 1 inhibits both complement and granulocyte activation during ex vivo hemodialysis[J]. J Lab Clin Med,1995,126(4):392
, http://www.100md.com
2 Pratt JR, Hibbs MJ, Laver AJ, et al. Allograft immune response with sCR1 intervention[J].Transpl Immunol, 1996,4(1):72
3 Sadallah S, Gudat F, Laissue JA,et al. Glomerulonephritis in a patient with complement factor 1 deficiency[J]. Am J Kidney Dis,1999,33(6):1153
4 Kunkel TA. Mutagenesis of cloned DNA. In: Ausubel F ed. Current protocols in molecular biology[M]. New York: John Wiley & Sons Inc, 1995. 8.1.1~8.1.6
5 Tijssen P. Hybridization to colony or plaque nucleic acids. In: Tijssen P ed. Hybridization with nucleic acid probes. Part Ⅱ[M]. Amsterdam: Elsevier Science Publishers, 1993. 488~492
(1999-05-11收稿,1999-11-02修回), 百拇医药