创伤性休克大鼠中性粒细胞CD18的变化及其与糖皮质激素受体相互作用的研究
作者:梅 冰 杨瑞和 霍正禄
单位:梅 冰 杨瑞和 霍正禄 上海第二军医大学长海医院急诊科,200433
关键词:创伤性休克;粘附分子;糖皮质激素受体;中性粒细胞;血管内皮细胞;大鼠
中国急救医学991203 [摘 要]目的 探讨中性粒细胞粘附分子CD18(PMN CD18)、中性粒细胞糖皮质激素受体(PMN GR)在大鼠创伤性休克早期的动态变化。方法 动物模型采用软组织损伤加颈动脉放血法,分别采用流式细胞仪和放射配体结合法测定PMN CD 18、PMN GR的表达值。结果 休克组休克45 min PMN CD18表达值明显增高,随后逐渐下降,至休克7.5 h与基础表达值仍相差非常显著(P<0.01);PMN GR随休克时间的延长逐渐下降。复苏2 h后上述改变最显著。肝、肺组织切片发现,复苏后2 h毛细血管内有大量白细胞粘附于血管内壁,同时血管周围有白细胞浸润,复苏6 h后上述改变减轻。结论 创伤性休克及复苏时,PMN-EC粘附明显增强,与PMN CD18的表达增加有关,PMN GR的减数调节是PMN CD18表达增加的原因之一。
, http://www.100md.com
[中图分类号]R 605.971 [文献标识码]A [文章编号]1002-1949(1999)12-0707-03
Studies on expression of neutrophil CD18、glucocorticoid receptor during traumatic shock in rats
MEI Bing, YANG Rui-he, HUO Zheng-lu.Emergency Department Changhai Hospital, Shanghai 200433, China
[Abstract]Objective To investigate the changes of neutrophil CD18(PMN CD18) and glucocorticoid receptor (PMN GR) after early traumatic shock in rats.Methods Traumatic shock was induced by means of soft tissue injury plus hemorrhage of carotid artery. PMN CD18 and PMN GR were measured by Flowcytometer and Radioligand-binding assay respectively.Results PMN CD18 increased markedly during traumatic shock, especially as time went on during the shock; the above changes reached the highest peak at 2 hours after resuscitation. Tissue examination showed that a lot of leukocytes adhered to liver and lung capillary in resuscitation group at 2 hours after resuscitation, the cells surrounding capillary showed cloady swelling, degeneration and local tissue infiltration of leukocytes the above changes decreased at 6 hours after resuscitation.Conclusion The adhesion of PMN-EC is significantly increased during traumatic shock and resuscitation and it may be due to the upregulation of PMN CD18 expression the upregulation of PMN CD 18 expression may be due to the downregulation of PMN GR.
, http://www.100md.com
[Key words]Traumatic shock; Adhesion molecule; Glucocoticoid receptor, neutrophil; Endothelium; Rat
PMN与EC粘附是其趋化、游走和吞噬活动的基础,创伤性休克及多脏器功能衰竭(MOF)等发病过程中均有大量白细胞粘附于血管内壁,应用粘附分子单克隆抗体治疗创伤性休克已取得了一定的疗效。目前国内外对PMN粘附的主要参与因子CD18在创伤性休克早期的变化规律及其与PMN GR的相互关系研究甚少。本实验复制大鼠创伤性休克模型,测定此过程中中性粒细胞粘附分子(PMN CD18)、中性粒细胞糖皮质激素受体(PMN GR)的动态变化,以期阐明PMN在创伤性休克早期的作用机理,为临床更好地防治创伤性休克提供理论依据。
1 材料与方法
1.1 动物与分组
, http://www.100md.com
健康SD大鼠160只,雌雄不拘,体重450±30 g,由上海市计生所提供。动物随机分为假手术组、休克组和复苏组。假手术组行颈总动、静脉插管但不致伤及放血。各组均于插管后即刻,术后45 min、1.5 h、3.5 h、5.5 h、7.5 h处死动物抽血查PMN CD18、PMN GR表达值。复苏组于休克1.5 h开始复苏(回输所失血液,并按放血量2倍补充乳酸林格氏液,复苏后2 h、4 h、6 h相当于休克后3.5 h、5.5 h、7.5 h)。假手术组每时相点标本量为6,其余均为10。
1.2 主要材料
大鼠PMN CD18单克隆抗体WT.3由美国Pharmingen公司提供;FITC标记羊抗小鼠二抗由上海华美生物工程公司提供;[1.2.4]3[H]Dex由英国放化公司提供;Percoll和Dex T 500为英国Pharmacia公司产品。EPICS XL型流式细胞仪为美国Epics division of coulter corporation产品;FJ-2108细胞代谢闪烁计数器为西安7412厂产品。
, http://www.100md.com
1.3 方法
1.3.1 模型 基本方法见文献[1],参考Lamson法[2]略作改进。动物20%乌拉坦(6 ml/kg)麻醉后固定于鼠台,行右颈总动、静脉插管。稳定30 min后,一重1 kg的铁棒从1米高处自由落下,砸中鼠双大腿,然后从颈总动脉放血,连接到自制的无菌贮血瓶,调节血液平面高度控制血压,休克期间维持血压在5.33 kPa。
1.3.2 指标测定 PMN CD18采用流式细胞仪细胞计数,以阳性细胞百分数为单位;PMN GR采用放射配体结合法测定[3],以Percoll密度梯度离心法分离中性粒细胞,基本方法见文献[4]。
1.3.3 组织学检查 肝、肺组织常规HE染色,石蜡包埋切片。
1.3.4 统计学处理 所有数据以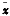 ±s表示,采用Base统计软件包进行完全随机资料的方差分析,组间均数比较用t检验。P<0.05为差异显著,P<0.01为差异非常显著。
±s表示,采用Base统计软件包进行完全随机资料的方差分析,组间均数比较用t检验。P<0.05为差异显著,P<0.01为差异非常显著。
, 百拇医药
2 结果
2.1 大鼠PMN CD18的动态变化
休克组休克45 min PMN CD18表达即明显升高,随后逐渐下降,至休克7.5 h与休克前基础表达值仍相差非常显著(P<0.01);复苏组PMN CD18呈双峰改变,第一峰在休克45 min,第二峰在复苏后2 h,较休克组同时相点明显升高(P<0.01),随后逐渐下降,复苏后6 h较休克组同时相点降低(P>0.05)(见表1)。
表1 创伤性休克大鼠PMN CD18的变化(单位:阳性细胞百分率) 组 别
n
休克前
休 克
复 苏
, 百拇医药
45 min
1.5 h
3.5 h
5.5 h
7.5 h
假手术组
6
23.17±2.40
24.57±2.44
24.18±1.91
22.80±1.91
23.00±2.29
, 百拇医药
24.27±2.21
休克组
10
22.50±1.22
51.24±4.28**
41.68±4.33**
41.30±2.96**
39.60±2.69**
38.82±2.66**
复苏组
, http://www.100md.com 10
23.64±1.37
51.46±5.31**
41.94±3.69**
54.48±4.86**##
41.90±2.86**
35.36±2.59**
各时相点与同组休克前比较**P<0.01,复苏组与休克组同时相点比较##P<0.012.2 PMN GR的动态变化
休克组休克1.5 h PMN GR较基础表达值降低(P<0.05),3.5、5.5、7.5 h与休克前相比P<0.01;复苏后2 h GR达最低值,较休克组同时相点明显降低(P<0.01),复苏后4、6 h开始回升(与复苏2 h相比P<0.05,P<0.01),复苏后6 h较休克组同时相点明显增高(P<0.05)(表2)。表2 创伤性休克大鼠PMN GR的变化(单位:位点/细胞) 组 别
, 百拇医药
n
休克前
休 克
复 苏
45 min
1.5 h
3.5 h
5.5 h
7.5 h
假手术组
6
3231±115
3188±147
, http://www.100md.com
3151±135
3069±136
3006±120
3082±137
休克组
10
3210±136
2949±139
2767±142*
2443±179**
2086±273**
, http://www.100md.com
1892±266**
复苏组
10
3177±169
2982±227
2793±206*
1460±275**##
1867±225**
2237±233**##
各时相点与同组休克前基础表达值比较*P<0.05,**P<0.01
, 百拇医药
复苏组同休克组同时相点比较#P<0.05,##P<0.01
2.3 肝、肺组织学检查
组织切片显示,假手术组肝、肺毛细血管内没有白细胞附壁;休克组各时相点血管内有少量白细胞附壁;复苏后2 h肝、肺毛细血管内大量白细胞粘附于血管内壁,血管周围组织细胞浊肿,并出现白细胞浸润;复苏后4、6 h白细胞粘附较复苏后2 h明显减少。
3 讨论
机体内白细胞与内皮细胞粘附是其趋化、游走和吞噬活动的基础,适度的白细胞粘附是机体发挥正常防御和免疫功能不可缺少的关键步骤,但过度的PMN-EC粘附可引起PMN和EC的大量激活及损伤,使组织损伤加重和死亡率增加[1,5]。PMN-EC粘附主要是通过PMN表面的粘附蛋白CD11/CD18介导的。已知CD11/CD18是由一条重链(β链,CD18)和一条轻链(α链,CD11 a-c)以非共价键结合而成的糖蛋白,属于整合素家族(Intergrin),主要参与白细胞—内皮细胞的粘附。参与PMN-EC粘附的粘附分子主要是CD11 b-c/CD18[6]。静息状态下,除了少量分布于细胞膜表面外,大部分位于细胞内储存池(intracellular pools)。细胞内储存池定位于粒细胞的第二级和第三级颗粒,以及单核细胞过氧化物酶阴性颗粒和胞内颗粒[7](intracellular vesicles),在各种刺激因素如佛波脂(PMA)、血小板激活因子(PAF)、肿瘤坏死因子(TNF)等的作用下CD11 b,c/CD18通过转位(translocation)与质膜融合,在数分钟内其数量可增加3~10倍[8]。
, http://www.100md.com
本实验发现,大鼠创伤性休克早期(45 min)PMN CD18明显升高并维持在较高水平,而组织切片显示,此时毛细血管内并无大量的白细胞附壁。休克早期CD18增高可能与膜聚集及CD18由胞内转位至细胞膜表面有关,此时并无CD18的表达增多,其原因可能是因为创伤早期局部软组织损伤及EC、PMN的直接受损所致,随后的酸中毒、组织缺氧及早期释放的炎症介质如TNF-α、白细胞介素-8(IL-8)、PAF等加重了上述改变。此时CD18配体细胞间粘附分子1(ICAM-1)及E-Selectin、L-Selectin等并未大量表达,故PMN-EC粘附并不明显。上述结果提示:创伤性休克早期CD18即明显增加,早期使用粘附分子单抗(或其他抗粘附药物)对机体有利。
创伤性休克是临床常见的病理过程,积极的复苏是治疗的基本手段。本实验发现,复苏2小时后CD18达最高峰,同时组织切片显示血管内大量白细胞粘附于内皮细胞。复苏相当于缺血再灌注过程,导致大量炎症介质释放以及PMN、EC的激活,激活的PMN、EC释放氧自由基、各种蛋白酶及炎症介质,这样形成恶性循环,导致PMN游离出血管外,血管通透性增大,渗出增多和组织水肿等一系列病理变化。从实验亦可看出,复苏6小时后PMN CD18已明显降低,说明从长时间讲复苏对机体是有利的。提示:①复苏2小时已有CD18表达的增多,缺血—再灌注损伤在此过程中发挥重要作用;②CD18参与了创伤性休克的病理过程,尤其是复苏过程中PMN CD18的大量增加加重了组织损伤。上述结果为临床用药提供了理论依据。
, http://www.100md.com
糖皮质激素为机体主要的内源性抗炎物质。研究表明,其作用主要是通过PMN GR实现的。以GC-GR为代表的内源性抗炎机制削弱是发生SIRS和MOF的机制之一[9~11]。为探讨PMN CD18变化机制,本试验同步测定了PMN GR的动态变化。结果发现,PMN GR到达最低值与PMN CD18到达高峰的时间均为复苏后2 h,此时组织切片显示白细胞粘附明显增强;复苏后6小时PMN GR较休克组同时相点明显升高,考虑由于复苏,有效血循环恢复较长时间,机体生理功能恢复所致,而此时PMN CD18也明显下降。提示:由于PMN GR降低,内源性抗炎机制削弱,不能抑制过度的炎症反应,各种炎症因子大量释放,激活PMN和EC,使PMN CD18转位或表达增加。提示PMN GR的减数调节可能是PMN CD18表达增加的原因之一。PMN GR亦可能通过细胞内信息传导,直接抑制PMN CD18 mRNA的表达,使PMN CD18表达减少,这有待进一步的研究。
本实验表明,在创伤性休克及复苏过程中PMN-EC粘附明显增加,与PMN CD18的表达增加有关,PMN GR的减数调节可能是PMN CD18表达增加的原因之一。复苏是抗休克的基本措施,但应采取相应的抗粘附制剂,以减轻复苏引起的过度粘附给机体带来的损伤,为临床用药提供了理论依据。
, 百拇医药
参考文献
[1]Fabian C,Croce A,Stewart M,et al.Neutrophil CD18 expression and block and endotoxin challenge[J].Annals of Surgery,1994,220(4):552-563.
[2]Glasser O,page H.Experimental hemorrhagic shock: A study of its production and treatment[J].Am J Physiol,1948,154:297-315.
[3]田英,徐仁宝.人周围血白细胞糖皮质激素受体的测定. 1983,3(1):27-30.
[4]Haslett C.Modulation of multiple neutrophil functions by preparative methods of trace concentration of bacterial LPS[J].Am J Pathol,1985,119:101-110.
, 百拇医药
[5]Simpson R,Alon R,Kobzik L,et al.Neutrophil and noneutrophil mediated injury in intestined ischemia-reperfusion[J].Ann Surg,1993,218:444-453.
[6]Arnaout MA.Structure and function of the leucocyte adhesion molecules CD11/CD18[J].Blood,1990,75:1037-1050.
[7]Miler LJ,Bainton DF,Borregaard N,et al.Stimulated mobilization of monocyte mac-1 and pl50,95 adhesion proteins from an intracellar vesicular compartment to the cell surface[J].J Clin Invest,1987,80:535-544.
, http://www.100md.com
[8]Freyer DR,Morganroth ML,Rogers CE,et al.Modulation of surface CD11/CD18 glycoproteins(mol,LFA-1 pl50, 95)by human mononeulear phagolcytes[J].Clin Immunol Immunopathol,1988,46:272-283.
[9]徐仁宝,谭金兴.致死性和非致死性烫伤大鼠胞液和胞核糖皮质激素受体的研究[J].中国科学,B辑(11):1009-1014.
[10]Alexandrova M,Farkas P.Stress-induced changes of glucocorticoid recepror in rat liver[J].J Steriod Biochem Mol Biol,1992,42:493-498.
[11]Cronstein N,Kimmel C,Levin I,et al.A mechanism for the antiinflammatory effects of corticosteroids: the glucocorticoid receptor regulates leukocyte adhesion to endothelial cells and expression of endothelial-leukocyte adhesion molecule 1 and intercellular adhesion molecule 1[J].Proc Natl Acad Sci USA,1992,89:9991-9995.
收稿:1998-11-30,修回:1999-07-10, 百拇医药
单位:梅 冰 杨瑞和 霍正禄 上海第二军医大学长海医院急诊科,200433
关键词:创伤性休克;粘附分子;糖皮质激素受体;中性粒细胞;血管内皮细胞;大鼠
中国急救医学991203 [摘 要]目的 探讨中性粒细胞粘附分子CD18(PMN CD18)、中性粒细胞糖皮质激素受体(PMN GR)在大鼠创伤性休克早期的动态变化。方法 动物模型采用软组织损伤加颈动脉放血法,分别采用流式细胞仪和放射配体结合法测定PMN CD 18、PMN GR的表达值。结果 休克组休克45 min PMN CD18表达值明显增高,随后逐渐下降,至休克7.5 h与基础表达值仍相差非常显著(P<0.01);PMN GR随休克时间的延长逐渐下降。复苏2 h后上述改变最显著。肝、肺组织切片发现,复苏后2 h毛细血管内有大量白细胞粘附于血管内壁,同时血管周围有白细胞浸润,复苏6 h后上述改变减轻。结论 创伤性休克及复苏时,PMN-EC粘附明显增强,与PMN CD18的表达增加有关,PMN GR的减数调节是PMN CD18表达增加的原因之一。
, http://www.100md.com
[中图分类号]R 605.971 [文献标识码]A [文章编号]1002-1949(1999)12-0707-03
Studies on expression of neutrophil CD18、glucocorticoid receptor during traumatic shock in rats
MEI Bing, YANG Rui-he, HUO Zheng-lu.Emergency Department Changhai Hospital, Shanghai 200433, China
[Abstract]Objective To investigate the changes of neutrophil CD18(PMN CD18) and glucocorticoid receptor (PMN GR) after early traumatic shock in rats.Methods Traumatic shock was induced by means of soft tissue injury plus hemorrhage of carotid artery. PMN CD18 and PMN GR were measured by Flowcytometer and Radioligand-binding assay respectively.Results PMN CD18 increased markedly during traumatic shock, especially as time went on during the shock; the above changes reached the highest peak at 2 hours after resuscitation. Tissue examination showed that a lot of leukocytes adhered to liver and lung capillary in resuscitation group at 2 hours after resuscitation, the cells surrounding capillary showed cloady swelling, degeneration and local tissue infiltration of leukocytes the above changes decreased at 6 hours after resuscitation.Conclusion The adhesion of PMN-EC is significantly increased during traumatic shock and resuscitation and it may be due to the upregulation of PMN CD18 expression the upregulation of PMN CD 18 expression may be due to the downregulation of PMN GR.
, http://www.100md.com
[Key words]Traumatic shock; Adhesion molecule; Glucocoticoid receptor, neutrophil; Endothelium; Rat
PMN与EC粘附是其趋化、游走和吞噬活动的基础,创伤性休克及多脏器功能衰竭(MOF)等发病过程中均有大量白细胞粘附于血管内壁,应用粘附分子单克隆抗体治疗创伤性休克已取得了一定的疗效。目前国内外对PMN粘附的主要参与因子CD18在创伤性休克早期的变化规律及其与PMN GR的相互关系研究甚少。本实验复制大鼠创伤性休克模型,测定此过程中中性粒细胞粘附分子(PMN CD18)、中性粒细胞糖皮质激素受体(PMN GR)的动态变化,以期阐明PMN在创伤性休克早期的作用机理,为临床更好地防治创伤性休克提供理论依据。
1 材料与方法
1.1 动物与分组
, http://www.100md.com
健康SD大鼠160只,雌雄不拘,体重450±30 g,由上海市计生所提供。动物随机分为假手术组、休克组和复苏组。假手术组行颈总动、静脉插管但不致伤及放血。各组均于插管后即刻,术后45 min、1.5 h、3.5 h、5.5 h、7.5 h处死动物抽血查PMN CD18、PMN GR表达值。复苏组于休克1.5 h开始复苏(回输所失血液,并按放血量2倍补充乳酸林格氏液,复苏后2 h、4 h、6 h相当于休克后3.5 h、5.5 h、7.5 h)。假手术组每时相点标本量为6,其余均为10。
1.2 主要材料
大鼠PMN CD18单克隆抗体WT.3由美国Pharmingen公司提供;FITC标记羊抗小鼠二抗由上海华美生物工程公司提供;[1.2.4]3[H]Dex由英国放化公司提供;Percoll和Dex T 500为英国Pharmacia公司产品。EPICS XL型流式细胞仪为美国Epics division of coulter corporation产品;FJ-2108细胞代谢闪烁计数器为西安7412厂产品。
, http://www.100md.com
1.3 方法
1.3.1 模型 基本方法见文献[1],参考Lamson法[2]略作改进。动物20%乌拉坦(6 ml/kg)麻醉后固定于鼠台,行右颈总动、静脉插管。稳定30 min后,一重1 kg的铁棒从1米高处自由落下,砸中鼠双大腿,然后从颈总动脉放血,连接到自制的无菌贮血瓶,调节血液平面高度控制血压,休克期间维持血压在5.33 kPa。
1.3.2 指标测定 PMN CD18采用流式细胞仪细胞计数,以阳性细胞百分数为单位;PMN GR采用放射配体结合法测定[3],以Percoll密度梯度离心法分离中性粒细胞,基本方法见文献[4]。
1.3.3 组织学检查 肝、肺组织常规HE染色,石蜡包埋切片。
1.3.4 统计学处理 所有数据以
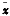 ±s表示,采用Base统计软件包进行完全随机资料的方差分析,组间均数比较用t检验。P<0.05为差异显著,P<0.01为差异非常显著。
±s表示,采用Base统计软件包进行完全随机资料的方差分析,组间均数比较用t检验。P<0.05为差异显著,P<0.01为差异非常显著。, 百拇医药
2 结果
2.1 大鼠PMN CD18的动态变化
休克组休克45 min PMN CD18表达即明显升高,随后逐渐下降,至休克7.5 h与休克前基础表达值仍相差非常显著(P<0.01);复苏组PMN CD18呈双峰改变,第一峰在休克45 min,第二峰在复苏后2 h,较休克组同时相点明显升高(P<0.01),随后逐渐下降,复苏后6 h较休克组同时相点降低(P>0.05)(见表1)。
表1 创伤性休克大鼠PMN CD18的变化(单位:阳性细胞百分率) 组 别
n
休克前
休 克
复 苏
, 百拇医药
45 min
1.5 h
3.5 h
5.5 h
7.5 h
假手术组
6
23.17±2.40
24.57±2.44
24.18±1.91
22.80±1.91
23.00±2.29
, 百拇医药
24.27±2.21
休克组
10
22.50±1.22
51.24±4.28**
41.68±4.33**
41.30±2.96**
39.60±2.69**
38.82±2.66**
复苏组
, http://www.100md.com 10
23.64±1.37
51.46±5.31**
41.94±3.69**
54.48±4.86**##
41.90±2.86**
35.36±2.59**
各时相点与同组休克前比较**P<0.01,复苏组与休克组同时相点比较##P<0.012.2 PMN GR的动态变化
休克组休克1.5 h PMN GR较基础表达值降低(P<0.05),3.5、5.5、7.5 h与休克前相比P<0.01;复苏后2 h GR达最低值,较休克组同时相点明显降低(P<0.01),复苏后4、6 h开始回升(与复苏2 h相比P<0.05,P<0.01),复苏后6 h较休克组同时相点明显增高(P<0.05)(表2)。表2 创伤性休克大鼠PMN GR的变化(单位:位点/细胞) 组 别
, 百拇医药
n
休克前
休 克
复 苏
45 min
1.5 h
3.5 h
5.5 h
7.5 h
假手术组
6
3231±115
3188±147
, http://www.100md.com
3151±135
3069±136
3006±120
3082±137
休克组
10
3210±136
2949±139
2767±142*
2443±179**
2086±273**
, http://www.100md.com
1892±266**
复苏组
10
3177±169
2982±227
2793±206*
1460±275**##
1867±225**
2237±233**##
各时相点与同组休克前基础表达值比较*P<0.05,**P<0.01
, 百拇医药
复苏组同休克组同时相点比较#P<0.05,##P<0.01
2.3 肝、肺组织学检查
组织切片显示,假手术组肝、肺毛细血管内没有白细胞附壁;休克组各时相点血管内有少量白细胞附壁;复苏后2 h肝、肺毛细血管内大量白细胞粘附于血管内壁,血管周围组织细胞浊肿,并出现白细胞浸润;复苏后4、6 h白细胞粘附较复苏后2 h明显减少。
3 讨论
机体内白细胞与内皮细胞粘附是其趋化、游走和吞噬活动的基础,适度的白细胞粘附是机体发挥正常防御和免疫功能不可缺少的关键步骤,但过度的PMN-EC粘附可引起PMN和EC的大量激活及损伤,使组织损伤加重和死亡率增加[1,5]。PMN-EC粘附主要是通过PMN表面的粘附蛋白CD11/CD18介导的。已知CD11/CD18是由一条重链(β链,CD18)和一条轻链(α链,CD11 a-c)以非共价键结合而成的糖蛋白,属于整合素家族(Intergrin),主要参与白细胞—内皮细胞的粘附。参与PMN-EC粘附的粘附分子主要是CD11 b-c/CD18[6]。静息状态下,除了少量分布于细胞膜表面外,大部分位于细胞内储存池(intracellular pools)。细胞内储存池定位于粒细胞的第二级和第三级颗粒,以及单核细胞过氧化物酶阴性颗粒和胞内颗粒[7](intracellular vesicles),在各种刺激因素如佛波脂(PMA)、血小板激活因子(PAF)、肿瘤坏死因子(TNF)等的作用下CD11 b,c/CD18通过转位(translocation)与质膜融合,在数分钟内其数量可增加3~10倍[8]。
, http://www.100md.com
本实验发现,大鼠创伤性休克早期(45 min)PMN CD18明显升高并维持在较高水平,而组织切片显示,此时毛细血管内并无大量的白细胞附壁。休克早期CD18增高可能与膜聚集及CD18由胞内转位至细胞膜表面有关,此时并无CD18的表达增多,其原因可能是因为创伤早期局部软组织损伤及EC、PMN的直接受损所致,随后的酸中毒、组织缺氧及早期释放的炎症介质如TNF-α、白细胞介素-8(IL-8)、PAF等加重了上述改变。此时CD18配体细胞间粘附分子1(ICAM-1)及E-Selectin、L-Selectin等并未大量表达,故PMN-EC粘附并不明显。上述结果提示:创伤性休克早期CD18即明显增加,早期使用粘附分子单抗(或其他抗粘附药物)对机体有利。
创伤性休克是临床常见的病理过程,积极的复苏是治疗的基本手段。本实验发现,复苏2小时后CD18达最高峰,同时组织切片显示血管内大量白细胞粘附于内皮细胞。复苏相当于缺血再灌注过程,导致大量炎症介质释放以及PMN、EC的激活,激活的PMN、EC释放氧自由基、各种蛋白酶及炎症介质,这样形成恶性循环,导致PMN游离出血管外,血管通透性增大,渗出增多和组织水肿等一系列病理变化。从实验亦可看出,复苏6小时后PMN CD18已明显降低,说明从长时间讲复苏对机体是有利的。提示:①复苏2小时已有CD18表达的增多,缺血—再灌注损伤在此过程中发挥重要作用;②CD18参与了创伤性休克的病理过程,尤其是复苏过程中PMN CD18的大量增加加重了组织损伤。上述结果为临床用药提供了理论依据。
, http://www.100md.com
糖皮质激素为机体主要的内源性抗炎物质。研究表明,其作用主要是通过PMN GR实现的。以GC-GR为代表的内源性抗炎机制削弱是发生SIRS和MOF的机制之一[9~11]。为探讨PMN CD18变化机制,本试验同步测定了PMN GR的动态变化。结果发现,PMN GR到达最低值与PMN CD18到达高峰的时间均为复苏后2 h,此时组织切片显示白细胞粘附明显增强;复苏后6小时PMN GR较休克组同时相点明显升高,考虑由于复苏,有效血循环恢复较长时间,机体生理功能恢复所致,而此时PMN CD18也明显下降。提示:由于PMN GR降低,内源性抗炎机制削弱,不能抑制过度的炎症反应,各种炎症因子大量释放,激活PMN和EC,使PMN CD18转位或表达增加。提示PMN GR的减数调节可能是PMN CD18表达增加的原因之一。PMN GR亦可能通过细胞内信息传导,直接抑制PMN CD18 mRNA的表达,使PMN CD18表达减少,这有待进一步的研究。
本实验表明,在创伤性休克及复苏过程中PMN-EC粘附明显增加,与PMN CD18的表达增加有关,PMN GR的减数调节可能是PMN CD18表达增加的原因之一。复苏是抗休克的基本措施,但应采取相应的抗粘附制剂,以减轻复苏引起的过度粘附给机体带来的损伤,为临床用药提供了理论依据。
, 百拇医药
参考文献
[1]Fabian C,Croce A,Stewart M,et al.Neutrophil CD18 expression and block and endotoxin challenge[J].Annals of Surgery,1994,220(4):552-563.
[2]Glasser O,page H.Experimental hemorrhagic shock: A study of its production and treatment[J].Am J Physiol,1948,154:297-315.
[3]田英,徐仁宝.人周围血白细胞糖皮质激素受体的测定. 1983,3(1):27-30.
[4]Haslett C.Modulation of multiple neutrophil functions by preparative methods of trace concentration of bacterial LPS[J].Am J Pathol,1985,119:101-110.
, 百拇医药
[5]Simpson R,Alon R,Kobzik L,et al.Neutrophil and noneutrophil mediated injury in intestined ischemia-reperfusion[J].Ann Surg,1993,218:444-453.
[6]Arnaout MA.Structure and function of the leucocyte adhesion molecules CD11/CD18[J].Blood,1990,75:1037-1050.
[7]Miler LJ,Bainton DF,Borregaard N,et al.Stimulated mobilization of monocyte mac-1 and pl50,95 adhesion proteins from an intracellar vesicular compartment to the cell surface[J].J Clin Invest,1987,80:535-544.
, http://www.100md.com
[8]Freyer DR,Morganroth ML,Rogers CE,et al.Modulation of surface CD11/CD18 glycoproteins(mol,LFA-1 pl50, 95)by human mononeulear phagolcytes[J].Clin Immunol Immunopathol,1988,46:272-283.
[9]徐仁宝,谭金兴.致死性和非致死性烫伤大鼠胞液和胞核糖皮质激素受体的研究[J].中国科学,B辑(11):1009-1014.
[10]Alexandrova M,Farkas P.Stress-induced changes of glucocorticoid recepror in rat liver[J].J Steriod Biochem Mol Biol,1992,42:493-498.
[11]Cronstein N,Kimmel C,Levin I,et al.A mechanism for the antiinflammatory effects of corticosteroids: the glucocorticoid receptor regulates leukocyte adhesion to endothelial cells and expression of endothelial-leukocyte adhesion molecule 1 and intercellular adhesion molecule 1[J].Proc Natl Acad Sci USA,1992,89:9991-9995.
收稿:1998-11-30,修回:1999-07-10, 百拇医药